用于渗透驱动过程的可再生汲取剂的制作方法
本发明涉及正渗透用汲取剂(drawsolutes)和使用其的方法。
背景技术:
在本说明书中列出或讨论明显地在先公开的文献不应必然地理解为所述文献是现有技术的部分,或是公知常识。
脱盐技术目前正获得普及,因为已广泛认为淡水稀缺是全球危机[1]。在成熟和发达的脱盐技术中,电渗析(ed)最适宜于处理浓度比海水低得多的进料流[2]。虽然反渗透(reverseosmosis,ro)被认为是用于海水脱盐的成熟技术,但是由于其操作接近于有关能耗的理论最优值[3],不能用于使具有高盐度(salinity)的进料流如海水ro盐水(brine)和由石油和天然气工业产生的某些废水脱盐[4]。这是因为这样的进料流的高液压要求。包括多级闪蒸(msf)、多效蒸馏(med)、蒸汽压缩(vc)或膜蒸馏(md)的热蒸馏技术消耗大量的能源,尽管它们可以用于使盐水脱盐。因此,期望的是开发能够有效地处理高浓度的盐水的可选脱盐技术。
正渗透(forwardosmosis,fo)关于这点已经显示出希望[5]。水通过膜的渗透是由渗透压差、更确切地说化学势梯度驱动的自动过程。另外,因为fo在更低的液压下操作,fo中的污染与ro相比明显更少和更容易清洁[6]。然而,fo过程单独的产物是稀释的汲取液(drawsolution),其实际上具有比进料液高的渗透压。因此,fo作为可行的脱盐技术的成功之处需要可以有效地再生且成本有效的更适宜的汲取剂的发现和开发。尽管已经研究了许多无机盐[7]和有机化合物[5]作为针对具有等于或甚至高于海水的盐度的进料显示充分高的汲取能力的汲取剂,它们的再生实际上消耗了比ro更多的电能[8]。因此整个过程在经济上不可行。事实上,所有非响应性或非可再生汲取剂,包括聚合电解质、两性离子化合物、量子点(quantumdot)、有机盐和不含氧酸配合物(hydroacidcomplex)在内[9-13],都面临上述同样棘手的挑战。因此,探索可以经由特定刺激或反应而大幅降低fo过程之后的稀释汲取剂的渗透压的‘智能’且可再生的汲取剂近来已变成fo技术相关的重点研究课题。已研究了磁性纳米颗粒[14]和可以通过复分解(metathesis)回收的无机盐(cuso4或mgso4)[15]。磁性纳米颗粒的问题是渗透压不足且附聚严重[16],而cuso4或mgso4的复分解再生是冗长的并且需要使用大量的化学品。
另一类智能汲取剂是包括具有低临界溶解温度(lcst)的大分子的分子。在低于lcst的温度下,汲取剂溶解于水中制成均相的汲取液;而在高于lcst的温度下,汲取剂之间的疏水相互作用主导,产生相分离。改性聚乙烯亚胺[17]、乙二醇醚[18]和热响应性离子液体[19]已证明能够以实验室规模进行海水脱盐。值得注意的是,这些lcst型可再生汲取剂源于亲水性与疏水性之间微妙的平衡。虽然较高的疏水性导致较低的lcst(例如,<60℃),有利于汲取剂回收的容易性,但期望较高的亲水性来产生较高的汲取能力。
近来报道的co2响应性有机胺化合物[20]和双重响应性聚合物也是有前途的汲取剂。这些化合物/聚合物在通过co2的质子化作用之后变成带电的电解质或聚合电解质并且在fo过程中产生高渗透压。有利地,该化合物/聚合物经由co2的脱除返回到未带电的天然或热响应性状态,从而促进再生过程。双重响应性聚合物作为汲取剂的使用[21]进一步降低汲取剂的反扩散并且缓和由基于低分子有机胺类的汲取剂带来的膜破坏的问题。
其他有效的热分解的可再生汲取剂是以氨水-二氧化碳体系为基础的[22-24]。包括碳酸氢铵、碳酸铵和氨基甲酸铵等的热分解盐是高度可溶的,可生成相当高的渗透压并且可热分解为co2和nh3气体,然后它们可以在再生过程中重组而形成原来的汲取剂。
尽管以上讨论的热可再生汲取剂(热解和lcst型)可能不会使fo消耗比ro少的能源,但它们可通过在再生过程中使用更便宜的低位热能代替电能而降低能源成本[25]。例如,使用热响应性离子液体作为汲取剂[19],用于海水脱盐的理论电能消耗只有用于ro的一小部分(16%)。低位热能可用于弥补分离所需要的能源的剩余部分,导致潜在地显著节约能源成本并减少碳足迹(carbonfootprint)。
技术实现要素:
在本发明的第一方面中,提供了一种无机盐形成和再生正渗透用汲取剂的用途,其中所述无机盐从选自以下组中的一种或多种中选择:硫酸钠、或更特别地,乳酸钙、磷酸氢二钠、焦磷酸四钠、和其水合物。
在本发明的第一方面的实施方案中:
(a)所述无机盐可以为磷酸氢二钠或其水合物(例如,其中无机盐为十二水合磷酸氢二钠);和/或
(b)所述无机盐可以提供为在水中浓度为10wt%至50wt%(例如,35wt%至45wt%,如40wt%)的溶液。
在本发明的第二方面中,提供了一种正渗透方法,其包括:
(a)将具有第一温度的第一溶液引入半渗透膜的第一侧,和将具有第二温度的含有无机盐的浓缩汲取液引入所述半渗透膜的第二侧;
(b)促进至少部分的所述第一溶液流过所述半渗透膜,从而在所述半渗透膜的所述第一侧形成第二溶液且在所述半渗透膜的所述第二侧形成稀释汲取液;
(c)将至少部分的所述稀释汲取液引向第三温度下的第一分离操作从而回收无机盐水合物和溶液流;
(d)将所述无机盐的水合物加热至第四温度从而使所述浓缩汲取液再生;和
(e)将所述浓缩汲取液再引入所述半渗透膜的所述第二侧,其中:
所述无机盐从选自以下组中的一种或多种中选择:硫酸钠、或更特别地,乳酸钙、磷酸氢二钠、焦磷酸四钠、和其水合物;和
所述第一温度和所述第二温度大于所述第三温度。
在本发明的第二方面的实施方案中:
(i)所述无机盐可以是磷酸氢二钠或其水合物(例如,无机盐为十二水合磷酸氢二钠);
(ii)所述无机盐可以提供在浓度为10wt%至50wt%(例如,35wt%至45wt%,如40wt%)的汲取液中;
(iii)所述第一温度和所述第二温度独立地为32℃至55℃,以及所述第三温度可为0℃至30℃(例如,20℃至25℃);
(iv)所述第四温度可为40℃至55℃;
(v)所述第一溶液可为海水、微咸水(brackishwater)、盐水、市政废水(municipalwastewater)、石油和天然气工业的废水、或采矿业的废水。
在本发明的第二方面的又进一步的实施方案中,当溶液流含有无机盐时,溶液流进行进一步的分离操作,从而提供溶剂流和无机盐水合物。例如,进一步的分离操作可以为:
(i)等压ro/nf过滤处理;和/或
(ii)有机溶剂辅助的提取结晶,从而提供所述无机盐水合物、和还会进一步分离以提供有机溶剂和所述溶剂流的溶剂混合物(例如,有机溶剂可以以相对于溶剂流为20wt%至150wt%、如60wt%至120wt%的重量%的比例加入溶液流;和/或有机溶剂可以选自由酮、酯、醚、腈和醇组成的组中的一种或多种(例如,有机溶剂为丙酮))。
附图说明
图1描述了在各种温度下na2hpo4在水中的溶解度。基于无水na2hpo4溶质给出以溶液的重量百分比和质量摩尔浓度(摩尔每千克水)的溶解度。与na2hpo4共享阳离子(nahco3)和阴离子((nh4)2hpo4)的其他无机盐的溶解度值也以质量摩尔浓度给出用于比较。
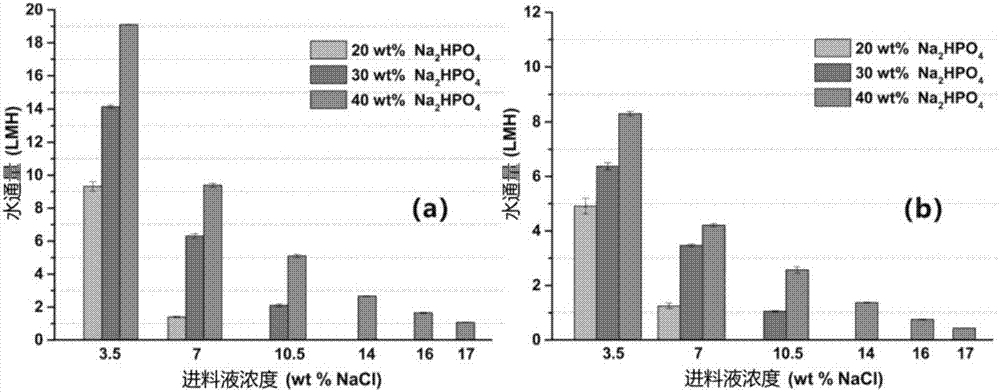
图2描述了在(a)pro模式和(b)fo模式中通过不同浓度的na2hpo4汲取液对不同盐度的进料液产生的水通量(waterflux)。汲取液和进料液在试验期间分别维持在50±1℃和46±2℃下。
图3描述了na2hpo4的相图,说明在各种温度下的fo结晶过程中的汲取剂流通。汲取液相分离为饱和的上清液和晶体相。晶体相的组成固定为十二水合物,并且不依赖于结晶温度,而上清液的浓度随着温度降低而降低。各相的重量比可以通过杠杆规则来确定。
图4是使用na2hpo4作为汲取剂经由fo的盐水处理的示意图,其可以从使用ro过程难以直接处理的非常高的盐度,例如17wt%的nacl溶液中汲取水。稀释汲取液,例如,20wt%的na2hpo4首先冷却至较低温度,其中大部分的汲取剂通过沉淀/结晶为na2hpo4·12h2o而再生,其仅在温和加热时转变为40wt%的na2hpo4溶液以直接再使用而不需进一步的稀释或浓缩。结晶上清液中的剩余的汲取剂,包含少了很多的na2hpo4,例如,在25和10℃下分别为10.5wt%和4.2wt%,可以通过溶剂辅助的提取结晶或简单地通过等压ro或nf过滤处理而再生。沉淀的na2hpo4晶体再次处于十二水合物形态na2hpo4·12h2o,并且能够直接再使用。
图5是当不同量的丙酮添加至在fo后的稀释汲取液冷却之后的流出物(即,10wt%的na2hpo4水溶液)时的na2hpo4、水和丙酮的浓度曲线。内嵌的图是在提取结晶期间沉淀的晶体中的na2hpo4浓度。
具体实施方式
本发明提供一种或多种可再生汲取剂,它不必然必须依赖于具有逆行温度依赖溶解度(retrogradetemperaturedependentsolubility)的lcst的物理现象。研究高度可溶的盐和小分子(有机或无机)以领会它们是否可具有期望的溶解度的温度依赖性的曲线,因为在不同的温度下的充分大的溶解度差可提供开发新的正渗透用汲取剂的可能性。
鉴定出可能的候选物质的列表,并且它们的性能归纳于表1(将实质上没有对温度的溶解度依赖性的氯化钠用作参考。表1中用星号标记的数据是在298k下的溶解度数据)。所有鉴定出的物质在适度高温例如333k(60℃)下具有高溶解度,但是在较低温度例如298k(25℃)或293k(20℃)下具有基本上较低的溶解度。
表1
经进一步的考虑之后,淘汰表1中的腐蚀性或有毒的物质,留下乳酸钙、磷酸氢二钠和焦磷酸四钠用于进一步的研究。所有这三种都显示了希望,但是磷酸氢二钠,不仅是因为其对温度高敏感的溶解度,而且还因为其低毒性(事实上,磷酸氢二钠是常用的食品添加剂),还有其它独特的属性,作为可再生汲取剂脱颖而出。考虑到这些属性,磷酸氢二钠可以用于不同的工业行业中的广泛应用。例如,磷酸氢二钠可以用于市政废水的处理中和处理来自石油和天然气以及采矿业的废水中的脱盐(例如,海水、微咸水、盐水)。磷酸氢二钠的无毒性质也允许其用于食品行业中。渗透压高的可再生汲取剂也可以发现在其他渗透驱动工艺中的应用,如压力延迟渗透(pressureretardedosmosis)和fo-ro混合工艺等。
因而,本发明涉及无机盐的用于形成和再生正渗透用汲取剂的用途,其中无机盐从选自由以下组中的一种或多种选择:硫酸钠、或更特别地,乳酸钙、磷酸氢二钠、焦磷酸四钠、和其水合物。无机盐的用途可以通过将无机盐(或其水合物形态)以10wt%至50wt%(例如,35wt%至45wt%,如40wt%)的浓度溶解于水中而作为汲取剂提供。本文中使用的重量百分比是基于无水无机盐的重量。在本文中可以提及的特定实施方案中,无机盐可以是磷酸氢二钠或其水合物(例如,无机盐可以是十二水合磷酸氢二钠),其中盐的浓度可以如前所述。
本发明还涉及正渗透方法,其包括:
(a)将具有第一温度的第一溶液引入半渗透膜的第一侧,和将具有第二温度的含有无机盐的浓缩汲取液引入半渗透膜的第二侧;
(b)促进至少部分的第一溶液流过半渗透膜,从而在半渗透膜的第一侧形成第二溶液且在半渗透膜的第二侧形成稀释汲取液;
(c)将至少部分的稀释汲取液引向第三温度下的第一分离操作从而回收无机盐水合物和溶液流;
(d)将无机盐水合物加热至第四温度从而使浓缩汲取液再生;和
(e)将浓缩汲取液再引入半渗透膜的第二侧,其中:
无机盐从选自以下组中的一种或多种中选择:硫酸钠、乳酸钙、磷酸氢二钠、焦磷酸四钠、和其水合物;并且
第一温度和第二温度大于第三温度。
在实例实施方案中,本发明可涉及磷酸氢二钠(或其水合物)在正渗透脱盐中作为可再生汲取剂的用途。已发现了40wt%(基于无水na2hpo4)的汲取液可从高达17wt%nacl的高盐度、或者在海水的约五倍盐度的进料流中生成水通量,这在所有可再生汲取剂报道中可能是最高的。
不像大多数的通过加热再生的可再生汲取剂一样,本文所述的新的汲取剂的多数可以通过将稀释汲取液冷却至环境温度,例如25、20或10℃而再生。例如,当稀释汲取液的温度降低至25℃时,相分离发生,提供十二水合磷酸氢二钠(na2hpo4·12h2o)固体晶体和包含10.5wt%的磷酸氢二钠的饱和上清液溶液。如下所示,虽然晶体形态在研究的窗口内不依赖于结晶温度,但是上清液的浓度发现是温度依赖的。例如,如果稀释汲取液反而分别冷却至20℃和10℃,则上清液的浓度可以进一步降低至7.5和4.2wt%(基于盐的无水形态)。沉淀晶体可以直接再用作汲取液,在温和加热下(例如,在高于32℃的温度下)熔化之后没有水和盐补充却与原来的汲取液(40wt%)的浓度恰好一样。因而,十二水合磷酸氢二钠可能是用于本发明的特别有吸引力的形式的磷酸氢二钠及其溶剂化物。
如前文所注意的,上清液仍然含有一定量的磷酸氢二钠,其也可以容易地再生。例如,可以用于实现上清液中的剩余的磷酸氢二钠的再生的一种方法是经由简单的过滤,例如,等压nf或ro,其中剩余的磷酸氢二钠由于二元磷酸根阴离子的大尺寸而可以容易地除去。然而,我们在这里还记载了溶剂辅助的结晶,或提取结晶,该方法是从上清液中再生汲取剂(例如,磷酸氢二钠)的有趣且高效的方法。虽然反溶剂提取结晶长久以来一直用于盐生产[30],但是尚未报道过其在汲取剂再生中的应用。迄今所得的结果证明,即使对于高盐度的盐水处理,磷酸氢二钠也用作新的和温度敏感的汲取剂。
用于溶剂提取结晶的溶剂可以是任何适宜的有机溶剂。有机溶剂可以以得到所使用的无机盐(例如,作为其十二水合物的磷酸氢二钠)的结晶的量来使用。例如,有机溶剂的使用量相对于溶剂流可以为20wt%至150wt%(例如,60wt%至120wt%)。本文中可以提及的有机溶剂包括选自由酮、酯、醚、腈、醇和其混合物组成的组中的溶剂。本文中可以提及的酮包括丙酮。本文中可以提及的酯包括乙酸乙酯。本文中可以提及的腈包括乙腈。本文中可以提及的醚包括二乙醚、四氢呋喃、二甘醇二甲醚、1,2-二甲氧基乙烷、1,4-二噁烷和甲基叔丁基醚。本文中可以提及的醇包括c1-4直链或支链醇、乙二醇和甘油。本文中可以提及的特定溶剂是丙酮。丙酮可以容易地与水分离,不像如乙醇等其他溶剂一样,丙酮在蒸馏期间与水不具有共沸点(就这点而言,将了解到非共沸溶剂可以优选用于本发明的实施方案中)。如从试验数据中可见的,还发现丙酮在沉淀na2hpo4时是高度有效的。
本文所述的fo过程和冷却诱导的沉淀再生在图4中示意性示出。图4中,系统400包括具有正渗透膜420的正渗透组件410,所述正渗透膜420将该组件分隔成两个区,进料液用第一区430和汲取液用第二区440。第一区包含供应进料液的入口431、和用于排出或到结晶器的出口432。第二区包含连接至第一回收装置450的入口441(入口441连接至第一回收装置的出口453)和也连接至第一回收装置的出口442(出口442连接至第一回收装置的入口454)。第一回收装置(或室)依次具有连接至第二回收装置460的入口461的另外的出口455,所述第二回收装置460具有连接至第二区440的入口441的出口462和提供处理水(treatedwater)464的另外的出口463。
如图4中所述,进料液在约45℃至约50℃的温度(第一温度)下通过入口431初始提供为7wt%的盐水溶液,同时汲取液在50℃(第二温度)下通过入口441提供为40wt%的na2hpo4溶液。一旦40wt%汲取液在fo过程中稀释(例如,稀释到如图4中描述的20wt%),则稀释汲取液就提供到第一回收室450,其在此经历冷却(例如,冷却至25℃;第三温度),得到晶体na2hpo4·12h2o452的沉淀和包含na2hpo4的上清液相451(例如,10.5wt%,在25℃下)。固体晶体452可以容易地从液态上清液451中除去(例如,通过出口453),并且通过加热到45℃至50℃的温度(第四温度)再熔化为液态,由此使40wt%的na2hpo4溶液再生,其可以通过入口441再次引入第二区440。这回收了相当大比例的na2hpo4,但是液态上清液451中仍然残留一定量的na2hpo4。即使能量密集地冷却至接近零度也不会使所有的汲取剂作为na2hpo4·12h2o从液态上清液中沉淀出。因此,汲取液冷却之后,需要接踵而至的再生过程以使汲取剂与上清液溶液完全分离。
图4说明用于进一步再生在第二再生装置460中残留在上清液中的剩余汲取剂的两种可行方法,如方框470和480中所示。
如图4的方框470中所示的第一选项是通过使用包括反渗透或纳滤膜471的膜组件对上清液直接应用纳滤(nf)或ro,从而生产净化水464(其通过出口463可离开装置,未示出)和另一批结晶的na2hpo4·12h2o452,其也可以经由出口462循环至第二区440。即使这不是本文为了详细研究所选择的过程,但是简要讨论其优点也是有用的。基于fo水通量试验(参见以下实施例3),10.5wt%上清液的渗透压预测是不高于4.5wt%nacl(约35bar)的渗透压。类似地,发现7.5wt%上清液(冷却至20℃)相当于渗透压为约26bar的3.4wt%nacl溶液。海水ro厂(27bar至60bar的液压)能够处理这样的上清液。因而,使用na2hpo4汲取剂的fo过程的一个独特的优点是借由fo与ro过程的组合将海水ro厂中的水回收从典型地50%提高至80%的能力。另外,该新的汲取剂可以使ro厂处理具有甚至更高盐度的其他盐水的能力扩大趋向于近乎零液体排放过程。其他潜在的有利特征是在该情况下仅需要等压nf或ro过程(图4),因为当水渗透通过nf或ro膜时,进料液由于伴随水合晶体从过饱和的上清液中的沉淀而不预期变得更加浓缩。
图4的方框480中所示的第二选项涉及示出为含有10wt%的na2hpo4的上清液451的溶剂辅助的结晶。该过程涉及将有机溶剂(例如,丙酮)加入上清液中以形成水和有机溶剂的溶剂混合物481,并且提供可以如前所述再使用另一批na2hpo4·12h2o。溶剂混合物481供应到蒸馏塔482,从而提供有机溶剂483和处理水464(通过出口463除去)。
在平行研究中,也研究了硫酸钠na2so4作为可能的汲取剂,这是由于其溶解度具有相对大的温度依赖性。硫酸钠也显示了作为汲取剂的潜在性,尽管na2so4的回收会比na2hpo4的更困难。然而,膜过滤(例如,nf或ro)和/或提取结晶在温度调节之后仍可使用。
如本文所讨论的,硫酸钠、或更特别地,乳酸钙、磷酸氢二钠、焦磷酸四钠和它们的水合物,特别是磷酸氢二钠及其水合物,可以认为是有前途的可替代的可再生汲取剂。本文中也证明了:可以使汲取剂首先通过冷却然后通过溶剂辅助而经由结晶过程再生。尽管本文公开的方法仍然是基于膜的方法,但是在fo和汲取剂再生期间消耗的主要能量是低位热能的形态,特别是如果废热可得的话,与电能相比是更便宜的。这可以比ro更有优势。与其他热驱动的工艺,例如水蒸馏,如潜在可用于盐水处理的msf、med和md相比,本文讨论的工艺可涉及替代的丙酮直接蒸馏,考虑到丙酮的较低沸点56℃、较低的蒸发焓539j/g和较低的比热2.16j/(g·k),这会是比水的膜蒸馏更加有优势。这与水的蒸发焓和比热相反,其分别为2260j/g和4.18j/(g·k)。
实施例
材料和仪器
氯化钠(>99.5%)购自默克公司。无水磷酸氢二钠(>98.5%)购自sigma-aldrich。分析试剂级丙酮购自fisherscientificuk。在整个试验当中使用电阻>18mω的去离子(di)水。所有化学品都按收到的使用。薄膜复合的fo膜购自hydrationtechnologyinnovations并且在使用前于去离子水中浸渍24小时。该膜可以耐受71℃的高温和2-11的ph范围,其特性参数可以从别处得到[31]。旋转蒸发仪(heidlphg3)用于模拟丙酮与水通过蒸发的分离。在70℃和310mbar下进行蒸馏2小时。沉淀的na2hpo4·12h2o晶体的熔化通过差式扫描量热仪(dsc,tainstruments,q10)记录。晶体水合物中的固成分,即无水na2hpo4通过热重分析(tainstruments,q500)确认。蒸馏之后产物水中的痕量丙酮残余物通过总有机碳(toc)分析仪(shimadzu,toc-vcsh)测定。fo过程中的反扩散通过离子色谱(dionexics-2100,thermoscientific)分析。
实施例1
磷酸氢二钠溶解度的测定
为测量在不同温度下的溶解度,过量的无水磷酸氢二钠与10g去离子水在密封小瓶中在磁力搅拌下在通过水浴控制的各种温度下混合。温度精确度在±0.2℃内。溶液和固体晶体混合物等温地搅拌24小时,并且静置2小时,使得完全沉降。使用移液管取出固定体积的饱和上清液,并且在真空中在100℃和100mbar下干燥之前称重(m溶),直到得到恒重(m干)。计算以重量百分比计的溶解度为m干/m溶×100%。
对于溶解度与温度之间具有正相关性的汲取剂,其期望的是通过在不是远高于室温的适度的温度下实现其最高可能的溶解度而产生高渗透压。另外,其在环境温度或室温下的溶解度应当尽可能低,以通过沉淀促进汲取剂回收。
图1示出作为温度函数的无水磷酸氢二钠在水中的溶解度。可以看出溶解度从25℃下的11.76g/100g急剧增大到50℃下的82.36g/100g,表明在25℃的小的温度窗口内的6.5倍的溶解度增加。在这样小的温度范围内的溶解度的大变化对于无机盐是非常罕见的。例如,与磷酸氢二钠分别共享阴离子和阳离子的磷酸氢二铵(nh4)2hpo4和碳酸氢钠nahco3具有较不显著的对温度的溶解度依赖性,如图1中所示。尽管诸如(nh4)2hpo4(和表1中列出的kno3)等盐的溶解度在升高的温度例如50℃下可以高于磷酸氢二钠na2hpo4的溶解度,但是它们在较低的温度例如25℃下相对高的溶解度是不期望的。这意味着在冷却至较低温度之后,稀释汲取液仍将会具有高质量摩尔浓度,这会危及它们有效再生的可行性[32]。然而,饱和na2hpo4溶液在室温下的质量摩尔浓度相对低并且实际上接近于海水的质量摩尔浓度。这可能表明与海水类似的渗透压并且能够使汲取剂回收可行。
对于na2hpo4有趣的是,温度增加超过50℃不会明显进一步增加其溶解度,其似乎在45wt%达到平稳。因此,为了实现汲取液的最高可得的渗透压,最大45wt%的na2hpo4溶液作为汲取液的使用似乎是自然的选择。然而,不像许多在它们的晶体中不具有任何结晶水的其他的盐一样,当冷却到低于35℃时磷酸氢二钠na2hpo4从过饱和溶液中以十二水合物的形态(na2hpo4·12h2o)沉淀出[33]。基于式计算以及还有实验测量,十二水合物中的无水盐度是40wt%。这是相当吸引人的,因为这表明了水合物晶体可简单地在加热下熔化为40wt%溶液并且再用作汲取液。因此,在该作业中研究的最高na2hpo4汲取液固定在40wt%,因此以na2hpo4·12h2o的形态再生的汲取剂可以直接再使用,而无需熔化后的进一步的处理。
虽然汲取液的精确的渗透压或同渗重摩(osmolality)由于在试验期间因在零下温度下的极低溶解度引起的沉淀而不能通过凝固点降低法来测量,但是可以容易地计算汲取剂在各种温度下的最大质量摩尔浓度。根据图1,40wt%的汲取液具有4.7mol/kg的相应的质量摩尔浓度。如下面在实施例3中讨论的,该汲取液的汲取能力从fo期间的水通量值实验地测量。
实施例2
水-丙酮-na2hpo4三元体系中的浓度测定
为测定于冷却稀释汲取液后得到的上清液的提取结晶之后在水/丙酮混合物溶液中的残余磷酸氢二钠浓度,将各种量的丙酮,相对于纯水的重量为20wt%至120wt%,添加至密封的小瓶中的上清液(其为在室温下的10wt%的na2hpo4溶液)。存在瞬时相分离,导致固体晶体水合物在添加丙酮时沉淀。允许混合物在固体晶体除去之前沉降1小时。然后提取出溶液部分,并且在放入100℃和100mbar下的干燥真空箱之前称重(m溶)直到实现恒重(m干)。然后相应地计算水/丙酮混合物中的na2hpo4浓度。所有测量重复3次。
发现丙酮在沉淀na2hpo4中是高度有效的,如从图5中提供的试验数据可看出的。图5示出当增加量的丙酮添加至混合物中时水/丙酮混合物中的na2hpo4浓度的非常急剧的降低。例如,当将fo之后的稀释汲取液冷却至室温时,得到10wt%的na2hpo4上清液。还测量水和丙酮的重量百分比,并且在图5中给出以用于参考。有趣的是,沉淀的晶体中的na2hpo4浓度实验上发现稳定在约40wt%,不管溶剂的添加量如何(参见图5中嵌入的)。这证实了晶体沉淀为十二水合物晶体形态,并且其他化合物如丙酮的存在不危害水合物晶体的纯度。事实上这是na2hpo4的高度期望的属性之一,因为其促进汲取剂的再生和直接再使用。
另外,作为实例,我们在简单的实验室蒸发仪中测试了重量比为54:46的丙酮/水混合物的蒸馏效率。产物水中的总有机碳含量(toc)可以容易地达到92ppm的水平。尽管该toc浓度可能已经超过作为饮用水的使用限度,但是对于一些工业应用来说可能是足够的。另外,我们相信当在实际工厂中使用更有效的分馏组件时产物水中的toc应当低得多。最后在该提取结晶和除去丙酮(即经由蒸馏)之后,产物水中的残余na2hpo4汲取剂可以简单地在相对低的压力下(估计在1bar下)泵送通过nf或rf精处理(polishing)组件,因为na2hpo4浓度根据提取结晶期间的溶剂的使用量可以低到0.28wt%。当需要时,该最终的处理步骤可以容易地整合到通常在ro工厂中建立以得到更高的纯度的精处理步骤中。
实施例3
水通量和汲取剂反扩散测量
fo期间的水通量通过监控进料液重量随时间减少而以切向流机构(cross-flowsetup)测量。该方法源自于已报道的标准程序[31]。进料液和汲取液的初始重量分别为500g和200g。有效的膜面积是58.5cm2。进料和汲取液并流流动,以便减少对膜的张力应力。流量为400ml/min,并且在进料和汲取侧都使用塑料隔离物以减少浓度极化。试验期间,监控汲取液和进料液中的温度,分别为50±1℃和46±2℃。进料液和汲取液的浓度在测量期间实质上保持恒定。水通量测量以fo模式(选择性膜层面向进料液)和pro模式(选择性层面向汲取液)两种模式进行。水通量通过以下计算:
通量=δm/(a*t)(1)
其中δm是进料液重量减少的值(kg),t是相应的测量时间(h),a是以平方米为单位的膜面积。因此,如果水的密度假定为1kg/l,则通量的单位是升每平方米每小时(lmh)。
汲取剂反扩散通过在fo过程之后使用离子色谱测量1小时进料液中的[hpo42-]来监控。在fo之前还测试来自初始进料中的对照样品。进料浓度通过在fo试验期间添加去离子水保持恒定。逆向扩散到进料液的na2hpo4的量(mr,以克为单位)通过对比fo前后的[hpo42-]浓度来得到。然后通过如下测定以克每平方米每小时(gmh)为单位的汲取剂的逆向通量:
通量汲取=mr/(a*t)(2)
其中a是有效膜面积(m2),t是以小时为单位的fo持续时间。
图2示出na2hpo4汲取液对各种盐度的进料液产生的水通量曲线。40wt%的汲取液可以以pro模式和fo模式从人造海水(3.5wt%nacl)分别产生19lmh和8lmh的高水通量。注意:这些水通量值比得上商业的海水ro厂的约12至15lmh的水通量值。fo模式与pro模式相比相对更低的水通量可归因于fo模式中的严重稀释的内部浓度的极化[5],这是利用当前产生的不对称膜的任何fo过程的常规现象。尽管水通量随着进料液的盐度增加由于通过膜的渗透压梯度降低而降低,但是即使当进料液的盐度增加至几乎为海水的盐度的5倍的17wt%nacl时,水通量也仍然保持在约1.0lmh。如果有更好的膜可更好地缓和内部浓度极化,则pro和fo两种模式中的水通量预期得到改善。然而,需要特别注意的是,40wt%的na2hpo4汲取液可以从具有这样高盐度的进料中在1.0lmh下汲取水。这意味着通过该新的汲取剂能够进行的fo脱盐,对于在逆流fo组件(counter-currentflowfomodule)中在低压下的海水脱盐而言,可以潜在地实现80%的水回收,这对于ro来说是不可能实现的。另外,其他困难的进料流,例如,不能经由ro处理的海水ro盐水和从页岩气行业中产生的水[4,34],现在使用该汲取液可以经由fo来处理。
事实上,新的汲取液提供了将盐水浓缩至相当于17wt%nacl的同渗重摩的可能性。有利地,这可以导致液体废弃物排放的显著减少,并且甚至可以有助于迈向零液体排放。
本文中产生的结果还表明了na2hpo4汲取剂具有非常低的反扩散,通常小于1gmh,例如,对于30wt%汲取液为0.86gmh。认为如果有更好的膜,则可以进一步降低。与其他无机(尤其是单价的)盐报道的数据[7](对于5wt%nacl典型地为9gmh)相比,na2hpo4的反扩散值低,并且甚至好于分子量类似于na2hpo4的两性离子如甘氨酸甜菜碱(2gmh)报道的值[10],并与离子液体汲取剂(~0.5gmh)报道的数据相当[19]。
不希望受理论束缚,这样的低水平的反扩散可以归因于二价阴离子hpo42-,因为相对大尺寸的hpo42-可以防止反扩散。此外,hpo42-阴离子与膜之间的静电排斥也可以起到作用,因为该实施例中使用的fo膜已知具有负的ζ电位[31]。另外,汲取剂中的阳离子种类也可以是重要的,因为已经报道过阳离子由于来自带负电的膜的吸引经常显示比阴离子高的通量,并且汲取液与进料液之间的双向阳离子交换是不可避免且明显的[35]。因此,如果汲取液的阳离子不同于na+(例如nh4+),则由于跨膜浓度梯度经由离子交换而失去阳离子,会发生汲取剂的不必要的损失。在汲取液中使用与进料(na+)中相同的阳离子而不是不同的阳离子(例如,铵),可以消除任何的涉及到这样的阳离子交换的电位问题。
图3示出从基于上述程序的溶解度测量中得到的na2hpo4的相图。在于50℃下进行的fo过程期间,40wt%的初始汲取液由于从进料流中跨膜汲取淡水而被稀释。在超过室温时进行fo是不寻常的[12,22]。接着将稀释汲取液从50℃冷却至结晶温度如25、20或10℃,以便回收汲取剂。如图3的na2hpo4相图中所示,稀释汲取液(例如,20wt%)在冷却时相分离为饱和上清液相和na2hpo4·12h2o水合物晶体相。
特别有趣和期望的是水合物晶体相的形态不依赖于温度,并且总是na2hpo4·12h2o。这是因为这些固体晶体可以从液态上清液中容易地除去并且在32℃下再熔化为液态,无机组分实际上‘自溶解’到释放的结晶水中从而在45℃下形成恰好40wt%的溶液(基于无水na2hpo4),准备泵回以作为汲取液用于直接再使用。这提供了潜在的第一步骤的汲取剂回收,其使汲取剂的大部分再生以用于直接再使用。第二步骤是回收液态上清液中仍然残留的汲取剂(例如,通过溶剂辅助的结晶或其他手段)。
另一方面,上清液中的na2hpo4的浓度依赖于结晶温度。当将稀释汲取液分别冷却至25、20和10℃时,得到10.5、7.5和4.2wt%的上清液,它可以进一步处理。各相的重量比可以通过杠杆原理确定。例如,当结晶温度为室温时,由于饱和上清液的浓度为约10.5wt%,上清液与晶体的重量比应当为约2:1。然而,如果温度进一步降低至10℃,则由于上清液中的盐更多地沉淀为晶体,重量比为约4:3。
参考文献
[1]p.aldhous,theworld'sforgottencrisis,nature,422(2003)251-251.
[2]y.ghalavand,m.s.hatamipour,a.rahimi,areviewonenergyconsumptionofdesalinationprocesses,desalinationandwatertreatment,(2014)1-16.
[3]m.elimelech,w.a.phillip,thefutureofseawaterdesalination:energy,technology,andtheenvironment,science,333(2011)712-717.
[4]d.l.shaffer,l.h.ariaschavez,m.ben-sasson,s.romero-vargascastrillon,n.y.yip,m.elimelech,desalinationandreuseofhigh-salinityshalegasproducedwater:drivers,technologies,andfuturedirections,environscitechnol,47(2013)9569-9583.
[5]t.cath,a.childress,m.elimelech,forwardosmosis:principles,applications,andrecentdevelopments,journalofmembranescience,281(2006)70-87.
[6]b.mi,m.elimelech,organicfoulingofforwardosmosismembranes:foulingreversibilityandcleaningwithoutchemicalreagents,journalofmembranescience,348(2010)337-345.
[7]a.achilli,t.y.cath,a.e.childress,selectionofinorganic-baseddrawsolutionsforforwardosmosisapplications,journalofmembranescience,364(2010)233-241.
[8]r.k.mcgovern,j.h.lienhardv,onthepotentialofforwardosmosistoenergeticallyoutperformreverseosmosisdesalination,journalofmembranescience,469(2014)245-250.
[9]q.ge,j.su,g.l.amy,t.s.chung,explorationofpolyelectrolytesasdrawsolutesinforwardosmosisprocesses,waterres,46(2012)1318-1326.
[10]k.lutchmiah,l.lauber,k.roest,d.j.h.harmsen,j.w.post,l.c.rietveld,j.b.vanlier,e.r.cornelissen,zwitterionsasalternativedrawsolutionsinforwardosmosisforapplicationinwastewaterreclamation,journalofmembranescience,460(2014)82-90.
[11]c.x.guo,d.zhao,q.zhao,p.wang,x.lu,na(+)-functionalizedcarbonquantumdots:anewdrawsoluteinforwardosmosisforseawaterdesalination,chemicalcommunications,50(2014)7318-7321.
[12]m.l.stone,a.d.wilson,m.k.harrup,f.f.stewart,aninitialstudyofhexavalentphosphazenesaltsasdrawsolutesinforwardosmosis,desalination,312(2013)130-136.
[13]q.ge,t.s.chung,hydroacidcomplexes:anewclassofdrawsolutestopromoteforwardosmosis(fo)processes,chemicalcommunications,49(2013)8471-8473.
[14]h.bai,z.liu,d.d.sun,highlywatersolubleandrecovereddextrancoatedfe3o4magneticnanoparticlesforbrackishwaterdesalination,separationandpurificationtechnology,81(2011)392-399.
[15]r.alnaizy,a.aidan,m.qasim,drawsoluterecoverybymetathesisprecipitationinforwardosmosisdesalination,desalinationandwatertreatment,51(2013)5516-5525.
[16]y.c.kim,s.han,s.hong,afeasibilitystudyofmagneticseparationofmagneticnanoparticleforforwardosmosis,waterscience&technology,64(2011)469.
[17]m.noh,y.mok,s.lee,h.kim,s.h.lee,g.w.jin,j.h.seo,h.koo,t.h.park,y.lee,novellowercriticalsolutiontemperaturephasetransitionmaterialseffectivelycontrolosmosisbymildtemperaturechanges,chemicalcommunications,48(2012)3845-3847.
[18]y.mok,d.nakayama,m.noh,s.jang,t.kim,y.lee,circulatoryosmoticdesalinationdrivenbyamildtemperaturegradientbasedonlowercriticalsolutiontemperature(lcst)phasetransitionmaterials,physchemchemphys,15(2013)19510-19517.
[19]y.cai,w.shen,j.wei,t.h.chong,r.wang,w.b.krantz,a.g.fane,x.hu,energy-efficientdesalinationbyforwardosmosisusingresponsiveionicliquiddrawsolutes,environmentalscience:waterresearch&technology,inpress(2015).
[20]m.l.stone,c.rae,f.f.stewart,a.d.wilson,switchablepolaritysolventsasdrawsolutesforforwardosmosis,desalination,312(2013)124-129.
[21]y.cai,w.shen,r.wang,w.b.krantz,a.g.fane,x.hu,co2switchabledualresponsivepolymersasdrawsolutesforforwardosmosisdesalination,chemicalcommunications,49(2013)8377-8379.
[22]j.r.mccutcheon,r.l.mcginnis,m.elimelech,anovelammonia—carbondioxideforward(direct)osmosisdesalinationprocess,desalination,174(2005)1-11.
[23]j.r.mccutcheon,r.l.mcginnis,m.elimelech,desalinationbyammonia–carbondioxideforwardosmosis:influenceofdrawandfeedsolutionconcentrationsonprocessperformance,journalofmembranescience,278(2006)114-123.
[24]r.l.mcginnis,m.elimelech,energyrequirementsofammonia–carbondioxideforwardosmosisdesalination,desalination,207(2007)370-382.
[25]d.l.shaffer,j.r.werber,h.jaramillo,s.lin,m.elimelech,forwardosmosis:wherearewenow?,desalination,(2014).
[26]a.apelblat,e.manzurola,solubilitiesofl-aspartic,dl-aspartic,dl-glutamic,p-hydroxybenzoic,o-anisic,p-anisic,anditaconicacidsinwaterfromt=278ktot=345k,thejournalofchemicalthermodynamics,29(1997)1527-1533.
[27]s.h.yalkowshy,y.he,p.jain,handbookofaqueoussolubilitydata,secondedition,crcpress,2010.
[28]w.m.haynes,crchandbookofchemistryandphysics,95thedition,2014.
[29]n.kubantseva,r.w.hartel,solubilityofcalciumlactateinaqueoussolution,foodreviewsinternational,18(2002)135-149.
[30]h.luo,q.wang,t.c.zhang,t.tao,a.zhou,l.chen,x.bie,areviewontherecoverymethodsofdrawsolutesinforwardosmosis,journalofwaterprocessengineering,4(2014)212-223.
[31]b.d.coday,d.m.heil,p.xu,t.y.cath,effectsoftransmembranehydraulicpressureonperformanceofforwardosmosismembranes,environscitechnol,47(2013)2386-2393.
[32]r.l.mcginnis,osmoticdesalinationprocess,in,uspatents6,391,205b1,2002.
[33]a.panson,g.economy,c.t.liu,t.bulischeck,w.lindsay,sodiumphosphatesolubilityandphaserelationsbasisforinvariantpointchemistrycontrol,journaloftheelectrochemicalsociety,122(1975)915-918.
[34]b.d.coday,p.xu,e.g.beaudry,j.herron,k.lampi,n.t.hancock,t.y.cath,thesweetspotofforwardosmosis:treatmentofproducedwater,drillingwastewater,andothercomplexanddifficultliquidstreams,desalination,333(2014)23-35.
[35]x.lu,c.boo,j.ma,m.elimelech,bidirectionaldiffusionofammoniumandsodiumcationsinforwardosmosis:roleofmembraneactivelayersurfacechemistryandcharge,environscitechnol,48(2014)14369-14376.
[36]d.k.brenner,e.w.anderson,s.lynn,j.m.prausnitz,liquid-liquidequilibriaforsaturatedaqueoussolutionsofsodiumsulfate+1-propanol,2-propanol,or2-methylpropan-2-ol,journalofchemicalandengineeringdata,37(1992)419-422.
[37]s.lynn,a.l.schiozer,w.l.jaecksch,r.cos,j.m.prausnitz,recoveryofanhydrousna2so4fromso2-scrubbingliquorbyextractivecrystallization:liquid-liquidequilibriaforaqueoussolutionsofsodiumcarbonate,sulfate,and/orsulfiteplusacetone,2-propanol,ortert-butylalcohol,industrial&engineeringchemistryresearch,35(1996)4236-4245.
[38]a.m.ting,s.lynn,j.m.prausnitz,liquid-liquidequilibriaforaqueoussystemscontainingn,n-diethylmethylamineandsodiumchlorideorsodiumsulfate,journalofchemicalandengineeringdata,37(1992)252-259.
- 还没有人留言评论。精彩留言会获得点赞!