用于具有集成热回收的变温循环过程的热化学反应器系统及用于操作其的方法与流程
本发明涉及根据一种根据权利要求1所述的热化学反应器系统和一种根据权利要求18所述的用于操作其的方法。
背景技术:
在不同温度水平下进行的技术过程非常普遍。因此,一个过程步骤在较高温度下进行,而另一个过程步骤在较低温度下进行。这些过程中的大多数涉及需要催化或反应材料的化学反应。
这些过程也可描述为变温循环过程,作为涉及在不同温度下进行的可逆吸热/放热反应的多步骤过程。
该过程类别包括替代燃料生产(合成气和碳氢化合物生产)和氧分离的领域中的还原氧化过程,或同样用于从空气中分离二氧化碳和水的吸附-解吸过程以及用于从空气或其它气体中分离二氧化碳的碳化-脱碳(carbonation-decarbonation)过程。
来自水和二氧化碳的合成气和碳氢化合物合成
来自可再生能源的替代燃料生产正在变得越来越重要。两种广泛可用且丰富的可再生资源是水h2o和二氧化碳co2。两种气体都可转化为一氧化碳co和氢气h2(也称为合成气)和烃类如甲烷ch4,该甲烷ch4继而又可用于合成其它有价值的化学物质。
使用太阳能作为用于h2o和co2转化的能源是适用的和生态的。因此,过去已经开发了用于由可再生能源h2o和co2生产液体燃料的太阳能热化学过程。间歇性太阳能这样转化为化学燃料提供了太阳能的长期储存和远距离输送。
太阳能热化学路径最通常基于使用金属氧化物作为中间体的两步还原-氧化(氧化还原)循环。在吸热还原步骤中,金属氧化物在温度t还原下还原,使用聚集太阳辐射作为高温过程热源:
其中δ是氧非化学计量。在放热氧化步骤中,金属氧化物在温度t氧化≤t还原下以h2o和co2氧化以产生合成气(h2和co的混合物):
合成气可使用例如公认的费-托合成和其它气体到液体过程转化为液体和气态燃料,例如柴油、煤油、汽油、甲醇和甲烷,以及其它烃类燃料。由于其形态稳定性和其快速动力学,二氧化铈目前被认为是对于太阳能热化学燃料生产的基准氧化还原材料。通常对于二氧化铈,t还原约1500℃且t氧化约800℃。
该过程的技术和经济可行性的最重要指标是两步氧化还原循环的太阳能到燃料能量转换效率,定义如下:
其中hhv是产物气体的较高热值,n是产生的摩尔数,q太阳能是太阳能输入,并且qpenalties是所需的任何附加能量,如泵送功和气体分离。
为了评估该过程的潜在效率,可应用热力学分析。对于0%、50%和100%热回收,纯铈在δ=0.1时的最大理论效率分别为20%、30%和60%。从概念上讲,将反应焓与可回收热分离以了解该过程的最终热力学极限是令人感兴趣的。纯压力变化(等温)循环与组合压力-变温循环的比较表明,无论氧化还原材料如何,最大效率都受到等温循环的显著限制。这是由于氧化期间热力学限制的产物气体浓度。
具有组合压力-变温的循环已经在实验中得到证实,并且观察到导致最高效率:利用使用二氧化铈作为氧化还原材料的实验室规模4kwth的太阳能反应器获得最大证明效率,导致η太阳能到燃料>5%。在这些太阳能实验运转中,t还原约1500℃并且t氧化约800℃,并且还原期间的总压力为p总=10mbar。
为了使燃料生产在经济上可行,需要更高的效率。确定以太阳能反应器设计达到更高效率所需的主要改进是(marxer等,energy&fuels,卷29,页241-3250,2015):
-回收还原和氧化温度之间的氧化还原材料的显热;
-回收由离开反应器的热气携带的显热;
-通过反应器孔口减少再辐射损失;
-通过反应器的隔热减少传导热损失。
随着面积与体积比减小,通过绝缘材料的传导损失通常随着反应器尺寸的增加而降低,并因此对于中试和工业规模的反应器来说不太重要。通过更高的太阳能集中比或更低的操作温度可在一定程度上减少再辐射损失,其中前者主要取决于太阳能光学设计,而后者主要取决于氧化还原材料的反应性质。
另一方面,显热回收是反应器设计的问题。这是最关键的改进,因为将氧化还原材料从t还原加热到t氧化所需的能量通常显著大于反应所需的能量以及由于再辐射引起的能量损失。如上所述,将显热回收率从0%提高到100%会导致使用二氧化铈作为氧化还原材料的最大太阳能到燃料效率从20%增加到近60%(scheffe和steinfeld,energy&fuels,卷26,页1928-1936,2012)。
已经提出了若干结合氧化还原材料的显热回收的反应器概念:
1.提出了一种由反向旋转的氧化还原材料环组成的设计,其中一侧暴露于聚集太阳辐射并保持在还原温度,而另一侧保持在氧化温度(diver等,proceedingsofasme4thinternationalconferenceonenergysustainability,卷2,页97-104,2010)。反向旋转环充当固-固热回收器。
2.开发了具有两个同心反向旋转筒的概念,其中中空外筒由二氧化铈制成,而内筒由惰性陶瓷制成,以提供热回收机制(lapp等,journalofsolarenergyengineering-transactionsoftheasme,卷135,第3号,2013)。
3.由(ermanoski等,journalofsolarenergyengineering-transactionsoftheasme,卷135,第3号,2013)提出的方法基于氧化还原材料颗粒的连续移动的填充床。使用固-固热交换器,在氧化和还原的颗粒之间交换显热能。
4.由(felinks等,appliedthermalengineering,卷73,页1006-1013,2014)提出的概念也基于氧化还原材料颗粒。然而,代替固-固热交换器,将由小颗粒组成的固相传热介质与氧化还原材料混合并用于回收显热能。
使用甲烷作为还原剂来自水和二氧化碳的合成气和烃合成
备选地,使用金属氧化物作为中间体的两步还原-氧化(氧化还原)循环可在高温还原步骤期间使用还原剂如ch4进行,以降低所需温度用于实现一定的还原延伸。因此,根据以下生产h2与co比为2的合成气:
其中δ是氧非化学计量。还原的金属氧化物的再氧化再次用h2o和co2进行以产生合成气:
与没有还原剂的还原相比,在还原反应期间使用还原剂如甲烷降低了为达到类似的还原所需的还原温度。用甲烷还原的产物是1/3的一氧化碳和2/3的氢合成气混合物。随后,用水和/或二氧化碳将还原的反应材料再氧化至其初始状态,以产生氢和/或一氧化碳。
从空气和其它气体混合物中的氧分离
可再生化学燃料可经由co2和h2o的太阳能驱动的电、光和热化学分解来合成。后一途径利用整个聚集太阳辐射光谱作为高温过程热,用于经由金属氧化物氧化还原循环产生co和h2(合成气)。该途径的一个关键缺点是消耗惰性气体用于降低氧分压(po2),用于使还原步骤的热力学平衡转变为较低温度。这继而又要求从排气中分离o2用于循环惰性载气并关闭材料循环。
氧的分离已经成为各种商业应用中的要求,如氧燃烧、碳质原料的自热气化,以及对于o2除去以避免催化剂在燃料电池中由o2钝化,以及在使生物燃料脱氧以使其更类似于石油衍生燃料时。
工业上,可通过利用沸石和碳分子筛的变压吸附(psa),通过陶瓷离子-电子传导(miec)膜和通过低温蒸馏将o2与空气分离。psa和miec膜不能产生高纯度的惰性气体,并且在低po2下利用膜从气体混合物分离o2依赖于具有更低po2的汽提气体(strippinggas)。这些分离技术还需要输入范围从每公吨o2100至350kwh的电功,这会损害太阳能到燃料的能量转换效率。由于太阳能热化学循环固有地遭受热损失,因此利用由废热驱动的氧气分离技术将是有益的。
用金属氧化物氧化还原材料如cu2o/cuo、mn3o4/mn2o3和coo/co3o4的热化学固态o2分离(tssos)利用低级过程热并且不需要电。tssos具有经由变温在低po2下分离和浓缩o2的潜力。
目前现有技术的tssos氧化还原材料cu2o具有约200mmolo2每摩尔cu2o的最大氧交换容量(δδ,即在还原和氧化条件之间的氧非化学计量的差异),当在1120和1450k之间循环时,在大约10μmolo2min-1g-1cu2o下交换。然而,cu2o不能与600-900k下的低级过程热一起使用。
钙钛矿提供了一种备选材料,其能够在较低温度下利用低等级太阳热能,如来自太阳能燃料生产过程的废热。钙钛矿在大范围的氧非化学计量比下具有高氧传导性和稳定的晶体结构。
氧交换能力表征在吸热还原期间在低温下的高能量转换效率与高氧化物还原温度下的氧分离过程的高速和延伸之间的折衷。对于具有abo3-δ化学计量的钙钛矿,其中a和b是十二和六配位空隙中的金属阳离子,tssos氧化还原循环可利用如下表示:
氧化物氧化:
氧化物还原:
从概念上讲,经由低温下钙钛矿的氧化,在低po2下从气体混合物中汽提出o2。这作为氧化步骤的输出产生了具有降低的po2的惰性气体,而浓缩的o2在升高的温度下从固体释放并且经由金属氧化物的部分还原而增加po2。srcoo3-δ、bacoo3-δ和bamno3-δ钙钛矿以及ag2o和cu2o参考的热重分析和高温x射线衍射显示srcoo3-δ的优越性能,以600-900k下12.1μmolo2min-1g-1下交换的44mmolo2mol-1srcoo3-δ的氧交换能力超过了在这些条件下的现有技术的cu2o的性能。
二氧化碳和水从空气和其它气体混合物中的吸附/解吸
在减少人为co2排放的几种策略中,直接从环境空气中捕获co2(通常称为直接空气捕获(dac))最近引起了越来越多的关注。dac的优势在于它能够解决来自分布式和移动源的现有和过去的排放,例如,源自运输部门。此外,dac系统不需要附接到排放源,而是可在逻辑上集中并且位于co2存储/处理站点或大量可再生(例如太阳能)能量源的旁边。具体而言,从大气中提取的co2可在封闭的材料循环中使用可再生能源加工成合成液态烃燃料。因此,dac独特地提供了真正可持续的基于液体燃料的能源未来的可能性。虽然一些研究声称dac可能潜在地变得具有竞争力而其它人质疑其经济可行性,但显然需要对dac的基本原理进行额外的研发,以可靠地评估其最终的工业规模适用性。
此外,如果h2o与环境空气共同提取,则在使用聚集的太阳能生产合成液态烃燃料时可实现主要的物流效益。太阳能燃料生产厂将位于地球阳光地带的荒芜地区,拥有大量的直接太阳辐射,但淡水资源有限或没有。因此,在dac过程中共同提取的水可成为有价值的副产品。注意,如果可获得海水,通过反渗透海水淡化的淡水提取比经由吸附从空气中的水提取的能量效率高出约两个数量级。
固体胺官能化材料已被确定为针对dac的有希望的吸附剂,因为它们在极低的co2分压下(如在环境空气的情况下)提供相对高的比co2容量和吸收速率。以前对这些材料的绝大多数研究都集中在最大化其co2吸附能力,而吸附剂再生通常通过用惰性气体吹扫来实现,再次产生高度稀释的co2。对于下游应用来说,浓缩的高纯度co2的解吸显然是至关重要的,但是这个问题基本上被忽视了。一些研究应用蒸汽汽提、湿度变化或温度-真空变化(tvs)过程以从空气中获得浓缩的co2。
胺官能化固体吸附剂的另一个有趣的优点是它们对空气湿度的耐受性。与诸如沸石的物理吸附剂相比,与干燥条件相比,在潮湿条件下观察到co2吸附容量的增加。然而,大量的水与潮湿气体共同吸附。假定氨基甲酸酯和氨基甲酸的形成是在干燥和潮湿条件下胺改性的二氧化硅上主要的基础co2吸附机理。对于胺改性纤维素总结出类似机制。可能通过物理吸附发生h2o的额外吸附。
与烟道气相反,空气的摩尔含水量通常比其co2含量高一至两个数量级。因此,每克吸附剂材料的水吸附可基本上超过co2吸附。这继而又意味着吸附剂再生期间对于水解吸的显著热量需求。所需的水解吸热将通常与共吸附水的蒸发热具有相同的数量级。尽管几种提出的dac概念基于胺官能化材料,但是在co2捕获期间它们的水的共吸附几乎没有量化。对于没有co2浓度的航天器空气再生,显示了基于胺的吸附剂上的h2o吸附的数据。测量了胺接枝的孔扩中孔性硅胶上的水吸附等温线,但仅用于单组分吸附。在柱-穿透实验中分析了co2和h2o在胺官能化二氧化硅上的共吸附,但没有提取浓缩的co2。
取决于空气相对湿度,基于测量的h2o和co2容量的tvs过程的特定能量需求估计为12.5kj/molco2的机械(泵送)功,以及在低于100℃时493至640kj/molco2的热。对于2mmol/g的目标co2容量,热需求将降低至272至530kj/molco2之间,这很大程度上取决于共吸附水的量。
经由碳化-脱碳热化学循环从空气中的co2捕获
大多数co2捕获技术涉及燃烧前化石燃料的脱碳或从燃烧烟道气中分离co2。考虑到来自运输和其它分布源的增加的排放,从环境空气中的co2捕获对于实现大气中全球co2浓度的稳定可能是必要的。
从空气中的co2捕获(相对于从烟道气流中的捕获)在热力学上是不利的,因为分离更稀释得多的气体需要更高的吉布斯自由能变化。然而,在此情况下,捕获设备可策略性地位于可再生能量源和最终储存地点附近,如具有高太阳辐射的居住沙漠和巨大的地质储存蓄水库。从空气中捕获co2具有物流和环境方面的优势,远离人口稠密的城市进行,并且不会为其捕获和运输产生额外的co2。
特别感兴趣的是基于cao的碳化-煅烧热化学循环,由净可逆反应代表:
该反应已经广泛研究用于从燃烧烟道气中分离co2,并且目前正在考虑使用太阳能从空气中分离co2。
如上面所提及的,所有这些过程的共同之处在于它们需要变温,涉及在不同温度下进行的可逆吸热/放热反应。
因此,希望提供一种针对可在不同温度下操作的这种变温过程的反应器系统。特别希望提供一种变温循环过程的概念,其中在一个过程步骤中释放的热能可储存并再循环到热化学循环中以用于需要热能的过程。
技术实现要素:
因此,本发明的目的在于提供这样的反应器系统,其中反应区在不同的温度下操作,使得提高了该过程的产量和总效率。
该目的通过根据权利要求1所述的热化学反应器系统和根据权利要求18所述的用于操作该热化学反应器的方法来解决。
因此,提供了一种用于具有集成热回收的变温循环过程的热化学反应器系统,其包括
-至少两个模块,其中每个模块包括至少一个化学反应区(crz)和至少一个热能储存单元(tes),
-其中至少两个模块可操作地连接用于至少一种传热流体(htf),用于在两个模块之间传输热量,
-其中每个化学反应区(crz)包括至少一种反应材料,该反应材料在温度t吸热下以可逆方式经历吸热反应,并且在温度t放热下经历放热反应,其中t吸热和t放热彼此不同,
-其中至少一种反应材料设在化学反应区(crz)中的每个内的至少一个封装中,使得避免了反应材料与所述至少一种传热流体的接触。
还可将封装(或包装)描述为用于反应材料的单独反应室。在封装或反应室中布置反应材料允许反应材料与传热流体分离,该传热流体将热输入和输出相应反应区中的反应材料,具有以下若干优点:
•htf不需要对于反应材料(如氧化还原材料)呈惰性,并且可为例如空气。
•在温度循环(例如氧化还原循环)期间,htf未以o2污染,并且o2可作为副产物分离。
•储热器和反应区可在不同压力和气体氛围下运行。例如,热存储单元可在p>p环境(超压)下操作以减少泵送功,而反应区可在p<p环境(真空)下操作以增强化学反应。
•来自两步热化学循环的产物可很容易地提取,因为它们在封装内以相对小的体积(与存储容积相比)产生。
如果反应材料未包封并因此不与htf分离,则htf必须是惰性的并且不能含有o2,这会阻止化学反应。在此情况下,需要使用惰性htf、如ar或n2,它们在热化学循环过程期间由产生的o2污染,并因此需要通过单独的过程进行清洁以再次重复使用。这引起能量和经济上的损失。
在本反应器系统的一个实施例中,每个化学反应区中的至少一种反应材料是至少一种金属氧化物,其在还原温度t还原下还原并在氧化温度t氧化下氧化,其中t还原和t氧化彼此不同。具体而言,t还原>t氧化。
金属氧化物可用于
a)用于将水和二氧化碳转化为包含氢和一氧化碳的合成气的反应材料的还原-氧化;
b)用于将水和二氧化碳转化为烃、特别是ch4的反应材料的还原-氧化;
c)借助还原剂如甲烷还原反应材料,以得到还原的反应材料和合成气。随后,还原的反应材料以水和/或二氧化碳氧化以形成初始反应材料和氢气和/或一氧化碳,和/或
d)用于从空气或从任何其它气体混合物中分离氧的反应材料的还原-氧化。
a)、b)和c)中使用的金属氧化物可包括ceo2,ceo2以至少一种过渡金属和/或至少一种稀土金属氧化物或至少一种钙钛矿掺杂。
考虑用于基于二氧化铈的循环的掺杂剂包括+2(ca、sr、li)、+3(sm、gd、y、cr、pr、la、sc)和+4(zr、hf)阳离子。通过用过渡金属和稀土金属氧化物掺杂其萤石结构来改变二氧化铈的热力学和动力学性质,可影响还原和氧化温度,使得材料可在较低的t还原下还原。这通常与较低的t氧化结合,这是将材料完全氧化回其初始状态所需的。
通用形式abo3的钙钛矿是另一种备选氧化还原材料。与掺杂ceo2类似,与纯二氧化铈相比,钙钛矿如la1-xsrxmno3(x=0.3-0.4)显示出不同的热力学和动力学性质,并因此允许在较低的t还原和t氧化下操作。
d)中的金属氧化物可包括cu2o/cuo、mn3o4/mn2o3和coo/co3o4或钙钛矿,如srcoo3-δ、bacoo3-δ和bamno3-δ。
在本反应器系统的另一个实施例中,每个化学反应区中的至少一种反应材料是至少一种化合物的在吸附温度t吸附下经历吸附并在解吸温度t解吸下解吸的至少一种材料,特别是至少一种气体,其中t吸附和t解吸彼此不同。
这例如适用于通过反应材料进行吸附-解吸的情况,该反应材料用于从空气或含有任何这些化合物的任何其它气体混合物中分离二氧化碳和/或水。这里,反应材料可为固体胺官能化材料,例如n-(2-氨基乙基)-3-氨基丙基甲基二甲氧基硅烷和原纤化纤维素悬浮液。
在本发明反应器系统的另一实施例中,每个化学反应区中的至少一种反应材料是在温度t碳化下经历碳化反应并且在温度t脱碳下与co2脱碳的至少一种材料,其中t碳化和t脱碳彼此不同。
这例如适用于从环境空气或从任何其它气体混合物中分离co2的反应材料的碳化/脱碳的情况。这里,反应材料可为碱金属氧化物或碱土金属氧化物,特别是在碳化期间转化为caco3的cao。
在本反应器系统的一个优选实施例中,两个化学反应区中的每一个与相应的热能储存单元相邻;即,第一化学反应区与第一热能储存单元相邻,而第二化学反应区与第二热能储存单元相邻。在本上下文中,“相邻”意指彼此直接接触,例如化学反应区布置在热存储单元的顶部上。
因此,特别优选的是,两个化学反应区中的每一个都布置在相应的垂直定向的热存储单元的顶部上。所述热存储单元的垂直布置允许利用分层并确保径向良好分布的颗粒床。因此,提供了一种双储存反应器系统,其由两个垂直定向的储热单元组成,如惰性材料的填充床,在其顶部上放置有包含封装的反应材料的化学反应区。
在本反应器系统的另一个优选实施例中,含有反应材料的至少一个封装与传热流体通过化学反应区的流动方向垂直、平行或以任何其它角度布置。
在本反应器系统的一个变型方案中,反应材料设在至少两个封装中,优选地在每个化学反应区中三个、四个或更多个。
在又另一个实施例中,至少一个封装以至少一个管或室的形式提供。
管或室优选地允许包封材料彼此平行和/或垂直布置。
在反应材料设在管中的情况下,管可以以单层或多层彼此平行布置。多个层可进一步彼此平行或垂直地堆叠。管层也可彼此偏移并且以1-90°之间的任何合适的角度布置;即,管层可旋转任何合适的角度,例如90°。
在反应材料设在室中的情况下,可将此室插入外壳中。室可类似雕刻到材料块中的凹槽形成。在材料块中可存在若干彼此平行布置的这种凹槽。室或凹槽优选地垂直地或以与htf流动方向成1-90°之间的任何合适的角度布置。在一个特别优选的实施例中,反应材料可封装在类似于燃料电池堆的堆叠中。因此,传热流体流过专用通道,而反应材料包含在分开的室中。
在本反应器系统的又一最优选实施例中,至少一个封装提供为管,其具有至少一个气体入口(例如用于将co2和h2o加入到具有温度t氧化的氧化还原材料中)和至少一个气体出口(例如,用于输送在具有温度t氧化的氧化还原材料外的氧化后获得的合成气)。
外壳或封装可由任何导热材料制成,特别是氧化铝或碳化硅或高温合金。
通常,外壳或封装材料应具有以下特性:
•储存材料和反应材料、如氧化还原材料两者应为惰性;
•必须承受所需的温度(tmax≥t还原);
•应提供从htf到反应材料的良好热传递,因此应具有高导热性;以及
•应该抑制o2从htf扩散到反应材料、例如氧化还原材料。
例如,在ceo2和相关的掺杂的ceo2或钙钛矿用作氧化还原材料的情况下,可使用氧化铝al2o3。潜在的备选方案可为碳化硅sic。如果反应器在tmax<1200℃下操作,例如通过使用新的钙钛矿氧化还原材料(其允许在这些温度下操作)或通过使用还原剂如ch4(g)、h2(g)或c(s),其促进氧化还原材料的还原,然后高温合金如因科镍合金(inconel)也可用作封装材料。
在本反应器系统的又另一优选变型方案中,使用至少两种、优选地至少三种具有不同还原/氧化温度或不同吸附/解吸温度的反应材料,其中不同的反应材料沿htf的流动方向串联布置。反应材料(例如氧化还原材料)可布置成使得t还原/氧化材料1>t还原/氧化材料2>t还原/氧化材料3。所述布置也可描述为级联氧化还原反应器。
在此情况下,反应材料中的每种可布置在管或堆叠中,使得在反应材料之间产生温度梯度,其中管和堆叠优选地垂直于htf流动方向布置。
反应材料封装在管或堆叠中,以防止传热流体和反应材料的直接接触。因此,不同的反应材料沿反应区的高度布置,使得各种材料的不同热力学和动力学性质(例如还原和氧化行为)最佳地适合化学反应区内的温度分布。例如,在其处达到最高温度的化学反应区的顶部中,选择对这些温度具有合适的热力学和动力学性质的材料,例如ceo2。在其处温度低于在顶部中的反应区的较低水平中,选择具有与在顶部中不同的热力学和动力学性质的反应材料,其在这些较低温度下有利地操作,例如掺杂的ceo2或钙钛矿。
也可将不同的反应材料平行于htf流动方向封装。在此情况下,不同的反应材料可在同一封装内层合,使得在最高温度下具有最合适的热力学和动力学性质的材料再次位于最热的区域中,而在较低温度下具有最合适的热力学和动力学性质的一种材料位于在其处获得最低温度的反应区的区域中。
在任何情况下,反应物的入口都在crz处,其含有反应材料,其具有对于以h2o和/或co2氧化的最不利的反应热力学和动力学,并且crz的产物气体是包含反应材料的crz的反应气体,该反应材料具有对于以h2o和/或co2氧化的其次有利的热力学和动力学性质。
热能储存单元可以以显热(shs)和/或潜热(lhs),和/或可逆热化学过程(tcs)的反应热的形式存储热能。
shs系统通过提高储存材料(通常是固体或液体)的温度来实现储存。在这种材料中存储显热主要取决于其热容量,该热容量决定了能量密度和热扩散率。潜在的固体shs材料例如是岩石、混凝土、陶瓷、沙子或金属。目前最常用的液体shs材料包括合成油和熔盐。
在lhs系统中,附加的热存储为存储材料的相变焓。因此,这些系统利用在高温下改变相的材料,如在固-液或液-气过渡的情况下。
tcs系统利用来自诸如太阳能场的热源的热来驱动可逆的化学反应。因此,正向反应是吸热反应(吸收热量),而逆反应是放热(释放热量)。化学反应中储存的热量取决于反应热和转化程度。因此,在tcs中,热经由可逆的化学反应循环:它作为吸热反应的焓储存,并通过反应物的放热重组作为显热回收。
在当前情况下,热能储存单元可包括陶瓷砖、zro2粒料、二氧化硅或氧化铝球作为储热材料。当氧化还原材料被带到t还原和t氧化时,在变温层tes中使用的所述储热材料允许储存和释放热。当二氧化铈用作氧化还原材料时,在tes的顶部处的储存材料必须承受高达t还原的温度,例如1500℃。这种高温在钢铁工业中使用的再生器中是常见的,在其处陶瓷砖用于预热空气达到1300-1600℃。在25和980℃之间测试zro2粒料。二氧化硅和氧化铝也耐极高温。为了降低存储成本,可沿轴向使用不同的存储材料,取决于温度历史以及给定轴向位置处的最大热应力和机械应力。
提出了一种氧化铝球填充床作为优选的储热单元。氧化铝具有高存储密度并且与高温兼容。对于储存中使用的颗粒尺寸存在折衷。小颗粒增加对流传热速率并因此增加了热分层,然而,它们也增加压降。一种优化途径是使用较大的颗粒尺寸用于暴露于在其处压降较高的较高温度的储存材料,而暴露于较低温度的材料可具有较小的颗粒尺寸以增加热传递。
本反应器系统此外联接或连接到至少一个外部热能量源(ese),用于加热加热区段中的传热流体,该加热区段可操作地连接到化学反应区和热能储存单元。外部热能量源可从太阳能接收器和/或电加热元件和/或等离子炬和/或燃料燃烧获得过程热。然而,使用太阳能来加热传热流体是优选的。
用于从加热区段通过化学反应区和储热单元输送热量的传热流体(htf)可为空气、二氧化碳、氦、氩、氮、蒸汽、熔盐、熔融/液态金属、熔融玻璃、合成油。
此外,加热区段的htf可与tes中的htf不同,并且通过热交换器联接。在此情况下,除了上述htf之外,加热区段的可能的htf还包括碳化硅、氧化铝、二氧化硅、氧化锆和其它陶瓷的固体颗粒。
如之前所提及的,本反应器系统构造成使得它允许在不同温度下操作化学反应区中的反应材料。
因此,提供了一种操作反应器系统的方法,其中两个化学反应区中的一个在吸热反应的温度t吸热下操作,而另一个化学反应区在反应材料的放热反应的温度t放热下操作,其中对于化学反应区所需的热由传热流体提供。
传热流体将所需的过程热从包括第一化学反应区和第一热存储单元的一个模块传输到包括第二化学反应区和第二热存储单元的另一个第二模块。传热流体因此流过第一模块并随后流过第二模块。如果吸热区和放热区中的反应达到预定水平,则将切换流动方向,这将在下面进一步详细解释。因此,本方法可作为循环过程进行;htf在两个模块之间来回泵送。
在本方法的一个实施例中,两个化学反应区中的一个在还原温度t还原下操作,而另一个化学反应区在用作反应材料的金属氧化物的氧化温度t氧化下操作。可能的金属氧化物如上所述。
如之前所述,作为反应材料的金属氧化物可用于将水和二氧化碳转化为包含氢和一氧化碳的合成气。
然而,作为反应材料的金属氧化物也可用于将水和二氧化碳转化为烃,特别是ch4。
作为反应材料的金属氧化物也可用于将甲烷或其它气态烃转化为氢和一氧化碳。
此外可能使用金属氧化物作为反应材料,用于从空气或从任何其它气体混合物中分离氧。
在本方法的另一个实施例中,两个化学反应区中的一个在吸附温度t吸附下操作,而另一个化学反应区在反应材料的解吸温度t解吸下操作。
在此情况下,吸附/解吸反应材料可用于从空气或从含有任何这些化合物的任何其它气体混合物中分离二氧化碳和/或水。合适的材料如上所列。
在本方法的又另一个实施例中,两个化学反应区中的一个在碳化温度t碳化下操作,而另一个化学反应区在反应材料的脱碳温度t脱碳下操作。
在此情况下,经历碳化/脱碳的反应材料可用于从环境空气或任何其它气体混合物中分离co2。优选的材料是cao。
传热流体为化学反应区提供所需的过程热。这是通过将通过外部热能量源在加热区段中加热的传热流体泵送通过相应的化学反应区来完成的。
显热变温层tes解决方案(如岩石填充床)的主要挑战是变温层退化,导致排放期间的出口温度下降、充填期间的出口温度升高、受限的存储利用系数以及可能降低的功率块效率。针对变温层退化的典型原因是:(1)htf与储存材料之间的受限的传热速率,(2)沿储存的轴向热传导和辐射,(3)与储存容器/绝缘材料的热交换,以及(4)由于在入口和出口处的垂直流动和在壁处的旁通流动而使具有不同温度的htf混合。通过选择例如tes的较高的高度与直径比,较小的存储填料颗粒或较低的质量流速,可降低这些机制的影响。然而,这些设计参数经受诸如泵送功增加或加热速率不足等缺点,并因此它们对变温层陡度的影响是受限的。解决排放期间温度下降的一种解决方案是在储存的顶部处使用相变材料以稳定排放期间的流出温度。
备选途径是主动增加和维持罐内的变温层陡度,并称为变温层控制。过去提出了各种变温层控制概念,如:
a)定期冲洗tes以将变温层推出存储器:缺点在于冲洗期间提取的能量处于低温并且可能失去,除非该设备具有可利用该较低温度htf的系统。
b)使用浮动屏障分离冷和热的流体:它有可能强烈降低tes中的热退化。然而,这仅可适用于在其处htf也是存储材料并且其与填充材料的使用不兼容的系统。
c)添加相变材料(pcm)以降低排放期间的温度下降并提高存储利用系数:尽管pcm通常比低成本的敏感存储填充材料明显更昂贵,但是成本降低是可能的。
d)用于变温层重建的虹吸:该方法由tes内的附加端口(分配器)组成,其用于提取变温层,而热和冷htf分别在顶部和底部处注入。然而,在虹吸过程期间提取的能量处于中间温度,并且对于我们而言可能无法将其用于该温度下的过程。
e)在变温层的某些位置处提取、升级和返回流体:tes内的其它端口用于在中间温度下提取htf,使用热能将其升级并将其在顶部处(热侧)返回到tes中。在聚集太阳能发电设备中,这是特别令人感兴趣的,因为该方法可在低太阳日照期间应用。
f)滑动流动以使压降效应与传热效应分离:填充床分成多个节段,在所有相邻节段之间具有端口。入口和出口始终连接到端口,使得htf流过两个tes节段。在第一节段完全饱和后,入口和出口端口切换到连续节段。
然而,如刚刚所述,这些途径具有若干缺点。
通过在变温层之前注入传热流体可克服这些缺点。因此,在本方法的一个实施例中,通过沿化学反应区和/或热能储存单元在不同位置处提取、加热和注入加热的传热流体来附加地控制(或维持)化学反应区的温度和温度分布(或变温层)。
可通过在沿反应器系统的模块中的至少一个或每个布置的多个端口处提取或注入传热流体来控制温度分布。在tes内部放置有若干附加的端口。然后,基于如下所述的某些标准,通过在变温层前沿之前注入流体来使变温层变陡。
此外优选的是,如果通过在变温层的中间位置处注入htf使至少一个模块内或两个模块内的变温层(或温度曲线)变陡,则切断变温层的某一部分。在此情况下,可基于比较两个端口之间的实际存储能量和目标/参考能量来确定用于切换htf注入端口的标准。
在另一个变型方案中,可通过在模块的一个端口处提取htf并在模块的另一个端口处将其注射回来控制温度分布。
在充填阶段期间应用的该方法的一个实施例中,在整个变温层区域已经通过相应的端口之前切换入口端口。这导致变温层的切断,将变温层的一部分截留在储存罐内,同时在新的入口端口和出口端口之间继续充填,具有更陡的变温层。在随后的排放期间,由于分散效应(轴向传导、受限的对流传热),变温层的截留部分变平,并然后被推出罐。可在充填期间执行类似的注入策略。
找到针对切换端口的可行标准具有挑战性。目标是切换注入端口,使得当流动反向时,出口温度保持在特定温度范围δt中。夹带的变温层部分与在下一次充填/排放阶段期间将由其引起的出口温度变化之间没有简单关系。所提及的出口温度变化取决于截留区段到下一阶段的出口的距离和多个传热效应。
一种可能的注入端口改变标准是基于储存在活动入口端口(xi)和应该用于注入的下一个端口(xi+1)位置之间的罐区段中的能量。一旦该能量达到某一参考能量,就切换注入端口。如果该参考能量定义为在低于/高于充填/排放温度的温度δt下的区段的能量,则标准可写成如下:
方程(a)和(b)分别对应于针对充填和排放阶段的注入端口改变标准。如果将δt设置为与δt相同的值,则发现δt的选择产生良好的结果:
还可通过冲洗热能储存单元以将储存的热输送到相应的化学反应区中来另外控制化学反应区的温度(温度分布或变温层)。
用于附加地控制化学反应区的温度(温度分布或变温层)的另一种途径是显热储存(shs)、潜热储存(lhs)和/或热化学热储存(tcs)的组合。
由于本反应器系统的构造特征(特别是由于氧化还原材料的封装),还可能分别控制化学反应区和热能储存单元的气氛和压力。
根据本方法,两个化学反应区中的一个在反应材料的吸热温度下操作,例如氧化还原材料的还原温度。在氧化还原材料的(吸热)还原的过程中,释放出需要冲洗出或提取的氧气。
因此,在本方法的一个实施例中,在氧化还原材料的还原温度t还原下操作的两个化学反应区中的一个以惰性气体冲洗和/或在真空压力下操作,使得来自氧化还原材料的放出的氧从化学反应区中除去。该反应步骤可在环境压力或真空条件下进行。
因此,在本方法的一个实施例中,在氧化还原材料的还原温度t还原下操作的两个化学反应区中的一个以惰性气体冲洗,并且由氧化还原材料释放的氧以惰性气体冲洗出化学反应区。
根据本方法,两个化学反应区中的另一个在反应材料的放热温度下操作,如在氧化还原材料的氧化温度下操作。在(放热)氧化的过程中,例如,加入到氧化还原材料中的co2/h2o还原为co/h2,同时还原的氧化还原材料氧化至其原始状态。该反应步骤可在环境压力或过压下进行。
因此,在合成气过程的情况下,二氧化碳和水(通过一个入口)加入到在氧化还原材料的氧化温度t氧化下操作的两个化学反应区中的一个,其中二氧化碳和水转化为一氧化碳和氢,它们随后从化学反应区(通过出口)排出。
在本方法的又另一个实施例中,如果在氧化还原材料的还原温度t还原下操作的两个化学反应区中的一个中的氧化还原材料还原到一定的还原延伸δ,对于二氧化铈通常在δ=0.01-0.1的范围内,和/或如果在氧化还原材料的氧化温度t氧化下操作的另一个化学反应区中的氧化还原材料氧化回到一定的还原延伸,则切换将热从加热区段传递到化学反应区和储热单元的传热流体的流动方向。
附图说明
现在借助于一个示例参考附图更详细地解释本发明。附图示出:
图1是本热化学反应器系统的第一实施例的示意图;
图2a是垂直于htf流动方向的反应材料的封装的一个变型方案的示意图;
图2b是反应材料的封装的另一变型方案的示意图;
图2c是反应材料的封装的又另一变型方案的示意图;
图2d是平行于htf流动方向的反应材料的封装的第一变型方案的示意性;
图2e是合成气过程中针对氧化还原材料的封装变型方案的示意图;
图3a是第一级联封装变型方案的示意图;
图3b是第二级联封装变型方案的示意图;
图3c是合成气过程中氧化还原材料的级联封装变型方案的示意图;
图4a是根据图1的反应器系统中的理想温度分布;
图4b是根据图1的反应器系统中的降级的温度分布;
图5a是将左罐带到还原温度的温度分布的移动;
图5b是在不升级csp接收器中的压缩空气的情况下的温度分布的进一步移动;
图5c是在右氧化还原区中获得均匀的氧化温度平台的变温层控制;
图5d是在没有升级的情况下推回变温层;
图6a是充填过程期间的温度分布;以及
图6b是排放过程期间的温度分布。
具体实施方式
在图1中,显示了以双储存反应器系统的形式的本反应器系统的第一实施例。双储存反应器系统由两个垂直定向的热能储存单元(变温层tes)、如惰性材料的填充床(packedbed)组成。将包含封装的氧化还原材料的化学反应区(crz)分别置于变温层tes的顶部上。填充床用作热能储存(tes)单元,其中建立轴向温度梯度(变温层)。
两个组合的crz/tes通过传热流体(htf)在操作上彼此联结,该传热流体(htf)通过两个crz/tes单元之间的系统传输热量。用于加热htf的加热区段设在两个crz/tes之间,使得在所述加热区段中加热的htf可分别流入crt/tes。
通过在两个crz/tes之间来回泵送htf,crz/tes中的变温层沿轴向方向移动,并因此氧化还原材料交替暴露于t还原和t氧化。由此在还原和氧化步骤之间回收显热(sensibleheat)。
如果在氧化还原材料的还原温度t还原下操作的两个化学反应区中的一个中的氧化还原材料还原到一定程度,和/或如果在氧化还原材料的氧化温度t氧化下操作的另一个化学反应区中的氧化还原材料氧化回到一定程度,则切换将用于加热区段的热输送到化学反应区和储热单元的htf的流动方向。
通过聚集太阳辐射获得的过程热添加到反应区域之间的htf,以提供还原焓并补偿热损失和变温层退化。
图2a-2e示出了反应材料的封装的某些变型方案。
在图2a中,反应材料封装在管中,该管垂直于化学反应区内的传热流体的流动方向布置。因此,封装的各种不同布置是可能的。图2b示出了可能的布置的一些示例;(a)具有平行堆叠层的平行管层(束),(b)具有垂直堆叠层的平行管层,(c)平行管层,其中层以一定角度(0-90度)堆叠。
反应材料也可封装在类似于燃料电池堆的堆叠中。因此,传热流体流过专用通道,而反应材料包含在分开的室中。这种布置在图2c中示出。反应材料(例如,ceo2)布置在凹槽中或加深在惰性封装材料(例如al2o3)块内。htf流过惰性封装材料中的通道,由此包含反应材料的凹槽和htf通道彼此垂直布置。
可存在多于一个的惰性封装材料块或堆叠,例如两个或三个块。在此情况下,块或堆叠可彼此平行或垂直地布置。
反应材料也可封装在平行于htf流动方向布置的管或堆叠中(见图2d)。这里,封装延伸通过tes的整个长度,但仅包含反应区内的反应材料。管或堆叠的其余部分可为空的或填充有惰性材料。可再次使用管束或堆叠。
在图2e中,示出了合成气过程中针对氧化还原材料的封装变型方案。这里,氧化还原材料封装在al2o3管中。在每个化学反应器区中,三个填充有氧化还原材料的管彼此平行布置。将管放置在垂直于htf流动方向的每个化学反应区内。
以这种方式,避免了htf和氧化还原材料之间的直接接触,允许使用任何合适的htf。此外,tes和crz可在不同的压力和气体氛围下操作。例如,tes单元可在p>p环境(超压)下操作以减少泵送功(pumpingwork),而crz可在热还原期间在p<p环境(真空)下操作和/或在氧化期间在p>p环境下操作以增强化学反应。
每个管在相对的端部处具有气体入口和气体出口,允许气体流过管以及反应物(例如co2、h2o)与氧化还原材料的充分接触时间。
如图2e所描绘,左化学反应区在氧化还原材料的还原温度t还原下操作。在氧化还原材料的(吸热)还原过程中,释放氧,通过将惰性气体加入到封装中或通过在出口处施加真空来提取所述氧。
右化学反应区在氧化还原材料的氧化温度t氧化下操作。将co2/h2o加入到具有t氧化的氧化还原材料中并转化为co/h2,随后所述co/h2从管中的氧化还原材料连续排出。同时,还原的氧化还原材料在(放热)氧化过程中氧化成其初始状态或限定的氧化态。
图3a-c示出了反应材料的级联布置(cascadedarrangement)的变型方案。这里,代替使用单一反应材料,使用多种反应材料,其在不同温度下还原和氧化以产生级联双储存反应器。
在图3a中,反应材料封装在管或堆叠中,以防止传热流体和反应材料直接接触。这里,不同的反应材料沿反应区的高度布置,使得各种材料的不同热力学和动力学性质(例如还原和氧化行为)最佳地适合化学反应区内的温度分布。例如,在其处达到最高温度的化学反应区的顶部中,选择对这些温度具有合适的热力学和动力学性质的材料,例如ceo2。在其处温度低于顶部的反应区的较低水平中,选择具有与在顶部中不同的热力学和动力学性质的反应材料,其在这些较低温度下有利地操作,例如掺杂的ceo2或钙钛矿。
图3a示意性地示出了三种不同反应材料的布置,用于垂直于传热流体的流动方向布置的平行管束的情况。类似的布置可通过堆叠实现。
如果封装平行于传热流体的流动方向,则不同的反应材料可在同一封装内层合,使得在最高温度下具有最合适的热力学和动力学性质的材料再次位于最热的区域,而在较低温度下具有最合适的热力学和动力学性质的材料位于在其处获得最低温度的反应区的区域中。图3b示意性地示出了三种不同反应材料的布置。
图3c示出了适合于合成气生产的这种级联布置。这里,与其它氧化还原材料相比,氧化还原材料1在最高温度下具有最合适的热力学和动力学性质:t还原/氧化材料1>t还原/氧化材料2>t还原/氧化材料3。针对这种布置的材料和相应的最佳操作温度可此外为许多可能性。
在图3的实施例中,第一层包含纯ceo2;t还原=1500℃,t氧化=900℃(材料1),较低的第二层包含5mol%zr4+掺杂的二氧化铈;t还原=1400℃,t氧化=700℃(材料2),并且最低的第三层包括镧-锶-锰钙钛矿la1-xsrxmno,其中x=0.3;t还原=1300℃,t氧化=500℃(材料3)。
图4a,b分别示出了双储存反应器中的理想和实际温度分布。
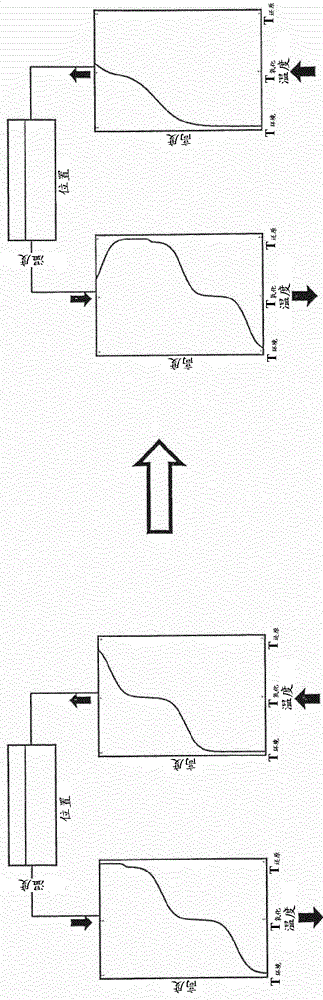
如果氧化还原材料总是暴露于还原或氧化温度,则具有双储存反应器的合成气的生产最大化。这意味着在反应区附近,温度分布理想地应该是在还原和氧化温度下分离两个平台的中断。此外,期望在低温下的第三平台,因为这降低了来回移动htf的泵的成本。为了使填充床的高度且因此材料成本最小化,理想情况下,该第三平台应通过第二个中断与在氧化温度下的平台隔开。因此,双储存反应器中完整的理想温度分布(所谓的变温层)如图4a所示。
然而,理想的温度分布在实践中不能实现,因为若干物理机制导致间断变得退化,即模糊(见图4b)。这些机制包括:htf与储存材料之间的受限的热传递率、沿储存的轴向热传导和辐射、与储存容器和绝缘体的热交换、由于在入口和出口处的垂直流动导致的不同温度下的htf混合、以及在容器壁处的旁路流动。
随着变温层变得越来越退化,合成气的产生将减少,并且存在超过泵的最大操作温度的危险,需要关闭双储存反应器。
为防止变温层退化而采取的动作通常称为“变温层控制”。在双储存反应器中,通过加热区段部分地实现变温层控制,因为加热的htf在等于还原温度的恒定温度下流入填充床。
然而,为了在氧化温度下维持平台,变温层控制是需要的。这可通过以下若干方式完成:冲洗tes以将变温层推出存储器,组合不同的几何形状/材料,例如,组合的敏感/潜热存储,提取,升级和在变温层的某些位置处返回htf,从变温层的位置处的tes中虹吸出htf,以及滑动流动(入口和出口随变温层位置移动)。
示例1
双储存反应器设置的描述
双储存反应器由两个连接的罐组成,每个罐包含具有变温层tes的区段或模块和具有氧化还原材料的区(如图1中所示)。
在反应区中,堆叠氧化铝管束,其包含内部二氧化铈作为反应材料(图2)。变温层tes由氧化铝球的填充床组成。htf是压缩空气(例如,在20bar下)。通常在冷侧进行htf的泵送。使用聚集太阳辐射/能量以加热接收器(加热区段)中的htf。
为了支持二氧化铈的还原,用惰性气体冲洗管,同时也抽真空(图2的左侧)。
在氧化铈的氧化期间,将co2和h2o注入管中以产生合成气(图2的右侧)。
操作步骤
在下文中,将分别讨论操作的各个步骤。由于两个罐是相同的,为简洁起见,仅讨论了半个循环。然后,循环的第二半部分将与第一半部分相同,只是所有操作动作都在左罐和右罐之间翻转。
开始时,左罐的二氧化铈处于氧化状态,而右罐的二氧化铈处于还原状态。进行以下步骤以使左罐的二氧化铈处于还原状态并且使右罐的二氧化铈处于氧化状态(并产生合成气)。
第一步骤(图5a,图2e左侧)
压缩空气从右罐的底部泵送通过右罐,并然后通过聚集太阳辐射接收器升级到所需的还原温度(t还原=1500℃)。可调整htf质量流速以获得期望的还原温度,取决于瞬时直接法向照射(dni)和进入接收器的入口温度。升级的压缩空气然后进入左罐,并作为冷压缩空气在底部离开其(图5a)。这样,右罐的高温平台从右罐移动到左罐。
含有二氧化铈的管内同时(垂直)流动:在右罐的管内,没有流动。在左罐的管中,注入少量惰性气体流,并且通过抽真空将总压降低(例如降至10pa),见图2e,左侧。
第二步骤(图5b)
一旦左罐的二氧化铈减少,则右罐的氧化还原材料通常尚未达到氧化温度,但由于受限的变温层陡度而在稍高的温度下(见图5a)。为了进一步冷却并防止高温平台(处于约t还原)的扩散,离开右罐的热压缩空气可引导到左罐而不用太阳能进行升级,导致图5b中示意性所示的温度分布。通过这种方式,仍然回收热,但不会发生变温层的扩散。
在右管内部再次没有流动,而在左罐中仍然抽真空以增加还原程度(图2e,左侧)。
第三步骤(图5c)
由于变温层退化,温度平台随时间退化。要重建平台,需要变温层控制。为了在右罐的氧化还原区中获得均匀的氧化温度,在右反应区的顶部和底部提取压缩空气,并将其混合物在右反应区的中部注入(图5c)。
第四步骤(图2e,右侧)
将co2和h2o注入右氧化还原区段的管中,以氧化二氧化铈并产生合成气(图2e,右侧)。
第五步骤(图5d)
在右氧化还原区的氧化后,压缩空气从左罐底部泵送通过右罐,并然后不用太阳能升级,其进入右罐并作为冷压缩空气在底部处离开其(图5d)。通过这种方式,仍然回收热,但不会发生变温层的扩散。
在第五步骤结束时,温度分布与步骤一的开始时相同,只是在左罐与右罐之间翻转的分布。因此,循环的下一半将是相同的程序,只是在两个罐之间翻转的所有动作。
示例2:温度分布(变温层控制)
根据本方法的一个实施例,在变温层之前注入htf。
在tes内部放置若干附加的端口。然后,基于某些标准,通过在变温层前沿之前注入流体来使变温层变陡。
在充填阶段(chargingphase)期间应用的该方法的示例可在图6a中看到。这里,在整个变温层区域已通过相应的端口之前切换入口端口。这导致变温层的切断,将变温层的一部分截留在储存罐内,同时在新的入口端口和出口端口之间继续充填,具有更陡的变温层。
在随后的排放期间,由于分散效应(轴向传导、受限的对流传热),变温层的截留部分变平,并然后推出罐(图6b)。可在充填期间执行类似的注入策略。
也可能的是,对于此示例可使用更多tc控制策略,如:
•在中高温下推出变温层:由于在氧化期间产生的氧化热,在大约t氧化下可能存在过热。需要提取该热以防止两个罐中的连续温度升高,使得再氧化变得越来越困难。例如,这可通过在第二步骤结束时通过在左罐的底部处注入压缩空气并在其顶部处在大约t氧化下提取压缩空气来提取变温层的一部分来完成。该热可用于例如运行涡轮以用于发电。
•替代执行步骤二,一可从(大约)右罐的中间提取流体并将其插入左罐中以使左罐达到氧化温度。这将避免移动整个温度分布。在左罐的氧化之后,相同量的流体将从左罐顶部返回到右罐的中部。
•替代在反应区中混合流体(步骤三),可在变温层tes中进行混合以获得在t氧化下的平台(例如在步骤一的开始)。这将具有以下优点,即,罐内的流量分配器将不必由陶瓷制成,而是可由钢制成。
•存在不同的混合/提取/注入可能性以增加温度梯度的陡度,如虹吸。
- 还没有人留言评论。精彩留言会获得点赞!