一种以苯丙氨酸—酪氨酸—组氨酸—谷氨酸为功能配基的四肽层析介质及其应用的制作方法
本发明涉及一种以苯丙氨酸—酪氨酸—组氨酸—谷氨酸为功能配基的四肽层析介质及抗体分离应用,属于生物化工领域中的蛋白层析分离技术。
背景技术
抗体具有特异性高、靶向性强和生物相容性好等优点,被广泛地应用于治疗药物和诊断试剂。随着基因工程的不断发展,抗体生产工艺的细胞表达量和培养规模逐步扩大,使得上游的产能不断地提升,给下游分离纯化带来了极大的压力。目前,抗体分离纯化过程中普遍使用蛋白a亲和层析,具有非常高的特异性,可以高效地捕获抗体,但存在价格昂贵、配基易脱落、洗脱条件苛刻以及再生困难等缺陷。
多肽亲和层析作为一种潜在的蛋白a亲和层析替代方法,以筛选和优化的多肽为功能配基,利用多肽配基与抗体之间的选择性结合,达到分离纯化抗体的目的。多肽亲和层析相较于蛋白a亲和层析,具有成本低、洗脱温和以及耐酶解等优点,属于仿生层析范畴,受到了广泛的关注。
据报道,已研发了一些多肽配基并应用于抗体分离纯化。yang等(us7408030b2;journalofchromatographya.2011,1218:1691-1700)通过组合化学法筛选得到“组氨酸-芳香族氨基酸-碱性氨基酸”组合模式的六肽配基(组氨酸-色氨酸-精氨酸-甘氨酸-色氨酸-缬氨酸,hwrgwv),可应用于哺乳动物细胞培养液中分离抗体,但该配基对白蛋白存在非特异性吸附,需要在高盐或添加辛酸钠条件下使用,以提高抗体的吸附选择性。menegatti等(biotechnologyandbioengineering.2013,1175:249-258)利用mrna展示技术筛选到环五肽配基cyclo[link-m-wfrhy-k],该配基能够特异性结合抗体,并可应用于从cho细胞培养上清液中分离抗体,不过对抗体的吸附容量较低。wang等(cn104645949a;biochemicalengineeringjournal.2016,114:191–201)通过分子模拟设计和筛选得到四肽配基(酪氨酸-苯丙氨酸-精氨酸组氨酸,yfrh),对抗体具有较高的结合容量,并可应用于cho细胞中分离单抗和牛乳清中分离bigg,但该配基需要通过添加盐离子屏蔽配基对于白蛋白的非特异性吸附,才能得到高纯度的抗体。huang和zhao等(cn103014880a;journalofchromatographya.2014,1359:100-111)利用分子模拟设计和筛选得到八肽配基(苯丙氨酸-酪氨酸-色氨酸-组氨酸-半胱氨酸-亮氨酸-天冬氨酸-谷氨酸,fywhclde),该配基对抗体具有较高的吸附选择性,并可应用于细胞培养上清液和人血清中分离抗体,不过对于抗体的动态载量不高,并且与抗体结合主要由静电相互作用主导,因此耐盐结合能力较弱,分离时料液可能需要稀释。因此,进一步研发性能更加优良的多肽配基,提高吸附容量,增强抗体选择性强,实现耐盐吸附,同时改善洗脱条件,对抗体的规模化制备具有重要的意义。
技术实现要素:
本发明的目的是提供一种以苯丙氨酸—酪氨酸—组氨酸—谷氨酸为功能配基的四肽层析介质,并应用于抗体分离。
本发明首先提供了一种以苯丙氨酸—酪氨酸—组氨酸—谷氨酸为功能配基的四肽层析介质,四肽层析介质包括层析基质、空间臂和配基,所述的层析基质为带有羟基的亲水性多孔微球,空间臂为己二胺,配基为苯丙氨酸、酪氨酸、组氨酸和谷氨酸组成的四肽。
配基的结构组成为:
当配基偶联在层析基质的结构组成为:
所述的层析基质为具有多孔结构和表面羟基的亲水性微球。
作为优选,所述的层析基质为琼脂糖凝胶或纤维素微球或聚甲基丙烯酸酯微球。
所述的配基为苯丙氨酸(phe)、酪氨酸(tyr)、组氨酸(his)和谷氨酸(glu)组成的四肽。
本发明中四肽层析介质的结构式中仅给出一个配基基团,仅仅是示例性说明,层析基质的表面和内部孔道表面具有大量的四肽配基基团。
本发明中层析基质为具有多孔结构和表面羟基的亲水性微球,结构式如下:
本发明还提供了一种上述四肽层析介质的制备方法:
包括如下步骤:
1)基质活化:层析基质用烯丙基溴进行活化,得到活化基质;
2)溴代醇化:活化基质采用n-溴代丁二酰亚胺进行溴代醇化,得到溴代基质;
3)空间臂偶联:将溴代基质、己二胺以及碳酸钠缓冲液混合反应,得到氨基活化基质;
4)配基偶联:氨基活化基质,依次用去离子水、无水乙醇和无水n,n-二甲基甲酰胺洗涤,抽滤,加入到含四肽、2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯和n,n-二异丙基乙胺的n,n-二甲基甲酰胺中,水浴摇床中反应,得到四肽介质;最后将四肽介质依次用无水n,n-二甲基甲酰胺、无水乙醇和去离子水清洗,抽滤,加入到乙酸钠和乙酸酐的混合液中,水浴摇床中反应,去离子水洗涤,得到以四肽为功能基团的层析介质。
作为优选的,所述步骤1)的基质活化步骤具体为:抽取层析基质,加入二甲基亚砜溶液、烯丙基溴和氢氧化钠,摇床中活化,抽滤,用去离子水洗涤,得到活化基质。
进一步优选的,取抽层析基质10g,加入10ml20%(v/v)二甲基亚砜溶液、10ml烯丙基溴和5g氢氧化钠,30-35℃下180rpm摇床中活化30-48小时。
作为优选的,所述步骤2)的溴代醇化步骤具体为:将活化基质、n-溴代丁二酰亚胺混合进行溴代醇化,摇床中反应,抽滤,用去离子水洗涤,得到溴代基质。
进一步优选的,将10g层析基质经活化得到的活化基质与5gn-溴代丁二酰亚胺混合进行溴代醇化,30℃下180rpm摇床中反应1小时,抽滤,用去离子水洗涤,得到溴代基质。
作为优选的,所述步骤3)的空间臂偶联步骤具体为:将溴代基质、己二胺以及碳酸钠缓冲液混合,摇床中反应,得到氨基活化基质;所述碳酸钠缓冲液的ph为12。
进一步优选的,将10g层析基质经活化、溴代醇化后的溴代基质和3ml己二胺以及1m碳酸钠缓冲液(ph12)混合,30℃下180rpm摇床中反应24小时,得到氨基活化基质。
作为优选的,所述步骤4)含四肽、2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯和n,n-二异丙基乙胺的n,n-二甲基甲酰胺中,以每毫升n,n-二甲基甲酰胺计,四肽为50mg、2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯为50mg,n,n-二异丙基乙胺31.25μl。
本发明还提供了一种四肽配基,其结构式如下:
该配基为借助计算机分子模拟的手段,对抗体和蛋白结合位点进行分析评估,设计筛选而得,其为苯丙氨酸(phe)、酪氨酸(tyr)、组氨酸(his)和谷氨酸(glu)组成的四肽。
本发明还提供了一种所述的四肽配基或所述的四肽为功能配基的层析介质在抗体分离中的应用。
同现有技术相比,本发明的有益效果体现在:
(1)本发明的四肽层析介质对抗体亲和力高,吸附容量大,静态吸附容量达到80mg/g介质以上,动态载量达到20mg/ml介质以上。
(2)本发明的四肽层析介质可在ph中性条件下吸附抗体,并在弱酸性条件下,借助静电排斥作用实现高效洗脱,从而避免过酸条件下抗体聚集或者活性下降。
(3)本发明的四肽层析介质对抗体的吸附选择性强,在中性条件下对于白蛋白的吸附量极低。
附图说明
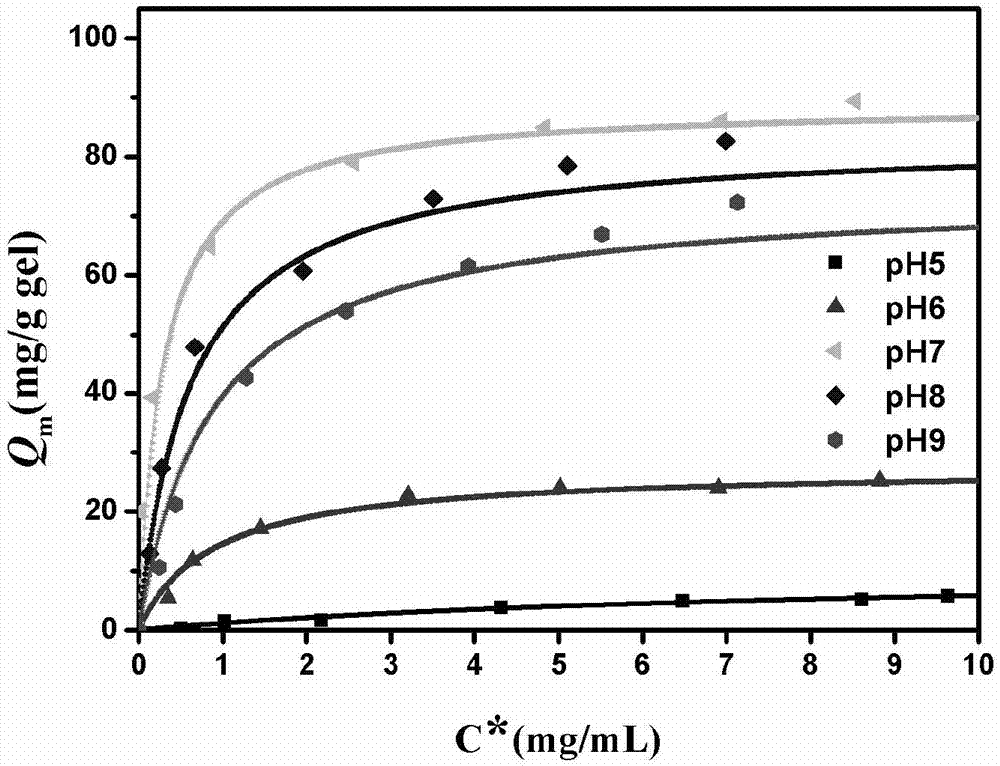
图1为实施例4中四肽层析介质在ph5.0~9.0条件下对higg的吸附等温线。
图2为实施例5中四肽层析介质在ph7.0条件下对higg和bsa的穿透曲线。
图3为实施例6中四肽层析介质从cho细胞培养上清液中分离单克隆抗体的还原型电泳分析图。
图4为实施例7中四肽层析介质从人血清中分离higg的还原型电泳分析图。
具体实施方式
下面通过具体的实施例对本发明作进一步的说明:
实施例1:四肽亲和层析介质的制备
以琼脂糖凝胶为基质制备四肽层析介质的过程主要包括基质活化、溴代醇化、空间臂偶联和配基偶联4个步骤。(1)基质活化:取抽干琼脂糖凝胶10g,加入10ml20%(v/v)二甲基亚砜溶液、10ml烯丙基溴和5g氢氧化钠,30℃下180rpm摇床中活化36小时,抽滤,用去离子水洗涤,得到活化基质;(2)溴代醇化:将活化基质、5gn-溴代丁二酰亚胺混合进行溴代醇化,30℃下180rpm摇床中反应1小时,抽滤,用去离子水洗涤,得到溴代基质;(3)空间臂偶联:将溴代基质和3ml己二胺以及1m碳酸钠缓冲液(ph12)混合,30℃下180rpm摇床中反应24小时,得到氨基活化基质;(4)四肽配基偶联:取1g氨基活化基质,依次用去离子水、无水乙醇和无水n,n-二甲基甲酰胺洗涤,抽滤,加入到2ml含100mg四肽、100mg2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯和62.5μln,n-二异丙基乙胺的n,n-二甲基甲酰胺中,25℃下水浴摇床中反应8小时,得到四肽介质;最后将介质依次用无水n,n-二甲基甲酰胺、无水乙醇和去离子水清洗,抽滤,加入到乙酸钠和乙酸酐的混合液中,25℃下水浴摇床中反应1小时,去离子水洗涤,得到以四肽为功能基团的层析介质,配基密度为89μmol/g介质。
实施例2:四肽亲和层析介质的制备
以纤维素微球为基质制备四肽层析介质的过程主要包括基质活化、溴代醇化、空间臂偶联和配基偶联4个步骤。(1)基质活化:取抽干纤维素微球10g,加入10ml20%(v/v)二甲基亚砜溶液、10ml烯丙基溴和5g氢氧化钠,35℃下180rpm摇床中活化48小时,抽滤,用去离子水洗涤,得到活化基质;(2)溴代醇化:将活化基质、5gn-溴代丁二酰亚胺混合进行溴代醇化,30℃下180rpm摇床中反应1小时,抽滤,用去离子水洗涤,得到溴代基质;(3)空间臂偶联:将溴代基质和3ml己二胺以及1m碳酸钠缓冲液(ph12)混合,30℃下180rpm摇床中反应24小时,得到氨基活化基质;(4)四肽配基偶联:取1g氨基活化基质,依次用去离子水、无水乙醇和无水n,n-二甲基甲酰胺洗涤,抽滤,加入到2ml含100mg四肽、100mg2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯和62.5μln,n-二异丙基乙胺的n,n-二甲基甲酰胺中,25℃下水浴摇床中反应8小时,得到四肽介质;最后将介质依次用无水n,n-二甲基甲酰胺、无水乙醇和去离子水清洗,抽滤,加入到乙酸钠和乙酸酐的混合液中,25℃下水浴摇床中反应1小时,去离子水洗涤,得到以四肽为功能基团的层析介质,配基密度为115μmol/g介质。
实施例3:四肽亲和层析介质的制备
以聚甲基丙烯酸酯微球为基质制备四肽层析介质的过程主要包括基质活化、溴代醇化、空间臂偶联和配基偶联4个步骤。(1)基质活化:取抽干琼脂糖凝胶10g,加入10ml20%(v/v)二甲基亚砜溶液、10ml烯丙基溴和5g氢氧化钠,30℃下180rpm摇床中活化30小时,抽滤,用去离子水洗涤,得到活化基质;(2)溴代醇化:将活化基质、5gn-溴代丁二酰亚胺混合进行溴代醇化,30℃下180rpm摇床中反应1小时,抽滤,用去离子水洗涤,得到溴代基质;(3)空间臂偶联:将溴代基质和3ml己二胺以及1m碳酸钠缓冲液(ph12)混合,30℃下180rpm摇床中反应24小时,得到氨基活化基质;(4)四肽配基偶联:取1g氨基活化基质,依次用去离子水、无水乙醇和无水n,n-二甲基甲酰胺洗涤,抽滤,加入到2ml含100mg四肽、100mg2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯和62.5μln,n-二异丙基乙胺的n,n-二甲基甲酰胺中,25℃下水浴摇床中反应8小时,得到四肽介质;最后将介质依次用无水n,n-二甲基甲酰胺、无水乙醇和去离子水清洗,抽滤,加入到乙酸钠和乙酸酐的混合液中,25℃下水浴摇床中反应1小时,去离子水洗涤,得到以四肽为功能基团的层析介质,配基密度为62μmol/g介质。
实施例4:四肽层析介质的静态吸附性能
取实施例1所得到的层析介质对人免疫球蛋白higg的静态吸附性能进行测试,考察不同ph条件的影响。首先用去离子水充分清洗介质,并用缓冲液平衡。分别准确称取0.03g介质于2ml离心管中,加入0.8ml不同higg浓度的缓冲溶液;将离心管置于恒温混匀仪中,25℃下1200rpm吸附3小时,达到吸附平衡后,离心分离,取出上清液测定higg的浓度;根据物料平衡计算介质的吸附容量,绘制吸附等温线,并根据langmuir方程拟合得到饱和吸附容量和解离常数。如附图1所示,在ph7.0条件时,介质对higg的吸附最佳,饱和吸附容量为87.9mg/g介质,解离常数为0.31mg/ml。本发明的四肽层析介质可在中性条件下对吸附higg,且吸附量较大。
实施例5:四肽层析介质的动态吸附性能
取适量实施例1所得到的层析介质装填到tricorn5/50层析柱中,进样前先用ph7.0的磷酸盐缓冲平衡层析柱。分别配制2mg/ml的人免疫球蛋白(higg)溶液和牛血清白蛋白(bsa)溶液,并调节ph为7.0。以0.5ml/min流速上样至蛋白穿透30%以上停止上样。紫外检测器在波长280nm下实时监测层析柱出口处穿透液的蛋白浓度变化,绘制穿透曲线,结果如附图2所示。上样结束后,先使用平衡缓冲液先冲洗,再依次使用20mmph4.0醋酸盐缓冲液洗脱,0.1mnaoh溶液对介质清洗再生,最后使用平衡缓冲液重新平衡。依据蛋白10%穿透时的上样体积,计算10%穿透时的动态附载量,higg的动态载量为24.3mg/ml,bsa的动态载量仅为2.2mg/ml。本发明的四肽层析介质对抗体具有良好的吸附选择性。
实施例6:四肽层析介质的分离性能
取适量实施例1所得到的层析介质填装于tricorn5/50层析柱中,约1ml。使用平衡缓冲液(20mmph7.5磷酸盐缓冲液)预平衡层析介质,约12倍柱体积(cv)。再以0.5ml/min流速将cho细胞培养上清液(mab浓度约为0.9mg/ml)上样。上样完成后,以1ml/min流速淋洗。然后以1ml/min流速进行洗脱,洗脱缓冲液为20mmph4.5醋酸盐缓冲液。最后,使用0.1mnaoh溶液以0.3ml/min流速对层析介质进行清洗再生,然后用平衡缓冲液重新平衡层析介质。,对上样、淋洗、洗脱和再生四个阶段的流出液进行收集,并将收集的组分进行sec-hplc和还原型sds-page分析,结果如附图3所示,分离得到单抗的纯度为94.4%,收率为93.2%。
实施例7:四肽层析介质的分离性能
取适量实施例1所得到的层析介质填装于tricorn5/50层析柱中,约1ml。使用平衡缓冲液(20mmph7.5磷酸盐缓冲液)预平衡层析介质,约12倍柱体积(cv)。再以0.5ml/min流速将人血清(higg浓度约为1.0mg/ml)上样。上样完成后,以1ml/min流速淋洗。然后以1ml/min流速进行洗脱,洗脱缓冲液为20mmph4.5醋酸盐缓冲液。最后,使用0.1mnaoh溶液以0.3ml/min流速对层析介质进行质清洗再生,然后用平衡缓冲液重新平衡层析介质。对上样、淋洗、洗脱和再生四个阶段的流出液进行收集,并将收集的组分进行sec-hplc和还原型sds-page分析,结果如附图4所示,higg的纯度和收率分别为94.2%和91.1%,分离效果好。本发明的四肽层析介质在抗体分离纯化过程中具有良好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!