一种铜掺杂氮修饰的碳材料、应用及芳香胺氧化偶联为对称/非对称偶氮苯的反应方法与流程
本发明属于催化材料领域,具体涉及一种铜掺杂氮修饰的碳材料、应用及芳香胺氧化偶联为偶氮苯的反应方法。
背景技术:
氧化芳香胺作为一种重要的方法是合成芳硝基、氧化偶氮苯、偶氮苯、亚硝基苯类化合物的重要途径。经过数十年的发展,多种氧化芳香胺选择性的合成偶氮苯的方法被提出,各种各样的金属或非金属试剂被用做催化剂和氧化剂。例如:ago,ag2o、pb(oac)4、agco3、mno2、bamno4、ce(oh)3o2h、rucl3、mntppcl-naio4、mn(tpp)oac-bu4nhso5、hgo-i2、nabo3-aceticacid;o2-ko-tbu、h2o2、o2-cucl、galvinoxyl-k3fe(cn)6-koh、zro2、gd(ш)复合物。这些方法中存在着一些问题:(1)、重金属、贵金属的大量使用,对环境造成一定的污染和不利于扩大应用。(2)、反应条件复杂,且常使用苯作为溶剂,对环境和人体都不健康。(3)、氧化剂化学计量或大大过量的使用,一些氧化剂的还原产物会造成环境污染。(4)、选择性差,产物的收率较低。(5)、交叉偶联合成不对称偶氮苯的报道很少。因此,开发能够克服以上问题的新方法具有重要的意义。
技术实现要素:
本发明的目的是为了克服现有技术存在的缺点和不足,而提供一种铜掺杂氮修饰的碳材料、应用及芳香胺氧化偶联为偶氮苯的反应方法。
本发明提供一种铜掺杂氮修饰的碳材料,通过以下步骤制备得到:
(1)将柠檬酸和硝酸镁溶解于水中,然后在80-150℃下,至得到黄色固体,为前躯体;
(2)步骤(1)得到的前驱体、三聚氰胺、铜盐混合研磨均匀,在氮气保护下,在温度为700-1000℃下反应0.5-3h,冷却至室温,研磨均匀后得到cu-n-c型,即为铜掺杂氮修饰的碳材料。
优选地,步骤(2)中,前驱体、三聚氰胺、铜盐三者质量比为4:4:3。
优选地,所述铜盐为cucl2。
本发明提供上述的铜掺杂氮修饰的碳材料作为催化剂的应用。
所述铜掺杂氮修饰的碳材料用于催化芳香胺合成对称偶氮苯或苯胺与非活化的芳香胺交叉偶联合成不对称偶氮苯类化合物。
其中,所述铜掺杂氮修饰的碳材料可以用于催化氧化芳香胺合成对称偶氮苯,反应式如下:
其中,所述铜掺杂氮修饰的碳材料也可以用于催化氧化苯胺与非活化的芳香胺交叉偶联合成不对称偶氮苯类化合物,反应式如下:
r1为h,r2为烷基、卤素或大位阻取代基团取代基。
一种芳香胺氧化偶联为对称/非对称偶氮苯的反应方法,具体如下:以芳香胺为反应底物,以上述的铜掺杂氮修饰的碳材料为催化剂,加入碱,以甲苯为溶剂,在氧气环境下反应。
当反应底物为苯胺时,最优反应条件如下,碱为吡啶,苯胺与吡啶的摩尔比为1:1,在65℃下反应40h,偶氮苯的分离收率可以达到91%。
本发明的有益效果如下:本发明提供了一种非均相催化剂铜掺杂氮修饰的碳材料,并提供了一种简单、易操作的无模板法合成方法,并将该材料应用于催化氧化芳香胺合成对称与不对称偶氮苯,具有良好的催化能力,较强的底物兼容性。本发明所提供的铜掺杂氮修饰的碳材料以及合成该类物质的方法鲜有报道,因此发现该方法具有重要意义。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,根据这些附图获得其他的附图仍属于本发明的范畴。
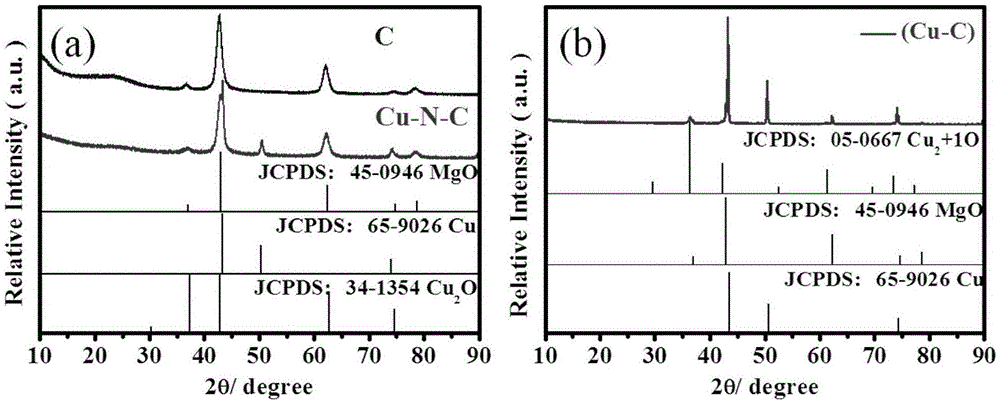
图1为以cucl2为铜源制备的cu-n-c(a)、cu-c(b)材料的xrd分析结果;
图2为以cucl2为铜源制备的cu-n-c(a-d)、cu-c(e-f)材料的sem图;
图3为以cucl2为铜源制备的cu-n-c(a)、cu-c(b)材料的xps图;
图4为以cucl2为铜源制备的cu-n-c(a)、cu-c(b)材料的c、n元素的xps图;
图5为以cucl2为铜源制备的cu-n-c、cu-c材料的cu元素的xps图;
图6为以cucl2为铜源制备的cu-n-c、cu-c材料的cl元素的xps图;
图7为以cucl2为铜源制备的cu-n-c、cu-c材料的o元素的xps图;
图8为以cucl2为铜源制备的cu-n-c(a)、cu-c(b)材料的bet图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
实施例1:
铜掺杂氮修饰的碳材料的合成:
将0.04mol的柠檬酸和0.02mol的硝酸镁加入到500ml的烧杯中,加入20ml的去离子水,充分溶解,并在90hz功率的超声清洗仪中震荡10min以使溶液变的澄清。将烧杯敞口放置在120℃的鼓风烘箱中,在此条件下保持24h。结束后关闭烘箱,冷却至室温后取出得到黄色的泡沫状的固体(载体的前驱体)。按照前驱体:三聚氰胺:铜盐三者质量比为4:4:3的比例,称取试剂于玛瑙研钵中研磨至均匀。转移至陶瓷干锅中后,放于气氛炉中n2保护条件下800℃保温1h(升温速率5℃/min),烧结完成后冷却至室温,取出后于玛瑙研钵中研磨均匀后得到黑色固体,即cu-n-c型催化剂(铜掺杂氮修饰的碳材料)。
本实施例中选用铜盐为cucl2。选取苯胺(0.5mmol)作为反应底物,吡啶(0.5mmol)作为辅助物,甲苯(2ml)作溶剂,使用合成的cu-n-c(cu,8mol%)类型材料作为催化剂在氧气条件下催化反应,24h,使用tlc、gcms检测手段对反应进行追踪,分离收率为70%。
实施例2:
与实施例1不同的是,选用cucl作为铜盐,使用合成的cu-n-c(cu,8mol%)类型材料作为催化剂催化苯胺反应,分离收率为44%。
实施例3:
与实施例1不同的是,选用cubr作为铜盐,使用合成的cu-n-c(cu,8mol%)类型材料作为催化剂催化苯胺反应,分离收率为13%。
实施例4:
与实施例1不同的是,选用cuso4作为铜盐,使用合成的cu-n-c(cu,8mol%)类型材料作为催化剂催化苯胺反应,验证得合成的cu-n-c类型材料没有催化性能。
实施例5:
与实施例1不同的是,选用cu(oac)2作为铜盐,使用合成的cu-n-c(cu,8mol%)类型材料作为催化剂催化苯胺反应,验证得合成的cu-n-c类型材料没有催化性能。
实施例6:
与实施例1不同的是,选用cuo作为铜盐,使用合成的cu-n-c(cu,8mol%)类型材料作为催化剂催化苯胺反应,验证得合成的cu-n-c类型材料没有催化性能。
实施例7:
与实施例1不同的是,选用cui作为铜盐,使用合成的cu-n-c(cu,8mol%)类型材料作为催化剂催化苯胺反应,验证得合成的cu-n-c类型材料没有催化性能。
通过实施例1-3和对比例1-4的催化性能对比,说明采用不同的铜盐作为铜源掺杂,合成出不同类型的cu-n-c材料对反应的催化结果差异较大。二价铜盐为铜源的催化剂均没有催化性能。以卤化铜为铜源的催化剂具有催化性能,其中cucl2的cu-n-c材料催化性能最高,偶氮苯的分离收率可以达到70%。
实施例8:
铜掺杂碳材料的合成:将0.04mol的柠檬酸和0.02mol的硝酸镁加入到500ml的烧杯中,加入20ml的去离子水,充分溶解,并在90hz功率的超声清洗仪中震荡10min以使溶液变的澄清。将烧杯敞口放置在120℃的鼓风烘箱中,在此条件下保持24h。结束后关闭烘箱,冷却至室温后取出得到黄色的泡沫状的固体(载体的前驱体)。按照前驱体:cucl2以质量比为4:3的比例,称取试剂于玛瑙研钵中研磨至均匀。转移至陶瓷干锅中后,放于气氛炉中n2保护条件下800℃保温1h(升温速率5℃/min),烧结完成后冷却至室温,取出后于玛瑙研钵中研磨均匀后得到黑色固体,即cu-c型材料(铜掺杂碳材料)。
选取苯胺(0.5mmol)作为反应底物,吡啶(0.5mmol)作为辅助物,甲苯(2ml)作溶剂,使用合成的cu-n-c(cu,8mol%)类型材料作为催化剂在氧气条件下催化反应,24h,使用tlc、gcms检测手段对反应进行追踪,验证得没有n元素掺杂的cu-c材料没有催化性能。
实施例9-35:
cu-n-c碳材料催化氧化苯胺偶联合成偶氮苯:
以苯胺作为反应底物(0.5mmol),以实施例1制备得到的cu-n-c材料作为催化剂,辅助物,溶剂(2ml),加入至schlenk密封反应管中,充入氧气。密封反应管后在预先设置好的65℃的油浴锅中加热搅拌24h后,取出静置,冷却至室温,然后打开反应管加入乙酸乙酯稀释混合物后使用tlc法观察反应情况。混合物经过真空旋转蒸发后的粗产物,使用柱层析法进行分离提纯,得到分离收率,使用乙酸乙酯和石油醚的不同极性的混合溶剂作为淋洗液。具体设置条件如表1所示,其中,标注为b(实施例27)的反应温度为55℃,标注为c(实施例28)的反应温度为75℃,标注为d(实施例33)的不添加cu-n-c,标注为e(实施例34)的不添加辅助物,标注为f(实施例35)的为在氮气环境下反应。
表1芳香胺氧化偶联反应条件
由表1可知实施例33、34是没有cu-n-c材料和吡啶同时参与反应时,均没有产物生成,说明两者的催化能力是协同作用的。实施例9-21分别在反应体系中加入不同的配体和碱,考察配位作用和酸碱度对反应的影响,实验结果表明,配体并没有起到与铜络合辅助催化的作用,而不同的碱对反应具有不同程度的催化作用,吡啶是最合适的辅助物。实施例22-26表明吡啶的用量以0.5mmol最佳。实施例28-32表明极性溶剂对反应体系不适应,不发生反应或者反应较差,非极性溶剂1,4-二氧六环中反应结果很差,甲苯弱极性溶剂中反应效果最佳。经过筛选后确定最优反应条件为:底物用量(0.5mmol),催化剂用量9mg(cu-n-c,cucl2,cu8mol%),吡啶(0.5mmol),甲苯(2ml),65℃,40h,o2。
实施例36-61:
cu-n-c碳材料催化氧化合成对称偶氮苯:
以底物用量(0.5mmol),催化剂用量9mg(实施例1所制备得到的cu-n-c,cu8mol%),吡啶(0.5mmol),甲苯(2ml),加入至schlenk密封反应管中,充入氧气,密封反应管后在预先设置好的65℃的油浴锅中加热搅拌24h后,取出静置,冷却至室温,然后打开反应管加入乙酸乙酯稀释混合物后使用tlc法观察反应情况,使用gc-ms方法检测反应产物的选择性结果。混合物经过真空旋转蒸发后的粗产物,使用柱层析法进行分离提纯,得到分离收率,使用石油醚作为淋洗液。对不同反应底物进行实验,反应式如下:
具体反应底物设置和实验结果如表2所示,其中,标注为a的(实施例39、60)为在85℃反应48h.cu-n-c材料中cu16mol%,标注为b的(实施例42)为cu-n-c(1:4:4),cu24mol%,反应48h,标注为c的(实施例46)为cu-n-c(1:4:4)cu16mol%,在85℃下反应48h,标注为d的(实施例51)为cu-n-c(1:4:4)cu24mol%,在75℃下反应48h。
表2cu-n-c材料催化氧化不同种类芳香胺合成偶氮苯
由实施例37、40、41、58、59可知对于不同烷基类型取代的芳香胺其氧化偶联产物的收率可以达到良好到优秀的水平,由实施例37-39可以看出随着位阻的增加,需要升高温度和增加铜的用量才能得到良好的收率,具有一定的位阻耐受性,由实施例54-56受到位阻的影响,产物依然有稳健的收率。由实施例42-47、51、52具有氧杂原子的烷氧基和弱吸电子cl元素取代的芳香胺受到位阻效应的影响产物收率明显降低,催化活性明显下降,然而,由实施例48-50对于br、f取代的芳香胺产物收率可以达到优秀水平,这可能受到不同元素的电负性差异的因素造成底物对催化剂的吸附性发生改变的原因造成的结果。实施例43、54说明对于强吸电子基团取代的芳香胺,该催化体系仍无法实现催化。实施例59-60说明含有不同数目的cl元素对催化剂的催化活性影响不大,产物依然有中等到良好的收率。总之,该催化体系可以有效地兼容烷基、烷氧基、卤素取代的芳香胺,使其达到良好到优秀的转化水平,说明cu-n-c/吡啶催化体系对吸电子和给电子官能团具有一定的兼容性,并能够克服一定邻位、间位和大位阻基团的位阻效应具有位阻兼容性。
实施例61-71:
cu-n-c碳材料催化氧化合成不对称偶氮苯:
对不同反应底物进行实验,反应式如下:
实验结果如表3所示,反应条件:化合物a(2.5mmol),化合物b(0.5mmol),吡啶(0.5mmol),cu-n-c(cu,24mol%),甲苯(2ml),加入于schlenk密封反应管中,充入氧气。密封反应管后在预先设置好的65℃的油浴锅中加热搅拌24h后,取出静置,冷却至室温,然后打开反应管加入乙酸乙酯稀释混合物后使用tlc法观察反应情况,使用gc-ms方法检测反应产物的选择性结果。混合物经过真空旋转蒸发后的粗产物,使用柱层析法进行分离提纯,得到分离收率,使用石油醚作为淋洗液。括号外的收率由gcms测得,括号中的收率是分离收率。其中标号为b的(实施例63),化合物a(0.5mmol),化合物b(1.5mmol)。其中标号为c的(实施例68),为在85℃下反应。
表3cu-n-c材料催化氧化不同种类芳香胺合成不对称偶氮苯
同一催化体系中实现芳香胺的交叉偶联非常困难,要克服自身偶联反应的发生,在已报到的文献中多采用吸电子取代的芳香胺和供电子取代的芳香胺实现交叉偶联,并且吸电子取代的芳香胺往往会过量,因此,底物的适用范围受到较大的限制,实现苯胺与各类芳香胺的交叉偶联具有十分重要的意义。由表3可知,在cu-n-c/吡啶催化体系中,可以将苯胺与非活化的芳香胺交叉偶联合成不对称偶氮苯类化合物。包括烷基(甲基、乙基)、卤素(f、cl、br、i)、大位阻取代基团(异丙基、叔丁基、2,6-二甲基)取代的底物都可以发生反应,得到中等收率。
实施例72:
将cu-n-c类型的催化剂按照苯胺(10mmol),催化剂(180mg),吡啶(10mmol),甲苯(40ml),加入于schlenk密封反应管中,充入氧气。密封反应管后在预先设置好的65℃的油浴锅中加热搅拌24h后,取出静置,冷却至室温,然后打开反应管加入乙酸乙酯稀释混合物后使用tlc法观察反应情况,使用gc-ms方法检测反应产物的选择性结果。混合物经过真空旋转蒸发后的粗产物,使用柱层析法进行分离提纯,得到分离收率,使用石油醚作为淋洗液。需要加入氧气球)。从实验结果表明,当反应的规模放大20倍时,偶氮苯的分离收率可以达到89%,催化剂的催化性能并未受到影响。
以下为cu-n-c材料的性能分析:
1.cu-n-c材料的cu的含量的测定:
采用空气条件下煅烧、酸溶、稀释定容的方法对合成的不同铜源的cu-n-c材料进行处理,使用optima8000型号的电感耦合等离子体发射光谱仪对实施例1-7制备得到的cu-n-c材料的金属铜的含量进行了测定,结果如表4所示。
表4不同铜源的cu-n-c材料的铜含量
2.实施例1得到的cu-n-c材料和实施例6到的cu-c材料的x-射线粉末衍射分析:
由图1可知(a)图中cu-n-c材料的铜被不同程度的还原得到了cu1+和cu0,并且单质铜的结晶度非常的好。由(b)图可知cu-c材料的铜也被不同程度的还原得到了cu1+和cu0,其中单质铜的衍射峰更加的尖锐,结晶度较cu-n-c材料的更强。从物质组成角度,两者没有差别。
3.实施例1得到的cu-n-c材料和实施例6得到的cu-c材料的扫描电子显微镜分析:
图2是扫描电子显微镜在不同倍率下观测到的cu-n-c、cu-c材料的形貌图,由(a)图可知cu-n-c材料是一种不规则、富含大量缺陷的材料。(c)图是其局部放大图,从图中可以看出cu-n-c材料具有片状三维堆积的结构。(b)、(d)图展示了该材料局部放大区域同时还具有簇状形貌的物质,具有粗细均匀、长短不一的特点。(e)、(f)分别展现了cu-c材料不同位置的形貌,与cu-n-c材料相比其形状无规律、形貌不规则。
4.实施例1得到的cu-n-c材料和实施例6得到的cu-c材料的x-射线光电子能谱分析:
分别对cu-c和cu-n-c材料进行了x-射线光电子能谱扫描,图3是两种材料总的元素扫描能谱图,有氮元素掺杂的cu-n-c材料比在相同实验条件下制备,没有氮元素掺杂的cu-c材料的cl、cu元素的含量多。
图4是采用分峰法对c、n元素的分析图。(a)是cu-n-c和cu-c材料的c元素的xps键能图谱,显示两种材料具有相似的碳的种类及,在284.8ev、286.2ev、288.9ev、296.1ev的键能位置有四个峰,主要有石墨化碳、碳氧单键或碳氧双键。(b)是cu-n-c材料中的n元素的键能图谱,显示在398.5ev、399.9ev、402.8ev有三个峰,分别代表着吡啶型氮、吡咯型氮、石墨型氮三种类型的氮。其中吡啶氮含量最高,是氮的主要存在形式。由于吡啶型氮掺杂的碳材料有助于催化剂活性中心cux与碳材料的结合。所以此方法能够有效的负载金属铜于碳材料上。吡咯型氮的结构不稳定,石墨型氮掺杂的碳材料对促进金属铜的吸附的效果不明显。
通过xps的检测分析cu-c和cu-n-c材料的铜的价态能谱图如图5所示,cu-c材料的cu2p3/2在xps图谱中的键能位置在933.1ev,935.0ev。所以材料中铜的价态应该有cu1+、cu2+,由于cu0和cu1+的键能相似,所以可能同时存在cu0、cu1+、cu2+;cu2p1/2在xps图谱中的键能位置在952.9ev,与cuo的键能位置吻合。cu-n-c材料的cu2p3/2在xps图谱中的键能位置在932.4ev,934.6ev。结果显示材料中铜的价态应该有cu1+、cu2+,由于cu0和cu1+的键能相似,所以可能同时存在cu0、cu1+、cu2+;cu2p1/2在xps图谱中的键能位置在952.1ev,与cuo的键能位置有些偏差,在±0.5ev的误差范围内,可能是cu0和cu1+的化合物。
图6显示cu-n-c和cu-c材料的cl元素的2p键能图谱,cu-n-c材料的cl2p有两个峰,键能分别是198.0ev、199.5ev。根据文献报道和数据库对比,这两个位置的键能分别对应化合物cucl2和cucl。cu-c材料的cl2p也有两个峰,键能分别是198.0ev、199.5ev。根据文献报道和数据库对比,这两个位置的键能均与化合物cucl2对应。
图7所示cu-n-c和cu-c材料的o元素的1s键能图谱,cu-n-c材料的o1s有两个峰,键能分别是531.5ev、532.6ev。根据文献报道和数据库对比,这两个位置的键能分别对应化合物mgo和h2o。cu-c材料的o1s有三个峰,键能分别是530.9ev、532.0ev、533.9ev。根据文献报道和数据库对比,这前两个位置的键能分别对应化合物cuo/cu2o、mgo,533.9ev可能是c-o键的键能。
表5cu-n-c和cu-c材料的不同种元素的含量
对不同元素的含量进行测定,测定结果如表5所示,经过对比发现有n元素掺杂的cu-n-c材料的cl和cu元素的含量较高,而cu-c材料中cl和cu元素的含量非常低。这可能是因为n元素的掺杂有利于铜盐和前驱体的充分混合,减少了两者的损失。同时,因为大量的铜被包裹在碳材料中造成xps与icp检测出的cu元素的含量差距较大。
总结,结合xrd、xps的分析结果,推测造成cu-c材料和cu-n-c材料的催化能力的巨大差异的原因可能是由于n元素的掺杂,铜源与前驱体充分混合后反应,可以使还原cucl2的历程中生成cucl,而cucl具有催化能力。cu-c材料由于没有n元素掺杂,不仅铜源无法与前驱体充分接触形成团聚,在还原过程中无法调节,致使cucl2直接被还原为单质cu,且由于团聚的缘故部分原料仍未充分反应。
5.实施例1得到的cu-n-c材料和实施例6得到的cu-c材料的氮气吸附脱附分析:
如图8是对cu-n-c和cu-c材料的n2吸附脱附曲线和孔径分布的研究,(a)中c材料对n2有着迅速、较强的吸附能力;掺杂如cu元素使c材料对n2的吸附速率和吸附量有所下降,脱吸附速率加快;同时掺杂cu、n元素是c材料对n2的吸附速率和吸附量急剧下降。这可能是因为不同元素的掺杂改变了c材料表面的理化性质及占用了一定的空隙使比表面积下降的原故(见表6)。(b)中c、cu-c、cu-n-c材料的孔径分布在介孔范围内,并且随着不同元素的掺杂有向微孔变化的趋势。
表6cu-n-c、cu-c、c材料的比表面积
以下为各实施例产物的结构表征:
实施例36:
(e)-1,2-diphenyldiazene.yellowsolide.1hnmr(500mhz,cdcl3,tms):δ7.91-7.93(m,4h),7.52-7.49(m,4h),7.48-7.44(m,2h).13cnmr(125.4mhz,cdcl3,tms):δ152.7,131.0,129.1,122.9.ms(ei):m/z(%)182.0(63),77.0(100),105.0(28),51.0(22),152.0(9),183.0(5),153.0(5).thiscompoundwasknown:wang,j.-q.;he,j.;cao,x.-q.;gu,h.-w.rscadv.,2014,4,16607.
实施例37:
(e)-1,2-di-p-tolyldiazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.81(d,j=10.0hz,4h),7.30(d,j=10.0hz,4h),2.42(s,6h).13cnmr(125.4mhz,cdcl3,tms):δ150.9,141.2,129.7,122.7,21.5.ms(ei):m/z(%)211.0(5),210.0(29),119.0(19),165.0(6),92.0(8),91.0(100),89.0(5),65.0(28),63.0(4),51.0(4).thiscompoundwasknown:cao,y.;liu,x.;li,h.-q.angew.chem.int.ed.,2014,53,7624.
实施例38:
(e)-1,2-bis(3-methylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.73-7.71(m,4h),7.41-7.38(m,2h),7.29-7.24(m,2h),2.45(s,6h).13cnmr(125.4mhz,cdcl3,tms):δ152.8,138.9,131.7,128.9,122.9,120.5,21.4.ms(ei):m/z(%)210.0(40),119.0(40),107.0(14),91.0(100),65.0(16).thiscompoundwasknown:zhang,c.;jiao,n.angew.chem.int.ed.,2010,49,6174.
实施例39:
(e)-1,2-bis(2-methylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.62(d,j=10.0hz,2h),7.37-7.33(m,4h),7.28-7.25(m,2h),2.74(s,6h).13cnmr(125.4mhz,cdcl3,tms):δ151.1,138.0,131.3,130.7,126.4,115.9,17.6.ms(ei):m/z(%)210.0(39),165.0(7),119.0(14),91.0(100),65.0(24).thiscompoundwasknown:zhang,c.;jiao,n.angew.chem.int.ed.,2010,49,6174.
实施例40:
(e)-1,2-bis(4-ethylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.86(d,j=10.0hz,4h),6.98(d,j=10.0hz,4h),4.10(q,j=5.0hz,4h),1.44(t,j=5.0hz,6h).13cnmr(125.4mhz,cdcl3,tms):δ160.9,147.0,124.3,114.7,63.8,14.8.ms(ei):m/z(%)237.4(31),132.5(19),106.8(100),102.7(14),78.7(21).thiscompoundwasknown:singh,s.;wahajuddin,w.;yadav,p.p.etal.rscadv.,2015,5,61876.
实施例41:
(e)-1,2-bis(4-isopropylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.84(d,j=10.0hz,4h),7.36(d,j=10.0hz,4h),2.90(m,2h),1.30(d,j=5.0hz,12h).13cnmr(125.4mhz,cdcl3,tms):δ152.0,151.2,127.1,122.8,34.1,23.9.ms(ei):m/z(%)265.3(36),146.3(12),118.7(100),90.7(28),76.7(6).thiscompoundwasknown:sarkar,p.;mukhopadhyay,c..greenchem.,2016,18,442.
实施例42:
(e)-1,2-bis(4-methoxyphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.87(d,j=10.0hz,4h),6.98(d,j=10.0hz,4h),3.85(s,6h).13cnmr(125.4mhz,cdcl3,tms):δ161.6,147.1,124.4,114.2,55.5.ms(ei):m/z(%)242.0(73),135.0(49),107.0(100),92.0(26),77.0(44),64.0(16).thiscompoundwasknown:zhang,c.;jiao,n.angew.chem.int.ed.,2010,49,6174.
实施例43:
(e)-1,2-bis(3-methoxyphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.56(d,j=10.0hz,2h),7.45-7.41(m,4h),7.05(d,j=10.0hz,2h),3.90(s,6h).13cnmr(125.4mhz,cdcl3,tms):δ160.3,153.8,129.8,117.9,117.2,105.7,56.5.ms(ei):m/z(%)242.0(45),135.0(18),107.0(100),92.0(24),77.0(35),64.0(16).thiscompoundwasknown:pothula,k.;wang,z.etal.rscadv.,2015,5,83144.
实施例44:
(e)-1,2-bis(2-methoxyphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.63(d,j=10.0hz,2h),7.43-7.40(m,2h),7.07(d,j=10.0hz,2h),7.00(t,j=10.0hz,2h),4.01(s,6h).13cnmr(125.4mhz,cdcl3,tms):δ156.9,143.0,132.2,120.9,117.6,112.6,56.4.ms(ei):m/z(%)242.0(17),135.0(76),120.0(16),92.0(41),79.0(43),77.0(100),64.0(16),51.0(14).thiscompoundwasknown:pothula,k.;wang,z.etal.rscadv.,2015,5,83144.
实施例45:
(e)-1,2-bis(4-chlorophenyl)diazene.yellowsolide.1hnmr(500mhz,cdcl3,tms):δ7.86(d,j=10.0hz,4h),7.49(d,j=10.0hz,4h).13cnmr(125.4mhz,cdcl3,tms):δ150.8,137.3,129.4,124.2.ms(ei):m/z(%)251.9(14),249.9(20),138.9(40),112.9(32),110.9(100),111.9(11),75.0(41),50.0(10).thiscompoundwasknown:morales-guio,c.;yuranov,i.;kiwi-minsker,l.topcatal.,2014,57,1526.
实施例46:
(e)-1,2-bis(3-chlorophenyl)diazene.yellowsolide.1hnmr(500mhz,cdcl3,tms):δ7.90(s,2h),7.84-7.82(m,2h),7.46(d,j=5.0hz4h).13cnmr(125.4mhz,cdcl3,tms):δ153.2,135.3,131.2,130.2,122.6,121.9.ms(ei):m/z(%)252.0(23),249.9(35),152.1(8),141.0(12),139.0(39),113.0(31),111.0(100),76.0(9),75.0(26).thiscompoundwasknown:cao,y.;liu,x.;li,h.-q.angew.chem.int.ed.,2014,53,7624.
实施例47:
(e)-1,2-bis-(4-bromophenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.79(d,j=10.0hz,4h),7.65(d,j=10.0hz,4h).13cnmr(125.4mhz,cdcl3,tms):δ151.2,132.4,125.2,124.4.ms(ei):m/z(%)341.8(24),339.8(46),337.8(25),184.9(52),182.9(53),156.9(95),154.9(100),152.0(20),76.0(60),75.0(42),63.0(13),50.0(22).thiscompoundwasknown:zhang,c.;jiao,n.angew.chem.int.ed.,2010,49,6174.
实施例48:
(e)-1,2-bis-(3-bromophenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ8.08-8.07(m,2h),7.92-7.89(m,2h),7.66-7.63(m,2h),7.44(t,j=10.0hz,2h).13cnmr(125.4mhz,cdcl3,tms):δ153.2,134.1,130.5,124.8,123.2,123.2.ms(ei):m/z(%)341.8(24),339.8(48),337.8(24),184.9(59),182.9(59),154.9(100),156.9(89),76.0(58),75.0(48),50.0(27).thiscompoundwasknown:morales-guio,c.;yuranov,i.;kiwi-minsker,l.topcatal.,2014,57,1526.
实施例49:
(e)-1,2-bis-(4-fluorophenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.93-7.91(m,4h),7.21-7.18(m,4h).13cnmr(125.4mhz,cdcl3,tms):δ164.0(d,j=238.2hz),149.0(d,j=2.5hz),124.8(d,j=10.0hz),116.0(d,j=11.3hz).ms(ei):m/z(%)217.9(24),218.9(3),123.0(29),96.0(7),95.0(100),75.0(21),69.0(3).thiscompoundwasknown:zhang,c.;jiao,n.angew.chem.int.ed.,2010,49,6174.
实施例50:
(e)-1,2-bis(4-ethoxyphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.86(d,j=10.0hz,4h),6.98(d,j=10.0hz,4h),4.10(q,j=5.0hz,4h),1.44(t,j=5.0hz,6h).13cnmr(125.4mhz,cdcl3,tms):δ161.0,147.0,124.3,114.7,63.8,14.8.ms(ei):m/z(%)270.1(12),163.1(100),148.1(98),134.1(65),93.0(75),77.0(90),65.0(64).thiscompoundwasknown:gund,s.h.;shelkar,r.s.;nagarkar,j.m..rscadv.,2014,4,42947.
实施例51:
(e)-1,2-bis(2-ethoxyphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.68(d,j=15.0hz,2h),7.44-7.34(m,2h),7.10(d,j=15.0hz,2h),7.05-6.99(m,2h),4.28(q,j=10.0hz,4h),1.54(t,j=10.0hz,4h).13cnmr(125.4mhz,cdcl3,tms):δ156.4,143.2,132.0,120.9,117.5,114.5,65.3,14.9.ms(ei):m/z(%)270.1(54),149.1(32),121.1(100),91.0(10),77.0(16),65.0(27).thiscompoundwasknown:k.n.simsek.monatsheftefuerchemie.,2010,141,1089.
实施例54:
(e)-1,2-bis(2,4-dimethylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.55(d,j=10.0hz,2h),7.13(s,2h),7.05(d,j=10.0hz,2h),2.69(s,6h),2.37(s,6h).13cnmr(125.4mhz,cdcl3,tms):δ149.3,140.7,137.8,131.8,127.1,115.7,21.4,17.6.ms(ei):m/z(%)238.0(33),133.1(9),105.0(100),103.0(11),79.0(17),77.0(17).thiscompoundwasknown:zhang,c.;jiao,n.angew.chem.int.ed.,2010,49,6174.
实施例55:
(e)-1,2-bis(3,5-dimethylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.52(s,4h),7.10(s,2h),2.41(s,12h).13cnmr(125.4mhz,cdcl3,tms):δ153.0,138.7,132.5,120.6,21.3.ms(ei):m/z(%)238.2(32),133.0(19),105.1(100),103.1(11),79.1(18),77.1(19).thiscompoundwasknown:dutta,b.;alpay,s.p.;suib,s.l.etal.angew.chem.int.ed.,2016,55,2171.实施例56:
实施例56:
(e)-1,2-bis(2,5-dimethylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.40(s,2h),7.22(d,j=10.0hz,2h),7.17(d,j=10.0hz,2h),2.69(s,6h),2.37(s,6h).13cnmr(125.4mhz,cdcl3,tms):δ151.0,136.0,134.9,131.4,131.1,116.3,21.1,17.2.ms(ei):m/z(%)237.4(30),132.5(6),104.7(100),102.7(10),78.7(15).thiscompoundwasknown:shiy.z..org.lett.,2013,15,1942.
实施例57:
(e)-1,2-bis(4-t-bu-phenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.84(d,j=10.0hz,4h),7.52(d,j=10.0hz,4h),1.36(s,18h).13cnmr(125.4mhz,cdcl3,tms):δ154.2,150.8,126.0,122.5,35.0,31.3.ms(ei):m/z(%)294.3(30),161.2(16),133.2(100),118.0(12),105.1(16),91.1(20).thiscompoundwasknown:sarkar,p.;mukhopadhyay,c..greenchem.,2016,18,442.
实施例58:
(e)-1,2-bis(4-cyclohexylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.82(d,j=10.0hz,2h),7.33(d,j=10.0hz,2h),2.60-2.56(m,2h),1.92-1.86(m,10h),1.48-1.40(m,10h).13cnmr(125.4mhz,cdcl3,tms):δ151.2,151.1,127.5,122.7,44.6,34.3,26.8,26.1.ms(ei):m/z(%)263.2(81),158.1(100),116.7(19),104.7(29),90.7(58),76.7(72).thiscompoundwasknown:zhang,c.;jiao,n.angew.chem.int.ed.,2010,49,6174.
实施例59:
(e)-1,2-bis(3-cl-4-methylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.89(s,2h),7.72(d,j=5.0hz,2h),7.36(d,j=5.0hz,2h),2.44(s,6h).13cnmr(125.4mhz,cdcl3,tms):δ151.4,139.3,135.2,131.3,122.5,122.2,20.2.ms(ei):m/z(%)280.1(18),278.1(28),153.1(26),127.1(31),125.1(100).thiscompoundwasknown:majhi,bijuetal.chemistry-aeuropeanjournal,2014,20,9862.
实施例60:
(e)-1,2-bis(2,4-dichlorophenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ8.01(s,2h),7.79(d,j=10.0hz,2h),7.61(d,j=10.0hz,2h).13cnmr(125.4mhz,cdcl3,tms):δ151.1,135.7,133.7,131.0,124.1,123.0.ms(ei):m/z(%)320.0(20),318.0(16),175.0(20),173.0(33),145.0(100),147.0(65).cao,y.;liu,x.;li,h.-q..angew.chem.int.ed.,2014,53,7624.
实施例61:
(e)-1-phenyl-2-(p-tolyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.90(d,j=10.0hz,2h),7.84(d,j=5.0hz,2h),7.52-7.44(m,3h),7.32(d,j=5.0hz,2h),2.43(s,3h).13cnmr(125.4mhz,cdcl3,tms):δ152.8,150.8,141.6,130.7,129.8,129.1,122.9,122.7,21.5.ms(ei):m/z(%)196.0(44),119.0(26),91.0(100),77.0(43),65.0(25),51.0(12).thiscompoundwasknown:morales-guio,c.;yuranov,i.;kiwi-minsker,l.topcatal.,2014,57,1526.
实施例62:
(e)-1-phenyl-2-(4-ethylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.92(d,j=10.0hz,2h),7.86(d,j=5.0hz,2h),7.52-7.45(m,3h),7.34(d,j=5.0hz,2h),2.73(q,j=10.0hz,2h),1.28(t,j=10.0hz,3h).13cnmr(125.4mhz,cdcl3,tms):δ152.7,151.0,147.8,130.7,131.0,129.1,122.9,28.9,15.4.ms(ei):m/z(%)209.6(10),132.5(23),104.7(100),78.7(25),50.8(10).thiscompoundwasknown:m.e.bouillon;h.h.meyer.tetrahedron,2016,72,3151.
实施例63:
(e)-1-phenyl-2-(4-chlorophenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.91(d,j=10.0hz,2h),7.87(d,j=10.0hz,2h),7.53-7.47(m,5h).13cnmr(125.4mhz,cdcl3,tms):δ152.5,151.0,136.9,131.3,129.4,129.2,124.2,122.9.ms(ei):m/z(%)216.0(43),139.1(28),111.0(66),105.1(32),77.0(100),75.0(23).cao,y.;liu,x.;li,h.-q.angew.chem.int.ed.,2014,53,7624.
实施例64:
(e)-1-phenyl-2-(4-bromophenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.92(d,j=5.0hz,2h),7.80(d,j=10.0hz,2h),7.65(d,j=10.0hz,2h),7.54-7.49(m,3h).13cnmr(125.4mhz,cdcl3,tms):δ152.5,151.4,132.4,131.3,129.2,125.4,124.4,122.9.ms(ei):m/z(%)259.9(45),261.9(43),182.9(19),184.8(18),156.9(36),154.9(40),105.0(52),77.0(100),50.9(17).thiscompoundwasknown:wang,m.;zhang,zetal.catal.sci.technol.,2016,6,1940.
实施例65:
(e)-1-phenyl-2-(4-iodophenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.92(d,j=5hz,2h),7.80(d,j=10hz,2h),7.65(d,j=10hz,2h),7.54-7.49(m,3h).13cnmr(125.4mhz,cdcl3,tms):δ152.5,151.4,132.4,131.3,129.2,125.4,124.4,122.9.ms(ei):m/z(%)242.05(73),135.05(49),107.05(100),92.00(26),77.00(44),64.00(16).thiscompoundwasknown:s.jan;l.matlhiasetal.chem.eur.j.,2015,21,11165.
实施例66:
(e)-1-phenyl-2-(4-fluorophenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.96-7.89(m,4h),7.53-7.45(m,4h).13cnmr(125.4mhz,cdcl3,tms):δ152.7,131.0,128.9(d,jf-c=48.9hz),127.3,124.5(d,jf-c=8.8hz),122.8,120.5,116.0(d,jf-c=22.6hz).ms(ei):m/z(%)199.9(55),123.0(36),105.0(25),95.0(100),77.0(81),51.0(20).thiscompoundwasknown:wang,m.;zhang,zetal.catal.sci.technol.,2016,6,1940.
实施例67:
(e)-1-phenyl-2-(3,5-dimethylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.90(d,j=10.0hz,2h),7.54(s,2h),7.52-7.46(m,3h),7.13(s,1h).13cnmr(125.4mhz,cdcl3,tms):δ152.9,152.7,138.8,132.7,130.8,129.1,122.8,120.6,21.3.ms(ei):m/z(%)210.0(49),133.1(18),105.0(100),77.0(62),51.0(10).thiscompoundwasknown:dutta,b.;alpay,s.p.;suib,s.l.etal.angew.chem.int.ed.,2016,55,2171.
实施例68:
(e)-methyl-4-(phenyldiazenyl)benzoate.yellowsolide1hnmr(500mhz,cdcl3,tms):δ8.19(d,j=10.0hz,2h),7.96(d,j=5.0hz,2h),7.95(d,j=5.0hz,2h),7.54-7.52(m,3h),3.96(s,3h).13cnmr(125.4mhz,cdcl3,tms):δ166.5,155.2,152.6,131.8,131.7,130.6,129.2,123.2,122.7,52.3.ms(ei):m/z(%)240.0(52),135.0(63),105.0(44),103.0(16),77.0(100),51.0(15).thiscompoundwasknown:zhang,c.;jiao,n.angew.chem.int.ed.,2010,49,6174.
实施例69:
(e)-1-phenyl-2-(4-(tert-butyl)phenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.90(d,j=10hz,2h),7.54(s,2h),7.52-7.46(m,3h),7.13(s,1h).13cnmr(125.4mhz,cdcl3,tms):δ152.9,152.7,138.8,132.7,130.8,129.1,122.8,120.6,21.3.ms(ei):m/z(%)238.1(50),161.1(14),133.1(100),105.0(31),91.0(29),77.0(54).thiscompoundwasknown:m.e.bouillon;h.h.meyer.tetrahedron,2016,72,3151.
实施例70:
(e)-1-phenyl-2-(4-isopropylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.93-7.83(m,4h),7.53-7.43(m,4h),7.37-7.34(m,1h),3.01-2.96(m,1h),1.30(d,j=5.0hz,6h).13cnmr(125.4mhz,cdcl3,tms):δ152.7,152.4,151.1,131.0,129.1,127.1,122.9,122.7,34.2,23.9.ms(ei):m/z(%)223.3(29),146.2(13),118.7(100),104.7(11),90.7(39),76.7(50).thiscompoundwasknown:m.e.bouillon;h.h.meyer.tetrahedron,2016,72,3151.
实施例71:
(e)-1-phenyl-2-(2,6-dimethylphenyl)diazene.yellowsolide1hnmr(500mhz,cdcl3,tms):δ7.93-7.83(m,4h),7.53-7.43(m,4h),7.37-7.34(m,1h),3.01-2.96(m,1h),1.30(d,j=5hz,6h).13cnmr(125.4mhz,cdcl3,tms):δ152.7,152.4,151.1,131.0,129.1,127.1,122.9,122.7,34.2,23.9.ms(ei):m/z(%)209.6(10),132.5(22),104.7(100),76.7(63),50.8(11).thiscompoundwasknown:yix.l.;jiaol.;xic.j..org.biomol.chem.,2016,14,9912.
以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
- 还没有人留言评论。精彩留言会获得点赞!