固化pH梯度的毛细管等电聚焦开管柱及其制备方法与流程
本发明涉及功能化有机材料和分析技术领域,特别是涉及一种固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱及其制备方法。
背景技术:
毛细管等电聚焦(cief)已成为两性化合物分离的一种广泛应用的方法,尤其在蛋白质的分离和分析中。cief主要分为两类:载体两性自由溶液毛细管等电聚焦(caf-cief)和固定化ph梯度毛细管等电聚焦(ipg-cief)。与ipg-cief相比,caf-cief已被广泛应用于分离多肽和蛋白质。然而,为了建立ph梯度,并在聚焦过程中维持电流,caf-cief要求在缓冲溶液和样品溶液中加入载体两性电解质(cas),这会降低在低波长处的紫外检测灵敏度,还会使cief和质谱的联用变得困难。
为了降低或避免cas的使用,厚的玻璃管(1.5mmid)被首先用于cas的固化(cas-ipg);该方法采用类似于凝胶铸造的方法。然而,如果当使用过高的电场时,“固定化”的梯度将倾向于从管中移出并向碱性处移动。其原因是cas没有被共价固定,凝胶本身也没有固定在管壁上。此外,ipg条带也用于分离蛋白,但其离线和单次使用的特点限制了其与其他检测仪器的结合。另外,ipg-cief由于其分辨率高、速度快、聚焦效果好、节省cas、与常规检测仪器易联用等特点而备受关注。整体型的ipg(m-ipg)柱的制备方法遵循三个步骤,即合成整体柱,引入官能团,以及将cas固定在聚合物柱上。此外,为了简化m-ipg的制备流程和探索新的材料,m-ipg柱在2006年至2011年之间取得了更进一步的进展。对于这些ipg-cief柱,通常使用含醛或环氧基团的功能性单体,因为cas的氨基很容易与这些活性基团反应。
开管电色谱(ot-cec)作为一种分离技术,它结合了毛细管和液相的高效分离和高选择性的优势,其分离能力被高度认可,特别是在蛋白质和肽的分离方面。利用多孔层开管(plot)技术进行蛋白质cief的可能性在2010年也已经被证实。然而,在没有使用cas的情况下,cief柱中ph范围的变化是逐步的,而不是线性的。ipg常被用于完全涂层的开管柱或完全填充整体柱,然而,对开管柱来说,由于常规的开管柱中仅有较薄的涂层,这不利于cas的键合,从而导致制备的固化ph梯度的常规开管等电聚集柱的效果差;对整体柱而言,尽管整体柱能够充分的键合cas,但是整体柱内的基质也会对分析物形成一定的干扰,特别是对复杂的蛋白类基质,进而影响该柱子的重复性。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种固化ph梯度的毛细管等电聚焦开管柱及其制备方法,用于对不同等电点的蛋白和/或小分子氨基酸进行分离,避免向缓冲溶液和样品溶液中添加载体两性电解质,从而防止干扰分析物的分离、引起基线波动、在低紫外波长处灵敏度降低等问题。
为实现上述目的及其他相关目的,本发明提供一种固化ph梯度的毛细管等电聚焦开管柱的制备方法,包括:在毛细管内表面修饰亲水性有机聚合物,再经载体两性电解质修饰,得到多孔层毛细管等电聚焦开管柱,在毛细管内表面修饰亲水性有机聚合物时,采用的试剂包括交联剂、功能性单体、均一性溶剂、致孔剂、溶剂、引发剂。均一性溶剂是指在聚合反应的有机物中引入该溶剂,从而能够调节聚合物在形成过程中的速度,使整体柱的各部分相对均一。
可选地,所述交联剂选自丙烯酰胺、n,n-亚甲基双丙酰酰胺中的至少一种。
可选地,所述功能性单体选自甲基丙烯酸缩水甘油酯、甲基丙烯酸甲酯-b-甲基丙烯酸缩水甘油酯、丙烯酸缩水甘油酯中的至少一种。
可选地,所述均一性溶剂选自1,4-丁二醇。
可选地,所述致孔剂选自环己醇、正十二醇、聚乙二醇2000中的至少一种。
可选地,所述溶剂选自n,n-二甲基亚砜。
可选地,所述引发剂选自偶氮二异丁腈、偶氮二异庚腈、二苯甲酮中的至少一种。
可选地,修饰亲水性有机聚合物时,按质量计,交联剂:功能性单体:均一性溶剂:致孔剂:溶剂:引发剂=(57-65):(20-23):(148-152):(187-190):(357-360):(5-7)。
可选地,修饰亲水性有机聚合物时,按质量计,丙烯酰胺:n,n-亚甲基双丙酰酰胺:甲基丙烯酸缩水甘油酯:1,4-丁二醇:正十二醇:n,n-二甲基亚砜:偶氮二异丁腈=(17-20):(40-45):(20-23):(148-152):(187-190):(357-360):(5-7)。
可选地,所述毛细管为内表面经含有活性基团修饰的毛细管。
可选地,所述毛细管为内表面经双键功能化修饰的毛细管。
可选地,采用的修饰物选自3-(三甲氧基甲硅基)甲基丙烯酸丙酯、3-(三甲氧基甲硅基)甲基丙烯酸乙酯、3-(三甲氧基甲硅基)甲基丙烯酸丁酯中的至少一种。
可选地,采用的溶剂选自甲醇、乙醇、异丙醇中的至少一种。
可选地,所述溶液的浓度为50%(v/v)。
可选地,采用活性基团修饰毛细管内表面时,将修饰物填入毛细管之后,于40-80℃环境中放置8-14h。
可选地,修饰亲水性有机聚合物时,将修饰物部分填充至毛细管中,根据分析物的复杂程度及兼顾仪器平台的要求来选择毛细管的填充长度。
可选地,修饰物的填充长度占毛细管总长度的比例为60-80%。
可选地,向毛细管中填入亲水性有机聚合物后,于40-80℃环境中反应8-14h。
可选地,所述载体两性电解质为具有不同ph范围的载体两性电解质。
可选地,所述载体两性电解质选自pharmalyte、ampholine中的至少一种。
可选地,所述载体两性电解质选自pharmalyte(3-10)、pharmalyte(4-6.5)中的至少一种。
可选地,向毛细管中填入载体两性电解质后,于60-80℃环境中反应18-26h。
可选地,所述毛细管的内径为50-100μm。
本发明第二方面提供一种固化ph梯度的毛细管等电聚焦开管柱,所述包括一毛细管,所述毛细管的内表面修饰有亲水性有机聚合物以及载体两性电解质,在毛细管内表面修饰亲水性有机聚合物时,采用的试剂包括交联剂、功能性单体、均一性溶剂、致孔剂、溶剂、引发剂。
可选地,所述交联剂选自丙烯酰胺、n,n-亚甲基双丙酰酰胺中的至少一种。
可选地,所述功能性单体选自甲基丙烯酸缩水甘油酯、甲基丙烯酸甲酯-b-甲基丙烯酸缩水甘油酯、丙烯酸缩水甘油酯中的至少一种。
可选地,所述均一性溶剂选自1,4-丁二醇。
可选地,所述致孔剂选自环己醇、正十二醇、聚乙二醇2000中的至少一种。
可选地,所述溶剂选自n,n-二甲基亚砜。
可选地,所述引发剂选自偶氮二异丁腈、偶氮二异庚腈、二苯甲酮中的至少一种。
可选地,修饰亲水性有机聚合物时,按质量计,交联剂:功能性单体:均一性溶剂:致孔剂:溶剂:引发剂=(57-65):(20-23):(148-152):(187-190):(357-360):(5-7)。
可选地,修饰亲水性有机聚合物时,按质量计,丙烯酰胺:n,n-亚甲基双丙酰酰胺:甲基丙烯酸缩水甘油酯:1,4-丁二醇:正十二醇:n,n-二甲基亚砜:偶氮二异丁腈=(17-20):(40-45):(20-23):(148-152):(187-190):(357-360):(5-7)。
可选地,所述毛细管的内表面预先修饰有活性官能基团。
可选地,所述活性官能基团选自双键。
可选地,修饰活性官能基团时采用的修饰物选自3-(三甲氧基甲硅基)甲基丙烯酸丙酯、3-(三甲氧基甲硅基)甲基丙烯酸乙酯、3-(三甲氧基甲硅基)甲基丙烯酸丁酯中的至少一种。
可选地,所述载体两性电解质为具有不同ph范围的载体两性电解质。
可选地,所述载体两性电解质选自pharmalyte、ampholine中的至少一种。
可选地,所述载体两性电解质选自pharmalyte(3-10)、pharmalyte(4-6.5)中的至少一种。
本发明第三方面提供上述毛细管等电聚焦开管柱在不同等电点的蛋白和/或小分子氨基酸分离中的应用。
与现有技术相比,本发明具有如下有益效果:本发明合成了一种固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱,首先对毛细管内表面修饰双键或者其他活性官能基团,然后利用双键的自由基反应或者其他反应机理键合不同种类的亲水性有机聚合物,使其表面富含环氧活性功能基团,然后利用环氧基的高反应活性,对其进行载体两性电解质的修饰;此外,本发明采用部分填充的技术,能够使制备的固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱的有效梯度覆盖载体两性电解质的全部范围。另外,本发明的等电聚焦柱兼有整体柱的高相比和传统开管柱的低柱压特点,使该等电聚焦柱能在较低的压力下完成聚焦样品的迁移过程,且重现性良好。利用该固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱,对不同等电点的蛋白及小分子氨基酸进行分离。这有助于避免向缓冲溶液和样品溶液中添加载体两性电解质,从而防止干扰分析物的分离、引起基线波动、在低紫外波长处灵敏度降低等问题。
附图说明
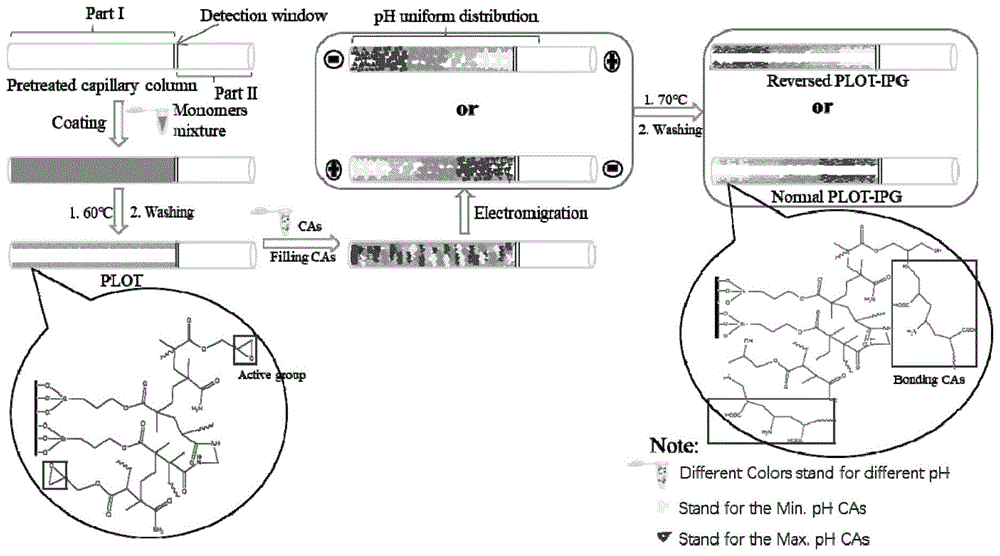
图1显示为固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱的制备流程图。
图2显示为实施例6制得的内径为100μm的固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱的扫描电镜图。
图3显示为亲水性聚合物及固化了载体两性电解质的亲水性聚合物的红外光谱图。曲线a为实施例4制得的内径100μm的亲水性有机聚合物多孔层毛细管等电聚焦开管柱的吸收曲线,曲线b为实施例6制得的内径100μm的固化了载体两性电解质的亲水性有机聚合物多孔层毛细管等电聚焦开管柱的吸收曲线。
图4显示为固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱用于分离标准蛋白的电色谱图。
图5显示为固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱用于分离人血清蛋白的电色谱图。
图6显示为固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱用于分离5个必需氨基酸的电色谱图。
具体实施方式
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
本发明首次使用部分填充技术来制备plot-ipg柱。本发明分两步制备了一种具有固定化ph梯度的多孔层开管毛细管柱(plot-ipg)。首先,用丙烯酰胺、甲基丙烯酸缩水甘油酯和n、n'–亚甲双丙烯酰胺的聚合物溶液对毛细管柱进行原位聚合涂层。所得到的涂层柱具有低的后压和高相比的特性。在第二步中,在制备的聚合物柱中电迁移了载体两性电解质的水溶液。因此,固定化cas的cief能够在这一多孔层柱上进行。而且由于聚合物的亲水性和开管的特性,plot-ipg柱中的非特异性吸附和蛋白沉淀也得到了缓解。
图1显示为以下实施例中固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱的制备流程图。
实施例1
双键功能化的50μm内径的毛细管柱的制备
内径为50μm的毛细管在微流泵的流速为1.0μl/min情况下,分别经过1.0mm氢氧化钠处理30min,去离子水处理10min,0.1mmhcl处理30min,去离子水处理10min,纯甲醇处理30min后,用n2气吹干。配置50%(v/v)的3-(三甲氧基甲硅基)甲基丙烯酸丙酯的甲醇溶液,并将该溶液填入上述的干燥后的毛细管中,待填满后,于60℃的烘箱中放置12小时。取出毛细管后,用甲醇冲1h,n2气吹干。
实施例2
双键功能化的100μm内径的毛细管柱的制备
内径为100μm的毛细管在微流泵的流速为1.0μl/min情况下,分别经过1.0mm氢氧化钠处理30min,去离子水处理10min,0.1mmhcl处理30min,去离子水处理10min,纯甲醇处理30min后,用n2气吹干。配置50%(v/v)的3-(三甲氧基甲硅基)甲基丙烯酸丙酯的甲醇溶液,并将该溶液填入上述的干燥后的毛细管中,待填满后,于60℃的烘箱中放置12小时。取出毛细管后,用甲醇冲1h,n2气吹干。
实施例3
50μm内径的亲水性多孔毛细管开管柱的制备
称取丙烯酰胺(17.0-20.0mg)、n,n-亚甲基双丙酰酰胺(40.0-45.0mg)、甲基丙烯酸缩水甘油酯(20.0-23.0mg)、1,4-丁二醇(148.0-152.0mg)、正十二醇(187.0-190.0mg)、n,n-二甲基亚砜(357.0-360.0mg),然后加入偶氮二异丁腈(5.0-7.0mg),混匀,n2气吹5min。取修饰后的50μm内径的毛细管50cm长,用记号笔在柱长的35cm处标记,然后吸取该溶液至标记处,两端用橡皮塞密封,并于70℃下反应24小时。待反应完成后,取出毛细管柱,并依次用甲醇冲洗2h,水冲洗1h。
实施例4
100μm内径的亲水性多孔毛细管开管柱的制备
称取丙烯酰胺(17.0-20.0mg)、n,n-亚甲基双丙酰酰胺(40.0-45.0mg)、甲基丙烯酸缩水甘油酯(20.0-23.0mg)、1,4-丁二醇(148.0-152.0mg)、正十二醇(187.0-190.0mg)、n,n-二甲基亚砜(357.0-360.0mg),然后加入偶氮二异丁腈(5.0-7.0mg),混匀,n2气吹5min。取修饰后的100μm内径的毛细管50cm长,用记号笔在柱长的35cm处标记,然后吸取该溶液至标记处,两端用橡皮塞密封,并于70℃下反应24小时。待反应完成后,取出毛细管柱,并依次用甲醇冲洗2h、水冲洗1h。
实施例5
ph3-10(宽梯度范围)的载体两性电解质pharmalyte修饰的亲水性多孔毛细管开管柱的制备
取上述实施例3、实施例4中制备的亲水性多孔毛细管开管柱,分别填入7%(v/v)载体两性电解质水溶液,经加12kv电迁移16min后,柱两端密封,并置于70℃烘箱中反应24h。反应结束后,依次用超纯水、乙醇冲洗。
实施例6
ph4-6.5(窄梯度范围)的载体两性电解质pharmalyte修饰的亲水性毛细管开管柱的制备
取上述实施例3、实施例4中制备的亲水性多孔毛细管开管柱,分别填入7%(v/v)载体两性电解质水溶液,经加12kv电迁移16min后,柱两端密封,并置于70℃烘箱中反应24h。反应结束后,依次用超纯水、乙醇冲洗,结果如图2和3所示。图2的电镜扫描图清晰的表明:我们的plot-ipg柱具有中空的结构,毛细管内壁的涂层较一般的开管柱的涂层厚,并具有大孔的特性;从图3的红外对比图可知:3413cm-1的峰值是聚合物中νo-h和νn-h的吸收值,以及在1666cm-1的νc=o峰值。图3中曲线b与曲线a相比,ir指纹区域存在差异。由于cas的存在(曲线b),谱带νc-n(1203cm-1)和νc-o(1109cm-1)明显增加;此外,我们也能看到δn-h(795cm-1)的吸收明显增加,这也进一步证明了cas被固定在该多空层的毛细管开管柱上。
实施例7
固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱线性范围的考察
利用传统毛细管电泳仪,将上述不同ph范围的亲水性有机聚合物多孔层固化ph梯度毛细管等电聚焦开管柱装于毛细管电泳系统进行表征,检测器为紫外检测器,检测波长为254nm。进样为:(a)0.12mg/ml碳酸酐酶、0.08mg/ml脲酶、0.15mg/ml牛血清白蛋白、0.10mg/ml胰蛋白酶抑制剂混合溶液;(b)0.2mg/ml胰凝乳蛋白、0.15mg/ml核糖核酸酶a、0.4mg/ml人血红蛋白和0.20mg/ml胰蛋白酶抑制剂混合溶液。流动相为:纯水(ph=7.85)。微流泵流速:u=200nl/min。线性相关结果见附图4。附图4表明:根据这些蛋白的pi,我们成功地分离和洗脱了这4个蛋白(如图4-a的曲线a所示),其pi值与洗脱时间的回归分析也显示出了良好的线性相关性(r=0.9965)。另外,如图4-a的曲线b所示,这些蛋白分离也良好,pi值与洗脱时间也呈很好的线性关系。因此,这进一步证明了我们的方法可以很好的固化不同ph范围梯度的cas。
实施例8
固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱用于人血清蛋白的分离
供试样品:将人血清样品用纯水稀释100倍。
将供试样品利用毛细管电泳仪进行检测,用微流泵移动聚焦区到检测窗口。检测条件:流动相为纯水,微流泵流速:u=200nl/min。色谱分离结果见附图5。实验结果表明:血清蛋白的分离在45min(聚焦35min,向窗口推进10min)内被完成。从图5a的右侧可以看到一些蛋白区,其中白蛋白峰明显,因为其含量在人血清样品中最高。另外,从这些蛋白的迁移顺序来看,pi值高的蛋白优先于pi值低的蛋白,这与plot-ipg柱(正向plot-ipg柱)的ph顺序一致。在人血清样品中,白蛋白的pi值(pi4.80)、α1-球蛋白(pi4.90)、α2-球蛋白(pi5.06)、β1-球蛋白(pi5.12)和β2-球蛋白(pi5.2)之前已经被报道。如图5b所示,它们与迁移时间的线性关系为r=0.9938。根据其碱性的不同,剩下的的蛋白质区带可以归为γ-球蛋白。
同时,我们也用宽的plot-ipg柱(考虑到蛋白区越靠近检测窗口,其峰形越尖锐,故此处我们使用反向plot-ipg柱)来分析人血清蛋白,其结果如图5-a左侧所示。可以看出,除了α1-球蛋白外,其余血清蛋白质的迁移顺序与上面的窄的plot-ipg的相反(正向plot-ipg柱)。
实施例9
固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱用于必需氨基酸的分离
供试样品:配制亮氨酸、色氨酸、苯丙氨酸、蛋氨酸和半胱氨酸的混合水溶液,各为0.01mg/ml。
将供试样品利用毛细管电泳仪进行检测,用微流泵移动聚焦区到检测窗口。检测条件:流动相为纯水,微流泵流速:u=200nl/min。色谱分离结果见附图6。实验结果表明:我们选取的5个酸性氨基酸(pi=5.05-5.98)可以通过紫外检测器来直接检测,不需要进一步的衍生化。从图6可以看出,亮氨酸(pi=5.98)和色氨酸(pi=5.89)基本可以得到分离,而其他的氨基酸能够实现基线分离。标为met`的峰来自蛋氨酸样品,这种推测通过该样品的聚焦实验得以证实。根据实验结果,通过计算表明我们新制备的plot-ipg柱的分辨率最多可达0.09ph单位。
综上所述,本发明属公开了一种固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱及其制备方法与应用。本发明首先合成亲水性有机聚合物多孔层毛细管开管柱,然后利用载体两性电解质溶液对该多孔涂层进行化学修饰,使不同ph值的载体两性电解质分子有序的固化在多孔层上。本发明的合成方法简单有效,制得的开管柱涂层厚、亲水且有大孔的特性,从而能一定程度上避免蛋白分析物的沉淀和非特异性的吸附。同时,本发明的固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱的制备方法采用部分填充的方法,能够使该柱的有效梯度覆盖载体两性电解质的全部梯度范围。此外,本发明制备的固化ph梯度的亲水性有机聚合物多孔层毛细管等电聚焦开管柱可以有效地对人血清蛋白和5个必需氨基酸进行分离。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!