一种多糖凝胶微囊及制备方法与流程
本发明属于生物医药领域,涉及一种多糖凝胶微囊及制备方法。
背景技术:
凝胶微囊,其结构与微胶囊相似,但由于其囊壁材料的特殊性,其整体上具有凝胶的性质,文献:梁治齐.微胶囊技术及其应用[m].北京:中国轻工业出版社,1999.。近年来,智能材料由于其独特的刺激响应性,一直活跃在传感器,文献:whitakercm,derouinee,o”connormb,etal.smarthydrogelsensorfordetectionoforganophosphoruschemicalwarfarenerveagents[j].journalofmacromolecularscience:parta-chemistry,2017,54(1):40-46.、人工肌肉,文献3:bassilm,davenasj,tahchime.electrochemicalpropertiesandactuationmechanismsofpolyacrylamidehydrogelforartificialmuscleapplication[j].sensors&actuatorsbchemical,2008,134(2):496-501.;文献4:kimsj,kimhi,parksj,etal.behaviorinelectricfieldsofsmarthydrogelswithpotentialapplicationasbio-inspiredactuators[j].smartmaterials&structures,2005,14(4):511-514.;组织工程,文献:eslahin,abdorahimm,simchiaa.smartpolymerichydrogelsforcartilagetissueengineering:areviewonthechemistryandbiologicalfunctions[j].biomacromolecules,2016,17(11):3441-3463.、药物控释,文献6:constantinm,bucatarius-m,dorofteif,etal.smartcompositematerialsbasedonchitosanmicrospheresembeddedinthermosensitivehydrogelforcontrolleddeliveryofdrugs[j].carbohydratepolymers,2017,157(supplementc):493-502.;文献7:huj,cheny,liy,etal.athermo-degradablehydrogelwithlight-tunabledegradationanddrugrelease[j].biomaterials,2017,112:133-140.等领域。智能水凝胶是智能材料的一种,它能够感知并响应外界环境细微的刺激和变化,如:ph、温度、光、电、压力等,发生体积的溶胀或者收缩,文献:刘壮,谢锐,巨晓洁等.具有快速响应特性的环境响应型智能水凝胶的研究进展[j].化工学报,2016,67(1):202-208.。一些合成高分子结构可控,能够制备出性能很好的水凝胶,但是制备体系中可能会引入一些有毒的小分子单体、引发剂或者催化剂等,限制了其在医药领域的应用。天然高分子(如:壳聚糖、海藻酸钠、葡聚糖、明胶等)因其具有良好的生物相容性、生物降解性、无毒以及来源广泛等优势,受到了越来越多研究者的青睐,,文献:liy,sunx,yeq,etal.preparationandpropertiesofanovelhemicellulose-basedmagnetichydrogel[j].actaphysico-chimicasinica,2014,30(1):111-120.。
除了刺激响应以外,智能水凝胶的机械性能也是其应用的关键要素。天然高分子所制备的水凝胶材料机械性能较差,作为药物载体“突释”现象严重,因此国内外研究者一直致力于改善其机械性能的研究。有研究表明:互穿(ipn)或者半互穿网络结构(semi-ipn)各组分之间的协同作用使得凝胶网络的稳定性提高,较单一的凝胶网络结构有更好的机械性能。
近年来利用天然高分子如葡聚糖、海藻酸盐、淀粉以及壳聚糖等为原料制备凝胶微囊已成为国内外研究的热点。壳聚糖和海藻酸钠两种常用的天然高分子材料,其分子结构上的氨基和羧基均是ph敏感基团,常用于制备ph响应的智能水凝胶,而且两者均是聚电解质,可以通过静电作用结合,形成微胶囊。壳聚糖常用戊二醛进行交联,但是小分子戊二醛具有毒性,在使用前需彻底清除,文献:thakura,wanchoork,hardeep,etal.chitosanhydrogelbeads:acomparativestudywithglutaraldehyde,epichlorohydrinandgenipinascrosslinkers[j].journalofpolymermaterials,2014,31(2):211-223.。
技术实现要素:
要解决的技术问题
为了避免现有技术的不足之处,本发明提出一种多糖凝胶微囊及制备方法,该多糖凝胶微囊提高凝胶微囊的载药性和对药物的缓释能力,该的制备方法工艺简单,不需要特殊设备,工业化实施容易。
技术方案
一种多糖凝胶微囊,其特征在于每份计量组份为50~100mgn-羧乙基壳聚糖、25~50mg海藻酸钠和20~40mg球霰石碳酸钙微粒,0.5~2.0g氧化葡聚糖和0.5~2.0gcacl2作为交联剂。
一种制备权利要求1所述多糖凝胶微囊的方法,其特征在于步骤如下:
步骤1:将50~100mgn-羧乙基壳聚糖、25~50mg海藻酸钠和20~40mg球霰石碳酸钙微粒溶解于5ml的离子水中,超声5~20min后静置,得到稳定的悬浮液w1;
步骤2:0.5~2.0g氧化葡聚糖和0.5~2.0gcacl2作为交联剂,溶于5ml的去离子水中,形成水相w2;
步骤3:将tween80和span80按照1∶1~1∶4的体积比溶解于20ml正庚烷中制备得到油相o;将步骤1中制备的悬浮液加入到油相中,在30℃~50℃下以800~1200rpm/min的转速机械搅拌10~60min分散成w/o乳液;
步骤4:将步骤3中制备的w/o乳液逐滴加入到步骤2制备的水相w2中,继续反应10~30min;反应结束后,将产物离心分离,用乙醇洗涤3~5次,将凝胶微囊放入烘箱中干燥24~36h,得到干燥的多糖凝胶微囊。
有益效果
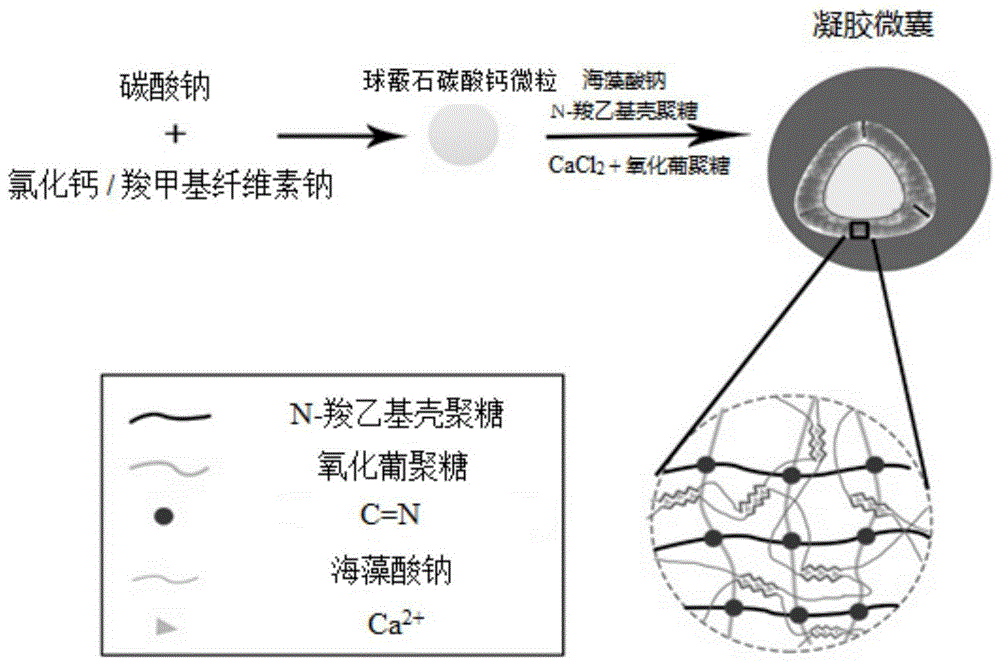
本发明提出的一种多糖凝胶微囊及制备方法,将球霰石碳酸钙粒子分散在n-羧乙基壳聚糖溶液中,壳聚糖分子上的氨基会通过静电作用包覆在球霰石碳酸钙粒子表面,加入海藻酸钠后,海藻酸钠分子上的羧基又会通过静电作用与壳聚糖剩余的氨基结合,并会与n-羧乙基壳聚糖分子中的羧乙基之间形成分子间氢键;加入氧化葡聚糖和cacl2作为交联剂,n-羧乙基壳聚糖上剩余的氨基会与氧化葡聚糖的醛基形成席夫碱键,海藻酸钠分子链上大量的羟基和羧基又会与ca2+通过“egg-box”原理发生聚集、凝胶化。多重交联可以形成致密的交联网络,稳固凝胶微囊的核壳结构。
本发明使用氧化葡聚糖作为交联剂,其分子链上同样含有双醛基结构,与戊二醛相似,而且在使用时可避免上述小分子的毒性问题。海藻酸钠分子中含有大量的羧基,可在极温和的条件下与ca2+、sr2+等二价阳离子经过离子交换快速形成凝胶,能够避免一些敏感性药物、酶、细胞等活性物质的失活,文献:高春梅,柳明珠,吕少瑜等.海藻酸钠水凝胶的制备及其在药物释放中的应用[j].化学进展,2013,25(6):1012-1022.。
本发明使用壳聚糖和海藻酸钠为原材料,以氧化葡聚糖和cacl2为交联剂,双重交联制备互穿网络结构的凝胶微囊。它具有原料可再生、产品可降解、易分离等优点,并可以通过高效利用生物炼制副产物而降低能源或者相关化学品的成本。这种凝胶微囊对环境的刺激,如温度、酸度等变化引起的微小刺激能产生不同程度的响应,故其在生物工程、药物载体、废水处理、化学存储器等方面具有很好的应用前景。
本发明涉及一种多糖凝胶微囊的制备方法,工艺简单,条件容易控制,成本低。制备的凝胶微囊具有很好的载药性能和药物缓释性能。
附图说明
图1为多糖凝胶微囊的制备机理示意图
图2为多糖凝胶微囊的扫描电镜图
图3为载药凝胶微囊的透射电镜图
图4为n-羧乙基壳聚糖的初始浓度对凝胶微囊载药率和包封率的影响
图5为海藻酸钠的初始浓度对凝胶微囊载药率和包封率的影响
图6为交联剂用量对凝胶微囊载药率和包封率的影响
图7为壳聚糖的初始浓度对凝胶微囊缓释性能的影响
图8为海藻酸钠的初始浓度对凝胶微囊缓释性能的影响
图9为交联剂的氧化度对凝胶微囊缓释性能的影响
具体实施方式
现结合实施例、附图对本发明作进一步描述:
实施例一:
(1)多糖凝胶微囊的制备
称取50mgn-羧乙基壳聚糖和25mg海藻酸钠溶解于5ml的离子水中,加入20mg载药球霰石碳酸钙微粒(浸入20ml150μg/ml的阿霉素溶液中,在37℃水浴的摇床上,以100rpm/min的速率震荡24h,然后以5000rpm/min的速度离心获得),40w超声5min后静置,得到稳定的悬浮液w1。称取0.5g氧化葡聚糖和0.5gcacl2作为交联剂,溶于5ml的去离子水中,形成水相w2。量取0.5gtween80和0.5gspan80溶解于20ml正庚烷中制备油相o,将悬浮液w1加入到油相o中,在30℃下以800rpm/min的转速机械搅拌10min分散成w/o乳液。将w/o乳液逐滴加入到水相w2中,继续反应10min。反应结束后,将产物离心分离,用乙醇洗涤3次,将凝胶微囊放入烘箱中干燥24h,得到干燥的凝胶微囊备用。
(2)凝胶微囊的载药性能以及对药物的缓释性能
被包埋沉积进凝胶微囊中的阿霉素的量通过紫外分析而定量,结果显示凝胶微囊对阿霉素的包埋率是80%。精密称取20mg载药凝胶微囊,装入透析袋中密封,置于ph=6.0的pbs缓冲溶液中,在温度为37℃、速率为100rpm/min的条件下恒温震荡处理,结果显示阿霉素释放速率先快后慢,可连续释放172h,最大释放量为26%。
实施例二:
(1)多糖凝胶微囊的制备
称取75mgn-羧乙基壳聚糖和35mg海藻酸钠溶解于5ml的离子水中,加入30mg载药球霰石碳酸钙微粒(浸入20ml100μg/ml的阿霉素溶液中,在37℃水浴的摇床上,以100rpm/min的速率震荡24h,然后以5000rpm/min的速度离心获得),40w超声10min后静置,得到稳定的悬浮液w1。称取1.0g氧化葡聚糖和1.0gcacl2作为交联剂,溶于5ml的去离子水中,形成水相w2。量取0.5gtween80和2.0gspan80溶解于20ml正庚烷中制备油相o,将悬浮液w1加入到油相o中,在40℃下以1000rpm/min的转速机械搅拌30min分散成w/o乳液。将w/o乳液逐滴加入到水相w2中,继续反应20min。反应结束后,将产物离心分离,用乙醇洗涤4次,将凝胶微囊放入烘箱中干燥30h,得到干燥的凝胶微囊备用。
(2)凝胶微囊的载药性能以及对药物的缓释性能
被包埋沉积进凝胶微囊中的阿霉素的量通过紫外分析而定量,结果显示凝胶微囊对阿霉素的包埋率是90%。精密称取20mg载药凝胶微囊,装入透析袋中密封,置于ph=6.0的pbs缓冲溶液中,在温度为37℃、速率为100rpm/min的条件下恒温震荡处理,结果显示阿霉素初始释放速率有所减慢,可连续释放172h,最大释放量为20%。
实施例三:
(1)多糖凝胶微囊的制备
称取100mgn-羧乙基壳聚糖、50mg海藻酸钠和40mg球霰石碳酸钙微粒分散/溶解于5ml的离子水中,超声20min后静置,得到稳定的悬浮液w1。称取2.0g氧化葡聚糖和2.0gcacl2作为交联剂,溶于5ml的去离子水中,形成水相w2。量取1.0gtween80和4.0gspan80溶解于20ml正庚烷中制备油相o,将悬浮液w1加入到油相o中,在50℃下以1200rpm/min的转速机械搅拌60min分散成w/o乳液。将w/o乳液逐滴加入到水相w2中,继续反应30min。反应结束后,将产物离心分离,用乙醇洗涤5次,将凝胶微囊放入烘箱中干燥36h,得到干燥的凝胶微囊备用。
(2)凝胶微囊的载药性能以及对药物的缓释性能
将制备的凝胶微囊浸入20ml50μg/ml的阿霉素溶液中,在37℃水浴的摇床上,以100rpm/min的速率震荡24h,然后以5000rpm/min的速度离心。被包埋沉积进凝胶微囊中的阿霉素的量通过紫外分析而定量,结果显示凝胶微囊对阿霉素的包埋率是96%。精密称取20mg载药凝胶微囊,装入透析袋中密封,置于ph=6.0的pbs缓冲溶液中,在温度为37℃、速率为100rpm/min的条件下恒温震荡处理,结果显示阿霉素的初始释放速率大大减慢,可连续释放172h,最大释放量为16%。
表1交联温度对微囊成球效果、粒径的影响
表2乳化剂用量对微囊成球效果、粒径的影响
表3搅拌速度对微囊成球效果、粒径的影响
表4乳化时间对微囊成球效果、粒径的影响
- 还没有人留言评论。精彩留言会获得点赞!