一种合成纳米K,Ca-CHA沸石的方法与流程
本发明属于沸石分子筛
技术领域:
,具体涉及一种纳米k,ca-cha沸石的制备方法。
背景技术:
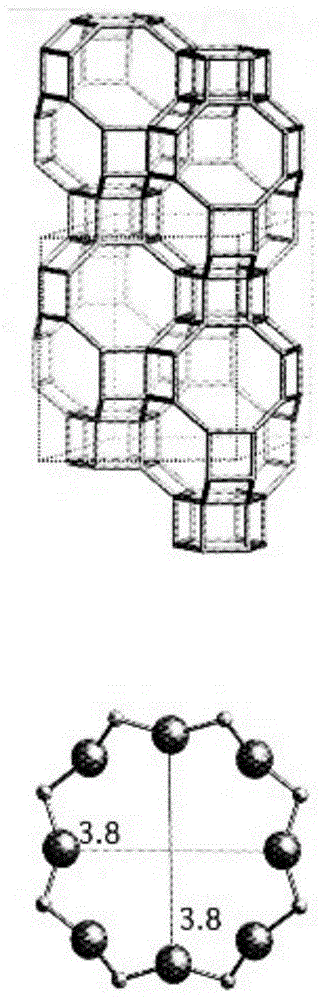
:cha沸石分子筛的骨架和孔道开口结构示意图见图1,是由[sio4]和[alo4]四面体共氧链接成四氧元环和六氧元环初级结构d6r笼和四氧元环八氧元环构建的cha笼,d6r笼与cha笼相互连接,进一步有序相联成开口孔径0.38×0.38nm的孔道结构。cha笼的空腔很大,达到0.84×0.84×0.82nm。cha结构类型沸石早先发现于天然矿物,俗称菱沸石(chabasite),一种sio2/al2o3摩尔比(sar)为4的ca型菱沸石(nature,181,1794-1796,1958)。因该天然物储量少、杂质多、sar太低、稳定性热不高,限制其应用,一般只适用于制吸附剂和阳离子交换剂。小孔口、大空腔的结构使低硅cha沸石分子筛吸附剂在气体吸附分离和净化方面具有很突出的应用前景。例如,该沸石吸附剂具有特别强的选择吸附co2的选择性,其对ch4和n2的分离选择性分别为co2/ch4=24-51和co2/n2=127-135。可以应用于从天然气和油田气去除co2和h2s,回收甲烷和乙烷。在液化空气制氧的工业设备上,用cha沸石分子筛吸附剂的变压吸附取代13x沸石吸附剂,可以高效低能耗分离除去空气中的水和二氧化碳分子。cha沸石分子筛吸附剂在焦化煤气中可以去除其中所含少量的co2、co、和ch4,制高纯h2。低硅cha沸石的另一重要应用是从空气中吸附去除小分子有毒、有害、恶臭气体。下表列举的几种典型的气体名称、化学式和分子尺寸。低硅cha沸石分子筛的骨架结构孔径是0.36×0.36nm,对所列的有毒、有害、恶臭气体的分子尺寸比较接近,可以通过改变吸附温度和压力,实现有效吸附。此外低硅cha沸石的硅铝摩尔比在4左右,与骨架平衡的阳离子比较多,可以通过用直径不同的金属阳离子交换制成不同阳离子型cha沸石分子筛吸附剂,精细调节其吸附孔径,以提高对特定分子的吸附选择性。表1典型小分子有毒、有害、恶臭气体的分子尺寸分子名称化学式分子尺寸/nm甲醛ch3cho0.33硫化氢h2s0.36甲氰ch3cn0.42氰化氢hcn0.33二氧化硫so20.36一氧化碳co0.37二氧化碳co20.37氨nh30.38由于天然矿物cha沸石资源有限,人们开始用人工合成解决该问题。中国专利cn102442679a公开了一种菱沸石的合成方法,以koh,白炭黑,层析硅胶,铝箔为原料制成高碱度的反应物(k2o/sio2=0.33-0.46),在加入5-25%的晶种条件下水热合成低硅cha沸石。有文献报道在含cs的无定形硅铝胶系统中加入cha沸石晶种成功地直接合成了sar8-10的cs-cha,在含b的硅铝胶系统中合成了sar12-14的sio2-al2o3-b2o3cha沸石(microporousandmesoporousmaterials196(2014)341–348)。汪彬在其硕士论文“粉煤灰制备沸石cha及其气体吸附性能的研究”(热能工程东北大学2014(学位年度))中提出,以工业固体废弃物粉煤灰为原料,采用碱熔融水热合成法制备菱沸石。用碱融粉煤灰的产物添加sio2硅源组成的反应物将合成的菱沸石的结晶度提高到71%。合成产物有较高的co2/n2的吸附分离选择性。国外期刊transactionsoftheindianinstituteofmetals58,5,p897-903,2005,10月,报道,粉煤灰合成的k-cha可用于去除水中的氨离子和磷酸根离子。sti(stilbite,辉沸石)沸石,是一种我国特有的天然sti(辉沸石)天然矿物,在我国内蒙、广西储藏的该矿品位高、储量大、开采成本低,在福建、湖南、江西等地也有发现,是一种有潜在应用前景的矿物资源。露天开采或者从矿洞中开采出来的该天然沸石晶体呈板状或束状集合体,与共生的花岗石、长石等性状差异很大,很容易通过简单的分选获得纯度很高的sti矿石。sti沸石晶体骨架具有开放的十元环孔道(0.49nm×0.62nm)和与其交叉的八元环孔道(0.27nm×0.56nm)。天然sti沸石硅铝摩尔比(sar)很低,而且范围较窄(sar=5-7),结构热稳定性差。典型的矿石晶胞化学组成为(ca,na2,k2)[al2si7o18]·7h2o。不同矿区产的sti沸石,可交换的阳离子ca2+、na+或k+的比例区别很大,有富钙型和富钾型等,我国发现的多为富钙型。天然sti沸石虽然晶体结构属于含规则孔道的分子筛,具有对分子形状和尺寸的吸附选择性和分子择形催化性质。但富钙sti沸石晶体结构经350℃焙烧2小时脱除其吸附和结晶水时,骨架完全被破坏而变成无定形的硅铝酸盐,失去了沸石分子筛应有的分子择形吸附性质和催化性质,故在催化和吸附等领域的应用受到极大限制,往往只能以一般无定形的硅铝酸盐原料用于生产水泥辅料或涂料、墙体的填充料等。个别情况下,也有利用其离子交换性制成去除重金属离子的净水剂,其分子筛的吸附和催化性能的价值难以体现。技术实现要素:鉴于此,本发明提出了一种合成纳米k,ca-cha沸石的方法。本发明提出了一种合成纳米k,ca-cha沸石的方法:以天然富钙sti辉沸石矿粉为第一原料,经高温焙烧后得无定形粉;无定形粉中加入cha晶种,在koh水溶液中通过水热反应合成纳米k,ca-cha沸石。进一步地,所述第一原料是细度1200-2000目的天然富钙sti辉沸石矿粉。进一步地,所述第一原料经400-500℃焙烧3-4h,破坏其原有的sti晶体结构后得到无定形粉。进一步地,加入的所述cha晶种与所述无定形粉重量之比是1-10:50-500。进一步地,所述koh水溶液的浓度为0.1-10mol/l,所述水热反应的固液比为1:5-15,转晶的温度为80-150℃,反应时间20-50h。进一步地,水热反应合成的所述纳米k,ca-cha沸石,其化学组成的二氧化硅与三氧化二铝的摩尔比sar是5-7,含有6-9%的cao,7-10%的k2o;与h-cha沸石标准样品相比,xrd粉末衍射线出现宽化现象;晶粒尺寸小于500nm。进一步地,合成的所述纳米k,ca-cha沸石,可制成纳米h,ca-cha沸石,制备所述纳米h,ca-cha沸石的过程为:以所述纳米k,ca-cha沸石为第二原料,第二原料经铵交换,阳离子k+和ca2+可以被nh4+交换,得第一前驱体,第一前驱体在一定的温度区间,经过一定时间焙烧处理脱去氨可制成纳米h,ca-cha沸石。进一步地,所述铵交换使用nh4cl水溶液,浓度为0.1-10mol/l,阳离子交换的温度为50-120℃,阳离子交换次数是1-5次。进一步地,前驱体1经过焙烧脱去氨的焙烧温度是400-500℃,焙烧时间是3-4小时。进一步地,合成的所述纳米h,ca-cha沸石,其化学组成的sar是5.8,含有5.12%的cao,1.40%的k2o;bet表面积187.3m2/g,微孔表面积29.8m2/g,介孔表面积157.6m2/g,微孔容积0.15ml/g,总孔容积0.596ml/g,显示出丰富的晶间孔,小的微孔的吸附特征。与现有技术相比,本发明的有益效果在于,本发明提出的纳米k,ca-cha沸石的合成方法是以天然富钙sti辉沸石矿粉为原料,此原料在我国储量丰富,价格低廉。此原料焙烧脱除其吸附和结晶水后,骨架完全被破坏而变成无定形粉,失去了沸石分子筛应有的分子择形吸附性质和催化性质,故在催化和吸附等领域的应用受到极大限制。本发明在此无定形粉中加入cha晶种,在koh水溶液中通过水热反应合成纳米k,ca-cha沸石;以纳米k,ca-cha沸石为第二原料,第二原料经铵交换后得第一前驱体,第一前驱体经过焙烧脱去氨可制成纳米h,ca-cha沸石。本发明合成的纳米沸石具有特殊的孔道结构,可应用于co2富集,废气中co、h2s、hcn、cos、nh3、nox等小分子有毒有害气体的吸附分离与去除。此外,本发明提出的合成方法,工艺简单、无环境污染、易于工业化。附图说明图1为本发明cha沸石分子筛的骨架和孔道开口结构示意图;图2为本发明实施例的xrd衍射谱,其中a为sti矿粉;b为焙烧sti矿粉;c为纳米k,ca-cha沸石;d为h-cha沸石标准样品;图3为本发明实施例的sem图;图4为本发明的k,ca-cha和h-ca-cha低温氮吸附等温线。具体实施方式以下结合附图,对本发明上述的和另外的技术特征和优点作更详细的说明。本发明实施例的纳米k,ca-cha沸石,其化学组成的二氧化硅与三氧化二铝的摩尔比sar是5-7,含有6-9%的cao,7-10%的k2o;纳米h,ca-cha沸石,其化学组成的sar是5.8,含有5.12%的cao,1.40%的k2o。具体而言,纳米k,ca-cha沸石与h-cha沸石标准样品相比,xrd粉末衍射线出现宽化现象,产生衍射的晶粒更细小。具体而言,纳米k,ca-cha沸石晶粒尺寸小于500nm,是几十纳米微小晶体的聚集晶。具体而言,纳米h,ca-cha沸石的bet表面积187.3m2/g,微孔表面积29.8m2/g,介孔表面积157.6m2/g,微孔容积0.15ml/g,总孔容积0.596ml/g,显示出丰富的晶间孔,小的微孔的吸附特征。具体而言,合成纳米k,ca-cha沸石的方法为:以天然富钙sti辉沸石矿粉为第一原料,经高温焙烧后得无定形粉;无定形粉中加入cha晶种,在koh水溶液中通过水热反应合成纳米k,ca-cha沸石。具体而言,第一原料是天然富钙sti辉沸石矿粉,产自我国广西,为1500-2000目、1-10μm长条形片状ca基cha矿粉。采用北京普析通用仪器公司的xd2型x射线粉末衍射仪测试,扫描范围5-35°/2θ,扫描速度4°/2θ/min;采用美国fei、公司novananosem450型场发射扫描电子显微镜、或荷兰phenom公司的phenomprox型台式扫描电子显微镜观测样品的晶体形貌以及晶粒尺寸,并拍摄照片;采用德国bruker公司的s8tigerx-光荧光散射仪器(xrf)测定样品的硅铝化学组成,sio2、al2o3、k2o、na2o、fe2o3、cao、mgo的百分含量并计算出其硅铝摩尔比(sar)。其xrd衍射谱见图2a,sem测试结果见图3上。具体而言,第一原料经400-500℃焙烧3-4h,原有的晶体结构崩塌,得到无定形粉,其xrd衍射谱见图2b,化学成分测试结果见表2。图中无定形粉的sti结构衍射峰消失,显示为背景的较平坦的无定形衍射区域,在20.9°/2θ和21.7°/2θ出现的二个明显且比较尖锐的衍射峰,是sti矿粉中所含约1-2%、对热高度稳定的杂晶石英的衍射。表2xrf测试的化学组成具体而言,加入的cha晶种与无定形粉重量之比是1-10:50-500。具体而言,koh水溶液的浓度为0.1-10mol/l,水热反应的固液比为1:5-15,室温下强烈搅拌2h,混合均匀倒入750ml耐压不锈钢反应釜中密封,置于均相反应烘箱中,在动态条件下反应,转晶的温度为80-150℃,反应时间20-50h,反应完成后取出、冷却、过滤、用去离子水洗涤至滤液ph=7-8后,再过滤、烘干,得到反应产物。具体而言,反应产物的化学组成见表2,反应产物和矿粉原料焙烧后的无定形粉的sar分别为5.53和5.54,mgo的含量分别为0.16%和0.19%,反应产物cao的含量产物为8.85%,高于原料的7.39%,尤其是k2o的含量,产物是7.48%,而原料是0.11%,很明显,在水热反应条件小反应物中的k+阳离子参与了cha沸石的结晶过程生成的k,ca-cha沸石;反应产物的xrd衍射谱(见图2c),与h-cha沸石标准样品(见图2d)相应位置的xrd粉末衍射线相比,都出现宽化现象,这是因为产生衍射的产物晶粒比较细小;反应产物sem图见图3下,场发射扫描电子显微镜拍摄的高分辨率照片(见图3)显示,k,ca-cha的晶粒尺寸小于500nm,是几十纳米微小晶体的聚集晶,说明本方法合成的产物为纳米k,ca-cha沸石。具体而言,合成的纳米k,ca-cha沸石可制成纳米h,ca-cha沸石,制备过程为:以纳米k,ca-cha沸石为第二原料,第二原料经铵交换,阳离子k+和ca2+可以被nh4+交换,得第一前驱体,第一前驱体在一定的温度区间,经过一定时间焙烧处理脱去氨可制成纳米h,ca-cha沸石。具体而言,铵交换使用nh4cl水溶液,浓度为0.1-10mol/l,将一定量的第二原料置于容量为250ml园底烧瓶中,倒入一定量的浓度为2.0mol/l的nh4cl溶液,在搅拌条件下加热至50-120℃持续2h,产物过滤,去离子水洗涤后的滤饼重复进行第二次离子交换,得第一前驱体纳米nh4-ca-cha沸石,经过滤、洗涤后、再过滤获得的滤饼120℃烘干后,在马福炉中于450℃焙烧3-4h,得h,ca-cha沸石。具体而言,对h,ca-cha沸石xrf测试的结果如表2所示,与纳米k,ca-cha相比,相应的数据为sar=6.42,cao=7.74%、mgo=0.0%、k2o=10.6%。经过二次nh4cl溶液的阳离子交换,纳米k,ca-cha沸石中的接近90%的k+被nh4+取代,而只有约34%的ca2+被nh4+取代。因ca2+是二价,k+是一价,进行阳离子交换时,需要二个nh4+取代纳米k,ca-cha沸石中的一个ca2+,也就是,实际上进入产物纳米k,ca-cha沸石结构与参与阳离子交换的nh4+近68%,这还是低于取代该产物纳米k,ca-cha沸石结构中k+。在阳离子交换过程中,nh4+取代纳米k,ca-cha沸石结构中k+和ca2+,必须通过溶液中阳离子的扩散,显然,带二个正电荷的ca2+极化能力要强于带一个正电荷的k+,因此,前者的水合离子团要大于后者,致使ca2+在水溶液中的扩散阻力大于k+,在同样交换条件下降低了ca2+被nh4+交换的效率。采用国产贝士德仪器公司的3h-2000ps2静态容量法比表面及孔径分析仪,对纳米k,ca-cha沸石和纳米h,ca-cha沸石进行低温氮吸附测试。低温氮吸附测定的线性等温线、对数吸附等温线和对数脱附等温线结果见图4。线性吸附等温线显示,二者在分压p/p0=0.1的微孔氮的吸附量都很低,纳米k,ca-cha沸石在40ml/g,而纳米h,ca-cha沸石提高到55ml/g左右。氮吸附量随分压p/p0提高而缓慢上升,在p/p0=0.8-1.0阶段,线性等温线迅速随分压而上升,在p/p0=1时,二者的氮吸附量达到360ml/g。而线性脱附等温线与线性吸附等温线在此分压区间并不重合,形成一个滞后环,这是由于二者样品中存在明显的介孔所致。从对数等温线的bjh法吸附和脱附微分积分孔体积孔径分布曲线上可以看出,纳米k,ca-cha样品在3-4nm范围都有一明显的峰,而在纳米h,ca-cha沸石样品的吸附微分积分孔体积孔径分布曲线上却未见明显的峰,但在脱附微分积分孔体积孔径分布曲线上在4nm显示明显的峰。说明,离子交换使纳米k,ca-cha沸石转变为纳米h,ca-cha沸石,不仅改变了沸石微孔性质,也改变了其聚合纳米晶聚晶粒晶间孔的性质。二者的低温氮吸附测定的主要数据见表3。表3低温氮吸附测定的主要数据表2数据显示纳米k,ca-cha沸石的微孔表面积、微孔容积都为0,这显然说明,该样品并不具有该结构类型沸石应该具有的微孔结构的基本性质。其原因在于,低温氮吸附所用的吸附质氮气的动力学直径是0.3nm,虽然可以进入孔口直径0.38nm的cha沸石的cha笼内被吸附,但sar6左右(即si和al原子比3)左右的k,ca-cha沸石属于低硅高铝沸石,与其骨架al所带负电荷平衡的阳离子k+、ca2+的含量比较高,而k+、ca2+的离子直径分别是0.27和0.21nm,k+、ca2+必然使结构cha笼口有效直径从0.38nm降低至接近0,使氮分子不能穿过cha笼口被吸进cha沸石的cha笼中,致使微孔表面积、微孔容积的数据都为0。经两次nh4cl溶液离子交换,纳米k,ca-cha沸石中的k+被交换生成的纳米nh4,ca-cha沸石再通过高温焙烧脱氨后生成的纳米h,ca-cha沸石,失去了k+的h,ca-cha沸石的cha笼口稍被开放,与k,ca-cha沸石相比,bet从134.6m2/g提高至187.3m2/g,微孔表面积从0上升至29.8m2/g,介孔表面积从134.4m2/g提高到157.6m2/g,微孔容积从0提高至0.15ml/g。但平均孔径却从17.7nm降低至12.7nm,其原因是h+取代k+后,使由纳米晶聚集的晶粒中晶间孔收缩所致。此外,k,ca-cha和h,ca-cha纳米聚晶的介孔表面积是微孔表面积的5倍以上,而微孔容积与总孔容积相比却几乎可以忽略不计,是本发明合成的cha纳米聚晶的孔结构特征。下面通过实施例对本实施例的合成纳米k,ca-cha沸石的方法进行说明。实施例一50g焙烧后的sti矿粉与2.5g的cha沸石晶种加入至450ml浓度为1.0mol/l的koh水溶液中,室温下强烈搅拌2h混合均匀后作为反应物,该反应物倒入750ml耐压不锈钢反应釜中、密封,置于130℃的均相反应烘箱中,在动态条件下反应48小时,取出、冷却、过滤、用去离子水洗涤至滤液ph=7-8后,再过滤、烘干。产物经xrd鉴定为cha结晶相(见图2c)。与h-cha沸石标准样品(sar=14,1-2微米单晶)的xrd粉末衍射谱(见图2d)相比,衍射峰的位置略为向大角度移动,这是实施例一合成的产物的sar较低,使晶胞比h-cha沸石标准样品的晶胞有些收缩所致。表3列出了反应原料焙烧sti矿粉和实施例1产物的xrf成分分析数据。反应产物和矿粉原料的sar分别为5.53和5.54,十分接近。二者mgo的含量分别为0.16%和0.19%,也相差无几。cao的含量产物为8.85%,高于原料的7.39%。特别明显的是k2o的含量,产物是7.48%,而原料是0.11%。很明显,在水热反应中的k+阳离子参与了cha沸石的结晶过程生成的k,ca-cha沸石。此外,合成产物与h-cha沸石标准样品相应位置的xrd粉末衍射线相比,都出现宽化现象,这可归因于产生衍射的产物晶粒比较细小。场发射扫描电子显微镜拍摄的高分辨率照片(见图3下)显示,k,ca-cha的晶粒尺寸小于500nm,是几十纳米微小晶体的聚集晶。此照片的结果与xrd粉末衍射图谱的结果一致,说明,实施例一合成产物为纳米k,ca-cha沸石。表4原料和产物化学组成实施例二50g焙烧后的sti矿粉与2.5g的cha沸石晶种加入至450ml浓度为1.0mol/l的koh水溶液中,室温下强烈搅拌2h,混合均匀后作为反应物,该反应物倒入750ml耐压不锈钢反应釜中、密封,置于150℃的均相反应烘箱中,在动态条件下反应48小时,取出、冷却、过滤、用去离子水洗涤至滤液ph=7-8后,再过滤、烘干。产物经xrd鉴定为cha结晶相。表3列出了反应原料焙烧sti矿粉和实施例二产物的xrf成分分析数据。反应产物和矿粉原料的sar分别为5.43和5.54,十分接近。二者mgo的含量原料为0.19%和产物0.0%,也相差无几。cao的含量产物为6.35%,低于原料的7.39%。特别明显的是k2o的含量,产物是8.31%,而原料是0.11%。很明显,在水热反应条件下反应物中的k+阳离子参与了cha沸石的结晶过程生成了k,ca-cha沸石。实施例三50g焙烧后的sti矿粉与2.5g的cha沸石晶种加入至450ml浓度为2.0mol/l的koh水溶液中,室温下强烈搅拌2h,混合均匀后作为反应物,该反应物倒入750ml耐压不锈钢反应釜中、密封,置于150℃的均相反应烘箱中,在动态条件下反应48小时,取出、冷却、过滤、用去离子水洗涤至滤液ph=7-8后,再过滤、烘干。产物经xrd鉴定为cha结晶相。表3列出了反应原料焙烧sti矿粉和实施例2产物的xrf成分分析数据。反应产物和矿粉原料的sar分别为6.42和5.43,高于后者。产物的mgo的含量分别为0.0%和0.19%,也相差无几。cao的含量产物为7.74%,略高于原料的7.39%。特别明显的是k2o的含量,反应产物和是10.6%、矿粉原料是0.11%。很明显,在水热反应条件下反应物中的k+阳离子参与了cha沸石的结晶过程生成了k,ca-cha沸石。对比实施例一和实施例二所用的koh浓度与水热反应温度,本实施例所用的koh溶液浓度从1.0mol/l提高到2.0mol/l,水热反应温度从130℃提高到150℃后,进入产物的k含量明显提高。提高反应物中koh溶液浓度和水热反应温度,有利于更多的k+进入产物的结构中。实施例四取实施例三的产物纳米k,ca-cha沸石25g置于容量为250ml圆底烧瓶中,倒入浓度2.0摩尔的nh4cl溶液120ml,在搅拌条件下加热至90-95℃持续2h,产物过滤,去离子水洗涤后的滤饼重复进行第二次离子交换。交换产物纳米nh4-ca-cha沸石经过滤、洗涤后、再过滤获得的滤饼120℃烘干后,在马福炉中于450℃焙烧3-4h,其产物用xrf测试的化学组成如下:sar=5.84,cao=5.12%、mgo=0.10%、k2o=1.40%,与实施例3的产物纳米k,ca-cha相比,相应的数据sar=6.42,ca=7.74%、mgo=0.0%、k2o=10.6%。此结果表明,二次nh4cl溶液的阳离子交换,实施例3的纳米k,ca-cha沸石中的大部分(接近90%)的k+离子被nh4+离子取代,而只有约34%的ca2+被nh4+取代。因ca2+是二价,k+是一价,进行阳离子交换时,需要二个nh4+取代纳米k,ca-cha沸石中的一个ca2+,也就是,实际上进入产物纳米k,ca-cha沸石结构与参与阳离子交换的nh4+离子近68%。这还是低于取代该产物纳米k,ca-cha沸石结构中k+离子。在阳离子交换过程中,nh4+离子取代纳米k,ca-cha沸石结构中k+和ca2+,必须通过溶液中阳离子的扩散,显然,带二个正电荷的ca2+极化能力要强于带一个正电荷的k+,因此,前者的水合离子团要大于后者,致使ca2+离子在水溶液中的扩散阻力大于k+,在同样交换条件下降低了ca2+被nh4+离子交换的效率。上述详细说明是针对本发明其中之一可行实施例的具体说明,该实施例并非用以限制本发明的专利范围,凡未脱离本发明所为的等效实施或变更,均应包含于本发明技术方案的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1