提取方法以及由该提取方法获得的组合物与流程
提取方法以及由该提取方法获得的组合物
1.相关申请的交叉引用
2.本专利申请要求于2018年12月11日提交的意大利专利申请第 102018000010978号的优先权,其全部公开内容通过引用并入本文。
技术领域
3.本发明涉及一种提取方法、组合物及其用途。
背景技术:
4.大麻(cannabis sativa l.,cs)是属于大麻科的雌雄异株一年生植物,自 古以来就以其从生产油和纤维到用于治疗目的的各种应用而闻名。事实上, cs目前在临床领域用于治疗各种病理如关节炎、多发性硬化症、癫痫、神经 性疼痛、睡眠障碍、hiv/aids患者食欲不振、化疗引起的恶心呕吐等。cs 用于治疗领域的主要是由于一类特殊化合物的药理作用,这类特殊化合物被称 为植物大麻素,具有萜酚分子结构。所述药理作用可归因于这些大麻素与存在 于哺乳动物、鸟类、鱼类和爬行动物中的特定受体(被称为内源性大麻素受体) 的结合,因为它们易于结合内源性大麻素如2
‑
酰基甘油和花生四烯酸乙醇胺。
5.植物大麻素中的每种都有不同的药理学特征。迄今为止,已鉴定出140多 种大麻素,其中最著名的是(
‑
)
‑
反式
‑
δ
‑9‑
四氢大麻酚(thc) ((6ar,10ar)
‑
6a,7,8,10a
‑
四氢
‑
6,6,9
‑
三甲基
‑3‑
戊基
‑
6h
‑
二苯并[b,d]吡喃
‑1‑
酚, cas号:1972
‑
08
‑
3),负责植物的精神活动;另一方面,大麻二酚(cbd) (2
‑
[(1r,6r)
‑3‑
甲基
‑6‑
(丙
‑1‑
烯
‑2‑
基)环己
‑2‑
烯基]
‑5‑
戊基苯并
‑
1,3
‑
二酚,cas号: 13956
‑
29
‑
1)不是精神药物,但具有镇痛、抗炎、抗惊厥和抗氧化特性。
[0006]
其他大麻素是delta
‑8‑
thc(δ
‑8‑
thc)((6ar,10ar)
‑
6a,7,10,10a
‑
四氢
‑
6,6,9
‑ꢀ
三甲基
‑3‑
戊基
‑
6h
‑
二苯并[b,d]吡喃
‑1‑
酚,cas号:5957
‑
75
‑
5);大麻酚(cbn) (6,6,9
‑
三甲基
‑3‑
戊基
‑
苯并[c]色烯
‑1‑
酚,cas号:521
‑
35
‑
7);大麻萜酚(cbg) (2
‑
[(2e)
‑
3,7
‑
二甲基辛
‑
2,6
‑
二烯基]
‑5‑
戊基
‑
苯
‑
1,3
‑
二酚,cas号:25654
‑
31
‑
3); 次大麻二酚(cbdv)(2
‑
((1s,6s)
‑3‑
甲基
‑6‑
(丙
‑1‑
烯
‑2‑
基)环己
‑2‑
烯基)
‑5‑
丙基 苯
‑
1,3
‑
二酚,cas号:24274
‑
48
‑
4);四氢次大麻二酚(thcv) ((6ar,10ar)
‑
6a,7,8,10a
‑
四氢
‑
6,6,9
‑
三甲基
‑3‑
丙基
‑
6h
‑
二苯并[b,d]吡喃
‑1‑
酚, cas号:28172
‑
17
‑
0);大麻色原烯(cbc)(2
‑
甲基
‑2‑
(4
‑
甲基
‑3‑
戊烯
‑1‑
基)
‑7‑ꢀ
戊基
‑
2h
‑1‑
苯并吡喃
‑5‑
酚,cas号:20675
‑
51
‑
8);次大麻酚(cbv)(6,6,9
‑ꢀ
三甲基
‑3‑
丙基
‑
6h
‑
二苯并[b,d]吡喃
‑1‑
酚,cas号:33745
‑
21
‑
0);次大麻萜酚 (cbgv)(2
‑
[(2e)
‑
3,7
‑
二甲基
‑
2,6
‑
辛二烯
‑1‑
基]
‑5‑
丙基
‑
1,3
‑
苯二酚,cas号: 55824
‑
11
‑
8)等。
[0007]
不过,这些大麻素不是由植物直接合成的;后者相反通过酶促产生酸官能 团结合在相对于羟基的α位的芳环上的相应酸形式,例如四氢大麻酚酸(thca) ((6ar,10ar)
‑1‑
羟基
‑
6,6,9
‑
三甲基
‑3‑
戊基
‑
6a,7,8,10a
‑
四氢
‑
6h
‑
苯并[c]色烯
‑2‑
羧 酸,cas号:547
‑
98
‑
8);大麻二酚酸(cbda)(2,4
‑
二羟基
‑3‑
[(1r,6r)
‑3‑
甲 基
‑6‑
(1
‑
甲基乙烯基)
‑2‑
环己烯
‑1‑
基]
‑6‑
戊基苯甲酸,cas号:1244
‑
58
‑
2);大 麻萜酚酸(cbga)(3
‑
[(2e)
‑
3,7
‑
二甲基
‑
2,6
‑
辛二烯
‑1‑
基]
‑
2,4
‑
二羟基
‑6‑
戊基苯 甲酸,cas号:25555
‑
57
‑
1);大麻色原烯酸(cbca)((+)
‑5‑
羟基
‑2‑
甲基
‑2‑
(4
‑ꢀ
甲基
‑3‑
戊烯
‑1‑
基)
‑7‑
戊基
‑
2h
‑1‑
苯并吡喃
‑6‑
羧酸,cas号:20408
‑
52
‑
0);次大 麻二酚酸(cbdva)(2,4
‑
二羟基
‑3‑
[(1r,6r)
‑3‑
甲基
‑6‑
(1
‑
甲基乙烯基)
‑2‑
环己 烯
‑1‑
基]
‑6‑
丙基苯甲酸,cas号:31932
‑
13
‑
5);四氢次大麻二酚酸(thcva) ((6ar,10ar)
‑
6a,7,8,10a
‑
四氢
‑1‑
羟基
‑
6,6,9
‑
三甲基
‑3‑
丙基
‑
6h
‑
二苯并[b,d]吡喃
ꢀ‑2‑
羧酸,cas号:39986
‑
26
‑
0);次大麻酚酸(cbva)(1
‑
羟基
‑
6,6,9
‑
三甲基
‑3‑ꢀ
丙基
‑
6h
‑
二苯并[b,d]吡喃
‑2‑
羧酸,cas号:64846
‑
02
‑
2);大麻酚酸(cbna) (1
‑
羟基
‑
6,6,9
‑
三甲基
‑3‑
戊基
‑
6h
‑
二苯并[b,d]吡喃
‑2‑
羧酸,cas号:2808
‑
39
‑
1); delta
‑8‑
thca(δ
‑8‑
thca)((6ar,10ar)
‑
6a,7,10,10a
‑
四氢
‑1‑
羟基
‑
6,6,9
‑
三甲基
ꢀ‑3‑
戊基
‑
6h
‑
二苯并[b,d]吡喃
‑2‑
羧酸,cas号:23978
‑
89
‑
4);次大麻萜酚酸 (cbgva)(3
‑
[(2e)
‑
3,7
‑
二甲基
‑
2,6
‑
辛二烯
‑1‑
基]
‑
2,4
‑
二羟基
‑6‑
丙基苯甲酸, cas号:64924
‑
07
‑
8)等。
[0008]
光和热(主要是热)触发脱羧反应,导致形成中性(非羧化)形式的相应 植物大麻素。
[0009]
根据花序中精神大麻素的百分比,cs用于治疗或娱乐目的(药物型具有 高thc含量)或用于生产种子和纤维(纤维型具有非常低的thc含量,例如 不产生精神作用)。种子大部分用于食品工业,例如,用于生产面粉和油。纤 维可用于各种目的,例如,用于生产纺织品、塑料、纸张和可燃材料,用于基 础设施等。大麻素由植物,尤其是在雌花上发现的称为毛状体(类似于毛发) 的特定结构中产生。然而,在植物的其他部分也可以发现少部分的大麻素。
[0010]
目前,制备cs的油性或乙醇花序提取物用于生产治疗多种疾病的药物。 使用油性或乙醇制剂是因为大麻素不溶于水。虽然基于大麻的汤药(tisane) 是一种非常常见的给药方法,但其大麻素提取能力非常差。还有许多基于单一 大麻素或其中两种大麻素的混合物(更常见的是thc和cbd)的药物。例如, 德国药典在其配方中包含50mg/ml的大麻二酚在中链甘油三酯油(mct油) 中的油性溶液,用作口服滴剂[dac/nrf 2015/2,cannabidiol
‑
50 mg/ml(nrf 22.10.)]。
[0011]
作为油性和乙醇提取物的特征的缺陷之一是大麻素(尤其对于酸形式)在 所述赋形剂中的不稳定性。正如citti等人最近观察到的[citti等人,药物和生 物医药分析杂志(journal of pharmaceutical and biomedical analysis),2016,128, 201
‑
209],如果将药品保持在4
‑
8℃的温度下,十天后可以获得更高的稳定性。 但是,不能长期保证制剂的稳定性。此外,由于口腔中的油感,患者不喜欢 cs提取物的油基口服溶液,特别是当将它们用于儿童时。另一方面,基于乙 醇的口服溶液可能因为乙醇而具有副作用。特别地,不建议在儿童中使用乙醇。
[0012]
此外,应该考虑到,由于吸收不良和显著的首过效应,用于口服给药的大 麻素制剂导致这些活性成分的生物利用度不良[m.a.huestis,人类大麻素药 代动力学(human cannabinoid pharmacokinetics),chem biodivers.2007,4(8), 1770
–
1804]。
[0013]
因此,需要允许长期保存和简单有效地施用cs活性成分的配方。除此之 外,还需要同样简单、可实施、安全且廉价的这些配方的制备方法。
[0014]
本发明的目的是提供一种提取方法、组合物及其用途,所述的提取方法、 组合物
及其用途至少部分地克服了已知技术的缺点,同时易于生产且成本低廉。
技术实现要素:
[0015]
根据本发明,提取方法、组合物及其用途在以下独立权利要求中提供,优 选地,在直接或间接从属于独立权利要求的任一项权利要求中提供。
具体实施方式
[0016]
根据本发明的第一方面,提供了一种提取方法,包括提取步骤,在该提取 步骤期间,使植物基质与水性液体(即含有水)接触,使得从植物基质中提取 至少一种大麻素并将该至少一种大麻素携带到水性液体组分中(从而获得组合 物)。相对于水性液体的总重量,水性液体包含至少40重量%的水和至少一种 络合组分,所述络合组分包含(尤其是)至少一种环糊精(cd)。
[0017]
特别地,相对于水性液体的总重量,(所获得的)该组合物包含至少40 重量%的水、络合组分和大麻素。
[0018]
根据本发明的方法能够以非常简单快捷的方式高效地提取一种或多种大 麻素。获得的结果(也参见以下的实施例,这些实施例表明该方法能够执行基 本上完全的提取)是令人惊讶的并且无法被预测。
[0019]
根据进行的实验,假设由于与cd的腔内的分子或部分亲脂性分子(大麻 素)形成非共价键,环糊精可以与大麻素形成主客体型包合络合物。令人惊讶 的是,包合络合物的形成导致客体分子(大麻素)的溶解度和它们对光、氧的 稳定性和对化学试剂的反应性的变化。
[0020]
在一些非限制性情况下,提取的大麻素是单一大麻素(例如cbda或 thca)。可替代地(并且优选地),提取的大麻素是大麻素的混合物。
[0021]
特别地,大麻素是一种或多种(具有萜酚分子结构的)植物大麻素。
[0022]
根据一些非限制性实施方式,在提取步骤期间,从植物基质中提取的大麻 素选自由以下组成的组:cbd、thc、δ
‑8‑
thc、cbn、cbda、thca、cbg、 cbga、cbc、cbca、cbdv、thcv、cbv、cbgv、cbdva、thcva、δ
‑8‑
thca、 cbna、cbva、cbgva(及其组合
–
即其混合物)。
[0023]
换言之,在提取步骤期间,从植物基质中提取至少一种大麻素并将该至少 一种大麻素携带到水性液体中,所述至少一种大麻素选自由以下组成的组: cbd、thc、δ
‑8‑
thc、cbn、cbda、thca、cbg、cbga、cbc、cbca、 cbdv、thcv、cbv、cbgv、cbgva、cbdva、thcva、δ
‑8‑
thca、cbna、 cbva、cbgva(及其组合
–
即其混合物)。
[0024]
特别地,在提取步骤期间,从植物基质中提取至少一种大麻素并将该至少 一种大麻素携带到水性液体中,所述至少一种大麻素选自由以下组成的组: cbd、thc、cbda、thca、cbg、cbga、cbc、cbca、cbdv、thcv、 cbdva、thcva(及其组合
–
即其混合物)。
[0025]
有利但非必须地,在提取步骤期间,从植物基质中提取至少以下大麻素并 将该至少以下大麻素携带到水性液体中:cbd、thc、cbda、thca、cbg、 cbc、cbca、cbdv、thcv、cbdva、thcva。
[0026]
特别地,在提取步骤期间,从植物基质中提取至少以下大麻素并将该至少 以下大麻素携带到水性液体中:cbd、thc、cbn、cbda、thca、cbg、 cbga、cbc、cbca、cbdv、thcv、
cbgva、cbdva、thcva、cbna、 cbva。
[0027]
更特别地,在提取步骤期间,从植物基质中提取至少以下大麻素并将该至 少以下大麻素携带到水性液体中:cbd、thc、cbn、cbda、thca、cbg、 cbga、cbc、cbca、cbdv、thcv、cbv、cbgv、cbgva、cbdva、 thcva、cbna、cbva。
[0028]
甚至更特别地,在提取步骤期间,从植物基质中提取至少以下大麻素并将 该至少以下大麻素携带到水性液体中:cbd、thc、δ
‑8‑
thc、cbn、cbda、 thca、cbg、cbga、cbc、cbca、cbdv、thcv、cbv、cbgv、cbdva、 thcva、δ
‑8‑
thca、cbna、cbva。
[0029]
根据一些非限制性实施方式,在提取步骤期间,从植物基质中提取至少以 下大麻素并将该至少以下大麻素携带到水性液体中:cbd、thc、cbda和 thca。
[0030]
另一方面,可以单独或以混合物提取其他已知的大麻素[l.o.hanus,s.m. meyer,e.munoz,o.taglialatela
‑
scafati,g.appendino,植物大麻素:同一标准 的关键清单,天然产物报告,2016,33(12),1357
‑
1392]。
[0031]
根据具体实施方式,在提取步骤期间,提取在[l.o.hanus,s.m.meyer,e. munoz,o.taglialatela
‑
scafati,g.appendino,植物大麻素:同一标准的关键清 单,天然产物报告,2016,33(12),1357
‑
1392]中引用的至少(或至少部分)大麻 素。
[0032]
通过这种方式,可以获得含有多种大麻素的组合物,因此能够保证它们协 同作用的益处。
[0033]
更准确地说,在提取步骤期间,提取了所含的所有(相关有机)物质。这 样,更能保证不同组分的协同效应。
[0034]
特别地,在提取步骤期间被提取并被携带至水性液体的大麻素包含酸(羧 化)大麻素,更特别地是酸(羧化)大麻素。
[0035]
换言之,在提取步骤期间,提取至少一种酸(羧化)大麻素并将该至少一 种酸(羧化)大麻素携带至水性液体。
[0036]
需要指出的是,这一点绝不是预料之中的。在这方面,应当记住,酸大麻 素不如它们的非酸性同系物稳定,并且通常使用已知的提取方法它们会降解。
[0037]
在一些非限制性情况下,提取的酸大麻素是单一大麻素。或者(并且优选 地),提取的酸大麻素是酸大麻素的混合物。
[0038]
根据一些非限制性实施方式,在提取步骤期间,提取在[l.o.hanus,s.m. meyer,e.munoz,o.taglialatela
‑
scafati,g.appendino,植物大麻素:同一标准 的关键清单,天然产物报告,2016,33(12),1357
‑
1392]中鉴定的至少一种酸(羧 化)大麻素。
[0039]
根据特定的非限制性实施方式,酸大麻素选自由以下组成的组:cbda、 thca、cbgva、cbga、cbca、cbdva、thcva、δ
‑8‑
thca、cbna、 cbva(及其组合
–
即其混合物)。换言之,在提取步骤期间,从植物基质中提 取(至少)一种大麻素并将该(至少)一种大麻素携带到水性液体中,该(至 少)一种大麻素选自由以下组成的组:cbda、thca、cbgva、cbga、cbca、 cbdva、thcva、δ
‑8‑
thca、cbna、cbva(及其组合
–
即其混合物)。
[0040]
特别地,在提取步骤期间,从植物基质中提取(至少)一种大麻素并将该 (至少)一种大麻素携带到水性液体中,该(至少)一种大麻素选自由以下组 成的组:cbda、thca、cbgva、cbga、cbca、cbdva、thcva、cbna、 cbva(及其组合
–
即其混合物)。
[0041]
更特别地,在提取步骤期间,从植物基质中提取(至少)一种大麻素并将 该(至少)
(cyclodextrins in drug delivery),expert opin.drug deliv.,2005,2(2),335
‑
351]。
[0057]
表1
[0058]
环糊精25℃下纯水中溶解度(mg/ml)α
‑
环糊精145β
‑
环糊精(βcd)18.52
‑
羟丙基
‑
β
‑
环糊精>600无规甲基化β
‑
环糊精>500β
‑
cd磺丁基醚的钠盐>500γ
‑
环糊精2322
‑
羟丙基
‑
γ
‑
环糊精>500
[0059]
根据特定的非限制性实施方式,络合组分包含(特别地,是)选自β
‑
环糊 精及其衍生物(特别地,烷基化的衍生物)的环糊精。更准确地说,络合组分 包括(特别地,是)hp
‑
β
‑
环糊精和/或β
‑
环糊精。甚至更准确地,络合组分包 括(特别地,是)hp
‑
β
‑
环糊精。
[0060]
已经通过实验观察到β
‑
环糊精比α
‑
环糊精毒性更小,并且具有比γ
‑
环糊 精更大的络合能力。
[0061]
有利但非必须地,相对于水性液体的总重量,所述水性液体包含至少50 重量%(特别地,至少70重量%)的水。
[0062]
根据一些非限制性实施方式,相对于水性液体的总重量,所述水性液体包 含至少80重量%(特别地,至少95重量%;更特别地,至少99重量%)的水。 特别地,相对于水性液体的总重量,所述水性液体包含至多99.9重量%的水。
[0063]
特别地,水性液体由水和络合组分组成。
[0064]
有利但非必须地(特别是,如果环糊精是hp
‑
β
‑
环糊精),对于每ml液体, 水性液体包含至多600mg(特别地,至多500mg;更特别地,至多250mg;甚 至更特别地,至多50mg;甚至更特别地,至多25mg)的络合组分。
[0065]
更准确地说,水性液体包含至多其(环糊精的)饱和浓度的环糊精。
[0066]
可替代地或另外地,对于每ml水性液体,水性液体包含至少0.1mg(特 别地,至少0.5mg;更特别地,至少1mg)的络合组分。
[0067]
有利但非必须地,提取步骤在低于40℃,特别是高于10℃(更特别是高 于5℃)进行。
[0068]
通过这种方式,一些大麻素(例如,酸大麻素)降解较少。
[0069]
根据一些非限制性实施方式,提取步骤在高于40℃(特别是高于60℃), 特别是低于115℃(特别是低于110℃)进行。
[0070]
通过这种方式,可以提高提取速度。
[0071]
有利但非必须地,植物基质包含(特别是)大麻的至少一部分。特别地, 植物基质包含(更准确地,是)大麻的至少花序(的部分)和/或叶子(的部 分)。特别地,植物基质包含(更准确地,是)大麻的至少花序(的部分)。
[0072]
根据本发明的第二方面,提供了一种组合物(特别是通过上述方法获得的 组合物),相对于组合物总重量,该组合物包含至少40重量%的水、络合组分 和至少酸(羧化)大麻素。络合组分至少包含(特别地,是)环糊精。需要注 意的是,在该组合物中,酸大麻素已
被证明是特别稳定的。
[0073]
在一些非限制性情况下,酸大麻素是单一酸大麻素。可替代地(以及优选 地),酸大麻素是酸大麻素的混合物。
[0074]
特别地,大麻素是一种或多种(具有萜酚分子结构的)植物大麻素。
[0075]
在一些非限制性情况下,环糊精是单一环糊精。可替代地,环糊精是环糊 精的混合物。
[0076]
换言之,在某些情况下,络合组分是单一环糊精。可替代地,络合组分是 环糊精的混合物。
[0077]
根据一些非限制性实施方式,络合组分选自由以下组成的组:α
‑
环糊精、 β
‑
环糊精、γ
‑
环糊精(其衍生物)及其组合。
[0078]
特别地,络合组分包括选自β
‑
环糊精及其衍生物的化合物;例如,络合组 分包括hp
‑
β
‑
环糊精。
[0079]
有利但非必须地,(特别是如果络合组分
–
特别环糊精
–
是hp
‑
β
‑
环糊精), 则对于每ml液体,所述液体包含至多600mg(特别地,至多500mg;更特别 地,至多250mg;甚至更特别地,至多50mg;甚至更特别地,至多25mg)的 络合组分。
[0080]
可替代地或另外地,对于每ml该组合物,该组合物包含至少0.1mg(特 别地,至少0.5mg;更特别地,至少1mg)的络合组分。
[0081]
有利但非必须地,相对于该组合物的总重量,该组合物包含至少50重量% (特别地,至少70重量%)的水。
[0082]
根据一些非限制性实施方式,相对于该组合物的总重量,该组合物包含至 少80重量%(特别地,至少95重量%;更特别地,至少99重量%)的水。特 别地,相对于该组合物的总重量,所述水性液体包含至多99.9重量%的水。
[0083]
特别地,水性液体由水和络合组分组成。
[0084]
有利但非必须地,相对于该组合物的总重量,该组合物包含至少约0.05 重量%(特别地,至少约0.1重量%;更特别地,至少约0.5重量%;甚至更特 别地,至少约1重量%)的酸大麻素。在一些非限制性情况下,相对于该组合 物的总重量,该组合物包含至多约15重量%(特别地,至多10重量%;更特 别地,至多5重量%)的酸大麻素。
[0085]
有利但非必须地,所述络合组分如上文所指出的那样定义(相对于本发明 的第一方面)。
[0086]
有利地但非必须地,酸大麻素包括以下中的至少一种(选自由以下组成的 组):cbda、thca、cbgva、cbga、cbca、cbdva、thcva、δ
‑8‑
thca、cbna、cbva(及其组合
–
即其混合物)。
[0087]
特别地,酸大麻素包括以下中的至少一种(选自由以下组成的组):cbda、 thca、cbgva、cbga、cbca、cbdva、thcva、cbna、cbva(及其 组合
–
即其混合物)。根据一些非限制性实施方式,酸大麻素包括以下中的至少 一种(选自由以下组成的组):cbda、thca、cbga、cbca、cbdva、thcva 及其组合(及其组合
–
即其混合物)。
[0088]
特别地,酸大麻素选自l.o.hanus,s.m.meyer,e.munoz,o. taglialatela
‑
scafati,g.appendino,植物大麻素:同一标准的关键清单,天然产 物报告,2016,33(12),1357
‑
1392中鉴定的酸大麻素。
[0089]
特别地,酸大麻素包括以下中的至少一种(选自由以下组成的组):cbda、 thca、cbga(及其组合)。更特别地,酸大麻素包括以下中的至少一种(选 自由以下组成的组):cbda、thca(及其组合)。
[0090]
根据特定的非限制性实施方式,酸大麻素包括(是)cbda。
[0091]
需要注意的是,酸大麻素(例如,cbda
–
基本上是离子型的)特别难以 到达大脑,因此难以具有精神作用。
[0092]
在任何情况下,例如,实验表明cbda具有不可忽视的药理特性(特别 是镇痛和/或抗炎)。
[0093]
有利但非必须地,该组合物(酸大麻素)包含(是)cbda、thca、cbga、 cbca、cbdva和thcva。
[0094]
特别地,该组合物(酸大麻素)包含(是)cbda、thca、cbga、cbca、 cbdva、cbna和thcva。
[0095]
更特别地,该组合物(酸大麻素)包含(是)cbda、thca、cbgva、 cbga、cbca、cbdva、thcva、cbna、cbva。
[0096]
在一些非限制性情况下,该组合物进一步包含cbd、thc、cbg、cbc、 cbdv和thcv。
[0097]
特别地,该组合物进一步包含cbd、thc、cbg、cbc、cbdv、thcv、 cbv、cbgv。
[0098]
根据一些非限制性实施方式,所述组合物包含(酸大麻素是)l.o.hanus, s.m.meyer,e.munoz,o.taglialatela
‑
scafati,g.appendino,植物大麻素:同一 标准的关键清单,天然产物报告,2016,33(12),1357
‑
1392中鉴定的酸大麻素的 混合物。
[0099]
根据一些非限制性实施方式,所述组合物包含(酸大麻素是)l.o.hanus, s.m.meyer,e.munoz,o.taglialatela
‑
scafati,g.appendino,植物大麻素:同一 标准的关键清单,天然产物报告,2016,33(12),1357
‑
1392中鉴定的酸大麻素的 混合物。
[0100]
根据一些非限制性实施方式,该组合物由至少一种酸大麻素、非酸大麻素 或酸和非酸大麻素的混合物的水溶液组成。所述溶液可以由先前描述的提取溶 液(原样或稀释或浓缩)组成,所述提取溶液中可添加各种添加剂(染色剂、 甜味剂、调味剂等)。该溶液也可以通过将如上所述地提取所得到的干燥残留 物溶解在水中来获得。在这种情况下,可以在溶解干燥残留物之前、之后或同 时将添加剂溶解在水中。
[0101]
有利但非必须地,该组合物中存在的环糊精与该组合物中存在的大麻素总 和之间的摩尔比为0.5至2。
[0102]
根据一些非限制性实施方式,该组合物中存在的环糊精与该组合物中存在 的给定大麻素总和之间的摩尔比为0.5至2;所述的给定大麻素是:cbd(大 麻二酚)、thc(四氢大麻酚)、cbda(大麻二酚酸)、thca(四氢大麻酚酸)、 cbg(大麻萜酚)、cbga(大麻萜酚酸)、cbc(大麻色原烯)、cbca(大麻 色原烯酸)、cbdv(次大麻二酚)、thcv(四氢次大麻二酚)、cbdva(次 大麻二酚酸)、thcva(四氢次大麻二酚酸)、cbdb(丁基大麻二酚 (cannabidibutol))和cbdba(丁基大麻二酚酸(cannabidibutolic acid))。应 注意,并非所有引用的大麻素都必须存在于该组合物中。存在这些大麻素中的 一种或多种就足够了;它是组合物中存在的以上列表中的大麻素的摩尔数总和, 该摩尔数总和在这些情况下被考虑用于确定提到的摩尔比。
[0103]
根据本发明的第三方面,提供了根据本发明第二方面的组合物用于美容治 疗(特
别是人体的美容治疗)的用途。
[0104]
根据一些实施方式,该用途提供组合物的局部施加(更准确地说,在皮肤上的局部施加)。
[0105]
更准确地,该组合物的用途是用于人体的至少一部分的美容治疗。该用途包括施加步骤,在该施加步骤期间将组合物施加到所述部分。
[0106]
另外或可替代地,根据本发明的第四方面,提供了根据本发明的第二方面的组合物作为缓和剂,特别是作为人体(或人体的至少一部分)的缓和剂的用途。
[0107]
根据本发明的第五方面,提供了用作药品(用作药物;用于药理学用途)的根据本发明的第二方面的组合物。特别地,提供所引用的组合物用于治疗炎症。
[0108]
根据一些非限制性实施方式,提供所引用的组合物用于选自由以下组成的组的用途:镇痛剂、抗炎剂、抗惊厥剂、抗氧化剂及其组合。特别地,提供所引用的组合物用于选自由以下组成的组的用途:镇痛剂、抗炎剂及其组合。
[0109]
在一些非限制性情况下,该用途提供组合物的局部施加(在皮肤上)和/或口服给药。例如,在这些情况下,根据一些变型,该组合物呈水性液体形式(溶液、糖浆、滴剂等)或固体形式(片剂、丸剂、胶囊等)。
[0110]
根据一些非限制性实施方式,提供了根据本发明第二方面的组合物用于治疗以下中的至少一种:关节炎、多发性硬化症、癫痫、神经性疼痛、睡眠障碍、(hiv/aids患者)食欲不振、(化疗引起的)恶心和呕吐及其组合。
[0111]
根据本发明的另一方面,提供了根据本发明的第二方面的组合物作为食品(和/或营养品和/或食品补充剂)的用途。
[0112]
除非另有明确说明,本文中引用的参考文献(文章、书籍、专利申请等)的内容在此全文引用。特别地,所提及的参考文献通过引用并入本文。
[0113]
本发明的进一步特征将从以下一些仅说明性和非限制性实施例的描述中变得清楚。
[0114]
实施例1
[0115]
在室温下用hp
‑
β
‑
cd从纤维型cs的花序中提取cbda和cbd
[0116]
在不同浓度的hp
‑
β
‑
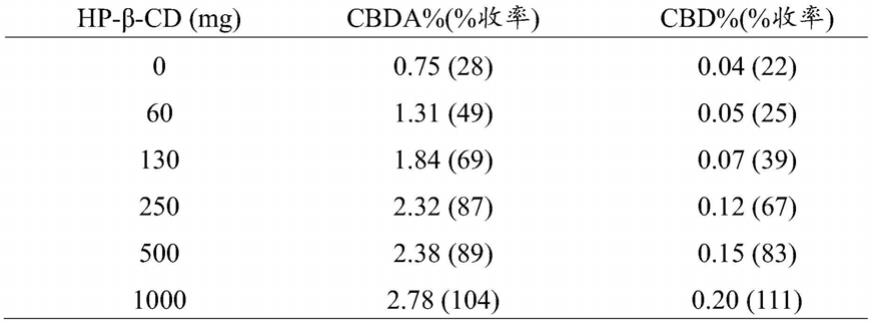
cd存在下,在环境温度下将500mg花序部分(cbda和cbd含量分别为2.66%和0.18%重量/重量)与50ml水单独地孵育2小时。具体实施例报告了使用0、60、130、250、500和1000mgcd进行的实验。提取在烧杯中进行。表2显示了所检测的两种大麻素(特别是cbda和cbd)的重量/重量百分比滴定量,参考根据cannabisflos德国药典(germanpharmacopoeia)提取后计算的实际滴定量。
[0117]
cannabisflos德国药典(https://www.monographcannabisflos.pdf)中报道的官方方法包括三个对500mg花序用20、12.5和12.5ml的96%乙醇进行提取和过滤的循环。在容量瓶中用洁净的96%乙醇将乙醇液相定容至50ml。在孔径为0.45μm的再生纤维素过滤器上过滤所述提取物。用9ml96%乙醇稀释1ml部分用于色谱分析。对于每种大麻素,构建了校准曲线以在提取物中和在具有花序的包合络合物水性配方中对大麻素进行量化。用浓度范围为0.25
‑
1.00μg/ml的认证标准品(cerilliant大麻素参比标准品,cerilliantcorporation,texas,usa)构建校准曲线。使用高效液相色谱和紫外检测器(hplc
‑
uv),按照citti等人发表的方法[citti等人,药物和生物医药分析杂志2016,128,201
‑
209]进行
滴定。
[0118]
在本实施例中,使用了称为“eletta campana”的纤维型cs品种。对于所述 品种,cbda的实际滴定量为2.66%(重量/重量),cbd的实际滴定量为0.18% (重量/重量)。提取收率百分比显示在表2中的括号内。从表中可以看出,收 率是使用在50ml水中的1000mg hp
‑
β
‑
cd与500mg cs花序的总数(也高于 按照德国药典进行提取得到的收率)。当然,并非预料之中的是,所使用的水 溶液能够提取(而且不仅溶解)大麻素。
[0119]
表2
[0120][0121]
此外还观察到,从提取中获得的部分随后被干燥(通过蒸发水),从而获 得水溶性粉末。
[0122]
实施例2
[0123]
在100℃下用hp
‑
β
‑
cd从纤维型cs的花序中提取cbda和cbd
[0124]
在不存在和存在250mg hp
‑
β
‑
cd的情况下,将两份250mg的elettacampana品种花序(cbda和cbd含量分别为2.66%和0.18%重量/重量)与 25ml水单独地孵育2小时。在磁力搅拌和气泡冷凝器存在下,在浸入硅油中 的烧瓶中进行提取。温度设定为100℃。表3显示了所检测的两种大麻素(特 别是cbda和cbd)的重量/重量百分比滴定量,参考根据cannabis flos德国 药典(german pharmacopoeia of cannabis flos)提取后计算的实际滴定量。如 上面给出的实施例1那样,cbda的实际滴定量为2.66%(w/w),cbd的实 际滴定量为0.18%(w/w)。提取收率百分比显示在表3中的括号内。可以看出, 随着时间的推移,cbd的百分比收率超过100%。这是由于通过温度所引发的 脱羧作用而将cbda转化为cbd的过程。此外,一旦形成,包合络合物就使 酸大麻素稳定,从而即便施加高温,也限制了酸大麻素转化(通过脱羧作用) 转化为相应的中性衍生物。
[0125]
表3
[0126][0127]
实施例3
[0128]
在25℃和8℃下eletta campana纤维型cs和hp
‑
β
‑
cd花序包合络合物中cbda和cbd的稳定性
[0129]
在两个单独的烧杯中在环境温度下磁力搅拌1小时的条件下,在存在 500mg hp
‑
β
‑
cd的情况下,将两份(每份500mg)cs花序(cbda和cbd 含量分别为2.66%和0.18%w/w)置于50ml水中。过滤后,将两种溶液转移 到琥珀色密闭容器中。将一个容器在环境温度(25℃)下避光保存,另一个在 8℃冰箱中保存。在cbda和cbd的特定实例中,在不同时间测量大麻素的 浓度以验证其稳定性,通过hplc
‑
uv分析一份。表4显示了从0到100天的 保存时间中不同时间的大麻素浓度。相对于时间0的cbda浓度差异百分比 显示在括号中。可以看出,在环境温度下,cbda会随着时间的推移而损失(尽 管非常缓慢
–
尤其是与目前使用的方法相比时),而如果将配方保持在8℃, cbda和cbd在100天内均保持惊人的稳定。
[0130]
根据对从cs的花序中获得的浸液进行的研究(已知技术)(因此,在没 有cd的情况下),在25℃水中cbd的浓度在7天内下降了60%,而如果所 述汤药保持在4℃,则在同一时间段内下降50%。至于cbda,其在25℃和4℃ 的水中的稳定性不能保证超过14天[r.pacifici等人,临床化学与检验医学 (clinical chemistry and laboratory medicine),2017,55(10),1555
‑
1563]。
[0131]
表4
[0132][0133]
可以注意到(尤其是在25℃下保存所获得的结果),在某些情况下,cbd 浓度会随着时间的推移而增加。这取决于至少部分cbda通过脱羧作用降解 为cbd的事实。
[0134]
*****
[0135]
从上文给出的描述和实施例,本发明的优势是显而易见的。事实上,已经 观察到
所获得的组合物显示出令人惊讶且显著高于迄今为止文献中报道的水 性和油性配方所显示的稳定性。文献中报道的基于cs花序的油性和水性配方 保证了大麻素,特别是酸大麻素的稳定性,仅在非常短期内,即几天的时间 [citti等人,药物和生物医药分析杂志2016,128,201
‑
209;r.pacifici等人,临 床化学与检验医学,2017,55(10),1555
‑
1563]。此外,在环境温度下仅搅拌1或 2小时后,根据本发明的提取收率在水中是最大的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1