烯烃氢甲酰化反应的Co基多相催化剂及制备和应用
烯烃氢甲酰化反应的co基多相催化剂及制备和应用
技术领域
1.本发明涉及一种高碳烯烃氢甲酰化反应的co基多相催化剂制备方法及其应用,属于多相催化技术领域。
背景技术:
2.氢甲酰化反应是烯烃与合成气生成比原料烯烃多一个碳的醛的反应,它是最重要的工业均相催化反应之一。氢甲酰化反应是典型的原子经济性反应,其催化过程和催化剂的研究已有近60年的历史。目前,全世界每年大约超过1200万吨的醛和醇是使用烯烃氢甲酰化技术生产的。此反应能够在不太苛刻的条件下,使原料烯烃生成醛,产物醛可以进一步加氢转化成醇。均相催化体系在温和的反应条件下具有较高的催化活性和目的产物的选择性,但催化剂同反应物料的分离问题困难,阻碍了均相催化体系的大规模工业化应用。多相催化与均相催化相比最大的优点是催化剂与反应物料容易分离,存在的主要问题是反应条件苛刻,反应活性相对较低等。目前氢甲酰化主要研究的热点集中在开发一种新型的多相化催化剂,使其既具有多相催化的催化剂与反应物料易分离的优点,又具有均相催化的高反应活性及温和的反应条件。
3.rh是典型的贵金属,资源稀缺而且价格昂贵严重影响氢甲酰化反应的经济性,如果可以采用非贵金属替代贵金属rh用于多相氢甲酰化反应,具有重要的实际意义。目前,氢甲酰化反应的催化剂真正用于工业规模生产的只有rh和co。金属rh和co的外层电子结构都具有d电子轨道,当其与含有孤对电子的配体作用时,成为配合物的中心原子或离子,产生空的价电子轨道,对烯烃的氢甲酰化反应有催化作用。rh是氢甲酰化反应中最活泼的元素,co的活性相对较低,但其仍具有较大的工业价值。由于贵金属rh的资源稀缺以及价格昂贵严重影响了上述过程的经济性,因此,考虑采用金属co代替金属rh作为催化剂的活性组分,应用于高碳烯烃多相氢甲酰化反应。
4.cn102281948a报道了一种聚合物负载的过渡金属催化剂络合物及使用方法,制备了具有较窄分子量分布的能溶的聚合物负载的rh催化剂。但是,催化剂制备、催化反应和催化剂分离过程都复杂。催化剂制备需要先控制官能单体和苯乙烯等合成可溶性的聚合物,再引入配体,最后负载rh催化剂。催化反应过程中需要添加压缩气体。催化剂采用纳滤的方式从反应混合物中分离,反应结果也不理想。
5.balue等(j.mol.catal.a,chem,1999,137:193-203)利用阳离子交换树脂作为载体,通过固载铑硫化合物形成多相催化剂,苯乙烯氢甲酰化的循环实验表明,该多相催化剂稳定性差,rh流失的现象较为严重。zeelie等(appl.catal.a:gen,2005,285:96-109)将苯乙烯和对苯乙烯二苯基膦修饰于聚乙烯纤维上,再将rh(acac)(co)2锚定在被修饰的聚乙烯纤维上,乙烯氢甲酰化的结果表明,该催化剂在100℃,5bar条件下,转化率较高但稳定性不好,反应50h后,反应活性急剧下降,催化剂失活现象较为严重。
6.ricken等(j.mol.catal.a:chem,2006,257:78-88)将配体nixantphos进行不同的官能团化修饰,修饰好的配体和rh(acac)(co)2共负载于聚甘油聚合物上,1-辛烯氢甲酰化
的实验表明,该催化剂在80℃,20bar条件下,转化率可以达到90%左右。然而,商业购买或通过常规的苯乙烯自由基聚合制备的聚合物载体由于凝胶形成、聚合物溶胀、聚合物骨架中磷配体的担载量有限以及催化活性组分流失等问题严重限制了这类催化剂的工业应用。
7.n.sudheesh等(journal of molecular catalysis a:chemical,2008,296:61-70)将hrh(co)(pph3)3催化剂原位的封装在hms介孔分子筛中并应用于长链烯烃的氢甲酰化反应。作者以1-己烯在浆态床中的反应作为研究重点,讨论了温度、一氧化碳分压、氢气分压和催化剂用量等对反应活性的影响,催化剂循环利用实验表明该催化剂具有较好的可重复利用性。随后,n.sudheesh等(applied catalysis a:general,2012,415-416:124-131)将hrh(co)(pph3)3原位的封装在hms介孔分子筛中的催化体系应用于丙烯的氢甲酰化反应,hms介孔分子筛作为一个纳米级反应器,在循环利用实验中表现出较高的稳定性,但同均相催化体系相比,反应活性上仍存在着较大的差距。
8.ki-chang song等(catalysis today,2011,164:561-565)用两种方法对sba-15进行了后修饰,一种方法是先用二苯基二乙氧基硅烷对sba-15的外表面进行钝化处理,然后再用n-(2-氨基乙基)-3-氨基丙基甲基二甲氧基硅烷对sba-15的内表面进行修饰,通过rh4(co)
12
同修饰于内表面的氨基进行反应,达到rh4(co)
12
固载于sba-15的目的。另一种方法是直接用n-(2-氨基乙基)-3-氨基丙基甲基二甲氧基硅烷对sba-15的表面进行修饰,通过rh4(co)
12
同修饰于分子筛内外表面的氨基进行反应,达到rh4(co)
12
固载于sba-15的目的。研究表明,第二种处理方法形成的固载化催化剂在氢甲酰化反应中表现出更优异的活性和稳定性,作者解释催化剂活性较好的原因在于内外表面同时修饰,可以使rh4(co)
12
更均匀的分布于分子筛的内外表面,从而使均相催化剂具有较大的自由空间。作者研究表明,多相催化剂n/i值较高的原因在于配体的空间位阻效应,有利于直链醛的生成。
9.us4252678公开了一种含有rh等过渡金属的胶态分散体的制备,其中过渡金属组分以1.0到20.0纳米的胶态分散体与采用羟基封端的(苯乙烯/丁二烯)功能化共聚物组成的催化剂体系,并应用于1-辛烯的氢甲酰化反应。该方法制备的催化剂无法应用于固定床和滴流床反应器,且催化剂与产物的难于分离。
10.综上所述,上述研究均相多相化的总体思想都是令有机官能团同均相催化剂相互作用,从而使均相催化剂固载于多相载体上,这些方法目前出现的最大问题就是均相催化剂的流失问题,以及均相催化剂固载于载体上表现出的活性下降问题,这两个问题是制约氢甲酰化均相固载化的最大瓶颈。另一方面,目前研究较多的主要是rh基氢甲酰化体系,由于rh是典型的贵金属,其资源稀缺且价格昂贵,严重影响了氢甲酰化反应过程的经济性。因此,开发co基多相氢甲酰化反应体系具有重要的实际应用意义。
技术实现要素:
11.为了解决上述问题,本发明的目的在于提供一种用于高碳烯烃氢甲酰化反应的co基多相催化剂,通过采用本发明催化剂,可以降低了催化剂同反应物和产物的分离成本,适应于大规模工业化生产;同时选用非贵金属co作为催化剂金属活性组分,有效提高了氢甲酰化反应过程的经济性。
12.为此,本发明提供一种用于高碳烯烃氢甲酰化反应的co基多相催化剂,其特征在于,所述co基多相催化剂由金属组分和有机膦配体聚合物组成。所述金属组分是金属co,所
述有机膦配体聚合物是含有乙烯基的有机膦配体经溶剂热聚合生成具有大比表面积和多级孔道结构的聚合物。
13.在一个优选实施方案中,所述金属组分co在所述固体多相催化剂总重量中占0.5%-50.0%(优选1%-20.0%)。
14.在一个优选实施方案中,所述金属组分co前驱物来源于co(no3)2、cocl2、co(oac)2、co(acac)2和co(acac)3中的一种或几种。
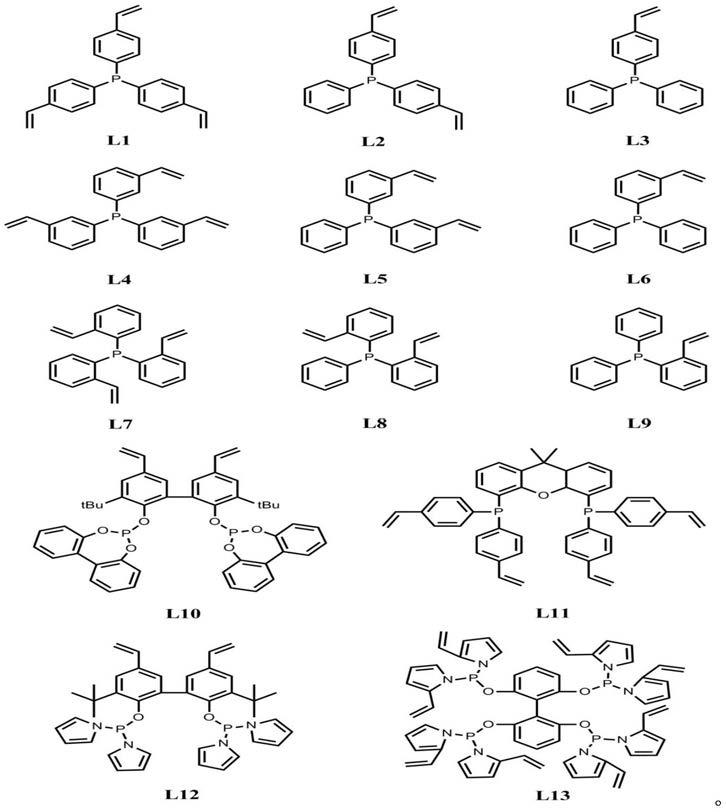
15.在一个优选实施方案中,所述有机膦配体聚合物是含有乙烯基的有机膦配体经溶剂热聚合生成的聚合物,其中所述含有乙烯基的有机膦配体选自以下各项中的一种或多种:
[0016][0017]
在一个优选实施方案中,所述膦配体选自以上两种或多种,具体选取膦配体l1、l5和l12,三者相应质量比为1:0.2:0.1。
[0018]
在一个优选实施方案中,所述有机配体聚合物的比表面积为100-3000m2/g,孔容为0.1-5.0cm3/g,孔径分布在0.1-200.0nm。
[0019]
在一个优选实施方案中,所述co基多相催化剂的制备方法包括:a)在273-473k(优选293-423k)和ar气体保护氛围下,在含有乙烯基官能团化的膦配体溶剂中,加入自由基引发剂,搅拌0.5-50h(优选1-20h);b)在273-473k(优选323-423k)和ar气体保护氛围下,将步骤a)的溶液在水热高压釜中静置0.5-100h(优选5-50h),进行溶剂热聚合反应;c)将步骤b)
结束后真空条件抽除溶剂,即得到所述有机膦配体聚合物;d)将所述有机膦配体聚合物置于含有金属活性组分co的溶剂中,在273-473k(优选293-423k)和ar气体保护氛围下搅拌0.5-100h(优选5-50h),随后真空条件抽除溶剂,即得到由有机膦配体聚合物负载金属活性组分的co基多相氢甲酰化催化剂。
[0020]
在一个优选实施方案中,上述催化剂制备方法步骤a)和d)中使用的溶剂是苯、甲苯、四氢呋喃、甲醇、乙醇、二氯甲烷、二氯乙烷或去离子水中的一种或几种;步骤a)中使用的自由基引发剂是过氧化环己酮、过氧化二苯甲酰、叔丁基过氧化氢、偶氮二异丁腈或偶氮二异庚腈的一种或几种;所述自由基引发剂与有机膦配体单体的重量比为1:500-1:5(优选1:400-1:10)。
[0021]
在一个优选实施方案中,上述co基多相催化剂在高碳烯烃氢甲酰化反应中的应用,在所述co基多相催化剂存在下使高碳烯烃(碳数≥4烯烃)与co/h2混合气在滴流床、浆态床或釜式反应器中进行所述氢甲酰化反应,其中反应温度为293-573k(优选323-523k),反应压力为0.1-20.0mpa(优选0.5-15.0mpa),液时空速为0.01-10.0h-1
(优选0.05-8.0h-1
),气体空速为100-20000h-1
(优选500-10000h-1
)。
[0022]
本发明产生的有益效果包括但不限于以下:与现有工业应用的氢甲酰化反应技术相比,由于采用新型co基多相催化剂,降低了催化剂同反应物和产物的分离成本,适应于大规模工业化生产;同时选用非贵金属co作为催化剂金属活性组分,有效提高了氢甲酰化反应过程的经济性。本发明催化剂在高碳烯烃氢甲酰化反应中,反应活性和产物醛选择性优异,反应稳定性良好。
具体实施方式
[0023]
为了更好的说明co基多相催化剂的制备方法及其在高碳烯烃氢甲酰化反应中的应用,下面举出一些催化剂样品的制备及其在反应工艺中应用的实施例,但本发明不限于所列举的实施例。除非另有具体说明,本技术中的含量和百分比均按“质量”计算。
[0024]
实施例1
[0025]
在298k和ar气体保护氛围下,将7.69g三(4-乙烯基苯)基膦、1.54g二(3-乙烯基苯)苯基膦和0.77g含有乙烯基的吡咯环双齿膦配体溶于100ml四氢呋喃溶剂中,向上述溶液中加入0.25g自由基引发剂偶氮二异丁腈,搅拌0.5h。将搅拌好的溶液移至水热高压釜中,于373k和ar气体保护氛围下溶剂热法聚合24h。待上述聚合后冷却至室温,338k条件真空抽除溶剂,即得到有机膦配体聚合物(其比表面积为950m2/g,孔容为1.26cm3/g,孔径分布在0.2-80.0nm)。在298k和ar气体保护氛围下,称取1.68g醋酸钴溶于100ml乙醇溶剂中,加入5.0g上述制备的有机膦配体聚合物,搅拌24h。随后,338k条件真空抽除溶剂,即获得由膦配体聚合物负载金属组分的co基多相催化剂。
[0026]
将上述制备的co基多相催化剂装入高压反应釜,再装入1-己烯原料和甲苯溶剂,在423k,3.0mpa,反应时间24h条件下进行氢甲酰化反应。反应产物采用离心分离的方法收集获得,分离后产物在agilent 7890a气相色谱仪上使用配有hp-5毛细柱的氢火焰检测器(fid)分析,以正丙醇为内标物,采用内标法计算。反应结果列于表1。
[0027]
实施例2
[0028]
在实施例2中,除了称取5.0g三(4-乙烯基苯)基膦和5.0g三(3-乙烯基苯)基膦替
代7.69g三(4-乙烯基苯)基膦、1.54g二(3-乙烯基苯)苯基膦和0.77g含有乙烯基的吡咯环双齿膦配体溶于100ml四氢呋喃溶剂中,其他过程与实施例1相同。反应结果列于表1。
[0029]
实施例3
[0030]
在实施例3中,除了称取10.0g三(4-乙烯基苯)基膦替代7.69g三(4-乙烯基苯)基膦、1.54g二(3-乙烯基苯)苯基膦和0.77g含有乙烯基的吡咯环双齿膦配体溶于100ml四氢呋喃溶剂中,其他过程与实施例1相同。反应结果列于表1。
[0031]
实施例4
[0032]
在实施例4中,除了加入0.05g自由基引发剂偶氮二异丁腈替代0.25g自由基引发剂偶氮二异丁腈,其他过程与实施例1相同。反应结果列于表1。
[0033]
实施例5
[0034]
在实施例5中,除了采用333k溶剂热法聚合替代373k溶剂热法聚合,其他过程与实施例1相同。反应结果列于表1。
[0035]
实施例6
[0036]
在实施例6中,除了称取0.336g醋酸钴替代1.68g醋酸钴溶于100ml乙醇溶剂,其他过程与实施例1相同。反应结果列于表1。
[0037]
实施例7
[0038]
在实施例7中,除了称取3.35g乙酰丙酮钴替代1.68g醋酸钴溶于100ml乙醇溶剂,其他过程与实施例1相同。反应结果列于表1。
[0039]
实施例8
[0040]
在实施例8中,除了称取2.78g硝酸钴水合物替代1.68g醋酸钴溶于100ml乙醇溶剂,其他过程与实施例1相同。反应结果列于表1。
[0041]
实施例9
[0042]
在实施例9中,除了氢甲酰化评价反应温度373k替代氢甲酰化评价反应温度423k,其他过程与实施例1相同。反应结果列于表1。
[0043]
实施例10
[0044]
在实施例10中,除了氢甲酰化评价反应压力1mpa替代氢甲酰化评价反应压力3mpa,其他过程与实施例1相同。反应结果列于表1。
[0045]
实施例11
[0046]
在实施例11中,除了氢甲酰化评价反应时间16h替代氢甲酰化评价反应时间24h,其他过程与实施例1相同。反应结果列于表1。
[0047]
实施例12
[0048]
在实施例12中,除了氢甲酰化评价反应原料1-辛烯替代氢甲酰化评价反应原料1-己烯,其他过程与实施例1相同。反应结果列于表1。
[0049]
实施例13
[0050]
在实施例13中,除了氢甲酰化评价反应原料1-十二烯替代氢甲酰化评价反应原料1-己烯,其他过程与实施例1相同。反应结果列于表1。
[0051]
对比例1
[0052]
在对比例1中,除了采用tio2载体替代有机膦配体聚合物,用于催化剂制备及其后续多相氢甲酰化反应评价,其他过程与实施例1相同。反应结果列于表1。
[0053]
对比例2
[0054]
在对比例2中,除了采用al2o3载体替代有机膦配体聚合物,用于催化剂制备及其后续多相氢甲酰化反应评价,其他过程与实施例1相同。反应结果列于表1。
[0055]
对比例3
[0056]
在对比例3中,除了采用sio2载体替代有机膦配体聚合物,用于催化剂制备及其后续多相氢甲酰化反应评价,其他过程与实施例1相同。反应结果列于表1。
[0057]
表1.co基多相催化剂高碳烯烃氢甲酰化反应结果
[0058][0059]
[0060]
由上述实施例1-3反应数据可以看出,当选取膦配体l1、l5和l12,三者相应质量比为1:0.2:0.1时,co基多相催化剂高碳烯烃氢甲酰化反应表现出最优的烯烃转化率及目标产物醛选择性。实施例1和实施例6反应数据对比可以看出,适宜的活性金属钴利于提高高碳烯烃氢甲酰化反应的烯烃转化率。实施例1、实施例9、实施例10反应数据对比可以看出,适宜的反应温度和压力有利于提高高碳烯烃氢甲酰化反应的烯烃转化率和目标产物醛选择性。根据实施例1-13以及对比例1-3反应数据结果可知,本发明提供的co基多相催化剂用于高碳烯烃氢甲酰化反应,对于高碳烯烃氢甲酰化反应而设计研发的新型co基多相催化剂,反应活性和选择性优异,反应稳定性良好;由于采用该新型co基多相催化剂,降低了催化剂同反应物和产物的分离成本,适用于大规模工业化生产;同时选用非贵金属co作为催化剂金属活性组分,有效提高了氢甲酰化反应过程的经济性。
[0061]
以上已对本发明进行了详细描述,但本发明并不局限于本文所描述具体实施方式。本领域技术人员理解,在不背离本发明范围的情况下,可以作出其他更改和变形。本发明的范围由所附权利要求限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1