定量研究生物被膜的微流控芯片及其制作方法与流程
[0001]
本发明涉及一种微流控芯片及其制作方法,具体涉及一种定量研究生物被膜的微流控芯片及其制作方法。
背景技术:
[0002]
生物被膜(biofilm)是微生物在长期进化过程中形成的一种高度组织且自我保护的生存状态,自然界中95%以上的细菌都以生物被膜形式存在。生物被膜可以附于接触的物体表面,分泌胞外聚合物extracellular matrix(ecm)(多糖、蛋白质和核苷酸等物质),并将自身包被于其中的大量细菌群聚膜样物。
[0003]
生物被膜的这种特殊结构及生理特性导致其对各种环境压力具有较强适应性和抗胁迫能力。例如,生物被膜态的菌体更能抵御生长环境中的营养匮乏、ph值变化、氧自由基、消毒剂、抗生素以及噬菌体的吞噬作用;可逃避吞噬细胞作用,与宿主免疫系统共生。同时,正因为生物被膜的这种对压力环境的高度抗胁迫性,导致其在食品领域的控制和消除是食品生产企业面临的难题,其在医学领域的逃避宿主免疫和高度耐药性(可达到浮游状态的100-1000倍)和难杀灭性,使得生物被膜相关感染(80%的感染性疾病与生物被膜有关)的临床治疗变得非常棘手。所以这就要求研究者,首先需要了解生物被膜的结构、组成、代谢等空间异质性,这是生物被膜研究的起源和基础;其次,在食品领域,需要了解生物被膜在食品加工环境下的生长特性与抗胁迫机制,这是指导食品污染控制的根本;第三,在医学领域,需要了解生物被膜的耐药机制、生物被膜的抗免疫机制等内容,这是指导临床治疗的关键。最后,最关键在于要建立研究生物被膜的高效定量技术手段。
[0004]
传统琼脂平板培养细菌及生物被膜的方法具有操作简便、成本低廉、技术门槛低等优势,几乎适合所有实验室和检测部门操作,但是其固体营养环境与自然界以及真实生理环境下的流体环境相差大,此外还难以实现精确地生物被膜生长动态追踪和定量计算。微流控技术是把生物、化学、医学分析过程的样品制备、反应、分离、检测、分析等基本操作单元集成到一块微米尺度的芯片上,在生物、化学、医学等领域具有巨大潜力。flow cell微流控技术是研究生物被膜的经典方法,细菌或细胞被冲进充满液体培养基的腔室中,粘附于固液交界面而形成生物被膜。研究者可以持续性地注入新的培养基来维持生物被膜的生长环境,还可以动态地加入并调节抗生素等各种扰动操作,以观察生物被膜的反应。这在一定程度上模拟了自然及生理条件下的生物被膜,并被作为研究生物被膜的标准方法。然而,flow cell微流控腔室中形成的生物被膜为三维生物被膜,生物被膜形貌复杂,用于成像的共聚焦显微技术采样缓慢且激光的光毒性较强,难以对生物被膜的动态行为进行长时间、高频率的观测,就难以实现生物被膜生长动态的高精度定量观测和计算。flow cell微流控腔室中细菌的定植大多靠随机粘附,这就对接种的细菌种类有较大限制。粘附力差、游动性强的细菌不容易粘附,导致难以形成生物被膜;而粘附力强及游动性差的细菌则可能粘附过多,导致腔室易脏、生物被膜密度大、生物被膜间相互干扰大。此外,当前传统微流控芯片的接种菌时菌液经过生长腔室,极易引起菌在预设接种位点之外的位置粘附,这样易造成
接种点之外的位置随机长成生物被膜,不仅对观察窗口内的生物被膜造成影响,而且易引起腔室和管道堵塞。
[0005]
当前微流控生物芯片大多采用pdms聚合物制作,pdms具有良好的生物兼容性、透明、易操作等优势,但是pdms也具有良好的透气性和气体溶解率,空气中的氧气可以通过pdms直接扩散进入腔室。如果生物被膜生长腔室高度较低,即生物被膜上表面直接紧贴pdms,则氧气直接从空气渗入生物被膜核心,并且这部分从空气中来源的氧气比重甚至高于培养基提供的,导致生物被膜在整个生长过程以及整个空间结构上不会产生氧气梯度。而氧是影响生物被膜生长及代谢的重要影响因素,多篇研究报道自然流体环境以及真实生理环境下的生物被膜,其外部由流体提供氧气,而生物被膜内部缺氧,导致其内外存在氧气梯度,并由此产生代谢以及对环境响应的空间异质性。因此传统pdms制作的低腔室高度的微流控芯片无法模拟真实生理环境下生物被膜内部的缺氧环境,进而难以真实模拟生理环境下生物被膜代谢状态的空间异质性及潜在的对各种环境压力的耐受性。
技术实现要素:
[0006]
本发明的目的是针对传统flow cell微流控生物被膜培养方法形成的生物被膜形貌复杂,用于成像的共聚焦显微技术采样缓慢且激光的光毒性较强,难以对生物被膜的动态行为进行长时间、高频率的观测及定量计算,且flow cell对接种的细菌种类有较大限制、通用性差且传统pdms薄层芯片难以实现生物被膜天然氧气梯度等问题,提供了一种定量研究细菌生物被膜动态行为的通用型微流控芯片。
[0007]
本发明所提供的定量研究生物被膜群体行为的微流控芯片,其微通道主体由pdms浇筑而成,并等离子体键合于玻璃基片上;
[0008]
所述微流控芯片的主腔室的一端设有入液口,另一端为出液口;
[0009]
垂直于流体流动的方向,所述主腔室的一侧或两侧连接一个或多个进菌管道,所述进菌管道与所述主腔室的连通处为接种位点,所述接种位点处所述pdms与所述玻璃基片为可逆键合;
[0010]
所述pdms的外表面涂封有环氧树脂层,并键合玻璃盖片作为观察窗口。
[0011]
上述的微流控芯片中,所述主腔室的高度为1~30μm,可形成规则的准二维生物被膜,采用普通光学显微镜替代共聚焦显微镜,即可实现长时间、高频率连续采样,实现对生物被膜生长动态高精度定量计算的目标。
[0012]
上述的微流控芯片中,所述玻璃盖片的厚度为0.17~1mm,所述玻璃盖片作为成像窗口,避免氧气从pdms上表面渗入生物被膜内。
[0013]
上述的微流控芯片中,所述主腔室的pdms薄层厚度为1
±
0.3mm。
[0014]
上述的微流控芯片中,所述环氧树脂层的厚度可为2~4mm;
[0015]
所述环氧树脂优选为树脂20;
[0016]
所述环氧树脂层可以避免氧气从任何可能外漏的pdms渗入腔室,这样保证了生物被膜生长腔室内的氧气唯一来源为培养基,而生物被膜外围菌快速生长消耗了氧气,导致内部菌缺氧,这样就实现了生物被膜内天然氧梯度。
[0017]
上述的微流控芯片中,优选所述主腔室的两侧分别连接两个所述进菌管道;
[0018]
即所述接种位点可以只在同一侧,也可以在所述主腔室两侧,并且每侧位点个数
可以是1~4个,根据实验需求灵活贴条。这样按照预定空间排布,提供多个接种位点,为研究多个生物被膜间的互作提供灵活设计;
[0019]
所述进菌管道的入口呈y型。
[0020]
本发明微流控芯片中,所述进菌管道与所述主腔室隔开(两者连接处pdms与玻璃基片为可逆的物理键合),上菌时大部分细菌被截留在预设接种位点,形成生物被膜的原始生发中心,而少数进入主腔室内的细菌则被来流培养基快速带入出液口,细菌在主腔室内几乎无停留,使其不易在主腔室内粘附,保证了主腔室内的干净和流体在整个实验流程中的通畅,同时也保证了只在预设接种位点形成生物被膜和其他随机生物被膜对目标生物被膜的干扰。
[0021]
本发明进一步提供了所述微流控芯片的制作方法,包括如下步骤:
[0022]
s1、采用pdms浇筑所述微通道主体;
[0023]
s2、在所述微通道主体上预留插流体管道位置打孔;清理所述pdms表面杂质后,将胶条贴附于预设的所述接种位点处;
[0024]
s3、在等离子体清洁器中处理所述微通道主体和所述玻璃基片;处理结束后,揭去所述pdms表面的所述胶条,然后将所述微通道主体与所述玻璃基片进行封装,在所述接种位点处,所述pdms与所述玻璃基片形成可逆键合;
[0025]
s4、将所述玻璃盖片等离子体键合于所述pdms的表面成像区域;然后将环氧树脂涂封所述pdms外表面,固化,即得到所述微流控芯片。
[0026]
步骤s1中,按照下述步骤制备所述微通道主体:将所述pdms与凝固剂混合均匀并脱气后浇筑于芯片模具上,于80~130℃烘烤30min~3h;
[0027]
所述pdms优选道康宁184胶,所述道康宁184胶与所述凝固剂的体积比7~12:1;
[0028]
所述芯片模具由光刻胶与硅晶片或载玻片组成,甩胶条件为1000~5000rpm/3s-1
min,胶层厚度为1~30μm,而后通过无掩模软单层光刻工艺制作芯片模具。
[0029]
步骤s2中,所述胶条为0.2~1mm宽的3m无尘胶带的胶条。
[0030]
通过在等离子体处理封装芯片过程中,通过贴胶条选择性的阻挡pdms表面,使其与玻璃的键合是可逆键合并在较小流体压力下可被抬起,成为接种位点。这种接种位点的数量与位置取决于贴胶条的数量与位置,其操作灵活度很大,可以创造单个或多个接种位点,满足单生物被膜研究以及多生物被膜的互作研究等的需求,再次扩展了该芯片的灵活性和通用性。
[0031]
本发明微流控芯片能够用于定量研究细菌生物被膜动态行为。
[0032]
通过将普通光学显微镜替代共聚焦显微镜,即可实现长时间、高频率连续采样的目标,且不对生物被膜活性样品有任何损伤。
[0033]
在所述接种位点依靠流体压力抬起pdms薄层,将菌剂挤进并压在所述pdms薄层下,形成生物被膜的生发中心进而形成生物被膜;
[0034]
本发明依靠压力的方式接种菌或细胞,而非依赖细菌自身的粘附,扩展了接种菌的范围和种类,因此所述微流控芯片适用于研究下述任一种生物被膜动态行为:
[0035]
1)革兰氏阴性菌、革兰氏阳性菌或分枝杆菌;
[0036]
2)球状细菌或杆状细菌;
[0037]
3)有鞭毛的细菌或无鞭毛的细菌;
[0038]
4)真菌;
[0039]
5)肿瘤细胞;
[0040]
根据不同实验需求,在接完菌后,可进行下述任一种研究:
[0041]
a)研究各类生物被膜的生长动态、转录、翻译及代谢空间异质性;
[0042]
b)研究各类生物被膜的抗生素耐受性;
[0043]
c)研究同种及不同种类生物被膜间的互作;
[0044]
d)研究生物被膜与宿主间的互作;
[0045]
e)通过所述进菌管道通入与所述主腔室内不同的培养基,研究生物被膜在不同环境压力下的选择适应性;
[0046]
f)在生物被膜长到特定尺寸后,通过所述进菌管道通入抗生素等药物刺激,研究杀灭生物被膜内部细菌后生物被膜的反应;
[0047]
g)在生物被膜长到特定尺寸后,通过所述进菌管道通入与所述主腔室不同的抗生素等刺激,研究内外同时刺激对生物被膜的影响。
[0048]
h)通过所述进菌管道通入气体,培养并研究厌氧菌、好氧菌以及固氮菌等的生物被膜;
[0049]
所述气体为空气、氮气、氧气或二氧化碳等。
[0050]
本发明还提供了利用所述微流控芯片研究生物被膜群体行为的方法,包括如下步骤:
[0051]
1)通过所述入液口注入培养基,所述培养基通过流体管道进入所述主腔室中,可保持所述入液口的压力为5~29psi;同时,通过所述进菌管道的入菌口向所述进菌管道注入所述培养基,在10~29ps的注入压力作用下抬起所述接种位点处的pdms,进而进入所述主腔室中,则在所述入液口来流的作用下,两股流体一起流向所述出液口,保持10~15min,以使所述主腔室内充满液体;
[0052]
2)通过所述进菌管道的入菌口向所述进菌管道注入待接种的菌液,在注入压力下抬起所述接种位点处的pdms,进而进入所述主腔室中,则在所述入液口来流的作用下,两股流体一起流向所述出液口;同时调节所述入液口和所述入菌口处的压力,以改变所述接种位点处pdms抬起的高度,以使部分细菌能够压在所述接种位点处的pdms下,而进入所述主腔室的细菌则被流体带入所述出液口;维持进菌10s~1min,保证在所述接种位点处截留足够多的细菌;
[0053]
3)去除所述入菌口处的压力,保留所述入液口处的压力为1~10psi,则所述接种位点处的pdms完全塌陷,稳固压住粘附的细菌,形成生物被膜的生发中心,细菌则以所述接种位点为圆心,向所述主腔室方向长出生物被膜,即可研究细菌生物被膜动态行为;
[0054]
为了避免所述进菌管道内长菌对生物被膜的影响,所述方法还包括如下步骤:在形成生物被膜的生发中心后,将所述入菌口处的菌液换成pbs溶液,开启1~5psi压力,则pbs溶液顺着所述进菌管道从呈y型的一个所述入菌口流向另一个所述入菌口,冲走所述进菌管道内所有的细菌;维持1~3h后关闭所述入菌口处的压力。
[0055]
本发明通过对等离子体封装过程的灵活设计,预留接种位点,预设接种位点可以只在同一侧,也可以在腔室两侧计。这样按照预定空间排布,提供多个接种位点,为研究多个生物被膜间的互作提供灵活选择。采用盖玻片和环氧树脂密封实现pdms芯片隔绝空气的
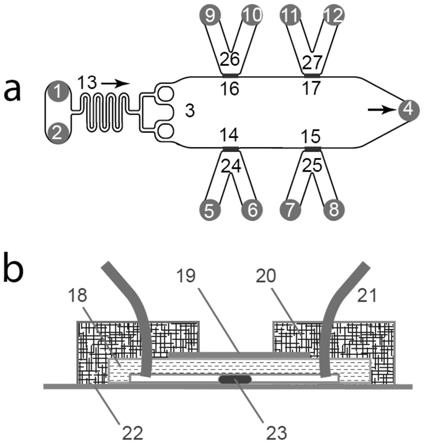
ptfe流体管道21的不锈钢针脚插入预留的针脚位置(1,2,4,5,6)。然后,将环氧树脂树脂20涂封该芯片的所有pdms外表面,注意避开用于成像的盖玻片表面。待环氧树脂20固化,芯片即制作完成。
[0069]
芯片工作时,m63b1培养基(kh2po
4 100mm,(nh4)2so
4 15mm,mgso
4 0.8mm,vitamin b1 3μm,22mm glucose,ph 7.4)从入口1进入,从换液口2流出,立即堵住换液口2,随即培养基通过流体管道13进入主腔室3,保持入口1的压力20psi。同时在入菌口5和6泵入培养基,在20psi压力作用下,抬起预留接种位点14的pdms,流体进入主腔室3。同时在入口1来流的作用下,两股流体一起流向出液口4。保持10min,置换腔室内所有的气体,保证腔室被液体充满。然后,将入菌口5和6连接的培养基换为wild type e.coli bw25113菌液,泵入菌液。同之前培养基一样,菌液挤过预留接种位点14流向出液口4,此时同时调节培养基入口1压力为10psi,入菌口5和6的压力调节为5psi,改变接种位点14处pdms抬起的高度,使得部分细菌能够压在接种位点14处的pdms下,而进入主腔室3的细菌则被流体带入出液口4。这样维持进菌30s,保证在接种位点14处截留足够多的细菌,然后关掉入菌口5和6的压力,保留培养基入口1的压力为3psi,接种位点14处pdms完全塌陷,稳固压住粘附的细菌,形成生物被膜的生发中心。同时,将入菌口6处的菌液换成pbs溶液,开启压力3psi,pbs溶液顺着进菌管道24从入口6流向5,冲走进菌管道24内所有的细菌(避免进菌管道24长菌),关闭入菌口6的压力。这样主腔室3内保持培养基的流动,而进菌管道24无营养流动,细菌则以接种位点14为圆心,向腔室方向长出生物被膜23,如图2a所示。培养温度为37℃,培养时间为48h。采用olympus ix83荧光显微镜进行数据采集,采集频率为10min/frame。生物被膜的典型特征是能够分泌ecm(extracellular matrix),为证明培养基出细菌群体为生物被膜,采用经典的胞外cellular染料calcofluor white(cfw)(100ug/ml)对生物被膜进行染色,绿色荧光即为染出的胞外cellular分布,可以看出本发明培养出的细菌群体即为生物被膜。
[0070]
同样的操作,当入菌口5和6连接的培养基换为s.typhimurim菌液时,长出的生物被膜如图2b所示。
[0071]
同样的操作,当从入口1进入的培养基为lb,且当入菌口5和6连接的培养基换为p.aeruginosa pao1菌液时,长出的生物被膜如图2c所示。同时,胞外ecm染料为100ug/ml hha-fitc(hippeastrum hybrid lecton(hha),fitc conjugated)。
[0072]
同样的操作,当入菌口5和6连接的培养基换为b.subtilis菌液时,长出的生物被膜如图2d所示。其中,b.subtilis菌为构建的表征启动子活力的荧光报告菌株(pyqxm-yfp,phag-mcherry),绿色表征产ecm的菌,品红色表征不产ecm的菌。此实验中,不加染料。
[0073]
同样的操作,当从入口1进入的培养基为m63b1,且当入菌口5和6连接的培养基分别为k.pneumoniae,e.faecium和m.smegmatis菌液时,长出的生物被膜分别如图2e、2g和2h所示。这些实验中,不加染料。
[0074]
同样的操作,当从入口1进入的培养基为tsb,且当入菌口5和6连接的培养基换为s.aureus菌液时,长出的生物被膜如图2f所示。此实验中,不加染料。
[0075]
实施例2、
[0076]
微流控芯片的结构以及制作过程同实施例1。
[0077]
按照实施例1中的步骤进行生物被膜研究,生物被膜的生长动态如图3a所示。进一步对生物被膜的生长速率进行定量计算,结果如图3b-d所示。可以看出,生物被膜以匀速生
长(图3b),其生长区域在营养充足的外围(图3c),而生物被膜内部因为缺乏营养不生长,而且在整个生长过程中,外围生长区域的宽度恒定(图3d)。
[0078]
同样的操作,改变入口1进入的m63b1培养基中的葡萄糖含量,分别为22mm、11mm、5.5mm、2.75mm、1.1mm、0.11mm,定量计算其生长速率,结果如图3e所示。可以看出,生物被膜的碳源浓度决定其生长区域宽度,进一步决定其生长速率。
[0079]
实施例3、
[0080]
微流控芯片的结构以及制作过程与实施例1基本相同,不同之处仅在于在主腔室3的两侧工设置14、15、16和17四个预接种位点。
[0081]
按照实施例1中的步骤进行生物被膜研究,细菌则以接种位点14、15、16、17为圆心,向腔室方向长出4个生物被膜,如图4所示。培养温度37℃,培养时间48h。采用olympus ix83荧光显微镜进行数据采集。
[0082]
实施例4、
[0083]
微流控芯片的结构以及制作过程与实施例1基本相同,不同之处仅在于pdms与凝固剂以体积比10:1混合均匀后掺入终浓度为1mg/ml的pttfpp(pt(ii)meso-tetrakis(pentafluorophenyl)porphine)。这是一种氧淬灭的荧光染料,用来测定生物被膜中的氧气分布。pttfpp预先溶解于四氢呋喃溶剂,后掺入进pdms胶混匀并脱气后浇筑于芯片模具上。按照实施例1中的步骤进行生物被膜研究,培养温度37℃,培养时间45h。采用olympus ix83荧光显微镜进行数据采集,采集频率为10min/frame。结果如图5所示。从图5a pttfpp化学sensor可以看出,生物被膜内的确存在氧梯度。进一步通过依赖于氧气成熟的荧光蛋白yfp检验(图5b-图5c),可以看出,该芯片下生物被膜内部yfp可以表达但因为缺氧无法成熟,导致其不发荧光,而一旦通入氧气,则内部yfp迅速成熟发出荧光。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1