联合回收烟气中二氧化硫并脱除氮氧化物的系统及方法
1.本发明属于化工和环境保护领域,涉及一种联合回收烟气中二氧化硫并脱除氮氧化物的系统及方法;尤其涉及一种钠
‑
铵双碱湿法吸收、电化学还原联合回收烟气中二氧化硫并脱除氮氧化物的系统及方法。
背景技术:
2.大气中的二氧化硫(so2)和氮氧化物(no
x
)是光化学烟雾、酸雨等环境问题的重要来源,对环境和人体健康都会造成极大的伤害,是重点关注的大气污染物。因此,工业烟气必须经过脱硫脱硝达到标准后才能排放。
3.烟气脱硫主要基于高浓度制酸技术和低浓度回收方法。no
x
的主要成分是no2和no,其中no更难以处理。近年来,它们引起了越来越多的关注,国家和行业设定的排放标准也越来越严格。通常工业烟气中的no
x
浓度较低,并且与so2共存,而且烟气的温度低,因此很难采用传统的还原和反硝化技术去除。鉴于上述烟气脱硫脱硝的需求和多污染物协同控制需求,目前迫切需要结合新的环保要求,提高烟气净化效率。工业中,常规的脱除烟气中so2的技术主要分为干法、湿法、半干法等几种,其中石灰石
‑
石膏法、循环流化床法等方法都是广泛应用且较为成熟的干法工艺方法,但是依然存在脱硫效率不理想、副产物多等问题。湿法脱硫效率较高,但也存在占地面积大以及二次废水处理困难的缺点。脱除no
x
的主要方法是采用选择性催化还原脱硝工艺,脱硝效率较高,但是存在运行费用高、条件苛刻、维护成本高等问题。
4.经过对现有技术的检索,专利cn103203176a通过复合氧化剂氧化no并用钙基吸收剂对氧化产物和so2进行吸收脱除,但仍存在氧化剂耗量较大、脱硫副产物多的问题;专利cn1660474a通过钠
‑
钙双碱法,以石灰石与脱硫液反应使脱硫剂得到再生,但脱硫副产物硫酸钙处理仍旧是问题;专利cn103990362a利用二氧化氯气体氧化no,结合湿法或半干法协同去除no
x
和so2,但氧化剂制备成本高,易造成二次污染;专利cn101347706a利用纯碱、烧碱或废碱作为吸收剂,电石渣作为再生剂进行烟气脱硫,以废治废、节能减排,但烟气中的二氧化硫无法再次利用。
5.总体来说,湿法吸收仍旧是较为高效、应用较广的脱硫脱硝方法。传统的亚硫酸钠
‑
亚硫酸氢钠吸收体系成本低、效率高,但氧化副反应产物易降低吸收液的吸收能力,且由于硫酸盐溶解度较低在低温条件下容易造成管道堵塞。此外,该方法对no
x
的去除效果有限。
技术实现要素:
6.本发明的目的在于针对上述现有烟气联合脱硫、脱硝工艺技术的缺陷,结合电化学还原方法的电极性能可调、反应物可控制的优点,提供一种钠
‑
铵双碱湿法吸收、电化学还原联合回收烟气中二氧化硫并脱除氮氧化物的系统及方法,与此同时有效解决实际工艺过程中氧化副产物硫酸盐低温易结晶导致的堵塞管道问题。
7.本发明的工作流程:除尘后臭氧氧化烟气中的氮氧化物为二氧化氮,利用亚硫酸钠和亚硫酸铵作为吸收剂吸收臭氧氧化后的烟气中的二氧化硫和氮氧化物,二氧化硫转化为亚硫酸氢钠,氮氧化物转化为硝酸盐和亚硝酸盐;后经蒸发再生释放出浓缩后的二氧化硫用以富集回收;借助电化学还原反应,将硝酸盐和亚硝酸盐还原为铵盐,铵盐再次循环回吸收池补充吸收液中的铵盐,当铵盐达到一定浓度后,浓缩排出后用作氮肥。
8.在本发明的体系中,利用电化学方法将硝酸根/亚硝酸根电化学还原为铵根,这一过程相对于还原到氮气容易实施,不需外加氯离子等,而且还原生成的铵根回到吸收池后,不仅没有降低对so2等的吸收效率,它的氧化产物硫酸根低温溶解度会远低于硫酸钠,可有效解决实际工艺中低温管道易堵塞这一突出问题。在本体系中,吸收过程中铵根的作用是,(1)氧化产物低温条件下溶解度远大于钠盐,有效解决管道堵塞问题;(2)铵根来自于no
x
的吸收产物,不需额外添加;(3)硝酸根/亚硝酸根经电化学过程还原为铵根,此过程更易实现,且于吸收池回用后可实现no
x
的循环利用,在解决实际工艺问题的基础上实现no
x
的无害化处理及利用;(4)铵根不会影响so2及no
x
的吸收效果。此外,对吸收液中亚硫酸根浓度及ph值无需过多控制,因为亚硫酸根浓度影响的是吸收量,浓度越高吸收容量越大;控制ph为碱性的方法就是添加碱液,例如氢氧化钠,这个过程本身就是提高亚硫酸根浓度的过程。
9.本发明的目的可以通过以下方案来实现:
10.第一方面,本发明涉及一种联合回收烟气中二氧化硫并脱除氮氧化物的方法,联合使用钠
‑
铵双碱湿法吸收法和电化学还原法。本发明联合使用钠
‑
铵双碱湿式吸收脱硫工艺方法和电化学还原脱硝方法,实现二氧化硫的吸收、再生回收以及氮氧化物的吸收、循环利用并脱除的目的。
11.作为本发明的一个实施方案,所述方法包括如下步骤:
12.s1、除尘后的烟气经过臭氧氧化,烟气中的一氧化氮no氧化为二氧化氮no2;
13.s2、使用亚硫酸盐吸收液吸收步骤s1烟气中的二氧化硫so2和氮氧化物no
x
,生成亚硫酸氢盐hso3‑
、硝酸盐no3‑
和亚硝酸盐no2‑
溶液;
14.s3、亚硫酸盐吸收液吸收饱和后经过蒸发再生,二氧化硫释放再生并进行富集回收;蒸发再生后的溶液进行电化学还原脱硝,其中的硝酸盐和亚硝酸盐被还原为氨氮;
15.s4、步骤s3还原脱硝处理后的含氨氮溶液循环至步骤s2,作为补充吸收液循环使用;或当步骤s3还原脱硝处理后的含氨氮溶液中铵盐浓度超过75%后排出体系。在本发明的体系中,随着反应的进行,吸收液中铵的浓度会逐渐增加,但当铵浓度过高时,容易造成氨逃逸,且由于ph的降低会降低吸收效率。
16.作为本发明的一个实施方案,步骤s1中,臭氧氧化过程通过臭氧发生器放电氧化空气或纯氧气成臭氧实现。
17.作为本发明的一个实施方案,步骤s2中,反应初始亚硫酸盐吸收液为亚硫酸钠溶液,浓度为10%
‑
20%;反应过程中亚硫酸盐吸收液为亚硫酸钠和亚硫酸铵的混合液;以占亚硫酸钠和亚硫酸铵总质量的百分比计,所述混合溶液中亚硫酸钠质量比为25
‑
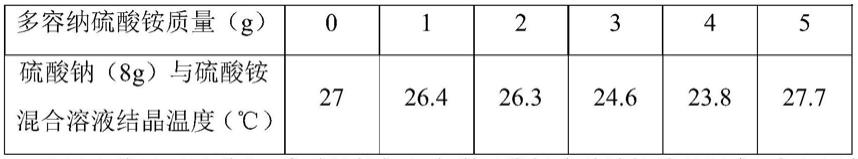
100%,亚硫酸铵质量比为0
‑
75%。
18.作为本发明的一个实施方案,步骤s2中,吸收过程在环境大气压(101kpa)及中低温(20℃
‑
60℃)条件下进行。优选的,所述吸收过程在环境大气压及40℃条件下进行。
19.作为本发明的一个实施方案,步骤s2中,在吸收过程中,部分亚硝酸盐被氧化为硝
酸盐,部分亚硫酸盐吸收液被烟气中的o2氧化为氧化副产物硫酸盐。
20.作为本发明的一个实施方案,步骤s2中,吸收过程外加补充碱液,所述碱液为氢氧化钠或者亚硫酸钠。步骤s3处理时,亚硫酸氢钠减压蒸发释放出so2,生成亚硫酸钠,这部分亚硫酸钠回至吸收池(脱硫吸收塔)作为吸收剂;此外,由于烟气中氧气的存在,吸收液会部分被氧化,所以该过程还需外加补充碱液,外加的碱液使用氢氧化钠或者亚硫酸钠。
21.作为本发明的一个实施方案,步骤s3中,蒸发再生过程是通过加热分解或减压蒸发过程实现二氧化硫再生。加热分解的温度为95
‑
100℃;排出的蒸发再生后溶液浓缩后作为肥料或建材原料使用。
22.作为本发明的一个实施方案,步骤s3中,富集回收的二氧化硫用以制备高浓度二氧化硫或者制酸。
23.作为本发明的一个实施方案,步骤s3中,电化学还原脱硝过程是在电解槽中进行的,电解槽中阳极为ir
‑
ru/ti基惰性电极,阴极为ti基金属氧化物电极,阴阳极之间通过质子交换膜隔开。
24.作为本发明的一个实施方案,所述ti基金属氧化物电极选自co3o4/ti或fe2o3/ti电极。
25.作为本发明的一个实施方案,所述ti基底金属氧化物电极是在ti基底上以溶胶
‑
凝胶法涂布负载金属氧化物薄膜而得。所述金属氧化物为co3o4或fe2o3。
26.作为本发明的一个实施方案,步骤s3中,蒸发再生装置中溶液的氨氮达到预设浓度后排出。蒸发再生装置中,吸收过程和电化学还原过程产生的氧化副产物硫酸钠和硫酸铵被排出系统,浓缩后作为肥料使用,产生经济效益。
27.第二方面,本发明还涉及一种联合回收烟气中二氧化硫并脱除氮氧化物的系统,所述系统包括依次相连的臭氧发生器、脱硫吸收塔、蒸发再生器、电化学反应池和吸收液补充池;所述吸收液补充池的补充吸收液经管道回流至脱硫吸收塔。
28.与现有技术相比,本发明具有如下有益效果:
29.1)本发明构成了一个亚硫酸钠
‑
亚硫酸铵湿法吸收体系,在保证总体吸收效率的前提下,降低了吸收体系的结晶温度,有效解决了传统工艺吸收过程氧化副产物低温条件下引起的管道堵塞的问题;
30.2)本发明利用电化学脱硝方法的优势,在传统工艺回收so2的同时吸收no
x
并循环利用,达到同时脱硫脱硝的目的。
附图说明
31.通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
32.图1为本发明的联合回收烟气中二氧化硫并脱除氮氧化物方法的整体流程示意图;
33.其中:1、臭氧发生器;2、吸收塔;3、蒸发再生器;4、电化学反应池;5、吸收液补充池,6、冷凝器。
具体实施方式
34.下面结合附图和具体实施例对本发明进行详细说明。以下实例在本发明技术方案的前提下进行实施,提供了详细的实施方式和具体的操作过程,将有助于本领域的技术人员进一步理解本发明。需要指出的是,本发明的保护范围不限于下述实施例,在本发明的构思前提下做出的若干调整和改进,都属于本发明的保护范围。
35.实施例1
36.本实施例涉及一种联合回收烟气中so2并脱除no
x
的系统及方法,该系统如图1所示,包括依次相连的臭氧发生器1、吸收塔2、蒸发再生器3、电化学反应池4、和吸收液补充池5;
37.臭氧发生器1设有烟气进口,除尘后的烟气输送至臭氧发生器1进行臭氧氧化处理;
38.吸收塔2设有尾气排放口和补充吸收液进口,吸收液补充池5内的补充吸收液经补充吸收液进口回流至吸收塔2;吸收液补充池5上还设有补充碱液装置;
39.蒸发再生器3上设有so2出口以及氧化副产物出口,蒸发再生器3内蒸发再生的so2经so2出口进入so2释放管路,所述so2释放管路上设有冷凝器6,用以回收富集高浓度的so2气体;硫酸钠和硫酸铵氧化副产物经氧化副产物出口排出系统,浓缩后作为肥料使用。
40.本实施例的联合回收烟气中so2并脱除no
x
的方法包括如下流程:除尘后的烟气经过臭氧氧化过程,将烟气中的一氧化氮氧化为二氧化氮;使用亚硫酸盐吸收液吸收烟气中的二氧化硫和氮氧化物,生成亚硫酸氢盐、硝酸盐和亚硝酸盐;吸收液吸收饱和后经过蒸发再生,二氧化硫释放再生并进行富集回收,用以制备高浓度二氧化硫或者制酸;蒸发再生后的溶液进行电化学还原,硝酸盐和亚硝酸盐被还原为氨氮;氨氮循环至吸收池补充吸收液循环使用,达到一定浓度后排出系统,作为肥料制造经济效益。
41.具体步骤如下:
42.第一步,除尘后的烟气经过臭氧氧化过程,烟气中的no被氧化为no2,此步骤将更有利于no
x
被吸收液吸收进入液体相,所述臭氧氧化过程通过臭氧发生器放电氧化空气或纯氧气成臭氧实现;
43.no+o3→
no2+o244.第二步,亚硫酸盐吸收液吸收烟气中的so2和no
x
,so2与吸收液so
32
‑
反应生成hso3‑
,no
x
进入液相生成no3‑
和no2‑
,no2‑
为主要成分;同时,在这一过程中,部分no2‑
被氧化为no3‑
,部分so
32
‑
吸收液被烟气中的o2氧化为副产物so
42
‑
;初始吸收液为吸收液na2so3,随着no3‑
和no2‑
的还原吸收液so
32
‑
是na2so3和(nh4)2so3的混合液,此吸收过程在环境大气压及常温条件下进行;
45.so2+so
32
‑
+h2o
→
2hso3‑
46.2no2+so
32
‑
+h2o
→
so
42
‑
+2no2‑
+2h
+
47.2no2+hso3‑
+h2o
→
so
42
‑
+2no2‑
+3h
+
48.no2+no+h2o
→
2no2‑
+2h
+
49.3no2+h2o
→
2no3‑
+no+2h
+
50.2no2+h2o
→
no2‑
+no3‑
+2h
+
51.[0052][0053]
2so
32
‑
+o2→
2so
42
‑
[0054]
第三步,吸收达到饱和的吸收液在蒸发结晶塔内蒸发再生,so2重新释放出来,并对此进行富集回收,用以制备高浓度so2气体或者用来制酸;所述蒸发再生过程是通过加热和减压蒸发过程实现so2再生;
[0055]
2hso3‑
→
so
32
‑
+so2+h2o
[0056]
第四步,蒸发再生后的溶液进行电化学还原,no3‑
和no2‑
被还原为nh
4+
;所述电化学还原脱硝过程是在电解槽中进行的,电解槽阳极为惰性ir
‑
ru/ti基电极,阴极为co3o4/ti、fe2o3/ti电极,阴阳极之间通过质子交换膜隔开;所述阴极co3o4/ti、fe2o3/ti电极是在ti基底上以溶胶
‑
凝胶法涂布负载co3o4及fe2o3薄膜;
[0057]
第五步,电化学反应池中的生成的氨氮循环至吸收池补充作为吸收液循环使用,从而实现n的循环利用,当氨氮达到一定浓度后随同吸收过程和电化学过程中产生的氧化副产物硫酸钠和硫酸铵被排出系统,浓缩后作为肥料使用,产生经济效益。
[0058]
实施例2
[0059]
本实施例的目的在于考量亚硫酸体系中,氧化副产物硫酸钠和硫酸铵的结晶情况,具体考察比较了硫酸钠和硫酸铵体系的结晶温度。
[0060]
在20g去离子水中加入8g硫酸钠(质量分数28%,接近饱和),向其中加入不等量的硫酸铵,测定混合硫酸盐溶液的结晶温度。
[0061]
将结晶实验溶液置于水浴中,磁力搅拌器用于加速溶液的温度传递和结晶,温度传感器和温度变送器用于监测和记录待分析的溶液的温度。同时,以去离子水设为空白对比。由循环冷凝器控制水浴的温度,逐渐降低水浴温度,记录混合液结晶情况。当混合液温度不再下降并突然上升时,说明溶液结晶放热导致体系升温,此刻即为结晶时刻。通过每个时刻混合液与去离子水的温度差可以得到温差曲线,从而得到结晶温度。
[0062]
混合体系多容纳不同硫酸铵量时的结晶温度如下:
[0063][0064]
从以上结果可以看出,硫酸铵的加入有利于降低硫酸钠的结晶温度,在相同条件下,可以多溶解超过50%的硫酸铵,这也证明了添加硫酸铵可以降低结晶温度,减缓氧化副产物硫酸盐引起的管道堵塞的问题。
[0065]
实施例3
[0066]
本实施例具体考察了硫酸钠和硫酸铵混合体系硫酸铵质量、含量与结晶温度关系。
[0067]
在20g去离子水中分别加入28%、25%、20%、15%、10%的硫酸钠与硫酸铵混合溶液(28%为接近饱和)改变其中硫酸铵的含量,测定混合硫酸盐溶液的结晶温度。测定方法同实施例2,测得的结晶温度如下:
[0068][0069]
从以上结果可以看出,结晶温度随着硫酸铵含量的增加而逐渐降低,而与混合溶质的总质量分数无关。结晶温度的显着降低再次证明,系统中的铵盐可以降低吸收液的结晶温度,并减少由结晶引起的管道堵塞。
[0070]
实施例4
[0071]
本实施例的目的在于考察亚硫酸钠和亚硫酸铵溶液对so2和no
x
的吸收效率。
[0072]
亚硫酸钠和亚硫酸铵吸收液对so2和no
x
的吸收效果通过液体吸收来实现,no、no2、so2的混合气体通过鼓泡吸收反应器经过亚硫酸钠和亚硫酸铵吸收液在环境大气压下进行充分的吸收反应,吸收过程中控制吸收温度至40℃,确保反应条件一致,反应充分进行。实时分析吸收池入口和出口的气体浓度,计算so2和no
x
气体吸收率。
[0073]
发明方式所用混合气体中no2、no、so2和o2的浓度范围分别为300、50
‑
100、3000
‑
10000ppm和0
‑
10%;总气体流量为1l/min;吸收剂浓度为5%。
[0074]
待吸收完全,检测计算亚硫酸钠和亚硫酸铵对so2的吸收效率分别为98.18%和98.47%,表明它们具有很好的吸附效果(>98%);对no2的吸收效率分别为98.38%和93.44%,表明去除效率较高,满足对no2的去除要求;对no的吸收效率分别为68.89%和69.18%,去除效率相对no2较低,难以达到行业排放标准,因此,在吸收前需要用臭氧将no氧化成no2,可以大幅提高no
x
的吸收效率。
[0075]
实施例5
[0076]
本实施例的目的在于考察联合回收烟气中so2并脱除no
x
的方法中所采用的亚硫酸盐吸收液对no
x
的吸收效果。
[0077]
向5%的亚硫酸盐吸收液中连续通入350ppm的no2和50ppm的no,吸收270分钟后,吸收产物浓度为0.385g/l的no3‑
和1.627g/l的no2‑
。结果表明,氮氧化物的吸收产物主要是no2‑
(大部分)和no3‑
,no3‑
的浓度明显低于no2‑
。而在整个吸收体系中,no2‑
不是稳定存在的状态,部分可被氧化为no3‑
。此外,在从no3‑
开始的电化学还原过程中,还原产物包括nh
4+
、n2等,而nh
4+
是最易还原的产物。当关注还原途径时,no3‑
首先被电化学还原为no2‑
,以及部分可能的no、n2o、n2,最后是nh
4+
,具体中间产物取决于电化学还原控制,包括电极材料、外加电压、环境等。从no2‑
电化学还原为nh
4+
比从no3‑
电化学还原为nh
4+
更容易,其中氮的电荷等于+3,而no3‑
中氮的电荷等于+5。考虑到no3‑
和no2‑
的竞争反应,来自no2‑
的反应由于其更高
的浓度和更有利的电化学电势而获得更快的反应速率。同时,no3‑
也被认为在还原反应的足够电压下被还原。因此,no3‑
的电化学还原是工艺进行的重点。
[0078]
实施例6
[0079]
本实施例的目的在于考察联合回收烟气中so2并脱除no
x
的方法中所采用的钛基金属氧化物电极电化学脱硝效果。
[0080]
在电解槽中进行电化学还原脱硝过程,常用的钛基金属氧化物电极处理硝酸盐废水。处理对象为c
n
=100mg/l的nano3溶液,含有0.1mol/l的na2so3,废水体积为100ml。
[0081]
采用溶胶
‑
凝胶法将co3o4、fe2o3涂覆负载在ti基底上,用作阴极电极,并以此证明对硝酸盐的电化学还原具有良好的效果;电解槽阳极采用惰性ir
‑
ru/ti基电极,阴阳极之间通过质子交换膜隔开;电压设置为5v,阴极和阳极的浸没面积为15cm2(5cm
×
3cm);反应过程中电流在0.06a~0.2a。
[0082]
3h后取样分析,测定硝酸盐氮的去除率和氨氮的产生率,结果如下。
[0083]
金属氧化物电极co3o4/tife2o3/tino3‑
‑
n去除率(%)93.763.8nh
4+
‑
n生成率(%)85.649.6
[0084]
从以上结果可以看出,co3o4/ti阴极表现出93.67%的硝酸盐去除效率,优于fe2o3/ti,同时显示出比fe2o3/ti(49.59%)更好的氨生成效率(85.56%)。两个阴极显示出约10%的总氮去除效率,其以其它气态或液态氮形式存在。总的来说,两种阴极都表现出良好的no3‑
还原性能,no3‑
主要被还原成nh
4+
氮,还有一小部分no3‑
和其他形式的氮。它提供了氮在吸收系统中转化和循环利用的可能性,以达到脱氮的目的。co3o4/ti具有令人满意的还原no3‑
的效率和nh
4+
生成效率,同时so
32
‑
的存在对电化学还原反应没有抑制作用,再次证明了该方案的可行性。
[0085]
实施例7
[0086]
本实施例的目的在与考察联合回收烟气中so2并脱除no
x
的方法中工艺连续运行对脱硝效率的影响。
[0087]
为考虑实际工艺连续运行的要求,在电化学脱硝过程中间歇式加入no3‑
‑
n源,每2小时加入浓度相当于硝酸盐氮初始浓度,考察每种形态氮的浓度和整个反应过程的酸碱度变化。每2小时,no3‑
‑
n浓度均有明显下降,全程维持在60%以上的间隔去除效率;nh
4+
‑
n浓度均有明显上升,全程维持在55.2%以上的间隔生成效率。当间隔时间延长至3小时,no3‑
‑
n去除效率提升至86.2%以上;nh
4+
‑
n生成效率提升至72%以上,且随时间推移此效率将继续提升。整个过程当中整体脱硝及氨氮转化效率维持在较高水平。
[0088]
工艺过程中的酸碱度结果显示,由于氨的形成,反应开始后ph值由初始值9.26迅速上升至12.45,随后维持在一个较高的值,约为12.7~13.1,且由于(nh4)2so3是一种弱碱盐,对过程有缓冲作用,该体系ph值一般比较稳定。
[0089]
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1