一种氨基功能化碳纳米管负载NiAuPd纳米催化剂的原位制备方法及应用
一种氨基功能化碳纳米管负载niaupd纳米催化剂的原位制备方法及应用
技术领域
1.本发明涉及催化剂制备以及环境和能源的可持续发展领域,特别是一种氨基功能化碳纳米管负载niaupd纳米催化剂的原位制备方法及应用。
背景技术:
2.氢能是一种清洁无污染的绿色能源,它被认为是解决全球环境污染与能源短缺的有效途径,近年来引起了广泛的研究兴趣。氢能的储存包括物理储氢与化学储氢两种,传统的高压气态储存和低温液态储氢方法存在效率低、安全性差和成本高的缺点,因此研发安全、高效的储氢方法是当下的研究热点。
3.甲酸(hcooh,fa)的氢含量为4.4wt%,具有优异的稳定性,在室温下呈液态稳定存在,因此被认为是一种有前景的化学储氢材料。甲酸的分解包括脱水反应(hcooh
→
h2o+co)和脱氢反应(hcooh
→
h2+co2)两种途径。脱氢反应生成h2是实验要求发生的途径,与此同时甲酸的脱水反应生成了co,而co会使燃料电池催化剂中毒失去活性,因此需要我们严格控制反应途径,避免脱水反应的发生,甲酸的分解途径与催化剂息息相关,因此,研发制备方法简单、经济高效的催化剂成为其作为储氢材料的关键。
4.贵金属对于甲酸脱氢反应有非常好的催化效果,但是贵金属的添加使得催化剂的制备成本变高,不利于商业化应用。通过添加非贵金属来替代部分贵金属的用量,可以有效降低催化剂的制备成本。此外对于甲酸分解制氢用催化剂来说,目前常用碱性还原剂,如硼氢化钠、氨水等,对金属进行还原,所得到的的催化剂还需经过离心、水洗等过程才可以进行使用,导致催化剂的制备步骤增加,制备方法复杂。
5.综上所述,寻找一种简单且有效的方法合成价格低廉、高效且分散性好的纳米催化剂对于降低催化剂成本,促进甲酸的实际应用是非常必要的。
技术实现要素:
6.本发明的目的是要解决现有技术中存在的不足,提供一种氨基功能化碳纳米管负载niaupd纳米催化剂的原位制备方法及应用。该方法采用甲酸(fa)作为还原剂和氢源,实现氨基功能化碳纳米管负载niaupd纳米催化剂的原位制备,同时通过非贵金属成分ni的加入,降低了催化剂的成本。本发明制备过程的简单,降低了制备过程中金属的损耗,所合成的催化剂直接应用于甲酸分解制氢反应,表现出良好的催化活性。
7.为达到上述目的,本发明是按照以下技术方案实施的:
8.一种氨基功能化碳纳米管负载niaupd纳米催化剂的原位制备方法,包括以下步骤:
9.步骤一、将碳纳米管cnts加入水中,超声处理后得到分散均匀的碳纳米管cnts与水的混合溶液;每10ml的水加入5~50mg的碳纳米管cnts;
10.步骤二、将3
‑
氨丙基三乙氧基硅烷apts,加入到步骤一的cnts水溶液中,继续搅拌
2~10min后,得到混合溶液a;
11.每10ml的混合溶液加入0.1~1ml的3
‑
氨丙基三乙氧基硅烷apts;
12.步骤三、依次将nicl2,na2pdcl4,haucl4水溶液,加入到步骤二的混合溶液a中,继续搅拌2~10min后,得到混合溶液b;
13.其中,摩尔比为,nicl2:haucl4:na2pdcl4=2:(1~4):(1~4);每10~15ml的溶液a加入0.02~0.1mmol的nicl2;nicl2、haucl4、na2pdcl4水溶液浓度为0.01~0.5m;
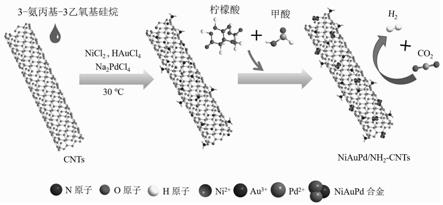
14.步骤四、将混合溶液b加入双颈烧瓶中,再将fa水溶液(0.1~5m)与柠檬酸ca水溶液(0.1~1m)加入到混合溶液b中,并继续搅拌进行金属还原反应,得到氨基功能化碳纳米管负载niaupd纳米催化剂;
15.其中,每10~20ml的溶液b加入3~10mmol的fa;ca与fa得摩尔比为(0.06~0.2):1;
16.所述的niaupd是三金属合金结构,且均匀的分散在氨基功能化碳纳米管。
17.所述步骤四中的金属au:pd为0.1~3,ni:(au
0.5
:pd
0.5
)为0.3~2。
18.所述步骤四中的金属ni:au:pd的最佳比例为1:2:2。
19.niaupd合金纳米粒子均匀的分散在cnts载体上,其颗粒尺寸约为4.3~8.6nm,平均颗粒尺寸约为6.5nm。
20.所述方法原位制备的氨基功能化碳纳米管负载niaupd纳米催化剂的应用,应用于催化甲酸室温水解制氢反应;
21.一种氨基功能化碳纳米管负载niaupd纳米催化剂的应用,其特征在于,包括如下步骤:将得到的催化剂分散在水中,再加入甲酸水溶液,温度25~60℃、常压,即可催化甲酸水解制氢;
22.其中,每5~15ml水中加入0.1~1mmol催化剂;甲酸水溶液的浓度为0.1~5m,催化剂和甲酸的摩尔比为0.01~0.5:1;催化剂的摩尔量以ni、au和pd三种元素的摩尔量之和计。
23.本发明的实质性特点为:
24.当前技术中,都采用碱性还原剂对金属进行还原,还原后的样品需经过离心、水洗的处理才能够用于催化fa脱氢反应。本发明采用fa作为还原剂和氢源,实现氨基功能化碳纳米管负载niaupd纳米催化剂的原位制备,并直接将催化剂用于fa分解制氢反应,而不需要任何处理,使制备和反应过程简单化。并且通过非贵金属成分ni的加入替代,降低了催化剂的成本。
25.与现有技术相比,本发明的有益效果是:
26.本发明的一种氨基功能化碳纳米管负载niaupd纳米催化剂的方法,采用原位还原法来合成碳纳米管负载niaupd纳米催化剂,在室温下即可完成,具有合成时间短,操作简便的优点,且明显提高了niaupd nps在cnts载体上的分散性并且降低了合金niaupd nps的颗粒尺寸;将合成的niaupd/nh2‑
cnts催化剂用于催化甲酸水溶液30~60℃温度下的分解制氢,该催化剂在没有任何添加剂存在的条件下仍然具有良好的催化活性,100%的转化率,100%的氢气选择性及较好的循环稳定性,其tof值在30℃和60℃时分别为699和3006mol h
2 mol pd
‑1h
‑1。niaupd/nh2‑
cnts中非贵金属ni的使用,有效的降低了催化剂的成本。其中apts的加入可以有效提高金属的分散性并且对cnts进行了
‑
nh2官能团的掺杂,柠檬酸的加
入也对金属的分散性和粒径大小起到了积极的影响,甲酸不仅作为储氢材料提供了氢源而且作为酸性还原剂参与催化剂的制备。总的来说,这种采用酸性还原剂在原位条件下直接还原金属制备催化剂的方法,实现了制备过程的简单化,并降低了制备过程中金属的损耗,合成了氨基功能化碳纳米管负载niaupd纳米催化剂,将所合成的催化剂直接应用于甲酸分解制氢反应,表现出良好的催化活性,为发展安全、高效、廉价的催化剂提供新的途径,并进一步促进甲酸作为储氢材料在实际生活中的应用。
附图说明
27.图1为niaupd/nh2‑
cnts催化剂制备的示意图;
28.图2为实施例1和比较例1中有/无ca添加的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts催化剂的x射线衍射图谱;
29.图3为实施例1中ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts催化剂的x射线光电子能谱图;其中:其中,图3(a)为ni 2p的x射线光电子能谱图,图3(b)为au 4f的x射线光电子能谱图,图3(c)为pd 3d的x射线光电子能谱图,图3(d)为n1s的x射线光电子能谱图图;
30.图4为实施例1中ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts催化剂透射电镜图片;
31.图5为实施例1中ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts和比较例2中的ni
0.2
au
0.4
pd
0.4
催化剂在30℃下催化甲酸分解的时间
‑
过程曲线。
32.图6为实施例1中ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts下催化甲酸分解的循环性能曲线图。
具体实施方式
33.下面结合具体实施例对本发明作进一步描述,在此发明的示意性实施例以及说明用来解释本发明,但并不作为对本发明的限定。
34.实施例1
35.1.如图1所示,一种氨基功能化碳纳米管负载niaupd纳米催化剂的原位制备方法,包括以下步骤:
36.将35mg cnts溶于10ml水中,超声15分钟,再加入0.4ml apts,搅拌5分钟。将ni:au:pd摩尔比为1:2:2的nicl2、haucl4和na2pdcl4溶液(浓度均为0.02m,体积分别为1ml、2ml、2ml,所用ni、au、pd金属总量为n
金属
=0.1mmol)加入这10ml的apts+cnts的水溶液中,继续搅拌5min后得到均匀的混合溶液(混合后总体积为15.4ml);再将0.3mmol的ca和5mmol fa(1m)一起加入到上述的混合溶液中,搅拌15分钟即可制得黑色的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts样品(催化剂的摩尔量以ni、au和pd三种元素的摩尔量之和计,即催化剂的摩尔数0.1mmol)。
37.2.样品检测
38.(1)将前述制得的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts催化剂离心(8000rpm,4min)、水洗3次、真空干燥,研磨成细小粉末;参考图2中的(a),x射线粉末衍射(xrd)结果表明,所制备的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts纳米复合物具有良好的结晶性,且ni、au、pd金属是以合金的形式存在在nh2‑
cnts衬底上;
39.(2)将前述制得的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts催化剂真空干燥;参考图3,x光电子能谱(xps)结果表明,该方法成功的合成了氨基功能化碳纳米管负载niaupd纳米催化剂,且
ni,au,pd均以金属态存在,其中ni主要以氧化态形式存在,可能是由于样品制备过程中的氧化造成。n1s峰的存在,证明了apts的成功掺杂;
40.(3)将前述制得的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts纳米催化剂稀释,滴在碳支持膜上,干燥。如图4所示,透射电子显微镜(tem)结果显示,ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts样品具有良好的分散性和较小的颗粒尺寸(~6.3nm)。
41.3.催化甲酸脱氢反应
42.将实施例1中所制得的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts样品直接催化体系中fa的分解制氢反应(催化剂的摩尔量以ni、au和pd三种元素的摩尔量之和计,即催化剂的摩尔数0.1mmol)。反应体系中含有15ml水和5mmol的甲酸,并通过气体量管测量所产生的氢气。
43.通过气体测量管测量所产生的氢气,此次催化甲酸水溶液制氢过程的制氢量(ml)与时间(分钟)图如图5中的(a)所示,ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts在30℃催化甲酸水解制氢具有较好的活性,在30分钟内产生全部245ml的气体,转换率达到100%。
44.在第一轮分解反应结束以后,等量的甲酸溶液通过恒压滴液漏斗加入到双颈烧瓶当中,剩下的操作与之前反应的相同。将同样的操作步骤在30℃水浴温度下再重复两次,如图6所示,所制备的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts纳米催化剂对于催化甲酸脱氢反应具有良好的循环稳定性,在反应圈后,虽然其反应时间略有增加,但仍具有100%的转化率。
45.说明本发明的材料可以在燃料电池工作温度<80℃范围内水解制氢反应优势显著。
46.比较例1
47.将35mg cnts溶于10ml水中,超声15分钟,再加入0.4ml apts,搅拌5分钟。将ni:au:pd摩尔比为1:2:2的nicl2、haucl4和na2pdcl4溶液(0.02m)加入这10ml的apts+cnts的水溶液中(n
金属
=0.1mmol),继续搅拌5min后得到均匀的混合溶液,再将5mmol fa溶液(1m)加入混合溶液中,搅拌15分钟即可制得黑色的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts(无ca)样品。再将此样品进行离心(8000rpm,4min)、水洗3次、真空干燥处理。如图2中的(b)所示,x射线粉末衍射(xrd)结果表明,所制备的ni
0.2
au
0.4
pd
0.4
/nh2‑
cnts纳米复合物在没有ca添加时也具有良好的结晶性,且ni、au、pd金属是以合金的形式存在在nh2‑
cnts衬底上,说明ca的加入并不会影响金属的结晶性;
48.比较例2
49.将0.4ml apts加入10ml水中,搅拌5分钟。将ni:au:pd摩尔比为1:2:2的nicl2、haucl4和na2pdcl4溶液(0.02m)加入这apts水溶液中(n
金属
=0.1mmol);再将0.3mmol的ca和5mmol fa(1m)一起加入混合溶液中,搅拌15分钟即可制得黑色的ni
0.2
au
0.4
pd
0.4
nps样品。将所制得的ni
0.2
au
0.4
pd
0.4 nps样品直接催化体系中fa的分解制氢反应。通过气体测量管测量所产生的氢气,此次催化甲酸水溶液制氢过程的制氢量(ml)与时间(分钟)图如图5中(b)所示,ni
0.2
au
0.4
pd
0.4 nps则没有催化活性,说明cnts载体的使用对催化活性的提高有重要作用。
50.实施例2
51.其他步骤同实施例1,不同之处为将ni:au:pd的摩尔量改为1:3:1;
52.得到的产品仍具有三金属合金结构,且性能与实施例1接近。
53.总的来说,该方法能够作为一种新的、简单的原位制备功能化载体负载金属催化
剂的方法,将所合成的催化剂应用于甲酸分解制氢反应,表现出有非常好的催化活性,为发展廉价、高效的金属催化剂提供新的途径,并进一步促进fa作为储氢材料在燃料电池、便携设备等领域的实际应用。
54.虽然本发明已经参考实施例被详细的描述了,对于本领域的普通技术人员来说可以理解,在所付权利要求范围内,可以进行部分细节上的变动。
55.本发明未尽事宜为公知技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1