一种回收油包水液滴中内容物的方法及液滴生成装置与流程
1.本发明属于生物技术领域,更具体而言,本发明提供了一种回收油包水液滴中内容物的方法及液滴生成装置。
背景技术:
2.在微流控技术应用中,为了实现物理上的隔离,油包水液滴是常用的结构。但是,为了回收液滴内容物,需要打破油膜表面张力。对此,本领域存在两种技术路线,第一种技术路线是加入化学破乳剂打破液滴,第二种技术路线是使用物理方法。在第一种技术路线中,通过加入破乳剂,替换油膜内的表面活性剂,破坏油膜稳定结构,促使油膜相互融合,最终实现油水分离。但是,该技术路线会受温度、破乳剂类型和破乳时间等影响,同时破乳剂对细胞活力也有影响。因此,该技术路线在使用时需要有针对性地建立技术方法。第二种技术路线包括采用去静电装置、真空抽吸等。但是,该技术路线在使用时需要考虑目标回收物的性质,对细胞等脆弱、易变性等物质效果不好。
3.已有方法采用1h,1h,2h,2h-全氟-1-辛醇为破乳剂回收液滴中的细胞。在具体应用中,先向液滴中加入dmem/f12培养基和1h,1h,2h,2h-全氟-1-辛醇后进行混匀,然后通过在4摄氏度、700g下离心实现相分离。此方法的缺点有:细胞得率在40~60%之间,总回收率低;由于采用700g离心,细胞沉积在线分离界面,细胞回收难度大;当细胞悬浮液中存在ficoll等试剂调节细胞悬浮液密度时,已有技术难实现相分离。
技术实现要素:
4.为了稳定和提高细胞回收率,并且在回收过程中保持细胞的活性和降低破乳剂对后续实验的影响,本发明提出了采用化学破乳剂来实现油包液滴内细胞或其他内容物的回收的方法。
5.因此,在一方面,本发明提供了一种回收油包水液滴中内容物的方法,所述方法包括:
6.1)向油包水液滴中加入破乳剂,然后静置;
7.2)将静置后的液体最下层的油相移出;
8.3)向所得的液体中再次加入所述破乳剂,然后静置;
9.4)将所得的液体进行低速离心,优选30g-100g,更优选40g-70g,最优选50g,所述液体形成上下两层,中间有界面;
10.5)收集所述界面之上包含所述内容物的液体,不触及所述中间的界面。
11.在一个实施方案中,所述方法还包括一次或多次的6):向所述界面上方的剩余液体中加入水性溶液,再次收集所述界面之上包含所述内容物的液体。
12.在一个实施方案中,所述油包水液滴中内容物是细胞,所述方法进一步包括,从包含所述内容物的液体中回收所述细胞,例如通过以500g离心10分钟。
13.在一个实施方案中,所述水性溶液为细胞培养液。
14.在一个实施方案中,在1中)所述油包水液滴位于上层,液滴生成油位于下层。
15.在一个实施方案中,所述方法还包括,在1)中加入破乳剂之前,除去部分的下层液滴生成油。
16.在一个实施方案中,所述油包水液滴使用液滴生成装置生成,优选使用微流控液滴生成装置。
17.在一个实施方案中,所述破乳剂选自单宁基混合物、乙氧基化或环氧化的pag、氧烷基化的聚(亚烷基)聚(胺)、聚(醚)聚(氨酯)和辛醇类,优选为辛醇类,更优选为正辛醇、异辛醇、丁辛醇、1h,1h,8h-全氟-1-辛醇或1h,1h,2h,2h-全氟-1-辛醇。
18.在一个实施方案中,在1)中,加入破乳剂的体积是油包水液滴体积的1倍。
19.在一个实施方案中,在1)中,所述静止持续8-15分钟,优选9-12分钟,最优选10分钟。
20.在一个实施方案中,在3)中,所述静止持续3-7分钟,优选4-6分钟,最优选5分钟。
21.在一个实施方案中,在3)中再次加入的破乳剂的体积少于在1)中加入的破乳剂的体积。
22.在一个实施方案中,在4)中,所述离心持续8-15秒,优选9-12秒,最优选10秒。
23.在一个实施方案中,所述方法的步骤在冰上进行操作。
24.在第二方面,本发明提供了一种液滴生成装置,用于本发明第一方面的方法,其包括液滴生成部件、收集管和负压产生部件,所述各个部件之间密封连接,
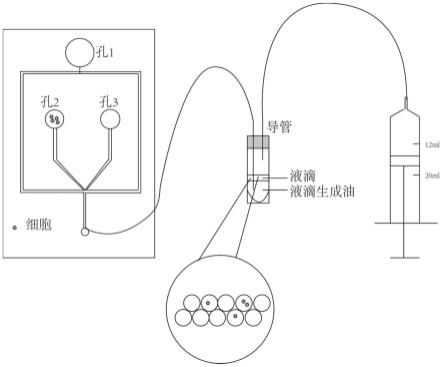
25.其中所述液滴生成部件包括多个加样口和一个液滴收集口,所述加样口分别用于加入液滴生成油、细胞悬液和优选的稀释液,所述多个加样口通过导管汇聚于节点,所述液滴收集口通过导管连接至所述节点,从而收集在所述节点形成的液滴;所述收集管与所述液滴收集口连通;所述负压产生部件与所述收集管连通,用于在所述收集管中形成负压。
26.在一个实施方案中,所述多个加样口以微流控方式加样。
27.在一个实施方案中,加入液滴生成油的加样口通过两个导管连接至所述节点。
28.在一个实施方案中,加入细胞悬液和稀释液的加样口与所述液滴收集口通过y型导管连通。
29.与现有技术中已有方法相比,本发明的方法操作时间近似,但是细胞回收率显著提高(可以达到80~90%);细胞活率较高(可以达到~90%);减少破乳剂污染样品的可能。
附图说明
30.通过以下附图对本发明进行说明。
31.图1示出了本发明的方法的操作流程图。
32.图2示出了负压液滴生成装置。
33.图3示出了投入20万外周血单个核细胞生成的油包水液滴进行测试的结果,比较了采用本发明的方法和对比实施例所得到的细胞率(p《0.5,*)。
34.图4示出了投入2万外周血单个核细胞生成油包水液滴进行测试的结果,比较了采用本发明的方法和对比实施例所得到的细胞率(p《0.01,**)。
35.图5示出了投入4万cho细胞生成的油包水液滴进行测试的结果,比较了采用本发明的方法和对比实施例所得到的细胞率(p《0.0001,****)。
具体实施方式
36.为更好地说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明进一步说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。所描述的实施方案仅仅是本发明的一部分实施方案,而不是全部的实施方案。基于本发明中的实施方案,本领域普通技术人员可以获得的所有其他实施方案,并且它们都属于本发明保护的范围。
37.图1示出了本发明的方法的操作流程图。首先,细胞悬液与液滴生成油形成油包水液滴,使用工作液例如细胞培养液调整细胞悬液的浓度;生成的油包水液滴经连接管滴入液滴收集管中,形成上层是油包水液滴下层是液体生成油的混合物;对于滴液体积比较大的,需要在破乳之前先移除一部分下层的油相,避免破乳剂被稀释,同时为了减少细胞损失,尽量将注射器深入底层,并留下部分的液滴生成油;然后滴加破乳剂,静置10分钟后分成上层细胞悬液、中层液滴和下层破乳剂和生成油混合物;移除下层后,再次滴加破乳剂,静置5-10分钟后以50g离心10秒,最终形成上层细胞悬液和下层破乳剂和生成油混合物。为了保持细胞存活,推荐在冰上进行操作,并且离心在4摄氏度进行。
38.图2示出了负压液滴生成装置。所述液滴生成装置各个部件之间密闭连接,从而可以在其中形成负压。负压液滴生成装置包括微流控液滴生成部件、收集管和注射器。其中,液滴生成部件包括三个加样口、一个液滴收集口,两个加样口通过呈y型管连接至液滴收集口。微流控可以以通常的方式进行,只要能对加样的流体进行控制即可。如图2所示,顶部开孔形成加样口,加入液滴生成油,左侧开孔形成加样口,加入细胞悬液,右侧开孔形成加样口,加入其他水相试剂例如细胞培养液。收集管密闭处理,可以由细胞冻存管改造,在冻存管盖顶部开口,连接导管,再使用热熔胶密闭导管和管盖之间的缝隙。当冻存管盖旋紧时,收集管仅通过和导管和外部连接。按图2示连接装置,拉动注射器后,装置生成负压,在外界大气压的推动下,加样口内液体以层流形式流动。左右两孔内液体在y型处交汇。液滴生成油在y型处形成横向剪切力,令水相液流断裂,形成液滴。在这一过程中细胞将被包裹进液滴。
39.在一个实例中,本发明的方法可以描述为:1)收集的样品有两层,上层是油包水液滴,下层是液滴生成油,由于液滴生成油和破乳剂互溶,会降低破乳剂的浓度,因此可以使用注射器针头从回收管中移除部分下层油相;2)向管内缓慢滴加约为液滴体积两倍的破乳剂(例如pfo),在4摄氏度下静置10分钟;3)此时破乳后聚集的液滴生成油和破乳剂在下层,水相在上层,中间层是未能破乳的液滴,这时使用注射器针头移除一半下层油和破乳剂混合液,避免后续加入的破乳剂被稀释;4)缓慢滴加新的破乳剂,并继续静置5-10分钟;5)以50g离心10秒;6)此时管内有两层,上层为细胞悬浮的水相,下层为液滴生成油和破乳剂的混合物,移取上层一半细胞悬液至新收集管;7)向原管中加入200微升细胞培养液;8)从原管移取200微升细胞悬液至步骤6)的新收集管;9)后续可以对收集的上层细胞悬液以500g,在4摄氏度下离心10分钟,将细胞调整至所需浓度,用于后续实验。
40.本发明的方法通过操作中更换破乳剂,用新破乳剂替换已消耗的破乳剂,取代高速离心的方法促进相分离,减少高速离心对上层细胞的损伤,同时加快破乳速度,降低破乳剂对细胞的损伤。本发明的方法对于不同细胞数量下细胞回收率比较稳定。本发明的方法通过对上层细胞悬液多次洗涤,避免了高转速离心造成的相界面细胞沉淀、多次离心造成
的细胞损失以及剧烈操作造成的相界面液滴的出现,保证上层细胞的完全回收,稳定细胞回收率。本发明的方法操作过程中避免直接触及相界面,通过多次加入培养基多次洗脱、稀释,在回收细胞的同时,避免了吸取破乳剂影响后续实验。同时,本发明的方法采用短时间低转速离心,沉降吸附在管壁上的油相,避免了对后续实验的干扰。
41.与现有技术的方法相比,本发明的方法具有以下有益效果:1)通常,目标细胞数量和操作方法对细胞回收率影响较大,针对上述问题,本发明优化操作流程,改变试剂使用比例,减少操作损失,提高并稳定回收率;2)现有技术的方法采用700g转速离心的目的是实现相分离,但是会导致细胞沉积在界面,影响细胞回收,本发明的方法不使用大速率离心;3)为了提高细胞悬浮性,现有技术的方法在细胞培养液中加入了ficoll等试剂,此类试剂在改善细胞悬浮的同时,也造成了油水分离的困难。尤其在混匀液滴和破乳剂的过程中,会在相分离界面出现大量结构稳定的小液滴,显微镜检查显示,包裹于其中的细胞约占整体的30%,此类液滴结构难以破坏,造成最终细胞回收率低;4)pfo等破乳剂对pcr反应中酶活性有抑制作用,因此回收过程中减少破乳剂残留可以减少影响后续的实验。
42.以下通过实施例和对比实施例对本发明进行说明。
43.实施例一:回收液滴中人外周血单个核细胞。
44.实验材料:
45.1.人外周血单个核细胞;
46.2. 1h,1h,2h,2h-全氟-1-辛醇(英文缩写pfo,sigma-aldrich,货号370533-25g);
47.3.液滴生成油(bio-rad,货号1864006);
48.4. 1ml带针管注射器(江苏治宇);
49.5.dmem培养基(gibico,gibco,货号11965092;加入5%fbs,hyclone,货号sh30084.03);
50.6.pdms微流控液滴生成装置(申请号:pct/cn2019/108536,图4);
51.7. 1.5毫升ep管(eppendorf);
52.8.吖啶橙和碘化丙锭混合染料(ao/pi,countstar);
53.9. 20%(m/v)ficoll溶液:称取10克ficol-pm400(cytival,货号17030010)粉末溶于50毫升杜氏磷酸盐缓冲液(英文缩写dpbs,gibco,货号c14190500bt)溶液;
54.10.工作液(10毫升):6.3毫升dmem,3毫升20%ficoll,0.5毫升fbs,0.1毫升f68溶液(gibco,货号24040-032),0.1毫升青霉素-链霉素溶液(gibco,货号15140-122)。
55.实验步骤:
56.1.分别调整细胞悬液浓度至4
×
106/毫升和4
×
105/毫升;
57.2.向图2液滴生成装置的孔2加入50微升细胞悬液,孔3加入50微升工作液,孔1加入100微升液滴生成油,拉动注射器(从13毫升刻度处拉至20毫升刻度),生成包含细胞的液滴,并通过导管,将生成的液滴导入液滴收集管;
58.2.此时,由于细胞沉降,部分细胞沉积在pdms微流控液滴生成装置加样口内,此部分细胞的丢失将影响后续统计细胞回收率。因此,当孔2内液面下降至孔高度约四分之一时,分别向孔2和3加入50微升dmem培养基,使用移液器缓慢吹打孔2内液体3次,以重悬沉淀细胞;
59.3.完成液滴生成后,上述液滴收集管内有两层,上层是油包水液滴,下层为少量液
滴生成油;使用1ml注射器移除液滴收集管下层油;
60.4.向液滴收集管内缓慢滴加200微升pfo,静置10分钟;
61.5.此时样品收集管内有三层,下层是液滴生成油和pfo的油相混合物,中间是未破乳的液滴,上层是破乳释放的含细胞的水相,使用1ml注射器移除液滴收集管下层油相;
62.6.向样品收集管内缓慢滴加100微升pfo,静置5分钟;
63.7.将所述样品收集管在50g下离心10秒;
64.8.此时样品收集管内液体分为两层,下层是液滴生成油和pfo的油相混合物,上层是破乳释放的含细胞的水相,两层之间有清晰的界面,使用100微升量程移液器轻轻吹打上层细胞悬液,不触及界面;
65.9.在液滴生成时,液滴内共包裹200微升液体;转移150微升上层细胞悬液至新1.5毫升ep管,剩余约50微升细胞悬液;
66.10.向所述样品收集管中加入200微升dmem培养基;
67.11.轻轻吹打所述样品收集管的上层细胞悬液,转移200微升上层至1.5毫升ep管,此时有少量细胞残留,但是为了避免pfo污染细胞,影响后续实验(如rna提取,pcr反应等);
68.12.对所述ep管中的细胞悬液进行细胞计数;
69.13.取10微升上述细胞悬液与10微升ao/pi染液混合,并使用countstar计数仪(countstar rigel s3)计算细胞活率。
70.对比实施例一:
71.与实施例一的区别是:实验步骤4中静置30分钟。
72.对比实施例二
73.接实施例一实验步骤3;
74.4.向管内加入100微升dmem培养基和200微升pfo;
75.5.使用200微升量程移液器轻轻混匀溶液;
76.6.在4摄氏度下以700g离心10分钟;
77.7.此时分为两层,下层是液滴生成油和pfo的油相混合物,上层是破乳释放的含细胞的水相,两层之间有清晰地界面;在液滴生成时,液滴内共包裹200微升液体,加上对本实施例步骤4加入的培养基,此时上层液体共有300微升,使用200微升量程移液器轻轻混匀上层细胞悬液;
78.8.转移300微升上层细胞悬液至新ep管;
79.9.对所述上层细胞悬液进行细胞计数;
80.10.取10微升上述细胞悬液与10微升ao/pi染液混合,并使用countstar计数仪(countstar rigel s3)计算细胞活率。
81.实验结果:
82.1.实施例一的方法单次操作时间~20分钟,可以获得清晰地油水界面;对比实施例一静置30分钟后,依然可以观察到液滴聚集在油水相中间层,说明对比实施例一不适合大量液滴的破乳;对比实施例二用时15分钟,可以获得清晰地油水界面。由于液滴残留,对比实施例二无法进行后续细胞计数和细胞活率统计。
83.2.细胞死亡统计(ao/pi染色结果):初始投入细胞活率90.05%,实施例一回收细胞活率为89.77~94.76%,对比实施例二为89.9~92.37%,两种方法没有显著的统计学差
异(wilcox-ranked检验方法,p=0.7)。
84.3.细胞回收率统计:
85.1)投入20万细胞,实施例一的细胞回收率80~95%;对比实施例二的细胞回收率为60~70%(图3);
86.2)投入2万细胞,实施例一的细胞回收率80~90%;对比实施例二的细胞回收率为20~45%(图4)。
87.3)上述结果表明,本方法能够在操作中保持细胞活率,同时降低细胞损失。
88.实施例二:回收中华仓鼠卵巢细胞(cho)。
89.实验材料:
90.1.中华仓鼠卵巢细胞悬液,密度为7.7
×
105/毫升;
91.2.其他材料同实施例一。
92.实验步骤:重复实施例一实验步骤,将细胞更换为中华仓鼠卵巢细胞。
93.对比实施例三、四:重复对比实施例一、二的步骤,将细胞更换为中华仓鼠卵巢细胞。
94.实验结果:
95.1.实施例二的方法单次操作时间~20分钟;对比实施例三静置30分钟后,依然可以观察到白色液滴聚集在中间层;对比实施例四用时15分钟。
96.2.细胞回收率统计:投入4万个细胞,实施例二的方法的细胞回收率75~90%;对比实施例四的细胞回收率为~10%(图5)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1