癌细胞膜内嵌的人骨微流控芯片及其制备方法与在分离循环肿瘤细胞中的应用
1.本发明涉及生物医药技术领域,特别涉及一种癌细胞膜内嵌的人骨微流控芯片及其制备方法与在分离循环肿瘤细胞中的应用。
背景技术:
2.循环肿瘤细胞是从实体瘤脱落到外周血中的肿瘤细胞,循环肿瘤细胞会随着外周血扩散到其他位置,癌细胞的转移增殖是是肿瘤病人死亡的主要原因。循环肿瘤细胞携带着肿瘤病人的全部基因信息,可以作为液体活检的重要手段之一,这会为病人的诊断,个性化治疗和术后评估提供重要的依据。然而,我们知道每毫升血液中可能仅有几个ctc,因此迫切需要开发从血液中的分离出稀少的循环肿瘤细胞的技术。过去几十年来,许多专家根据ctc的物理化学性质开发了很多富集的方式。比如磁性分离,尺寸分离,微流控分离等。其中,微流控设备因为其易制造,成本低,且可以高效处理复杂的细胞流体等优点在ctc富集研究方面具有重要的优势。
3.抗体修饰的基底与几何图像结合的微流控设备被认为是一种很有前景的可以高效分离ctc的装置。其中,人骨芯片可以增强样本与抗体修饰的基底的接触,进而增强对ctc的分离效率。同时,为了更大增加两者的接触机会,修饰了抗体的纳米结构的基底的微流控被广泛作为研究。其中,纳米球,纳米柱,纳米纺丝等基底不仅仅增大了基底的粗糙度,而且增大基底与细胞的接触面积,从而达到了提高细胞捕获效率的目的。然而这种纳米基底在提高目的细胞的捕获效率的同时,也造成了大量背景细胞非特异性粘附在纳米基底。传统的整体释放细胞的方法往往是通过对整个基底的作用来达到富集ctc的目的。
4.然而上述这种方式将靶细胞和非特异性粘附的背景细胞一起释放,会导致富集的ctc的纯度低,不利于对ctc进行下游分析。也有从基底上回收单细胞的技术,比如激光切割,微操作,流式细胞分选等,然而,现有的单细胞分离的方法往往需要借助外来的设备,成本较高且细胞捕获效率不高。
5.因此,急需开发出一种同时保证细胞捕获效率和捕获纯度的方法来富集ctc的方法或者材料工具,成为亟待解决的技术问题。
技术实现要素:
6.本发明目的是提供一种癌细胞膜内嵌的人骨微流控芯片及其制备方法与在分离循环肿瘤细胞中的应用,该癌细胞膜内嵌的人骨微流控芯片可用体外对模拟血液样本和临床病人血液样本中微量ctcs进行特异性捕获和释放,捕获效率高且捕获纯度高。
7.在本发明的第一方面,提供了一种癌细胞膜内嵌的人骨微流控芯片的制备方法,所述方法包括:
8.将癌细胞株的细胞悬液进行培养,待所述癌细胞贴壁后洗涤并固定,获得癌细胞膜基底;
9.将所述癌细胞膜基底于bsa溶液和nhs
‑
s
‑
s
‑
biotin溶液进行孵育,后在链酶亲和素溶液中浸泡,后pbs洗涤,加入将生物素化的抗epcam抗体溶液进行孵育,获得epcam抗体修饰的癌细胞膜基底;
10.将所述epcam抗体修饰的癌细胞膜基底与人骨pdms整合,获得癌细胞膜内嵌的人骨微流控芯片,简称mhb
‑
chip。
11.进一步地,所述固定采用质量为分数为2~3%的戊二醛溶液。
12.进一步地,所述癌细胞株包括乳腺癌细胞株、前列腺癌细胞株、结肠癌细胞株、肝癌细胞株、胃癌细胞株和肺癌细胞株中的一种。
13.进一步地,所述bsa溶液为浓度为5~20mg/ml的牛血清白蛋白溶液;所述nhs
‑
s
‑
s
‑
biotin溶液为将活化脂二硫键连接生物素溶解于dmso中获得,所述nhs
‑
s
‑
s
‑
biotin溶液的浓度为0.05~0.5mg/ml。
14.进一步地,所述链霉亲和素溶液的浓度为40~60μg/ml;所述生物素化的抗epcam抗体溶液的浓度为10~30μg/ml。
15.在本发明的第二方面,提供了一种采用所述方法制备得到的癌细胞膜内嵌的人骨微流控芯片。
16.在本发明的第三方面,提供了所述的癌细胞膜内嵌的人骨微流控芯片在在分离循环肿瘤细胞中的应用。
17.在本发明的第四方面,提供了一种分离循环肿瘤细胞的方法,所述方法采用所述的癌细胞膜内嵌的人骨微流控芯片,包括:
18.从含有循环肿瘤细胞的血液样本中提取获得外周血单核细胞悬液;
19.将所述外周血单核细胞悬液通入到所述癌细胞膜内嵌的人骨微流控芯片,从而捕获多个循环肿瘤细胞;
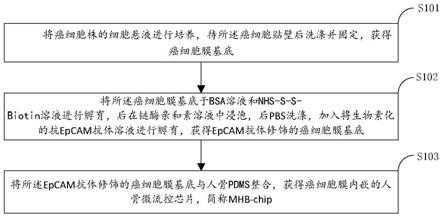
20.向所述捕获多个循环肿瘤细胞的芯片中通入dtt溶液以释放所述捕获的细胞,获得循环肿瘤细胞。
21.进一步地,所述外周血单核细胞悬液加入到所述癌细胞膜内嵌的人骨微流控芯片上的流速为0.25~0.5ml/h。
22.进一步地,所述dtt溶液的浓度为45~55um。
23.本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
24.1、本发明提供的癌细胞膜内嵌的人骨微流控芯片的制备方法,(1)采用癌细胞膜基底,可以通过bsa引入nhs
‑
s
‑
s
‑
biotin(活化脂二硫键连接生物素),接着经过化学反应成功的将epcam抗体修饰在基底;后人骨pdms整合获得,由于pdms层是人骨结构,可以增大细胞与基底的相互作用,以实现增强捕获的目的。(2)癌细胞膜基底可以通过简单的培养和固定制备,操作简单,成本低。(3)癌细胞膜的表面是纳米结构,可以增强与靶细胞的相互作用,可以实现更牢固更高效地捕获循环肿瘤细胞;(4)癌细胞膜表面是电负性的,可以作为一种天然的防污层以阻止背景细胞的非特异性粘附,达到提高富集纯度的目的;
25.2、采用本发明的癌细胞膜内嵌的人骨微流控芯片在分离循环肿瘤细胞的应用中,使用生物相容性的dtt断裂s
‑
s键以达到释放细胞的目的,同时保证了释放细胞的活性。
26.3、本发明提供的一种高效高特异性识别捕获循环肿瘤细胞的mhb
‑
chip,可用体外对模拟血液样本和临床病人血液样本中微量ctcs进行特异性捕获和释放,以高效和高纯度
的富集循环肿瘤细胞;从而有望在癌症转移的预警和预防领域发挥重要作用。
附图说明
27.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
28.图1为本发明的癌细胞膜内嵌的人骨微流控芯片在分离循环肿瘤细胞的原理图;
29.图2为实施例1的mhb
‑
chip的细胞膜照片;其中,图2(a)为mcf
‑
7细胞膜底物的明场图像其中比例尺=1cm;图2(b)为mcf
‑
7细胞基质的sem图像,其中比例尺=100μm;图2(c)为放大结构的sem图像,其中比例尺=5μm;
30.图3为抗白细胞粘附结果;其中,图3(a)为平板玻璃上粘附的白细胞荧光显微镜图像,比例尺=100μm;图3(b)为mcf
‑
7细胞基底粘附的白细胞荧光显微镜图像,比例尺=100μm;图3(c)为白细胞对平板玻璃和mcf
‑
7细胞基底的粘附率;
31.图4为mhb
‑
chip和hb
‑
chip上捕获的mcf
‑
7细胞的sem图像;其中,图4(a)为mhb
‑
chip上mcf
‑
7细胞的sem图像,比例尺=10μm;图4(b)为hb
‑
chip上mcf
‑
7细胞的sem图像,比例尺=10μm;
32.图5为不同流速下mhb
‑
chip的捕集效率;
33.图6为mhb
‑
chip和hb
‑
chip的捕获效率研究;
34.图7为mhb
‑
chip的细胞释放性能研究;图7(a)
‑
图7(b)在mhb
‑
chip上捕获的mcf
‑
7细胞释放前后的荧光图像,比例尺=100μm;图7(c)为mcf
‑
7细胞释放活
‑
死细胞荧光图,比例尺=100μm;
35.图8为本发明提供的一种癌细胞膜内嵌的人骨微流控芯片的制备方法的流程图;
36.图9为本发明提供的一种分离循环肿瘤细胞的方法的流程图。
具体实施方式
37.下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
38.在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
39.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得。
40.本发明实施例提供一种癌细胞膜内嵌的人骨微流控芯片,总体思路如下:
41.根据本发明一种典型的实施方式,提供了一种癌细胞膜内嵌的人骨微流控芯片的制备方法,如图8所示,所述方法包括:
42.步骤s101、将癌细胞株的细胞悬液进行培养,待所述癌细胞贴壁后洗涤并固定,获得癌细胞膜基底;
43.该实施方式中,所述癌细胞株应选取那些研究集中、术后转移和复发程度中高的癌细胞株,可采用但不局限于下列癌细胞株:乳腺癌细胞株、前列腺癌细胞株、结肠癌细胞株、肝癌细胞株、胃癌细胞株、肺癌细胞株。优先推荐选用乳腺癌细胞系(即mcf
‑
7细胞)作为体外循环肿瘤细胞模型。因乳腺癌细胞系(即mcf
‑
7细胞)的转移和复发程度适中,风险性较小;且生物标记物epcam在该细胞表面稳定性高度表达,故选取乳腺癌细胞系(即mcf
‑
7细胞)为体外ctcs模型,将会有助于本研究的顺利开展。
44.作为一种可选的实施方式,所述固定采用质量为分数为2~3%的戊二醛溶液。
45.作为一种可选的实施方式,所述bsa溶液为浓度为5~20mg/ml的牛血清白蛋白溶液;所述bsa溶液为将牛血清白蛋白溶解于pbs(ph值为7.2
‑
7.4)溶液中获得。
46.步骤s102、将所述癌细胞膜基底于bsa溶液和nhs
‑
s
‑
s
‑
biotin溶液进行孵育,后在链酶亲和素溶液中浸泡,后pbs洗涤,加入将生物素化的抗epcam抗体溶液进行孵育,获得epcam抗体修饰的癌细胞膜基底;
47.作为一种可选的实施方式,所述bsa溶液为浓度为5~20mg/ml的牛血清白蛋白溶液;所述bsa溶液为将牛血清白蛋白溶解于pbs(ph值为7.2
‑
7.4)溶液中获得。优选地,bsa溶液的浓度为10mg/ml。
48.所述nhs
‑
s
‑
s
‑
biotin溶液为将活化脂二硫键连接生物素溶解于dmso中获得,所述nhs
‑
s
‑
s
‑
biotin溶液的浓度为0.05~0.5mg/ml。优选地,nhs
‑
s
‑
s
‑
biotin溶液的浓度为0.1mg/ml。
49.所述范围的浓度有利于成功得获得epcam抗体修饰的癌细胞膜基底。
50.作为一种可选的实施方式,所述链霉亲和素溶液的浓度为40~60μg/ml(优选为50μg/ml);所述浸泡的条件为:2~6℃下浸泡6~15h;所述生物素化的抗epcam抗体溶液的浓度为10~30μg/ml(优选为20μg/ml);该范围有利于后续捕获循环肿瘤细胞;
51.步骤s103、将所述epcam抗体修饰的癌细胞膜基底与人骨pdms整合,获得癌细胞膜内嵌的人骨微流控芯片,简称mhb
‑
chip。
52.所述步骤s103中,具体可采用夹具将所述epcam抗体修饰的癌细胞膜基底与人骨pdms整合。
53.所述人骨pdms可采用现有技术常规的方法获得,具体为:
54.首先将第一层负胶滴在硅片上,之后通过匀胶机以2000rpm/min的速度将其旋涂均匀,之后将硅片先后置于65度和95度的烘台上烘烤5min,待硅片温度降低后,将其放置在光刻机上进行紫外曝光,再将其放在烘台上烘烤2h以固化表面光刻胶。此时,第一层的光刻胶已经完成。待光刻胶恢复室温后,将第二层光刻胶滴加在硅片上,之后通过匀胶机以2000rpm/min的速度将其旋涂均匀,之后将硅片先后置于65度和95度的烘台上烘烤5min,待硅片冷却室温后,将其与另外一种图案的研磨版对准进行紫外曝光,在将硅片置于烘台加热固化。然后将硅片放置显影液中处理5min,之后在用丙酮和显影液冲洗,最后用氮气吹干。把吹干的硅片放于烘台上烘烤,165度,30min,最终得到人骨蛇形芯片的模板。
55.将实验室a胶和b胶以10:1的质量比混合均匀,倒在具有图案的硅片上,静置过夜,气泡消失后,放置烘台,80度烘烤2h。将固化好的pdms层轻轻揭下,然后切割,打孔,得到具有图案的pdms层以待后续使用。
56.综上可知,本发明提供的癌细胞膜内嵌的人骨微流控芯片的制备方法,(1)采用癌
细胞膜基底,可以通过bsa引入nhs
‑
s
‑
s
‑
biotin(活化脂二硫键连接生物素),接着经过化学反应成功的将epcam抗体修饰在基底;后人骨pdms整合获得,由于pdms层是人骨结构,可以增大细胞与基底的相互作用,以实现增强捕获的目的。(2)癌细胞膜基底可以通过简单的培养和固定制备,操作简单,成本低。(3)癌细胞膜的表面是纳米结构,可以增强与靶细胞的相互作用,可以实现更牢固更高效地捕获循环肿瘤细胞;(4)癌细胞膜表面是电负性的,可以作为一种天然的防污层以阻止背景细胞的非特异性粘附,达到提高富集纯度的目的。
57.根据本发明另一种典型的实施方式,提供了用所述方法制备得到的癌细胞膜内嵌的人骨微流控芯片。
58.本发明的癌细胞膜内嵌的人骨微流控芯片mhb
‑
chip由两个功能部件组成,包括人骨聚二甲基硅氧烷(pdms)层和epcam抗体修饰的癌细胞膜基底。
59.本发明提供的一种高效高特异性识别捕获循环肿瘤细胞的mhb
‑
chip,可用体外对模拟血液样本和临床病人血液样本中微量ctcs进行特异性捕获和释放,以高效和高纯度的富集循环肿瘤细胞;从而有望在癌症转移的预警和预防领域发挥重要作用。
60.根据本发明另一种典型的实施方式,提供了所述的癌细胞膜内嵌的人骨微流控芯片在分离循环肿瘤细胞中的应用。
61.所述的癌细胞膜内嵌的人骨微流控芯片在分离循环肿瘤细胞时,先采用所述癌细胞膜内嵌的人骨微流控芯片进行捕获,后使用生物相容性的dtt断裂s
‑
s键以达到释放细胞的目的,同时保证了释放细胞的活性。综上所述,该微流控设备可以高效和高纯度的富集循环肿瘤细胞,显示了这种安全高效的方式具有一定的临床应用潜力。
62.本发明的微流控芯片对临床病人血液样本中ctcs的捕获研究手段,可采用但不局限于本方法:获取肿瘤病人的血液样本,经percoll细胞分离液获取淋巴细胞层后,将其通入在mhb
‑
chip进行捕获实验。优先推荐使用本发明中通过获取肿瘤医院的癌症病人血液样本,对捕获到的细胞进行三荧光染色之后,分析其捕获情况。
63.根据本发明另一种典型的实施方式,提供了一种分离循环肿瘤细胞的方法,所述方法采用所述的癌细胞膜内嵌的人骨微流控芯片,如图9所示,包括:
64.步骤s201、从含有循环肿瘤细胞的血液样本中提取获得外周血单核细胞悬液;
65.本发明的含有循环肿瘤细胞的血液样本取自术后转移和复发程度高的晚期癌症病人,可选取并不局限于下列癌症病人:结肠癌病人、乳腺癌病人、肝癌病人、前列腺癌病人、胃癌病人、肺癌病人。
66.所述提取方法采用现有技术常规方法提取,具体为通过淋巴细胞分离液从血液样本中提取并洗涤。
67.步骤s202、将所述外周血单核细胞悬液通入到所述癌细胞膜内嵌的人骨微流控芯片,获得捕获多个循环肿瘤细胞的芯片;
68.优选地,所述外周血单核细胞悬液加入到所述癌细胞膜内嵌的人骨微流控芯片上的流速为0.25~0.5ml/h。当流量为0.25~0.5ml/h时,捕集效率可达到80%以上。
69.步骤s203、向所述捕获多个循环肿瘤细胞的芯片中通入dtt溶液以释放所述捕获的细胞,获得循环肿瘤细胞。
70.该实施方式中使用生物相容性的dtt断裂s
‑
s键以达到释放细胞的目的,同时保证了释放细胞的活性。
71.作为一种优选的实施方式,所述dtt溶液的浓度为45~55um。dtt溶液的浓度若过大导致细胞活性降低,若过小导致细胞释放效率低。
72.下面将结合实施例及实验数据对本技术的一种癌细胞膜内嵌的人骨微流控芯片及其制备方法与在分离循环肿瘤细胞中的应用进行详细说明。
73.实施例1癌细胞膜内嵌的人骨微流控芯片及其制备方法
74.1、癌细胞膜内嵌的人骨微流控芯片mhb
‑
chip由两个功能部件组成,包括一个表面具有人骨图案的聚二甲基硅氧烷(pdms)层和一个透明的mcf
‑
7细胞膜基底(ms)。
75.2、癌细胞膜内嵌的人骨微流控芯片的制备方法
76.(1)为了制备ms,我们将1
×
106mcf
‑
7细胞悬液加入培养皿(将干净的玻璃放在培养皿中)中进行培养。当细胞在玻璃上完全生长时,去除培养基并用pbs洗涤。接下来,用2.5%戊二醛固定ms上的细胞,从而保持mcf
‑
7细胞膜的纳米结构。;
77.(2)将10mg/ml的牛血清白蛋白溶液引入mcf
‑
7细胞膜。在室温下用nhs
‑
s
‑
s
‑
biotin(0.1mg/ml溶解于dmso)溶液处理mcf
‑
7细胞膜2h,接着将所述癌细胞膜基底使用50μg/ml链霉亲和素溶液与ms 4℃孵育过夜。在进行细胞捕获实验之前,将pbs中20μg/ml生物素化的抗epcam抗体溶液加入ms中,室温2h,pbs洗涤3次,获得epcam抗体修饰的癌细胞膜基底;
78.(3)根据现有方法制备pdms层,pdms层上面有一个人形图案,获得人字骨(hb)pdms。通过夹具将所述人字骨(hb)pdms和epcam抗体修饰的癌细胞膜基底ms整合形成mhb
‑
chip。
79.本发明实施例的mhb
‑
chip的细胞膜照片如图2所示,由图2可知,图2(a)显示基底表面长满了mcf
‑
7细胞,图2(b)和图2(c)显示制备的基底表面是一种纳米结构。实施例2癌细胞膜内嵌的人骨微流控芯片及其制备方法
80.1、癌细胞膜内嵌的人骨微流控芯片mhb
‑
chip由两个功能部件组成,包括一个表面具有人骨图案的聚二甲基硅氧烷(pdms)层和一个透明的mcf
‑
7细胞膜基底(ms)。
81.2、癌细胞膜内嵌的人骨微流控芯片的制备方法
82.(1)为了制备ms,我们将1
×
106mcf
‑
7细胞悬液加入培养皿(将干净的玻璃放在培养皿中)中进行培养。当细胞在玻璃上完全生长时,去除培养基并用pbs洗涤。接下来,用2.5%戊二醛固定ms上的细胞,从而保持mcf
‑
7细胞膜的纳米结构,获得癌细胞膜基底;
83.(2)将5mg/ml的牛血清白蛋白溶液浸泡mcf
‑
7细胞膜,接着室温下用nhs
‑
s
‑
s
‑
biotin(0.05mg/ml溶解于dmso)溶液处理mcf
‑
7细胞膜2h,接着将所述癌细胞膜基底使用40μg/ml链霉亲和素溶液与ms 4℃孵育过夜。在进行细胞捕获实验之前,将pbs中10μg/ml生物素化的抗epcam抗体溶液加入ms中,室温2h,pbs洗涤3次,获得epcam抗体修饰的癌细胞膜基底;
84.(3)根据现有方法制备pdms层,pdms层上面有一个人形图案,获得人字骨(hb)pdms。通过夹具将所述人字骨(hb)pdms和epcam抗体修饰的癌细胞膜基底ms整合形成mhb
‑
chip。本发明实施例的mhb
‑
chip的捕获效率大约为80%,捕获纯度基本同实施例1。
85.实施例3癌细胞膜内嵌的人骨微流控芯片及其制备方法
86.1、癌细胞膜内嵌的人骨微流控芯片mhb
‑
chip由两个功能部件组成,包括一个表面具有人骨图案的聚二甲基硅氧烷(pdms)层和一个透明的mcf
‑
7细胞膜基底(ms)。
87.2、癌细胞膜内嵌的人骨微流控芯片的制备方法
88.(1)为了制备ms,我们将1
×
106mcf
‑
7细胞悬液加入培养皿(将干净的玻璃放在培养皿中)中进行培养。当细胞在玻璃上完全生长时,去除培养基并用pbs洗涤,获得癌细胞膜基底;
89.(2)将20mg/ml的牛血清白蛋白溶液浸泡mcf
‑
7细胞膜,接着室温下用nhs
‑
s
‑
s
‑
biotin(0.05mg/ml溶解于dmso)溶液处理mcf
‑
7细胞膜2h,接着将所述癌细胞膜基底使用60μg/ml链霉亲和素溶液与ms 4℃孵育过夜。在进行细胞捕获实验之前,将pbs中30μg/ml生物素化的抗epcam抗体溶液加入ms中,室温2h,pbs洗涤3次,获得epcam抗体修饰的癌细胞膜基底;
90.(3)根据现有方法制备pdms层,pdms层上面有一个人形图案,获得人字骨(hb)pdms。通过夹具将所述人字骨(hb)pdms和epcam抗体修饰的癌细胞膜基底ms整合形成mhb
‑
chip。本发明实施例的mhb
‑
chip的捕获效率大约为80%,捕获纯度基本同实施例1。
91.对比例1
92.该对比例为hb
‑
chip,即现有技术中的人字骨(hb)pdms。
93.应用例1采用实施例的mhb
‑
chip芯片分离循环肿瘤细胞的方法
94.1、mhb
‑
chip捕获mcf
‑
7细胞
95.从含有循环肿瘤细胞的血液样本中提取获得外周血单核细胞悬液;将细胞悬液通入到实施例1所述癌细胞膜内嵌的人骨微流控芯片,获得捕获多个循环肿瘤细胞的芯片;
96.为了优化mhb
‑
chip芯片的捕获性能,我们首先选择epcam阳性的mcf
‑
7细胞作为样本,研究不同流速(0.25ml/h,0.5ml/h,1ml/h,2ml/h,4ml/h)下的捕获效率。将1ml mcf
‑
7细胞样品以不同流速(0.25ml/h,0.5ml/h,1ml/h,2ml/h,4ml/h)引入芯片。然后用pbs轻轻冲洗mhb
‑
chip。在荧光显微镜下观察和计数捕获的细胞。
97.结果如图5所示,表明随着流量的增加,捕集效率逐渐降低,当流量为0.25~0.5ml/h时,捕集效率可达到80%以上。因此,我们后续实验选择0.25ml/h作为后续实验的优化条件。
98.2、循环肿瘤细胞的释放
99.为了释放捕获的ctcs,使用dtt对捕获的细胞进行释放实验(50um,30min),pbs冲洗后,从设备的出口收集芯片细胞。使用荧光显微镜对微流控装置上残留的细胞进行成像和计数。在释放过程后使用fda/pi染色来鉴定细胞活性。
100.结果如图7所示,由图7可知,图7(a)图是捕获的细胞图片,图7(b)是经过dtt处理的细胞图片,我们可以看到图7(b)细胞数量明显减少。接着,我们对释放下的细胞镜像活死性鉴定,利用fda/pi溶液进行染色。结果表明可以成功释放细胞,同时保证了释放细胞的活性。
101.实验例1、比较实施例的ms和对比例1的gs的抗粘附能力
102.准备实施例1中mhb
‑
chip的基底(即实施例1中的epcam抗体修饰的癌细胞膜基底,简称ms);和对比例1中hb
‑
chip的基底(gs)。
103.通过淋巴细胞分离液从血液中提取pbmcs,用pbs洗涤三次。然后,我们在室温下用fda(10μg/ml)对收集的细胞染色10分钟,获得染色的细胞悬液;
104.将1
×
105fda染色的白细胞悬液分别加入到实施例1的ms中和对比例1中的gs中室
温孵育1h,并用pbs轻轻冲洗。荧光显微镜下(ix
‑
81,olympus,日本)观察ms和gs上的白细胞粘附。
105.结果如图3(a)和图3(b)所示,粘附gs的白细胞数明显多于粘附ms的白细胞数,粘附gs的白细胞数约为7%,粘附ms的白细胞数约为0.5%(图3(c))。说明本发明的ms具有良好的抗白细胞粘附作用。
106.实验例2、比较实施例1和对比例1的芯片的捕获效率和捕获纯度
107.1、将浓度为105个/ml的fda染色的mcf
‑
7细胞以0.25ml/h的速度通过实施例1的mhb
‑
chip和对比例1的hb
‑
chip。然后用pbs轻轻冲洗mhb
‑
chip和hb
‑
chip。荧光显微镜下观察并计数。
108.由图6可知,本发明实施例的mhb
‑
chip芯片的mcf
‑
7细胞捕获效率约为80%,对比例1的hb
‑
chip芯片的mcf
‑
7细胞捕获效率约为60%。mhb
‑
chip芯片的捕获效率明显高于hb
‑
chip,这可能是由于mhb
‑
chip芯片底部为纳米结构,表明本发明实施例的mhb
‑
chip芯片增强了ms与mcf
‑
7细胞之间的相互作用,可以实现更牢固更高效地捕获循环肿瘤细胞。
109.2、所述计数完成后,用2.5%戊二醛固定。样品经15%、30%、50%、70%、80%、90%、100%酒精浓度脱水,超临界二氧化碳干燥。通过扫描电镜观察mhb
‑
chip芯片和hb
‑
chip芯片捕获的细胞形态。
110.结果如图4所示,可知在mhb
‑
chip上捕获的mcf
‑
7细胞表面光滑(图4(a)),而在hb
‑
chip上捕获的mcf
‑
7细胞有许多伪足(图4(b)),这可能是由于mhb
‑
chip的ms是电负性的,表明本发明的mhb
‑
chip可以作为一种天然的防污层以阻止背景细胞的非特异性粘附,达到提高富集纯度的目的。
111.最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
112.尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
113.显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1