一种铁酸铜尖晶石材料及其制备方法与应用
1.本发明涉及污水处理技术领域,尤其涉及一种铁酸铜尖晶石材料及其制备方法与应用。
背景技术:
2.近年来,随着国家经济的高速发展,人工合成的有机、无机污染物大量排入水体中,造成了严重的水质污染。其中,持久性难降解有机污染物的污染尤为严重且难以解决,成为了环境治理修复的一大难题。这些有机污染物在环境中停留时间长,不易被微生物降解,并且具有生物富集性,会随着食物链富集,最终危害人体健康。因此,在当前情况下,迫切需要更有效的技术来去除废水中的难降解有机污染物。
3.传统的高级氧化技术是以产生
·
oh为活性物质,将难降解有机物氧化降解为低毒或无毒的小分子物质的一种化学氧化技术。目前应用高级氧化技术处理偶氮染料废水的方法主要有非均相fenton法及类fenton法,催化湿式氧化法,光催化氧化法等。这些高级氧化技术成本较高,有些反应条件甚至较为苛刻(高温高压),因而限制了其应用。
4.基于硫酸根自由基(so4‑
·
)的高级氧化技术是近年国内外发展起来的一类新型技术,也已成为当前比较比较热门的废水处理技术之一。研究发现,so4‑
·
氧化能力强,能够在较宽的ph(4.0~9.0)范围保持其活性,有效稳定地与有机污染物接触并发生反应,可快速降解大多数有机污染物,将其矿化为co2和无机酸。
5.一般采用活化过硫酸盐产生so4‑
·
。过硫酸盐包括过一硫酸盐(pms)和过二硫酸盐(pds)。与pds相比,pms更容易被活化,对底物的降解效率更高,因此,本发明选择pms进行研究。活化过pms的常规方法通常有热、紫外、超声、碱、过渡金属以及金属氧化物等。热、紫外以及超声都属于能量活化方式,需要投入很大的能量,在实际应用中增大了水处理的成本。过渡金属催化过硫酸盐的均相反应在去除有机污染物方面表现出很高的效率,应用也很广泛。然而,过渡金属催化pms的均相反应,容易造成重金属离子的二次污染。因此非均相催化体系引起了广泛关注。
6.尖晶石铁氧体材料是一种具有磁性的铁氧体材料,高效稳定并且容易分离。铁酸铜(cufe2o4)作为尖晶石铁氧体的一种,材料来源广泛,毒性小,并非潜在的致癌物质,因此,认为铁酸铜活化过硫酸盐在处理水中难降解有机污染物方面具有良好的应用前景。然而,目前关于铁酸铜过硫酸盐体系的研究中,还存在铁酸铜投加量大,金属铜离子溶出及材料重复利用性不好等问题。
技术实现要素:
7.本发明的目的在于,针对现有技术的上述不足,提出一种铁酸铜尖晶石材料及其制备方法与应用。
8.为实现上述目的,本发明采用如下的技术方案:
9.本发明提供的一种铁酸铜尖晶石材料的制备方法,包括以下步骤:
10.步骤s1,将硝酸铜和硝酸铁溶解后混合均匀,得混合盐溶液;向混合盐溶液中滴加柠檬酸,加热搅拌,蒸发水分,得到铁酸铜溶胶态混合液;
11.步骤s2,将步骤s1得到的铁酸铜溶胶态混合液进行干燥,研磨,得到铁酸铜固体粉末;
12.步骤s3,将步骤s2得到的铁酸铜固体粉末放入高温炉中煅烧,然后冷却至室温,经乙醇和水洗涤、干燥后,得到铁酸铜尖晶石材料。
13.进一步的,步骤s1中,硝酸铜、硝酸铁和柠檬酸的摩尔比为1:2:(3~4);加热搅拌的温度50~90℃,搅拌时间2~6h。
14.进一步的,步骤s2中,干燥温度为100~150℃,干燥时间为10~16h。
15.进一步的,步骤s3中,煅烧的升温程序为室温~200℃以1℃/min升温,200℃保温30min~120min,然后以2℃/min升温至300℃~600℃,在600℃下保温180min~360min;干燥的温度为60~80℃,干燥时间10~16h。
16.本发明还提供了一种铁酸铜尖晶石材料,采用上述制备方法得到的。
17.本发明还提供了上述铁酸铜尖晶石材料在废水处理中的应用,将所述铁酸铜尖晶石材料、过一硫酸盐和碳酸氢盐混合联用,用于处理废水中的有机污染物。
18.进一步的,所述有机污染物的浓度为0.05~0.3mm,所述铁酸铜尖晶石材料在废水中的投加量为0.21~1.25mm,所述过一硫酸盐在废水中的投加量为0.32~1.63mm,所述碳酸氢盐在废水中的投加量为5~10mm。
19.进一步的,所述铁酸铜尖晶石材料、过一硫酸盐和碳酸氢盐的质量比为1:2:0.6~1:1.7:2。
20.进一步的,所述有机污染物包括橙黄ii、罗丹明b、活性艳蓝、甲基橙和苯酚中的任一种。
21.本发明提供的技术方案带来的有益效果是:
22.(1)本发明提供的铁酸铜尖晶石材料是采用改进溶胶凝胶法制备得到的,通过改变柠檬酸与金属离子混合方式,控制了络合过程的均匀性,有助于材料颗粒尺寸的均匀,通过改进煅烧程序,材料在200℃保温一定时间,避免了煅烧过程中材料膨胀,使所得材料均匀性好,晶体结构稳定,所得的铁酸铜尖晶石材料结晶良好,颗粒均匀,颗粒尺寸为10~20nm。
23.(2)本发明的铁酸铜尖晶石材料应用于废水中有机污染物的处理,是以铁酸铜尖晶石材料作为催化剂,过硫酸盐吸附在铁酸铜尖晶石材料表面之后,其金属位点活化过硫酸盐产生表面活性自由基,包括硫酸根自由基和羟基自由基,这些自由基可高效氧化难降解有机物,将其分解为小分子物质,从而达到对目标污染物的降解和去除。
24.(3)而且本发明的铁酸铜尖晶石材料与碳酸氢盐联合活化过硫酸盐,可以快速持续地产生硫酸盐自由基和羟基自由基,结合分子氧化作用,能够快速分解多种难降解有机物,降解效率高达95%以上,足以应用于水污染治理与修复领域,这是因为碳酸氢盐的加入能构引发过氧单碳酸根(hco4‑
)的产生,hco4‑
可与cu(ⅱ)和fe(ⅱ)反应,分别产生cu(ⅲ)和fe(ⅲ),维持cu(ⅱ)/cu(i)循环,保证活性自由基快速且持续的生成。
25.(4)与现有技术相比,本发明提供的制备方法工艺简单、生产成本低,适合大规模生产;应用技术成本小、无污染、降解效率高,且该材料具有强磁性,易分离回收,可多次循
环利用,在难降解有机污染物污染水体的修复领域中具有广阔的经济效益和应用前景。
附图说明
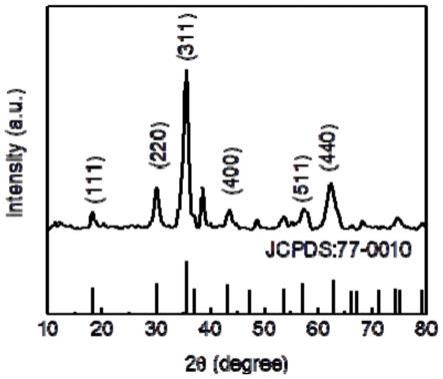
26.图1为实施例1制备的铁酸铜尖晶石材料的x射线粉末衍射图谱;
27.图2为实施例1制备的铁酸铜尖晶石材料的sem图;
28.图3为单独过一硫酸盐、单独铁酸铜尖晶石材料、过一硫酸盐/铁酸铜尖晶石材料和铁酸铜尖晶石材料/过一硫酸盐/碳酸氢盐体系去除橙黄ii的降解效果对比图;
29.图4为铁酸铜尖晶石材料/过一硫酸盐/碳酸氢盐体系去除不同有机污染物的降解效果对比图。
具体实施方式
30.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图和实施例对本发明实施方式作进一步地描述。
31.实施例1
32.制备铁酸铜尖晶石材料:
33.根据化学式cufe2o4中各元素的化学计量比,分别称取原料:fe(no3)3·
9h2o:4.04克,cu(no3)2·
3h2o:1.28克,柠檬酸:3.15克。
34.先将cu(no3)2·
3h2o和fe(no3)3·
9h2o溶于装有100ml超纯水的烧瓶中,在60℃水浴中搅拌;柠檬酸粉末溶解于100ml纯水中,以分液漏斗滴加至盐溶液中,混合溶液继续在50℃~60℃水浴中搅拌2h~4h;之后调整水浴锅温度至80~90℃,继续搅拌,蒸发水分;将得到的透明溶胶转入烘箱中,100℃~105℃干燥10~16h得到凝胶;将凝胶转入马弗炉中,煅烧一定时间(室温~200℃以1℃/min升温,在200℃保温30min~120min,然后以2℃/min升温至300~600℃保温180min~360min),然后冷至室温;取出样品研磨后用纯水漂洗多次至溶液呈中性,再转入烘箱中,60℃~80℃干燥数小时得到粉末状样品。
35.如图1所示,为实施例1制备的铁酸铜尖晶石材料的x射线粉末衍射图谱,结果显示无其它杂峰出现,所制得的铁酸铜尖晶石材料是纯物相。
36.如图2所示,为实施例1制备的铁酸铜尖晶石材料的sem(扫描电子显微镜)图;可以看出制备的铁酸铜尖晶石材料结晶良好,颗粒均匀,颗粒尺寸为10~20nm。
37.实施例2
38.将实施例1制备得到的铁酸铜尖晶石材料应用于去除橙黄ii(ao7)的研究。
39.试验1:取浓度为0.29mm的橙黄ii溶液100ml,按0.63mm的量加入铁酸铜尖晶石材料,室温下反应30min。
40.试验2:取浓度为0.29mm的橙黄ii溶液100ml,按0.98mm的量加入过一硫酸盐,室温下反应30min。
41.试验3:取浓度为0.29mm的橙黄ii溶液100ml,按0.63mm的量加入铁酸铜尖晶石材料,按0.98mm的量加入过一硫酸盐,室温下反应30min。
42.试验4:取浓度为0.29mm的橙黄ii溶液100ml,按0.63mm的量加入铁酸铜尖晶石材料,按0.98mm的量加入过一硫酸盐,加入2mm的碳酸氢盐,室温下反应30min。
43.如图3所示,为试验1
‑
4的去除有机污染物橙黄ii的降解效果对比图,可看到铁酸
铜尖晶石材料/过一硫酸盐/碳酸氢盐(cufe2o4/pms/hco3‑
)体系可大幅提高过一硫酸盐降解橙黄ⅱ的效率。反应30min后,单独过一硫酸盐、单独铁酸铜尖晶石材料、过一硫酸盐/铁酸铜尖晶石材料,铁酸铜尖晶石材料/过一硫酸盐/碳酸氢盐联合的条件下对橙黄ⅱ的去除效果依次为3.5%、6.5%、16.8%、95.0%。
44.实施例3
45.将过一硫酸盐/碳酸氢盐/铁酸铜尖晶石材料体系应用于处理不同的有机污染物的研究。
46.试验5:取浓度为0.2mm的橙黄ii溶液100ml,按0.15g/l的量加入铁酸铜尖晶石材料,按0.3g/l的量加入过一硫酸盐,加入2mm的碳酸氢盐,室温下反应30min。
47.试验6:取浓度为0.2mm的罗丹明b溶液100ml,按0.15g/l的量加入铁酸铜尖晶石材料,按0.3g/l的量加入过一硫酸盐,加入2mm的碳酸氢盐,室温下反应30min。
48.试验7:取浓度为0.2mm的活性艳蓝溶液100ml,按0.15g/l的量加入铁酸铜尖晶石材料,按0.3g/l的量加入过一硫酸盐,加入2mm的碳酸氢盐,室温下反应30min。
49.试验8:取浓度为0.2mm的甲基橙溶液100ml,按0.15g/l的量加入铁酸铜尖晶石材料,按0.3g/l的量加入过一硫酸盐,加入2mm的碳酸氢盐,室温下反应30min。
50.试验9:取浓度为0.2mm的苯酚溶液100ml,按0.15g/l的量加入铁酸铜尖晶石材料,按0.3g/l的量加入过一硫酸盐,加入2mm的碳酸氢盐,室温下反应30min。
51.如图4所示,为试验5
‑
9不同污染物在铁酸铜尖晶石材料/过一硫酸盐/碳酸氢盐(cufe2o4/pms/hco3‑
)体系下的去除能力比较图,可看到该体系对污染物都有良好的降解效果。反应30min后,橙黄ⅱ、罗丹明b、活性艳蓝、甲基橙及苯酚都达到了95.0%以上的降解率,特别是对于甲基橙,反应7min时几乎降解完全。由此可知,铁酸铜尖晶石材料/过一硫酸盐/碳酸氢盐体系对污染物选择性低,具有很好的应用及发展前景。
52.在不冲突的情况下,本文中上述实施例及实施例中的特征可以相互结合。
53.以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1