本发明属于生物材料,具体涉及一种基于phi29dna聚合酶滚环复制长链碱基修饰核酸活性制备水凝胶的方法。
背景技术:
1、phi29dna聚合酶是来源于枯草芽孢杆菌噬菌体phi29的嗜温(30℃)dna聚合酶,属于b型dna聚合酶[1]。2001年phi29dna聚合酶首次被用于等温多重引物滚环扩增[2],利用phi29dna聚合酶特殊的链置换和连续合成特性,以环状dna为模板,以短的与部分环状模板互补的dna为引物,在phi29dna聚合酶的催化下,以dntps为原料合成单链dna。该单链dna产物包含多个串联重复序列的核酸片段,无需常规pcr所需的热循环步骤即可形成。等温多重引物滚环扩增方法具有高速、有效的特点,短时间内即可实现1万倍的扩增,可连续合成长达70kb的dna片段。同时,phi29dna聚合酶具有3’到5’外切酶校正功能,因而错误率比标准的taq聚合酶低1000倍[3]。扩增产物可用于snp基因分型、dna测序等。使用phi29dna聚合酶的多引物滚环扩增还具有能够产生双链产物的优点,使其应用于后续限制性内切酶消化或其他基因克隆、核酸标记和靶标检测的相关方法成为可能。
2、已有研究探索了phi29dna聚合酶识别部分糖修饰核酸的活性。己糖核酸(hna)和阿拉伯糖核酸(fana)在该聚合酶的活性位点中没有明显的空间位阻,核酸外切酶缺失的phi29dna聚合酶表现出了对此类xna的合成活性,并可能实现滚环扩增,合成含有这类xna的长链核酸分子[4]。近年来,phi29dna聚合酶凭借这些独特的性质,被广泛应用于多种dna功能高分子材料的制备中。其中,dna水凝胶是一种交联亲水性聚合物,是以dna为结构基元构筑的三维高分子网络,近年来成为国际热点研究方向。dna水凝胶既利用了水凝胶的骨架结构,也保留了dna的生物功能,实现了水凝胶材料结构与功能的完美融合,在生物传感器制备、药物递送、细胞培养、蛋白质体外合成、智能器件开发、环境保护等领域表现出广泛的应用前景。此外,随着精准医疗和分子诊断技术的出现,phi29dna聚合酶将在核酸测序和病毒检测中具有重要的应用价值。dna是生命系统的核心遗传物质,引导生物发育和生命机能运作。从材料化学角度,dna是一种天然的生物高分子,具有合成高分子无法比拟的特点。例如:碱基互补配对特性使dna具有精准、高效的自组装能力;dna序列多样可调,结构精准可控,具有丰富的刺激响应性;自然进化赋予生物体丰富多样的生物酶,可在分子水平对dna进行精准操作;dna具有良好的生物相容性和生物可降解性。
3、碱基修饰核酸大多是在天然碱基的不同部位进行化学修饰后而形成的衍生物。相比天然核酸,某些碱基修饰核酸具有更加丰富的性能,在生物工程、纳米技术、分子生物学和医学等领域具有巨大的应用潜力。合成碱基修饰核酸主要有化学合成和酶合成两种方法。通常情况下,化学合成碱基修饰核酸操作困难且效率低下,此外,某些修饰不能用化学方法引入。酶合成是另一种制备碱基修饰核酸对方法。目前已经报道了用聚合酶链式反应(pcr)合成含有5-取代嘧啶类似物[5-6]和各种嘌呤衍生物的碱基修饰核酸[7]。然而,这类合成方法依赖繁琐的热循环步骤,效率低下,且无法均一扩增产物,极大限制了碱基修饰核酸的推广应用。
4、参考文献:
5、[1]arunas l,zivile k,vilma z-r等.duality of polynucleotide substratesfor phi29 dna polymerase:3’-->5’rnase activity of the enzyme.[j].rna(newyork,n.y.),2008,14(3).
6、[2]dean f b,nelson j r,giesler t l等.rapid amplification of plasmidand phage dna using phi29 dna polymerase and multiply-primed rolling circleamplification[j].cold spring harbor laboratory press,2001,11(6).
7、[3]练杜娟,仇建萍,张平静等.phi29dna聚合酶最新应用研究进展[j].药物生物技术,2016,23(02):150–154.
8、[4]torres l l,pinheiro v b.xenobiotic nucleic acid(xna)synthesis byphi29dna polymerase[j].current protocols in chemical biology,2018,10(2):e41.
9、[5]ja¨ger,s.,and famulok,m.(2004)generation and enzymaticamplification of high-density functionalized dna double strands.angew.chem.,int.ed.43,3337–3340.
10、[6]wong,k.k.,and mcclelland,m.(1991)pcr with 5-methyldctp replacingdctp.nucleic acids res.19,1081–1085.
11、[7]bailly,c.,and waring,m.j.(1995)transferring the purine 2-aminogroup from guanines to adenines in dna changes the sequence-specific bindingof antibiotics.nucleic acids res.23,885–892.
技术实现思路
1、为了克服现有技术的缺点与不足,本发明的首要目的在于提供一种基于phi29dna聚合酶滚环复制长链碱基修饰核酸活性制备水凝胶的方法。
2、本发明的另一目的在于提供通过上述方法制备得到的非天然核酸水凝胶。
3、本发明的再一目的在于提供通过上述非天然核酸水凝胶的应用。
4、本发明的目的通过下述技术方案实现:
5、一种基于phi29dna聚合酶滚环复制长链碱基修饰核酸活性制备水凝胶的方法,包括如下步骤:
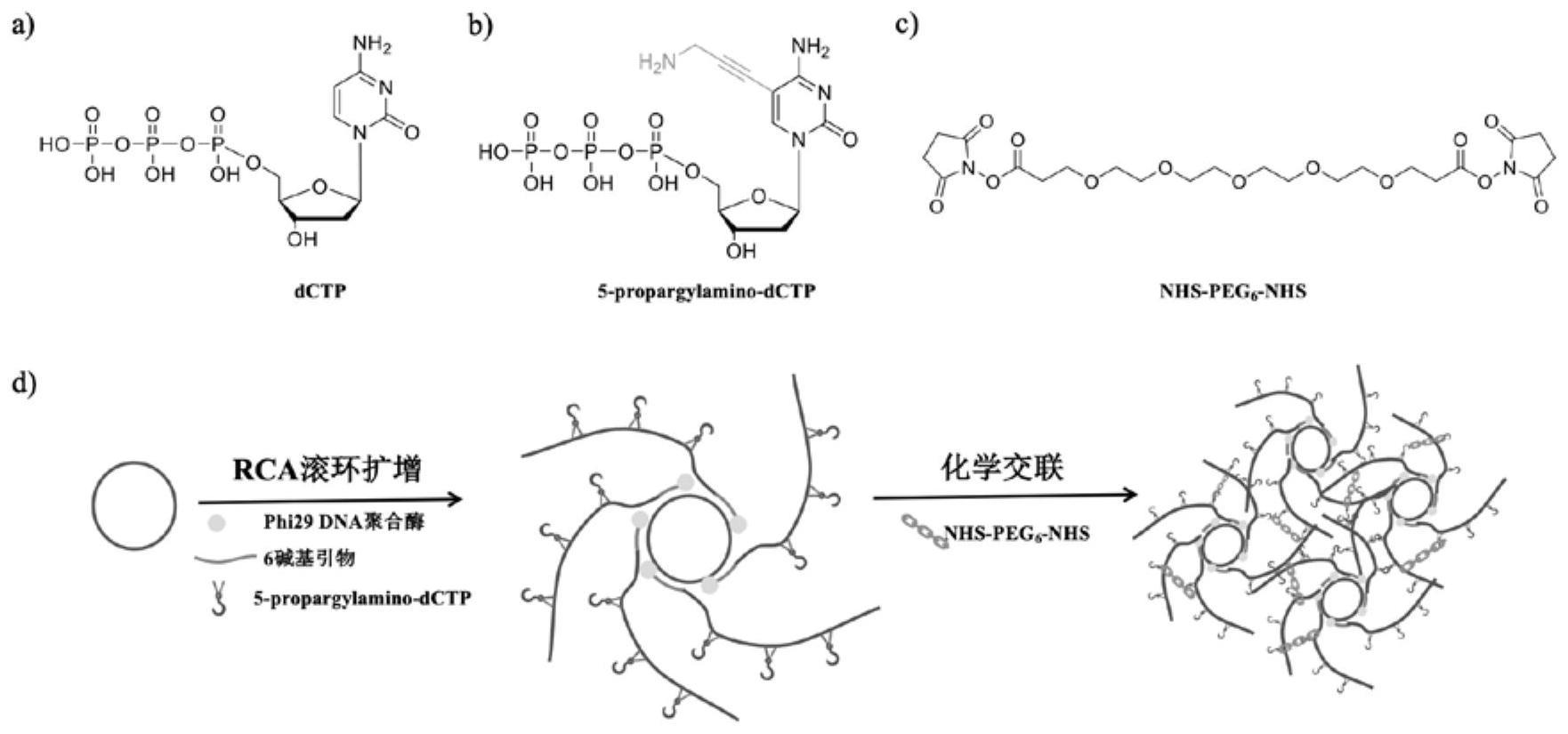
6、(1)制备碱基上含氨基连接臂的核酸:在含有phi29dna聚合酶的滚环扩增反应体系中掺入可配对的、碱基部分的5号位含炔丙氨基修饰的人工核苷酸,制备得到部分碱基上含氨基连接臂的核酸;
7、(2)制备非天然核酸水凝胶:步骤(1)所得核酸浓缩、退火,将退火产物与化学交联剂在磷酸盐缓冲液中混合,孵育,即获得所述的水凝胶。
8、步骤(1)中所述的掺入的方式可以是完全替代或部分替代天然核苷酸中的一种或多种,以最终得到的核酸片段中碱基上含氨基连接臂的核酸含量为10%~40%为优。
9、步骤(1)中所述的核酸片段中碱基上含氨基连接臂的核酸优选为间隔分布,更优选为等间隔分布,长度优选为1000~5000bp;更优选为2000bp。
10、步骤(1)的具体操作优选如下:在phi29dna聚合酶缓冲液加入模板和引物,退火结合;退火后加入dntps、bsa(牛血清蛋白)和phi29dna聚合酶,孵育。所述的phi29dna聚合酶缓冲液中各物质的浓度以1×phi29dna聚合酶缓冲液含有:模板5~20nmol/l、引物5~20μmol/l、dntps各0.4~0.6mmol/l、bsa 0.02~0.03mg/ml、phi29dna聚合酶0.2~0.3u/μl计;更优选为模板10nmol/l、引物10μmol/l、dntps各0.5mmol/l、bsa 0.025mg/ml、phi29dna聚合酶0.25u/μl。
11、所述的退火结合的条件为95℃,5min,逐渐冷却至室温(20~30℃)后于冰上放置5min;所述的孵育的条件为27~32℃,10~14h,更优选为30℃,12h。
12、步骤(1)中所述的滚环扩增反应优选进行2~4轮。
13、步骤(2)中所述的化学交联剂优选为磺基双琥珀酰亚胺酯多聚乙二醇nhs-pegn-nhs,其中,所述pegn中的n为聚乙二醇中乙二醇单体的个数,所述n的取值范围为2~12,更优选为6。
14、步骤(2)中所述的浓缩优选通过30kda的过滤膜在6000rpm离心30min实现。
15、步骤(2)中所述的退火的条件优选为95℃,5min,逐渐冷却至室温。
16、步骤(2)中所述的孵育体系中各物质的终浓度分别优选为:退火产物2~4μg/μl、化学交联剂2~4mmol/l;孵育的条件为35~40℃,10~14h;更优选为退火产物3μg/μl、化学交联剂3mmol/l;孵育的条件为37℃,12h。
17、步骤(2)中所述的磷酸盐缓冲液优选ph 8.4~8.6的磷酸盐缓冲液。
18、一种非天然核酸水凝胶,通过上述方法制备得到。
19、上述非天然核酸水凝胶在生物医学领域中的应用。
20、本发明相对于现有技术具有如下的优点及效果:
21、本发明探究了phi29dna聚合酶对碱基上带有修饰的核苷酸的识别,拓展了phi29dna聚合酶底物谱,并在此基础上提出了一种利用非天然核酸骨架高效制备核酸水凝胶的方法。通过phi29dna聚合酶滚环复制方法扩增碱基修饰核酸,从而制备共价交联的dna水凝胶。在这之前从未有通过phi29dna聚合酶滚环扩增制备共价交联水凝胶的相关研究。
22、本发明探究了phi29dna聚合酶对含氨基连接臂的核苷酸识别以及对非天然碱基对的识别能力。通过酶法合成碱基上有修饰的核酸,提供了共价结合位点,由于共价键比氢键稳定性更强,从而可提高dna水凝胶的稳定性。通过滚环扩增可快捷获取大量核酸,为新型核酸水凝胶的形成提供了一种简易、普适性高的制作方法。
