一种适用于厌氧细菌的胞外聚合物提取方法
1.本发明涉及胞外聚合物提取领域,具体涉及一种适用于厌氧细菌的胞外聚合物提取方法。
背景技术:
2.厌氧细菌在重金属、有机污染物等污染物的环境过程研究和污染治理领域均具有十分重要的作用。例如,在环境过程研究中,厌氧细菌影响重金属的沉淀、溶解等形态转化,促进了有机物污染的降解;在污染治理过程中,以厌氧细菌发酵降解污染物为基础的活性污泥法是常用的水体净化处理方法。厌氧细菌在生长过程中会持续产生并释放由生物大分子及其降解产物组成的粘性胶体状物质,即胞外聚合物(extracellular polymeric substances,eps)。胞外聚合物对于厌氧细菌的生存至关重要,具有粘附固定细菌、支撑细菌团聚体结构、保持水分、提供防护屏障、维持营养水平等作用。
3.胞外聚合物主要由蛋白质、多糖、核酸等生物大分子组成,具有丰富的苯环、吲哚环、吡咯环等芳香结构和羧基、羟基、氨基、醛基等官能基团。生物大分子之间通过分子间的弱相互作用(如范德华力、疏水作用、氢键等)共同构成胞外聚合物的三维空间结构并维持一定的结构稳定性。胞外聚合物的组成成分和结构特征使得其在污染物吸附、絮凝、矿化、氧化还原等过程中扮演重要角色。因此,详细考察研究胞外聚合物与污染物的相互作用对于预测污染物的环境行为和污染物的防控治理具有重要的意义,而胞外聚合物的分离提取是分析其组成、结构和功能的关键步骤。
4.胞外聚合物(eps)分为结合态和溶解态,目前,结合态的胞外聚合物的常用分离提取方法有物理提取法(如离心后,采用树脂法、加热法等处理)和化学提取法(如氢氧化钠、硫酸、树脂等)。对于厌氧细菌而言,由于其对生存环境要求苛刻,必须生存在无氧或缺氧环境中,目前应用于微生物结合态的胞外聚合物的提取方法均无法适用于厌氧细菌,其操作过程会导致厌氧细菌死亡,导致释放胞内物质,污染胞外聚合物。如:采用加氢氧化钠、硫酸等化学方法,一方面会严重破坏细菌细胞,释放胞内物质;另一方面碱、酸等会部分分解胞外聚合物的组分,使得提取到的胞外聚合物与真实细菌周围的胞外聚合物存在较大差异。而物理提取方法可以尽可能减轻对胞外聚合物组分的影响,但是单纯离心的方法得到的结合态的胞外聚合物产量太低,而采用加热、树脂等方法,操作时间长,也容易造成细菌死亡。
5.因此,如何在减轻细菌结构破坏、避免对结合态的胞外聚合物组分和结构产生影响的前提下,开发出经济有效的适用于厌氧细菌的结合态胞外聚合物的提取方法具有重要的现实意义。
技术实现要素:
6.本发明要解决的技术问题在于克服现有技术中采用的提取方法均无法适用于厌氧细菌,其操作过程会导致厌氧细菌死亡、释放胞内物质、污染结合态的胞外聚合物等缺陷;从而提供能够在减轻细菌结构破坏、避免对结合态的胞外聚合物组分和结构产生影响
的前提下,提高结合态的胞外聚合物产量的一种适用于厌氧细菌的胞外聚合物提取方法。
7.一种适用于厌氧细菌的胞外聚合物提取方法,包括在厌氧环境下进行如下步骤:
8.获取厌氧细菌的生长培养液,将生长培养液进行离心弃上清液、清洗后重悬获得重悬液;
9.在冰水浴中对重悬液进行超声处理,离心去掉厌氧细菌,获取上清液;
10.将上清液过滤去除掉残留的细菌细胞获得滤液,该滤液即为厌氧细菌的胞外聚合物。
11.该胞外聚合物可以密封后放入冰箱中保存或经过冷冻干燥处理得到胞外聚合物粉末再进行保存。
12.所述超声处理的处理条件为60w、40khz,超声处理时间5~8min。
13.所述生长培养液的离心条件为4000rpm、5~8min、4℃;
14.所述重悬液的离心条件为8000rpm、20min、4℃。
15.所述清洗和重悬时所采用的溶液为磷酸盐缓冲溶液或氯化钠溶液。
16.所述磷酸盐缓冲溶液为浓度为10mm的na2hpo4和浓度为2mm的kh2po4混合溶液;
17.所述氯化钠溶液的浓度为0.1wt%。
18.所述上清液过滤时采用的滤膜的孔径为0.22μm,材质为聚醚砜或聚四氟乙烯。
19.所述厌氧环境为手套箱内含95%氮气和5%氢气的环境。
20.所述生长培养液的获取过程为:
21.将培养液进行脱氧处理,然后再分装到厌氧瓶中进行灭菌;
22.将厌氧细菌接种到厌氧瓶中进行培养后即可获得生长培养液。
23.所述生长培养液为厌氧细菌培养至对数期、稳定期或衰退期后得到的培养液。
24.所述灭菌的方式为:高压蒸汽灭菌,121℃,15~20min。
25.所述脱氧处理的过程为:将培养液煮沸,然后趁热转移到厌氧手套箱中,利用真空泵抽取空气,待溶液不再沸腾后,通入纯度为99.99%以上的氮气,重复抽气至少三次。
26.本发明技术方案,具有如下优点:
27.1.本发明提供的一种适用于厌氧细菌的胞外聚合物提取方法,其结合厌氧操作方式,在严格保证厌氧条件下,避免细菌暴露氧气发生死亡;同时,采用轻微超声法,通过超声产生的剪切力结合物理离心方式来提取厌氧细菌的胞外聚合物,避免了厌氧菌死亡释放胞内物质,减少对胞外聚合物组分的影响;其在减少细菌死亡的情况下提高胞外聚合物产量高,效果显著。
28.2.本发明的方法中,培养和提取步骤具有操作时间短、操作成本低、胞外聚合物产量高、无二次污染等优点。
29.3.本发明优化了生长培养液的获取过程,其中包括培养液的脱氧处理,可以有效降低厌氧细菌接种后的死亡率,提高生长培养液的生产效率。
30.4.本发明进一步优化了脱氧处理的过程,严格控制厌氧环境,保证厌氧细菌的生存条件;通过煮沸、再沸腾过程,将细菌培养液中的氧气被彻底脱去,相比纯氮气曝气脱氧效果更为显著。具体的,将培养液煮沸,利用溶液温度升高气体溶解度降低的原理,排除培养液中的氧气。然后趁热转移到厌氧手套箱的过渡舱中,利用真空泵抽取舱内空气,由于气压降低,培养液的沸点下降,培养液再次沸腾,进一步去除培养液中残留的氧气。待溶液不
再沸腾后,通入纯氮气(99.99%),随后反复抽气2~3遍,以彻底去除培养液中的氧气。
附图说明
31.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
32.图1是本发明中geobacter sulfurreducens pca的生长曲线图;
33.图2是本发明实施例1中胞外聚合物的dna含量对比图;
34.图3是本发明实施例1中胞外聚合物的总有机碳含量对比图;
35.图4是本发明实施例1中胞外聚合物的多糖含量对比图;
36.图5是本发明实施例1中胞外聚合物的蛋白质含量对比图;
37.图6是本发明实施例1中标记为a的胞外聚合物的三维荧光光谱图;
38.图7是本发明实施例1中标记为b的胞外聚合物的三维荧光光谱图;
39.图8是本发明中desulfovibrio desulfuricans nd132的生长曲线图;
40.图9是本发明实施例2中胞外聚合物的多糖和蛋白质含量对比图;
41.图10是本发明实施例2中胞外聚合物的三维荧光光谱图。
具体实施方式
42.提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
43.实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
44.实施例1
45.一种适用于厌氧细菌的胞外聚合物提取方法,本实施例中采用的厌氧细菌菌种为铁还原菌geobacter sulfurreducens pca(美国模式培养物集存库编号atcc 51573)。培养液配方参考自文献(lovley and phillips,applied and environmental microbiology,1988,54(6):1472-1480.),以20mm乙酸盐作为电子供体,40mm延胡索酸盐作为电子受体。培养液ph值利用优级纯hno3和naoh调节ph=7.4~7.5,利用3-(n-吗啉)-1-丙磺酸钠(mops)维持培养液中ph值的稳定。
46.具体过程如下:
47.在厌氧手套箱中,确保手套箱内气体为95%氮气和5%氢气,进而构成厌氧环境。
48.将培养液煮沸,利用溶液温度升高气体溶解度降低的原理,排除培养液中的氧气。然后趁热转移到厌氧手套箱的过渡舱中,利用真空泵抽取舱内空气,由于气压降低,培养液的沸点下降,培养液再次沸腾,进一步去除培养液中残留的氧气。待溶液不再沸腾后,通入纯氮气(99.99%),随后反复抽气3遍,以彻底去除培养液中的氧气。
49.将冷却后的培养液分装到钳口厌氧瓶中,厌氧瓶密封后进行灭菌操作;
50.利用一次性无菌注射器按照1:20体积比的接种比例将g.sulfurreducens pca菌液加入到100ml灭菌后的培养液中,菌液浓度为1.49
×
109个/ml。钳口厌氧瓶在厌氧手套箱内黑暗培养,培养温度25℃。
51.接种后每12h取样,利用紫外可见分光光度计或酶标仪(如spark 10m,瑞士tecan)测定波长600nm处的吸光度值(od
600
),绘制生长曲线监测细菌生长状况。g.sulfurreducens pca生长曲线如图1所示。
52.待细菌生长至不同生长阶段后,在厌氧手套箱内在4000rpm的条件下离心8min,弃掉上层培养液,剩余厌氧菌体清洗3次后,再悬浮至一定体积,然后均分为两份,分别标记为a和b。
53.将a密封到钳口厌氧瓶中,置于冰水浴中以60w功率、40khz频率的超声处理8min;b中加入阳离子交换树脂(70g/g vss)后密封,于冰水浴中以600rpm的速度搅拌1h。
54.然后将a和b均在4℃,8000rpm的条件下离心20min,在手套箱内将上清液通过0.22μm孔径的聚醚砜(pes)滤膜去除残留细菌,得到滤液。该滤液即为胞外聚合物溶液,该滤液密封后放入-20℃冰箱中保存备用。本步骤中,重悬液离心条件的设置,能够避免再用0.22μm滤膜过滤时重悬液中残留细菌堵塞滤膜,影响胞外聚合物收集,并且还能保证收集的胞外聚合物的产量。
55.对胞外聚合物收集后剩余的细菌做活死菌染色计数实验。即染色后,利用激光扫描共聚焦显微镜观察计数,通过计算得出,活菌所占比例为93.96
±
1.56%。
56.使用二苯胺比色法进行dna的测定,采用小牛胸腺dna作为标准样品建立标准曲线,结果如图2所示。超声提取法得到的胞外聚合物的dna含量要明显小于树脂提取法,表明本发明的轻微超声法可以有效避免厌氧细菌的死亡,避免胞内物质外泄污染胞外聚合物的组分。
57.使用总有机碳分析仪(如multi n/c 3100,德国analytik jena或vario toc cube,德国elementar)测定胞外聚合物中的总有机碳(toc)含量,结果如图3所示;使用苯酚-硫酸法进行多糖含量的测定,采用葡萄糖作为标准样品建立标准曲线,结果如图4所示;使用bca蛋白定量试剂盒对蛋白质含量进行测试,采用牛血清蛋白作为标准样品建立标准曲线,结果如图5所示。
58.通过上述结果可知:除了对数期外,在稳定期和衰减期提取的胞外聚合物,超声法的总有机碳量、多糖含量和蛋白质含量都略小于树脂提取法。树脂法的含量较高,可能是由于树脂提取过程中导致较多的铁还原菌死亡,胞内物质外泄导致的。
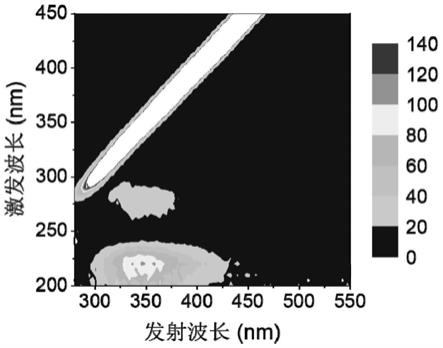
59.采用荧光分光光度计(如f-7100,日本hitach)采集胞外聚合物的三维荧光光谱图(3d-eem)以获得主要荧光组分的位置和种类,激发波长设置200~450nm,发射波长设置250~550nm,波长间隔5nm,狭缝宽度设置5nm,扫描速度1200nm/min。加装300nm的滤光片以消除二级瑞利散射的影响,并利用紫外吸收光谱进行内滤效应校正,结果如图6和图7所示。通过图6-图7可知,超声提取法得到的胞外聚合物的荧光组分与树脂提取法相同,均是芳香蛋白质为主的荧光组分,表明本发明方法是一种有效的厌氧细菌胞外多聚物的提取方法。
60.实施例2
61.一种适用于厌氧细菌的胞外聚合物提取方法,本实施例中采用的厌氧细菌菌种为
硫酸盐还原菌desulfovibrio desulfuricans nd132(来自cynthia c.gilmour,美国smithsonian环境研究中心)。培养液配方参考自文献(gilmour et al.,applied and environmental microbiology,2011,77(12):3938-3951.),以27mm丙酮酸盐作为电子供体,20mm硫酸盐作为电子受体。培养液ph值利用优级纯hno3和naoh调节ph=7.4~7.5,利用3-(n-吗啉)-1-丙磺酸钠(mops)维持培养液中ph值的稳定。
62.具体过程如下:
63.在厌氧手套箱中,确保手套箱内气体为95%氮气和5%氢气,进而构成厌氧环境。
64.将培养液煮沸,利用溶液温度升高气体溶解度降低的原理,排除培养液中的氧气。然后趁热转移到厌氧手套箱的过渡舱中,利用真空泵抽取舱内空气,由于气压降低,培养液的沸点下降,培养液再次沸腾,进一步去除培养液中残留的氧气。待溶液不再沸腾后,通入纯氮气(99.99%),随后反复抽气2~3遍,以彻底去除培养液中的氧气。
65.将冷却后的培养液分装到钳口厌氧瓶中,厌氧瓶密封后进行灭菌操作;
66.利用一次性无菌注射器按照1:20体积比的接种比例将d.desulfuricans nd132菌液加入到100ml灭菌后的培养液中,菌液浓度为1.93
×
109个/ml。。钳口厌氧瓶在厌氧手套箱内黑暗培养,培养温度25℃。
67.接种后每12h取样,利用紫外可见分光光度计或酶标仪(如spark 10m,瑞士tecan)测定波长600nm处的吸光度值(od
600
),绘制生长曲线监测细菌生长状况。d.desulfuricans nd132生长曲线如图8所示。
68.待细菌生长至稳定期后,在厌氧手套箱内在4000rpm的条件下离心8min,弃掉上层培养液,剩余厌氧菌体清洗3次后,再悬浮至一定体积。将其密封到钳口厌氧瓶中,置于冰水浴中以60w功率、40khz频率的超声处理8min。然后在4℃,8000rpm的条件下离心20min,在手套箱内将上清液通过0.22μm孔径的聚醚砜(pes)滤膜去除残留细菌,得到滤液。该滤液即为胞外聚合物溶液,该滤液密封后放入-20℃冰箱中保存备用。
69.对胞外聚合物收集后剩余的细菌做活死菌染色计数实验。即染色后,利用激光扫描共聚焦显微镜观察计数,通过计算得出,活菌所占比例为92.27
±
1.55%。
70.使用苯酚-硫酸法进行多糖含量的测定,采用葡萄糖作为标准样品建立标准曲线;使用bca蛋白定量试剂盒对蛋白质含量进行测试,采用牛血清蛋白作为标准样品建立标准曲线。结果如图9所示,d.desulfuricans nd132胞外聚合物的多糖含量与g.sulfurreducens pca近似,而蛋白质的含量显著高于g.sulfurreducens pca。
71.采用荧光分光光度计(如f-7100,日本hitach)采集胞外聚合物的三维荧光光谱图(3d-eem)以获得主要荧光组分的位置和种类,激发波长设置200~450nm,发射波长设置250~550nm,波长间隔5nm,狭缝宽度设置5nm,扫描速度1200nm/min。加装300nm的滤光片以消除二级瑞利散射的影响,并利用紫外吸收光谱进行内滤效应校正,结果如图10所示,d.desulfuricans nd132的胞外聚合物主要荧光组分也是芳香蛋白质。因此,本发明的提取方法同样适用硫酸盐还原菌胞外聚合物的提取。
72.显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1