一种光响应横向过滤芯片及单个癌细胞的分离与释放方法
1.本发明属于生物、化学及材料科学领域,涉及一种光响应横向过滤芯片及单个癌细胞的分离与释放方法。
背景技术:
2.恶性肿瘤严重威胁着人类的生命健康,转移是导致大多数实体肿瘤患者死亡的主要原因。在肿瘤转移过程中,一些癌细胞从原发灶脱落、迁移进入血液循环系统,通过血液循环系统传播转移到身体的其他器官与组织,这部分细胞称其为循环肿瘤细胞。目前ctcs的检测和分析已经在临床中获得了一定的应用,例如和两款产品分别被美国fda和欧盟批准,可用于前列腺癌、乳腺癌和结肠癌等肿瘤诊断。然而,ctcs检测在临床上进一步应用仍然存在较大的技术难点,其一,临床样本分离的ctcs需要极高的纯度,个别残留在ctcs中的其他细胞会扰乱ctcs信号,导致假阳性错误结果;其二,肿瘤患者存在瘤内和瘤间异质性,即ctcs个体之间的差异,导致血液循环系统中的ctcs在增殖能力、转移能力等方面都存在差异。目前常用的基于多细胞的群体捕获和释放的ctcs检测方法中,容易消除异质性的有效信息,从而无法实现对肿瘤转移不同阶段的ctcs基因组、蛋白组、rna的分析研究和阶段性的抗肿瘤治疗和耐药性评估。
3.对ctcs进行单细胞操控是解决ctcs纯度和异质性问题的一种行之有效的方法,即在单细胞水平对ctc进行高纯度捕获和选择性定点释放,同时保持细胞个体的活性和原始性,从而对特定阶段的异质性单细胞进行分析。现有的单细胞分离方法如荧光流式、荧光激活流式技术均能有效获得单个细胞,但是需要大量细胞样本,另外激光显微切割技术可从组织中分离单个细胞,但易带来激光损伤,显微操控技术从单细胞悬浮液中吸取单细胞,但吸取效率较低、操作难度大,这些技术或者设备的缺陷使单细胞分离难以满足ctcs检测的要求。
4.因此,构建一种新型的、基于物理阵列和光热/温敏复合材料于一体的光响应单细胞分析微流控芯片;该芯片可用于高时效、高纯度地捕获复杂样本中的ctcs,并且实现高效率、无损的单细胞释放,且释放后的细胞具有高活性。
技术实现要素:
5.本发明的首要目的在于克服现有技术的缺点与不足,提供一种光响应横向过滤芯片及单个癌细胞的分离与释放方法,基于本发明的光响应横向过滤芯片能够实现单个癌细胞的快捷、简易、高效无损的分离获取。
6.本发明的目的通过下述技术方案实现。
7.第一方面,本发明提供了一种光响应横向过滤芯片,包括芯片基板和基底,所述芯片基板设有主通道和2条沿着主通道且分别位于主通道两侧的释放通道,所述主通道的两侧分别设有1组由多个微捕获单元组成的微捕获阵列,同一组微捕获阵列中相邻2个微捕获单元之间形成筛分通道,主通道与释放通道通过筛分通道连通,且筛分通道与主通道连接
的一侧为入口侧,筛分通道与释放通道连接的一端为出口侧,出口侧尺寸<癌细胞尺寸<入口侧尺寸,微捕获单元的表面包裹有功能材料,所述功能材料经光照升温后可融化,进而使得出口侧尺寸变大至满足癌细胞通过并进入释放通道。
8.通道宽度及比例会影响捕获结构中细胞所受侧向流体作用力,作为优选,所述释放通道与所述主通道宽度比大于2:1。
9.进一步地,所述释放通道的宽度为100~1000μm。
10.进一步地,所述主通道的宽度为50~500μm。
11.进一步的,2组筛分阵列对称设置。
12.可选地,所述微捕获单元为的微米柱、三角锥、在芯片基板上的正投影为多边形等结构。更有选多边形为梯形。
13.进一步的,功能材料为光热材料和温敏高分子材料的共混物。光热材料包括但不限于金银为代表的贵金属材料、石墨烯为代表的碳材料、吲哚箐绿为代表的有机染料。温敏高分子材料包括但不限于明胶、聚[甲基丙烯酸-2-(n,n-二甲氨基)酯](pdmaema)等。
[0014]
第二方面,本发明还提供了光响应横向过滤芯片的制备方法,包括:
[0015]
1)芯片基板材料的预混合物(单体:交联剂=1:1~10:1)混合均匀,倒入盛有结构的硅片的培养皿中,完全排气泡,在50~85℃下烘1~5h,使芯片基板材料彻底固化。
[0016]
2)用手术刀将固化的芯片基板材料结构切下并剥离,打孔,与基底一起放入plasma等离子处理机中进行0.1~2min表面改性,然后迅速对准键合,然后将预混有光热材料的温敏高分子溶液注入芯片,使微捕获单元的表面覆盖功能材料,即制得光响应横向过滤芯片。
[0017]
步骤1)中芯片基板材料材料为聚二甲基硅氧烷、环烯烃共聚物、聚苯乙烯、聚甲基丙烯酸酯、聚对苯二甲酸乙二醇酯、聚四氟乙烯、聚丙酸酯、聚碳酸酯、聚乙烯、聚丙烯和聚氯乙烯中的一种或多种。
[0018]
步骤2)所述键合方法为等离子体表面改性法,是不可逆键合。
[0019]
步骤2)中所述基底材料为玻璃、纸、硅、金属、塑料、pdms或pmma等有机高分子聚合物等材料的一种或多种。
[0020]
优选地,所述的芯片基板材料为pdms,所述的基底材料为玻璃。
[0021]
本发明第二方面所述制备方法,制作工艺简单,制作成本低,能适用于大规模的工业化生产的。由所述制备方法制得的分离捕获单细胞的微流控芯片能实现单细胞的快速获取,且可以同时获取多个单细胞,整个单细胞获取的方法简单高效,成本低廉。
[0022]
第三方面,本发明提供一种近红外光响应金纳米棒的制备方法。本发明所述近红外光响应金纳米棒为所述分离捕获单细胞的微流控芯片的应用之一,包括如下步骤:
[0023]
(1)将0.05~5mol/l的十六烷基溴化铵(ctab)溶液与0.0001~0.001mol/l的haucl4溶液,按照体积比1:1~10混合搅拌,随后加入0.1~10ml 0.0001~0.1mol/l的nabh4溶液,剧烈搅拌0.5~20min,此时溶液颜色变成黄褐色,放置水浴锅中1~10h,即得到粒径约为2~4nm的金种子液。
[0024]
(2)配制0.05~5mol/l的ctab溶液,0.005~0.1mol/l的agno3溶液,将0.1~1ml的agno3溶液加入到ctab溶液中。
[0025]
(3)将1~10ml的0.0001~0.001mol/l的haucl4加入到(2)中,缓慢搅拌,加入10~
200μl 0.01~1mol/l的抗坏血酸,最后加入1~20μl的金种子液,缓慢搅拌1~10min,在室温下静置10~36h,即得金纳米棒纳米颗粒。
[0026]
一种近红外光响应金纳米棒,通过上述方法制备得到。
[0027]
第四方面,本发明还提供一种高分子明胶溶液的制备方法。本发明所述高分子明胶溶液为所述分离捕获单细胞的微流控芯片的应用之一,包括如下步骤:
[0028]
一)配制浓度为1~100mm的磷酸盐缓冲溶液,将缓冲溶液进行高温灭菌。
[0029]
二)将分子量从三万到三十万的明胶溶解在上述配好的磷酸盐缓冲溶液中,配制不同浓度的明胶溶液。
[0030]
第五方面,本发明提供了癌细胞捕获和分离方法,基于上述的一种光响应横向过滤芯片进行,
[0031]
包括如下步骤:
[0032]
(1)配置细胞悬液和进行细胞标记;
[0033]
(2)将步骤(1)标记后的细胞悬液从一端注入主通道,在设定压力作用下,细胞悬液向主通道的另一端流动,过程中癌细胞进入筛分通道并被捕获;
[0034]
(3)癌细胞停止捕获后,从一端向主通道注入缓冲液,在设定压力作用下,缓冲液向主通道的另一端流动,稳流后红外光照微捕获单元,进而功能材料融化,使得出口侧尺寸变大,同时在流体力作用下癌细胞通过出口侧进入释放通道。
[0035]
与现有技术相比,本发明具有如下优点和效果:
[0036]
本发明制备的光响应单细胞分析微流控芯片具有优异的光响应性和温敏效应。在流体的作用下,癌细胞基于物理尺寸被“嵌入”在通道中,使用近红外光对通道进行“融化”,从而对单个细胞进行释放,获得无损单个ctc样本用于后续细胞培养、药敏实验和异质性。本发明具有高分离效率、高选择性释放、生物相容性、可收集性等优势。
附图说明
[0037]
图1为梯形阵列芯片显微成像。
[0038]
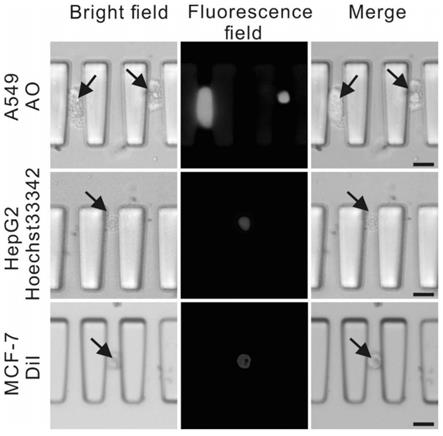
图2为芯片捕获a549细胞、hepg2细胞、mcf-7细胞荧光成像图。
[0039]
图3为芯片捕获细胞后经过光照释放图。
[0040]
图4光响应单细胞分析微流控芯片的构建。a)芯片分离结构示意图;b)光热响应体系与芯片结构复合;c)温敏水凝胶、光热纳米材料、温敏水凝胶网络夹心结构剖面图。
[0041]
图5为comsol软件对流体流速进行模拟仿真。
[0042]
图6在不同流速下对sk-br-3细胞的捕获效率。
[0043]
图7在优化的条件下,对不同细胞的捕获效率进行了研究。
[0044]
图8在37度和光照两种条件下细胞释放效率与细胞活力。
具体实施方式
[0045]
本发明不局限于下列具体实施方式,本领域一般技术人员根据本发明公开的内容,可以采用其他多种具体实施方式实施本发明的,或者凡是采用本发明的设计结构和思路,做简单变化或更改的,都落入本发明的保护范围。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
[0046]
本发明下面结合实施例作进一步详述:
[0047]
下面结合附图对本发明作进一步描述,以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
[0048]
图1和图4所示,本发明光响应横向过滤芯片,包括有主通道和释放通道,主通道位于芯片中央;其中,主通道两侧含有多个微捕获单元组成的对称阵列结构;微捕获单元为特殊尺寸的梯形结构;阵列结构与释放通道连通。
[0049]
具体的,一种光响应横向过滤芯片,包括芯片基板和基底,所述芯片基板设有主通道和2条沿着主通道且分别位于主通道两侧的释放通道,所述主通道的两侧分别设有1组由多个微捕获单元组成的阵列结构,也即微捕获阵列,同一组微捕获阵列中相邻2个微捕获单元之间形成筛分通道,主通道与释放通道通过筛分通道连通,且筛分通道与主通道连接的一侧为入口侧,筛分通道与释放通道连接的一端为出口侧,出口侧尺寸<癌细胞尺寸<入口侧尺寸,微捕获单元的表面包裹有功能材料,所述功能材料经光照升温后可融化,进而使得出口侧尺寸变大至满足癌细胞通过并进入释放通道。
[0050]
通道宽度及比例会影响捕获结构中细胞所受侧向流体作用力,作为优选,所述释放通道与所述主通道宽度比大于2:1。所述释放通道的宽度为100~1000μm,所述主通道的宽度为50~500μm,2组筛分阵列对称设置。可选地,所述微捕获单元为的微米柱、三角锥、在芯片基板上的正投影为多边形等结构。本实施例以多边形为梯形为例。
[0051]
功能材料(也即光响应水凝胶)为光热材料和温敏高分子材料(温敏水凝胶)的共混物。光热材料包括但不限于金银为代表的贵金属材料、石墨烯为代表的碳材料、吲哚箐绿为代表的有机染料。温敏高分子材料包括但不限于明胶、聚[甲基丙烯酸-2-(n,n-二甲氨基)酯](pdmaema)等。
[0052]
图4(b)所示,本发明提供了光热响应体系与芯片结构复合示意图,通过光刻技术制备基于物理尺寸分离芯片,然后将预混有光热材料的温敏高分子溶液注入芯片,温敏高分子在微纳米结构(如微米柱、三角锥、多边形等)四周形成包裹。
[0053]
被含有光热材料的温敏高分子溶液包裹的微捕获单元形成软结构,结构之间最大间隙为1~50μm,最小间隙为0.5~20μm。
[0054]
通过局部近红外光照或局部加热,使温敏高分子材料软结构融化,芯片结构间隙增大,间隙为5~50μm。
[0055]
具体的,光响应横向过滤芯片的制备方法,包括:
[0056]
1)芯片基板材料的预混合物(单体:交联剂=1:1~10:1)混合均匀,倒入盛有结构的硅片的培养皿中,完全排气泡,在50~85℃下烘1~5h,使芯片基板材料彻底固化。
[0057]
2)用手术刀将固化的芯片基板材料结构切下并剥离,打孔,与基底一起放入plasma等离子处理机中进行0.1~2min表面改性,然后迅速对准键合,然后将预混有光热材料的温敏高分子溶液注入芯片,使微捕获单元的表面包裹功能材料,即制得光响应横向过滤芯片(也即高分子复合芯片阵列)。
[0058]
步骤1)中芯片基板材料材料为聚二甲基硅氧烷、环烯烃共聚物、聚苯乙烯、聚甲基丙烯酸酯、聚对苯二甲酸乙二醇酯、聚四氟乙烯、聚丙酸酯、聚碳酸酯、聚乙烯、聚丙烯和聚氯乙烯中的一种或多种。
[0059]
步骤2)所述键合方法为等离子体表面改性法,是不可逆键合。
[0060]
步骤2)中所述基底材料为玻璃、纸、硅、金属、塑料、pdms或pmma等有机高分子聚合物等材料的一种或多种。
[0061]
本实施例的芯片基板材料为pdms,所述的基底材料为玻璃。
[0062]
本发明所述光响应横向过滤芯片,提供了一种高时效、高纯度地捕获复杂样本中的ctcs,并且实现高效率、无损的单细胞释放,且释放后的细胞具有高活性的方法,可应用于临床血液样本中从病人血液中获取高纯度的ctcs,进行体外培养,获得可增殖的ctcs细胞系,进行抗癌药物敏感性实验,提供个性化的癌细胞信息。
[0063]
实施例一
[0064]
在本实施例中,使用光响应横向过滤芯片在不同流速下对sk-br-3细胞进行捕获,其步骤如下:
[0065]
(1)细胞培养:取出已经培养好的sk-br-3细胞,用适量的胰酶(含0.25%edta)消化处理,待细胞从瓶底脱落形成悬液时,加入1ml的培养基终止消化,将细胞悬液转移至离心管中1000rpm离心3~7min,取上清,取细胞团加入10ml 1
×
pbs buffer(ph 7.4)吹打均匀,进行细胞计数,采用三次计数,取平均值。细胞悬浮液置于4℃冰箱保存,备用。
[0066]
(2)细胞标记:细胞悬液1ml加入1~50μl 0.05~0.5%tritonx-pbs溶液,室温孵育1~20min;加入5~30μl 1~10%bas-pbs溶液,室温孵育5~20min;再加入5~50μl抗体混合液,特异性标记细胞,37℃孵育10~60min;最后加入0.05~0.5ml的冲洗液冲洗未结合的抗体溶液,减少背景颜色。
[0067]
(3)搭建进样装置:采用正压进样模式,微泵提供正压,通过注射器输液针管与芯片进样口连接,软管与芯片出样口连接,废液通过软管收集至小烧杯中。
[0068]
(4)进样操作:用移液枪吹打细胞悬液,使细胞均匀分散,取2ml的注射器吸取细胞悬液,施加10、30、40、50、60、80、100μl/min的流速对sk-br-3细胞进行捕获;在显微镜下观察,根据荧光计数目标细胞。
[0069]
实验测试分析
[0070]
在不同流速下芯片对sk-br-3细胞的捕获效率,实验表明当流速低于30μl/min时,芯片获得较高的分离效率(图6)。
[0071]
实施例二
[0072]
本实施例与实施例一基本相同,特别之处在于:
[0073]
在本实施例中,使用光响应横向过滤芯片在优化的条件下,对mcf-7和wbc细胞进行捕获,其步骤如下:
[0074]
(1)细胞培养:取出已经培养好的mcf-7和wbc细胞,用适量的胰酶(含0.25%edta)消化处理,待细胞从瓶底脱落形成悬液时,加入1ml的培养基终止消化,将细胞悬液转移至离心管中1000rpm离心3~7min,取上清,取细胞团加入2ml pbs buffer吹打均匀,进行细胞计数,采用三次计数,取平均值。细胞悬浮液置于4℃冰箱保存,备用。
[0075]
(2)本步骤与实施例一相同;
[0076]
(3)本步骤与实施例一相同;
[0077]
(4)进样操作:用移液枪吹打细胞悬液,使细胞均匀分散,取2ml的注射器吸取细胞悬液,施加30μl/min的流速对mcf-7和wbc细胞进行捕获;在显微镜下观察,根据荧光计数目标细胞。
[0078]
实验测试分析
[0079]
在优化的流速30μl/min下,mcf-7细胞也被高校捕获,捕获效率高达88%,但是白细胞的捕获效率仅4%(图7)。上述结果表明所构建的芯片具有低的非特异性吸附和高的捕获性能。
[0080]
上述实施例表明本发明方法制备得到的光响应横向过滤芯片具有高效的单细胞捕获性能,可用于循环肿瘤细胞异质性研究,应用于临床血液样本提取。
[0081]
图8为在37度和光照两种条件下细胞释放效率与细胞活力,其中癌细胞捕获和分离方法为基于上述的一种光响应横向过滤芯片进行,包括如下步骤:
[0082]
(1)配置细胞悬液和进行细胞标记;
[0083]
(2)将步骤(1)标记后的细胞悬液从一端注入主通道,在设定压力作用下,细胞悬液向主通道的另一端流动,过程中癌细胞进入筛分通道并被捕获;
[0084]
(3)癌细胞停止捕获后,从一端向主通道注入缓冲液,在设定压力作用下,缓冲液向主通道的另一端流动,稳流后红外光照微捕获单元,进而功能材料融化,使得出口侧尺寸变大,同时在流体力作用下癌细胞通过出口侧进入释放通道。
[0085]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1