1.本发明涉及液滴生成技术领域,具体涉及适于在临床诊断、基因表达分析、微生物检测等场合下需要生成液滴的方法、装置及耗材。
背景技术:
2.在生物分子诊断方面通过聚合酶链反应(polymerase chain reaction,pcr),将样本提取纯化后的核酸(dna/rna模板)和mix;探针引物混合,将液体分割成均匀的液滴;每个液滴包含几个或0个模板,pcr反应后进行信号放大检测,通过泊松分布计算达到对样本病原体的绝对定量,即数字pcr。数字pcr检测方法在基因突变检测分析以及靶向用药伴随检测、癌症的标志物检测、下一代基因测序等领域都有重要的应用。
3.随着科技发展,微流控与微液滴的结合为一些微反应、微萃取提供了新的方向。在这些应用中,微液滴稳定均一的制备显得尤为重要。传统的液滴制备技术大多使用微管道,利用油相与液相相互形成剪切力形成油包水的微液滴,或是使用物理切割成的微孔来分割液滴。
4.参见公开号为cn 112439470 a的专利,其公开了一种制备微液滴的加样针以及微液滴的制备方法,其中加样针采用“上部设有用于连接供液适配器的适配部,中部设有用于样品储存的储液部,下部设有用于微液滴生成的吐液部,适配部的上端开口为供液开口,吐液部的下端开口为吐液开口,从供液开口到所述吐液开口直径依次递减,吐液开口内径为25~200微米,外径为200~800微米,加样针与样品溶液以及所述油性液体接触时,接触角均不小于80
°”
的设计,通过所述加样针制备微液滴时,加样针在油性液体内做速度变化的周期性往复运动,从而使得所述样品溶液在吐液开口处受到油性液体周期性的剪切力,进而使得所述加样针内的所述样品溶液进入所述油性液体内,实现了微液滴生成。显然,该专利中对于加样管的内径、厚度、锥度、角度等均有着严格的要求,加工成本高。
5.参见公开号为cn 111841439 a的专利,其公开了一种高通量制备均匀单乳液滴的装置及方法,其制备液滴时,先向腔体内持续通入驱动相液体,以形成稳定驱动相流场,接着,向分散相液体通道的入口端持续通入分散相液体,致动单元通过扰动接口输入扰动给分散相液体通道内的分散相液体,实现对分散相液体射流破碎的控制,分散相液体从毛细结构的出口端排出,经过驱动相液体包裹,从排出孔排出,形成单乳液滴。该专利在进行液滴制备时,分散相液体、驱动相液体均是射流状态,第一两股射流的控制比较困难,并且生成的液滴收集时需要在空气中形成,受外部因素影响而造成污染,同时不利于收集和后续的分析;进一步由其结构特点可知,该液滴生成方式并不适合数字pcr液滴或单细胞液滴等生物检测领域的液滴制备,原因是,在这些领域中,待检测样本量通常比较小,不足以如该专利中所介绍的那样能够形成稳定可控的射流。此外,该装置本身结构比较复杂,成本很高。
技术实现要素:
6.针对数字pcr液滴生成、单细胞液滴制备等存在的现有问题,本发明提供一种新型液滴生成方法及液滴生成装置。
7.为解决以上问题,本发明一方面,提供一种特别适用于但不限于制备数字pcr液滴、单细胞液滴的液滴生成方法,所述液滴生成方法通过混合第一液体、与所述的第一液体不混溶的第二液体以形成液滴,所述的液滴生成方法包括以下步骤:提供储存有第一液体的第一腔体;经具有液体进出口的第二腔体朝向所述的第一液体中输入第二液体,其中,采用与所述的第二液体不混溶的第三液体来驱动所述的第二液体流动并且对所述的第三液体施加振动,以及,在输入所述第二液体的过程中,使所述第一液体与所述第一腔体、第二腔体保持相对静止,所述第一腔体与所述第二腔体保持相对静止,所述的第二液体被所述的第一液体包裹获得所述的液滴,其中,所述的第一液体、第三液体为连续相,第二液体为分散相。
8.上述技术方案优选地,所述的第二腔体的液体进出口的内径为0.1-1毫米;进一步优选地,所述的第二腔体的液体进出口的内径为大于0.2毫米。更进一步优选地,所述的第二腔体的液体进出口的内径为0.3-1毫米。还进一步优选地,所述的第二腔体的液体进出口的内径为0.3-0.6毫米。
9.上述技术方案优选地,所述的第二液体的输入速度为2-200微升/分钟;进一步优选地,所述的第二液体的输入速度为10-50微升/分钟。
10.振动机构的类型例如可以是现有技术中已经使用的那些,本发明对此并无特别要求。但作为本发明优选的实施方式,在进行液滴生成时,可采用的振动频率为10hz-1khz;可采用的振动幅度为5微米-1000微米。进一步优选地,振动频率为50hz-600hz,进一步优选地,振动频率为80hz-600hz,更进一步优选地,振动频率为100hz-600hz,还进一步优选为150hz-600hz,更进一步优选为150hz-500hz,还进一步优选为150hz-300hz。在一些具体实施方式中,振动的频率为100-300hz。所述振动的幅度优选为5微米-600微米,更优选为5微米-300微米,进一步优选为5微米-100微米,更进一步为5微米-60微米。在一些实施方式中,振动的幅度为5微米-50微米,在另一些实施方式中,振动的幅度为20微米-60微米。
11.上述技术方案优选地,所述的第一液体、第三液体为油相,且所述的第一液体中添加有表面活性剂;所述的第二液体为包含了待检测生物或化学物质的水相。
12.上述技术方案优选地,所述的第二腔体的液体进出口的中心线与所述的第一液体的液面垂直。
13.上述技术方案优选地,向所述的第一液体中输入所述的第二液体时,将所述的第二腔体的液体进出口插入至所述的第一液体的液面以下。
14.上述技术方案优选地,先在所述的第二腔体内填充所述的第三液体,然后经所述的第二腔体的液体进出口将所述的第二液体吸取到已经存有所述的第三液体的第二腔体中,最后驱动所述的第三液体进而驱动所述的第二液体再从所述的第二腔体的液体进出口输出。
15.上述技术方案优选地,获得所述的液滴的直径为50-250微米。
16.本发明另一方面提供一种实现上述液滴生成方法的液滴生成系统,其包括:
容器,所述的容器具有用于放置所述的第一液体的第一腔体,所述的容器具有与所述的第一腔体连通的口部;加样管,所述的加样管具有第二腔体,所述的加样管上开设有分别与所述的第二腔体相连通的液体进出口、液体推注口以及振动接入口,所述的液体进出口的内径为0.1-1毫米,所述的液体进出口用于吸入所述的第二液体、第三液体及输出所述的第二液体,所述的液体推注口用于接入驱动源,所述的振动接入口用于接入振动源;驱动源,其连接至所述的液体推注口;振动源,其施加振动至所述的振动接入口。
17.上述技术方案优选地,所述的第二腔体的液体进出口的内径为0.3-0.6毫米。
18.上述技术方案优选地,所述的加样管具有第一管腔、第二管腔以及第三管腔,所述的第一管腔、第二管腔以及第三管腔共同形成所述的第二腔体,所述的第一管腔沿第一方向延伸,其一端形成所述的液体推注口,另一端与所述的第二管腔相连通;所述的第二管腔上开设所述的振动接入口;所述的第三管腔沿第二方向延伸,其一端与所述的第二管腔相连通,另一端形成所述的液体进出口,其中,所述的第一方向、第二方向垂直。
19.上述技术方案优选地,所述的第二腔体靠近所述的液体进出口处收窄。进一步优选地:所述的腔体靠近所述的液体进出口处逐渐收窄。
20.上述技术方案优选地,所述的振动接入口处封装有膜片,所述的振动源向所述的膜片施加振动。
21.上述技术方案优选地,所述的液滴生成系统为数字pcr液滴生成系统或单细胞液滴生成系统。
22.上述技术方案优选地,所述的液体进出口、振动接入口的中心线重合。
23.上述技术方案优选地,所述的容器的底部和四周封闭,所述的口部开设在所述的容器的顶部。
24.上述技术方案优选地,在液滴生成时:所述的容器的口部、振动接入口以及液体进出口的中心线重合,且沿竖直方向延伸。
25.上述技术方案优选地,所述的驱动源包括泵体,如柱塞泵;所述的振动源包括振动发生器,采用本领域常规的各种高频振动发生器,例如可以是高频机械振动发生器(压电陶瓷装置、音圈电机、mems等)。
26.本发明另一方面提供一种实现所述的液滴生成方法的加样管组件,包括加样管,所述的加样管具有腔体,所述的加样管上开设有分别与所述的腔体相连通的液体进出口、液体推注口以及振动接入口,所述的液体进出口的内径为0.1-1毫米,所述的液体进出口用于吸入或输出所述的第二液体,所述的液体推注口用于接入驱动源,所述的振动接入口用于接入振动源,所述的加样管一体成型制成。
27.上述技术方案优选地,所述的组件还包括密封帽,所述的密封帽套设在所述的加样管的液体推注口、和/或液体进出口处。
28.上述技术方案优选地,所述的组件还包括托架,所述的托架上开设有多个收容腔,所述的收容腔用于收容所述的加样管。
29.上述技术方案优选地,所述的腔体的液体进出口的内径为0.3-0.6毫米。
30.上述技术方案优选地,所述的加样管具有第一管腔、第二管腔以及第三管腔,所述的第一管腔、第二管腔以及第三管腔共同形成所述的腔体,所述的第一管腔沿第一方向延伸,其一端形成所述的液体推注口,另一端与所述的第二管腔相连通;所述的第二管腔上开设所述的振动接入口;所述的第三管腔沿第二方向延伸,其一端与所述的第二管腔相连通,另一端形成所述的液体进出口,其中,所述的第一方向、第二方向垂直。
31.上述技术方案优选地,所述的腔体靠近所述的液体进出口处收窄。进一步优选地:所述的腔体靠近所述的液体进出口处逐渐收窄。
32.上述技术方案优选地,所述的振动接入口处封装有膜片。该膜片可以是金属或非金属材质,厚度可以为0.005毫米-2毫米。
33.上述技术方案优选地,所述的液体进出口、振动接入口的中心线重合。
34.本发明另一方面提供一种液滴生成系统、取样管组件在临床诊断、基因表达分析、微生物检测中的应用。
35.本发明中,对于油相没有特别限制,可以是现有技术所报道的任何合适的油相。优选地,油相包括油和表面活性剂。具体地,所述油可以是例如氟碳油、硅油、矿物油、烃油、植物油中的一种或多种的组合。所述表面活性剂一般具有3~6的亲水亲脂平衡值(hlb)。表面活性剂在油相中的含量一般为0.1wt%~20wt%,优选为0.1%~10%。
36.适于产生油包水的液滴的表面活性剂在现有技术中已有大量报道,它们均适用于本发明所述的油相中。
37.作为本发明的一个具体且优选方面,当油是氟碳油时,表面活性剂是含氟表面活性剂,具体例如全氟辛醇、全氟癸醇、全氟十四酸、全氟聚醚羧酸及其衍生物等。
38.作为本发明的又一具体且优选方面,当油是硅油时,表面活性剂可以为非离子表面活性剂如聚乙二醇辛基苯基醚(tritonx-100)、硅氧链非离子表面活性剂如abil em90,阴离子表面活性剂如sds等。
39.作为本发明的还一具体且优选方面,当油是烃油时,表面活性剂可以为非离子表面活性剂如吐温20、吐温80、硅氧链非离子表面活性剂如abil em90,阴离子表面活性剂如sds,磷脂等。
40.由于上述技术方案运用,本发明与现有技术相比具有下列优点:本发明提供了全新的液滴生成方法,突破现有纳升量级液滴生成技术必须采用0.1毫米以下微管道的限制,用显著降低的成本即可实现小体积均一液滴的制备。
附图说明
41.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
42.附图1为根据本发明的液滴生成系统的工作原理示意图(液滴生成状态);
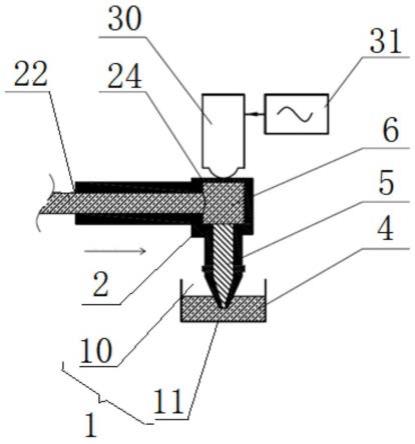
附图2为根据本发明的液滴生成系统的工作原理示意图(第三液体充满第二腔体);附图3为根据本发明的液滴生成系统的工作原理示意图(第二腔体吸入第二液体);附图4为实施例1中给出的单个加样管的结构示意图;附图5为实施例1中给出的加样管组件的结构示意图;附图6为实施例2中给出的液滴生成系统的结构示意图;附图7为采用本发明液滴生成方法制备的典型液滴(第二液体为水)的显微镜图;附图8为采用本发明液滴生成方法制备的典型液滴(第二液体为pcr试剂)的显微镜图;附图9为显示了液滴生成管靠近出口处的速度场分布的示意图;以上附图中:1、容器;10、第一腔体;11、口部;2、加样管;20、第二腔体;200、第一管腔;201、第二管腔;202、第三管腔;21、液体进出口;22、液体推注口;23、振动接入口;24、膜片;25、密封帽;26、托架;27、基体;28、连接头;29、枪头;30、压电陶瓷;31、信号源;4、第一液体;5、第二液体;6、第三液体;7、柱塞泵;8、固定件;9、连接件。
具体实施方式
43.下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
44.在本发明的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性。
45.在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。术语“管”,在没有特别限定时,泛指任何提供腔道的部件。
46.现有技术中,用于生成微液滴的微管道普遍被认为较小是有利的,因此,实际采用的微管道的内径通常都在0.1毫米以下。同时,现有技术中微液滴的生成技术主要包括共流聚焦方式和微管道振动方式,对于共流聚焦方式而言,分散相液体被振动喷射到连续相中并被连续相包裹后,一起从喷射孔喷射出形成液滴,对于微管道振动方式而言,则需要微管道(加样管)本身做往复振动以产生液滴。
47.本发明的发明人在大量的实验研究中发现,仅仅是结合分散相振动和适当内径的微管道就实现了均一液滴的制备。基于此发现,发明人进一步对于其机理进行了研究,对影响液滴生成的关键影响因素进行了仿真结构分析,并通过进一步实验进行了验证。研究表
明,本发明的液滴生成具有显著不同于现有技术的任一种液滴生成方式的全新生成原理,相比现有的液滴生成方式,该液滴生成方式可以在真正意义上实现非微流控尺度的结构(本发明披露的所有与生成过程相关的腔体和耗材的几何尺度都在0.1毫米尺度以上;一般来说0.1毫米为区分微流控的关键尺寸)生成纳升体积微滴。而现有技术中在数字pcr、单细胞分选等领域的微滴生成技术所实际能够真正使用的结构尺度都是小于或者接近纳升微滴的直径0.1毫米的。利用该液滴生成技术可以用远远大于纳米微滴尺寸的结构产生纳米级微滴,是实现微滴式数字pcr使用成本的核心技术突破。基于该液滴生成技术,甚至可以直接采用一般的移液枪头作为关键的生成耗材。该液滴生成技术,除了分散相的微运动外,无其他机械运动,我们将该技术定名为无振弹射技术(non-vibrational ejection)。本发明披露了一种通过液滴生成管道内的速度梯度造成分散相失稳而生成液滴的技术,实现了纳升精度的控制。
48.本发明的液滴生成原理描述如下:振动机构通过与膜片的直接相连来推拉膜片或者通过与膜片的接触来触动膜片,使得膜片产生周期性振动,带动腔体里面的液体(第二液体/分散相/水相)产生周期性运动,同时持续向腔体注入驱动流体(驱动油),则在加样管的液体进出口的油水界面(第一液体与第二液体之间的界面),产生包括前推弹射与回抽运动的周期性运动。在前推弹射阶段,根据管状流体特性,由泊肃叶流动可知,管中间的流速会大于近壁面的流速(如图9所示,其中显示了液滴生成管出口的速度场分布,亮度表示速度大小,可见出口中心的速度为最大,这会拉伸油水界面),导致中间界面的移动速度,大于靠近壁面的界面的移动速度,从而导致油水界面形成锥形界面,界面不断被拉长,由于油水界面处的表面张力具有收缩趋势,将界面切断成液滴的趋势,当拉伸的界面逐渐细长,根据拉普拉斯方程可知,界面张力逐渐增大,超过一定临界值即可切断界面,发生瑞利泰勒不稳定性现象,形成液滴。这也是加样管的液体进出口远远大于微滴直径(~0.1毫米)时还可以生成的关键原因。后续的回抽运动会拉回锥形界面完成一个周期运动。另外一点需要指出的是,研究发现,液滴生成的确切位置在加样管的第三管腔内(在一些具体的实验中,液滴在距离液滴进出口大约0.5毫米处生成),与其他生成技术中液滴形成在管道出口外不同。这也体现了本发明技术的独特性。
49.本发明所基于的无振弹射技术,相比采用微管道在油性液体中不断高频振动的液滴生成方法来说,具有明显优势,一方面,对微管道伸入油相液体的深度无需严格的要求,并且不会对已经生成的液滴产生破坏,整体生成过程中液滴的品质和生成的操作均更加可控;另一方面,现有技术中对于微管道内径的要求均在0.1毫米以内,内径越大,要求施加的高频摆动频率越高,控制要求高,稳定性较差,同时对于微管道本身制造时一致性的要求也越高,本发明通过对水相液体施加振动,实现液滴的生成,对于微管道的液体进出口内径的要求降低(可以大于0.1毫米,优选大于0.2毫米,特别优选0.3毫米以上),既可以保证液滴均一、控制也更加容易,显著降低了加样管加工难度和降低了加工成本。而相比共流聚焦方式来说,本发明在实现液滴生成的均一性和稳定性的前提下,系统的结构可以大大简化,结构更加简单、操作更加方便,成本显著降低。
50.下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术
人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
51.实施例1如图1所示的一种液滴生成系统,主要包括:容器1、加样管2、驱动源以及振动源。
52.容器1具有用于放置第一液体4的第一腔体10,容器1具有与第一腔体10连通的口部11。在本实施例中:容器1的底部和四周封闭,口部11开设在容器1的顶部,生成的液滴可以直接保存在容器1中,后续直接进行pcr加热循环,扩增,分析,避免了液滴的再次转移收集。
53.加样管2具有第二腔体20,加样管2上开设有分别与第二腔体20相连通的液体进出口21、液体推注口22以及振动接入口23,液体进出口21用于吸入第二液体5、第三液体6及输出第二液体5,液体推注口22用于接入驱动源,振动接入口23用于接入振动源,并且液体进出口21、振动接入口23的中心线重合,由于通过振动接入口23向第二腔体20内的第二液体5、第三液体6进行振动输入,液体进出口21、振动接入口23的中心线重合使得振动传递的距离最短,且更容易可控。图示中:加样管2具有第一管腔200、第二管腔201以及第三管腔202,第一管腔200、第二管腔201以及第三管腔202共同形成第二腔体20,其中:第一管腔200沿第一方向延伸(图示水平方向),其一端形成液体推注口22,另一端与第二管腔201相连通(图示左端);第二管腔201上开设振动接入口23(图示上端),振动接入口23处封装有膜片24;第三管腔202沿第二方向延伸(图示竖直方向),其一端与第二管腔201相连通(图示上端),另一端形成液体进出口21(图示下端),其中,第一方向、第二方向垂直,此外,第二管腔201的宽度均大于第二管腔201以及第三管腔202的宽度。
54.在本实施例中:第二腔体20靠近液体进出口21处收窄,逐渐收窄为优,或者说第三管腔202从上直下逐渐收窄。液体进出口的内径为0.1-1毫米,优选地为0.3-0.6毫米,在该范围内的内径的加样管在加工过程中比较容易保持其一致性,这样在生成液滴时,也能保证液滴大小的均一。
55.如图4所示,本实施例中的加样管2可以通过一体成型制成,单个加样管2可以作为耗材,并且配合以密封帽25,将密封帽25套设在加样管2的液体推注口22、和/或液体进出口21处保持整个加样管2的密封,在客户使用时只需要通过拿掉密封帽25与驱动源配合,液体进出口21浸入矿物油;同时给予膜片24以能量(高频振动波)就可快速形成均匀的液滴。耗材整体采用高分子材料制成保证矿物油长期稳定性保存;膜片24使用激光焊接,保证了一致性和平整性,保证能量传播过程中的一致性和精密度;密封帽25采用的热固性高分子材料丁基保证长期的密封可靠性。
56.此外,可以通过不同形式的组合:可以使用一耗材托架26,托架26上开设有多个收容腔,收容腔用于收容加样管2。在使用过程中可以根据液滴生产的数量以及实验要求,进行不同生成装置的组合,组合方式和数量不限,如图5所示,在生成液滴时进行取用。
57.驱动源连接至液体推注口22,驱动源可以采用泵体,如柱塞泵,通过三通阀与液体推注口22联通。
58.振动源施加振动至振动接入口23,振动源包括振动发生器,采用本领域常规的各种高频振动发生器,例如可以是高频机械振动发生器,如本实施例的压电陶瓷30配合信号
源31、音圈电机、mems等。
59.利用上述液滴生成系统可以制备均一稳定的液滴,具体制备方法包括以下步骤:在第一腔体10内放入第一液体4,并使第一腔体4保持静止,经具有液体进出口21的第二腔体20朝向第一液体4中输入第二液体5,其中,采用与第二液体5不混溶的第三液体6来驱动第二液体5流动并且对第三液体6施加振动,第二液体5被第一液体4包裹获得液滴并被保存在第一腔体10内,其中,第一液体4、第三液体6为连续相,第二液体5为分散相。在本实施例中:第一液体4、第三液体6为油相,如矿物油,且第一液体4中添加有表面活性剂。添加表面活性剂是优选的,有助于使得制备并保存在第一腔体10内的液滴更加稳定。第二液体5为包含了待检测生物或化学物质的水相,如样本混合物。
60.在制备过程中,第二液体的输入速度为2-200微升/分钟;优选地,第二液体的输入速度为10-50微升/分钟。振动频率为10hz-1khz;和/或振动幅度为5-300微米;优选地,振动频率为150hz-600hz;振动幅度为10-50微米,通过参数的有效控制,以制备出大小均一的液滴,并且制备更可控。
61.以下具体阐述使用本实施例的液滴生成系统生成液滴的过程:在容器1中添加具有表面活性剂的第一液体4;取一个加样管2,取下其液体推注口22、液体进出口21的密封帽25,将液体推注口22连接柱塞泵,振动接入口23施加压电陶瓷30。
62.如图2所示,通过柱塞泵,使液体进出口21产生吸力,吸取第三液体6(矿物油),使第三液体6充满第二腔室20,即充满第一管腔200、第二管腔201以及第三管腔202。
63.如图3所示,通过柱塞泵,使液体进出口21产生吸力,吸取第二液体5(样本混合物),使第二液体5充满第二腔室20的第三管腔202,第二腔室20的第一管腔200、第二管腔201内为第三液体6。
64.将第二腔室20的液体进出口21插入至容器1的第一液体4内,并且保持容器1的口部11、振动接入口23以及液体进出口21的中心线重合,且沿竖直方向延伸。
65.通过柱塞泵,推动第一管腔200、第二管腔201内的第三液体6将第三管腔202内的第二液体5,同时信号源31产生高频信号输入压电陶瓷30使之产生震动带动膜片24,震动经第三液体6传导至液体进出口21处的第二液体5,使出口液面产生震动并通过粘滞力、表面张力、压力和重力的相互作用形成液滴,同时在柱塞泵持续推动下中直到第二腔室20中的第二液体5完全推出形成均一大小的扩物质油包裹的液滴,获得直径为50-250微米的液滴,液滴下落至第一液体4中,并保存在第一腔体10中,如图1所示。生成完成后可对容器1进行pcr加热循环,扩增,分析。
66.为防止不同样本的交叉污染可更换;使用后可以将取样管2直接整体抛弃,防止污染。
67.实施例2如图6所示,本实施例提供又一种结构形式的液滴生成系统。在本实施例中:加样管2包括基体27、连接头28以及枪头29。其中:连接头28的一端(图示上端)连接至基体27上,枪头29的一端(图示上端)连接至连接头28的另一端(图示下端),即加样管2不是通过一体成型制成。第一管腔200形成在基体27内,第一管腔200的一端形成液体推注口22(图示左
端);连接头28连接至基体27上后,基体27、连接头28内共同形成第二管腔201,第一管腔200的另一端(图示右端)与基体27内的第二管腔201相连通,基体27上的第二管腔201上开设振动接入口23(图示上端),振动接入口23处封装有膜片24。枪头29内形成第三管腔202,并且枪头29的第三管腔202的口径从上端至下端逐渐收窄,下端形成内径为约0.5毫米的液滴进出口。枪头29的上端部接插在连接头28上,使枪头29的第三管腔202与连接头28内的第二管腔201相连通。枪头29为一次性使用,用完一次后即可取下进行更换。
68.在本实施例中:液体推注口22处连接柱塞泵7 ,通过液体推注口22向腔内的液体提供推注力。膜片24采用不锈钢薄膜,通过一固定件8压紧在振动接入口23处。振动源压电陶瓷30通过一连接件9连接至固定件8上,当压电陶瓷30启动进行上下往复振动时其将带动膜片24上下运动,从而对腔体内的液体产生周期性扰动。
69.采用上述装置进行液滴生成时,将枪头29插入水(试剂)液面下,柱塞泵7抽吸,带动液路中的动力油产生吸力,将水(试剂)吸入枪头29中。吸取水(试剂)完成后,移动整个模块,将枪头29前端2毫米部分插入配方油液面下,此时柱塞泵7以设定输入速度推送,带动液路中的动力油产生推力,推动水(试剂)在枪头29内移动(例如速度为36.5微升/分钟),与此同时,给压电陶瓷30通电产生振动(振动频率为150hz,振幅为50微米),通过连接件9带动不锈钢膜片24上下振动,此时枪头29的水(试剂)就会在枪头29内形成液滴,所形成的液滴进一步从枪头29被推出并进入到配方油中。如图7、图8所示,无论第二液体是纯水,还是pcr试剂,都能够获得非常均一的液滴,且液滴大小均为约105微米。
70.由以上实施例可知,本发明在液滴的制备上具有多种技术优势,包括但不限于:1、通过简单的结构即可形成均一微量的液滴,具有可重复连续制备等技术优势,在临床诊断、基因表达分析、微生物检测等场合中均能够应用,具有很好的实用性;2、液滴在加样管内即生成,在装置既定的情况下,液滴的生成效果主要受振动频率影响,对加样管内径的微小变化、对于加样管插入油相界面以下的位置、对于油相的配方组成等等均不敏感,因此,液滴生成的一致性和可控性得到显著提升;3、对加样管的内径控制要求显著下降,相应地可以明显降低成本,因此,加样管可作为耗材,防止所生成样品间的相互污染,可以采用一次性加样管;4、所制备的液滴直接保存在液滴接收容器中,无需进行转移,制备完的液滴可以直接进行pcr扩增以及分析,实现液滴生成、分析的一体化;5、上述应用可将样本分割成大小均一的微量微液滴进行检测,具有检测结果特异性高、灵敏度高、精准度高等优势;同时还可以通过对单个微液滴的检测更利于在微观层面对样本进行分析研究;6、本发明的液滴生成系统及方法应用领域广泛,可以应用的领域包括但不限于以下各方面:临床诊断:1)、无创产前诊断:通过母体游离的dna片段对胎儿遗传性疾病的检测;2)、癌症标志物检测;3)、病毒检测;4)、拷贝数变异分析;5)、突变检测。
71.基因表达分析(主是分析细胞之间遗传基因差异):1)、基因表达分析;2)、单细胞基因表达分析。
72.下一代测序方面:1)、测序结果验证;2)、测序文库质控。
73.转基因成分定量:转基因成分分析。
74.微生物检测:1)、水样微生物检测;2)、病原微生物检测。
75.上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:李昂 彭德镇 周阳
- 技术所有人:上海远赞智造医药科技有限公司 武汉爱基百客生物科技有限公司
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 2、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 3、褚老师:高分子生物材料与生物传感器,包括抗菌/抗污高分子材料、生物基高分子材料、超分子水凝胶、蛋白质材料的合成与自组装、等离子体聚合功能薄膜、表面等离子体共振光谱(SPR)、表面增强拉曼散射(SERS)生物传感器等。
- 4、廖老师:1. 晶面可控氧化铝、碳基载体及催化剂等高性能、新结构催化材料研究 2. 乙烯环氧化催化剂的研究与开发 3. 低碳不饱和烯烃的选择性氧化催化剂及工业技术开发
- 5、李老师:1. 加氢精制 2. 选择加氢 3. 加氢脱氧 4. 介孔及介微孔分子筛合成及催化应用
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....