一种数字PCR微腔芯片及制备方法与流程
一种数字pcr微腔芯片及制备方法
技术领域
1.本技术属于数字pcr技术领域,具体涉及一种数字pcr微腔芯片及制备方法。
背景技术:
2.数字pcr(polymerase chain reaction,聚合酶链式反应)是最新一代的微量核酸绝对定量工具,其原理是将反应液平均分散至皮升至纳升的微量反应体系中,在pcr循环反应之后,根据发出荧光信号的微量反应体系所占有的比例来判定原始dna浓度,实现核酸分子绝对定量,该技术灵敏度高、特异性强、定量准确,可广泛应用于临床诊断、转基因成分定量、单细胞基因表达、环境微生物检测和下一代测序等方面。
3.提供可靠、均一、高质量、高密度的反应单元是dpcr(数字pcr)的核心。当前液滴分割的技术路线按照液滴分割方法和荧光检测方法分类,主要包括微滴式,微滴芯片式和微腔芯片式。其中,微腔芯片式,通过物理分割的方式预先分割好不同的微小反应单元,然后采用拍照的方式进行荧光检测,固相分割的方法,可以保证体系大小的稳定性、均一性不会随着反应体系的变化而变化。微腔芯片式对试剂的兼容性更高,便于体外诊断企业在系统上开发自己的应用试剂盒,打造完全开放的数字pcr平台。在微腔芯片式技术路线中,对微腔构筑、表面处理以及液体进入微腔结构的方式,这两大核心决定了样本能否高效进行平均分割以及pcr反应能否顺利进行。
技术实现要素:
4.针对上述现有技术的缺点或不足,本技术要解决的技术问题是提供一种数字pcr微腔芯片及制备方法。
5.本技术通过以下技术方案来实现:
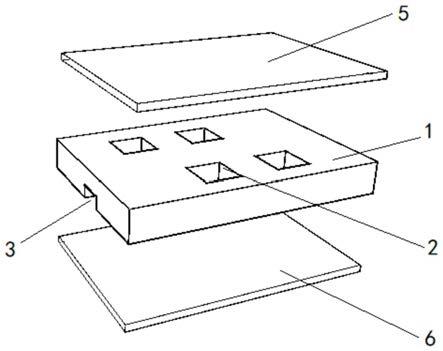
6.本技术提出了一种数字pcr微腔芯片,包括:基底、第一键合层以及第二键合层,所述基底的正面设置有多个微腔结构,所述基底的背面设有与所述微腔结构连通的流道,其中,所述第一键合层与所述基底的正面键合,所述第二键合层与所述基底的背面键合。
7.可选地,上述的数字pcr微腔芯片,其中,所述流道的设置深度小于所述微腔结构的设置深度。
8.可选地,上述的数字pcr微腔芯片,其中,所述流道的设置深度与所述微腔结构的设置深度之和等于所述基底的厚度。
9.可选地,上述的数字pcr微腔芯片,其中,所述第一键合层采用透明材料制成。
10.可选地,上述的数字pcr微腔芯片,其中,所述流道包括主流道以及与所述主流道连通的多个分支流道,所述分支流道与其对应设置的所述微腔结构连通设置。
11.可选地,上述的数字pcr微腔芯片,其中,所述主流道的宽度大于所述分支流道的宽度。
12.可选地,上述的数字pcr微腔芯片,其中,所述微腔结构通过刻蚀方式刻蚀于所述基底的正面。
13.可选地,上述的数字pcr微腔芯片,其中,所述流道通过刻蚀方式刻蚀于所述基底的背面。
14.可选地,上述的数字pcr微腔芯片,其中,所述基底采用硅基底。
15.本技术另一方面还提出了一种所述的数字pcr微腔芯片的制备方法,所述制备方法包括如下步骤:
16.在基底的正面进行微腔结构图形光刻;
17.刻蚀出所述微腔结构;
18.在基底的背面进行流道图形光刻;
19.刻蚀出所述流道;
20.在所述基底的正面和背面分别键合所述第一键合层和所述第二键合层。
21.与现有技术相比,本技术具有如下技术效果:
22.本技术通过在基底的双面分别设置微腔结构以及流道,保留了微腔芯片式的优势,液滴分样方便,便于实现高通量自动化数字pcr系统开发;并且本技术提出的双面刻蚀的工艺既可保证流道和微腔结构的制备精度,而且制备方法简单,容易实现。
23.本技术中,液体在一定的外部压力下经流道流入到微腔结构中,微腔结构内部经过表面处理,可以保证pcr反应高效进行。
24.本技术涉及基底双面刻蚀,首先在正面刻蚀出微腔结构,然后在背面刻蚀出流道,或者先在正面刻蚀出流道,然后在背面刻蚀出微腔结构,流道将与微腔结构相交,完成结构制备后,将该数字pcr微腔芯片进行封装;该数字pcr微腔芯片,在使用时,将反应液加入到芯片入口处,入口处将施加合适的外力,液体将均匀流入各微腔结构中,完成液体分割。
附图说明
25.通过阅读参照以下附图所作的对非限制性实施例所作的详细描述,本技术的其它特征、目的和优点将会变得更明显:
26.图1:本技术一实施例数字pcr微腔芯片的封装结构图一;
27.图2:本技术一实施例数字pcr微腔芯片的封装结构图二;
28.图3:本技术一实施例中微腔结构的示意图;
29.图4:本技术一实施例中流道的结构示意图;
30.图5:本技术一实施例中基底的正面俯视图。
具体实施方式
31.下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
32.如图1和图2所示,在本技术的其中一个实施例中,一种数字pcr微腔芯片,包括:基底1、第一键合层5以及第二键合层6,所述基底1的正面设置有多个微腔结构2,所述基底1的背面设有与所述微腔结构2连通的流道,其中,所述第一键合层5与所述基底1的正面键合,所述第二键合层6与所述基底1的背面键合。本实施例通过在基底1的双面分别设置微腔结
构2以及流道,保留了微腔芯片式的优势,液滴分样方便,便于实现高通量自动化数字pcr系统开发。
33.在本实施例中,所述基底1优选地采用硅基底1。
34.进一步地,所述微腔结构2通过刻蚀方式刻蚀于所述基底1的正面,所述流道通过刻蚀方式刻蚀于所述基底1的背面。本实施例利用半导体刻蚀的方法可以方便地在基底1上形成体积一致的微腔结构2,这一微腔结构2可作为数字pcr的反应腔室。同时,可在每个微腔结构2旁可刻蚀出一定深度的流道,pcr反应液可以通过外力经过流道引流到微腔结构2中,可以实现数字pcr反应液的均一分样。
35.其中,在本实施例中,所述流道的设置深度小于所述微腔结构2的设置深度,上述结构可增加所述微腔结构2的毛细力,使得pcr反应液更加容易地被导流至所述微腔结构2中。
36.如,在一实施例中,所述基底1的设置厚度为300μm,所述流道的设置深度可以是100μm,所述微腔结构2的设置深度为200μm。
37.其中,在本实施例中,优选地,所述流道的设置深度与所述微腔结构2的设置深度之和等于所述基底1的厚度,这样可以保证所述流道与所述微腔结构2相连通,可以将pcr反应液导流至所述微腔结构2中。
38.如图4和图5所示,所述流道包括主流道3以及与所述主流道3连通的多个分支流道4,所述分支流道4与其对应设置的所述微腔结构2连通设置。在本实施例中,所述分支流道4的设置数量并不做限定,所述分支流道4的设置数量与所述微腔结构2的设置数量相同。其中,所述微腔结构2的布设方式可以按照矩形阵列的方式布设,如图3所示,该布设方式仅为举例说明,并不对本技术的保护范围进行限定。
39.进一步地,所述主流道3的宽度大于所述分支流道4的宽度。如,在一实施例中,所述主流道3的刻蚀宽度可以是100μm,所述分支流道4的刻蚀宽度可以是20μm。
40.其中,所述第一键合层5采用透明材料制成,如采用透明玻璃制成。所述第一键合层5的设置,在保证pcr反应后,对所述微腔结构2的荧光观测顺利进行。
41.本实施例对所述第二键合层6的制作材料并不做限定,以所述第二键合层6能与所述基底1发生键合为宜,其中,所述第二键合层6可采用,如玻璃、塑料等等。
42.本实施例另一方面还提出了一种所述的数字pcr微腔芯片的制备方法,所述制备方法包括如下步骤:
43.在基底1的正面进行微腔结构2图形光刻;
44.刻蚀出所述微腔结构2;
45.在基底1的背面进行流道图形光刻;
46.刻蚀出所述流道;
47.在所述基底1的正面和背面分别键合所述第一键合层5和所述第二键合层6。
48.在半导体刻蚀过程中,大致步骤有:涂光刻胶-光刻-hm刻蚀-去胶-清洗等步骤;在本数字pcr微腔芯片中,如果要构建不同深度的流道和微腔结构2,需要分两步进行。先进行沟道刻蚀,刻蚀后于沟道图形上通过再次涂胶-光刻-刻蚀等步骤进行微腔结构2的二次刻蚀;或者先进行微腔结构2的刻蚀,获得大密度的微腔结构2后,再于微腔结构2的图形上经过再次涂胶-光刻-刻蚀等步骤进行流道的二次刻蚀。但是这种方法存在一些弊端:1)二次
刻蚀的图形需要与第一次刻蚀的图形进行严格的对准;2)二次刻蚀时,已经有的图形(微腔结构2或流道)会影响光刻胶的旋涂均一性,影响二次刻蚀图形的精度和均一性;3)二次刻蚀时,仍需要旋涂光刻胶,光刻胶将进入流道或者微腔结构2中,给后续清洗增加了麻烦。本实施例采用双面刻蚀的方法以避免上述技术缺陷。具体地,首先通过涂胶-光刻-刻蚀等步骤在基底1上刻蚀出高密度的微腔结构2,为避免现有图形对后续二次刻蚀的影响;在背面进行流道的刻蚀,通过涂胶-光刻-刻蚀等步骤实现流道的构建,保证流道的深度与微腔结构2的深度之和等于基底1的厚度。这样即可保证流道可与微腔结构2相连,可将反应液导流至微腔结构2中。实现流道和微腔结构2的刻蚀之后,将用透明塑料或玻璃对硅片进行双面封装,保证pcr反应后,对微腔结构2的荧光观测可顺利进行。
49.其中,对于双面刻蚀的先后顺序本实施例并不做限定,可以先进行正面刻蚀,也可以先进行背面刻蚀。以下通过两个实施例对上述制备方法进行详细描述。
50.实施例1
51.本实施例使用双面刻蚀工艺制备数字pcr微腔芯片。具体地,包括如下步骤:
52.步骤一,取300μm厚的硅片晶圆基底1,经过ipa等溶剂清洗;
53.步骤二,在所述基底1的正面进行微腔结构2的图形光刻,经过涂胶、曝光、显影等步骤;
54.步骤三,深硅刻蚀:刻蚀出如图1和图3所示的微腔结构2,深度约200μm,微腔结构2的直径约100μm;
55.步骤四,通过干法、湿法方式清洗去胶;
56.步骤五,在所述基底1的背面进行流道图形光刻,经过涂胶、曝光、显影等步骤;
57.步骤六,刻蚀出如图2和图5所示的流道,深度约100μm,可与微腔结构2相交,主流道3的宽度约100μm,支流道宽度约20μm;
58.步骤七,双面刻蚀完成后,将芯片进行亲水图层修饰;
59.步骤八,采用透明玻璃和玻璃与基底1进行键合。
60.步骤九,键合后,通过流道面将数字pcr反应液通过外力输送至流道内及微腔结构2内;
61.步骤十,经过pcr扩增后,光学系统将通过微腔面获取荧光图像,进行后续分析。
62.实施例2
63.本实施例使用双面刻蚀工艺制备数字pcr微腔芯片。具体地,包括如下步骤:
64.步骤一,取300μm厚的硅片晶圆基底1,经过ipa等溶剂清洗;
65.步骤二,在所述基底1的背面进行流道图形光刻,经过涂胶、曝光、显影等步骤;
66.步骤三,刻蚀出如图2和图5所示的流道,深度约100μm,主流道32宽度约100μm,支流道宽度约20μm;
67.步骤四,通过干法、湿法方式清洗去胶;
68.步骤五,在所述基底1的正面进行微腔结构2的图形光刻,经过涂胶、曝光、显影等步骤;
69.步骤六,深硅刻蚀:刻蚀出如图1和图3所示的微腔结构2,与流道相交,深度约200μm,微腔结构2的直径约100μm;
70.步骤七,双面刻蚀完成后,将芯片进行亲水图层修饰;
71.步骤八,采用透明玻璃和玻璃与基底1进行键合。
72.步骤九,键合后,通过流道面将数字pcr反应液通过外力输送至流道内及微腔结构2内;
73.步骤十,经过pcr扩增后,光学系统将通过微腔面获取荧光图像,进行后续分析。
74.本技术采用双面刻蚀的方法,在所述基底1的正面和背面分别刻蚀出微腔结构2以及流道,并将该数字pcr微腔芯片进行封装;该数字pcr微腔芯片,在使用时,将反应液加入到芯片入口处,入口处将施加合适的外力,液体将均匀流入各微腔结构2中,即可完成液体分割。保证pcr反应后,对微腔结构2的荧光观测可顺利进行。
75.在本技术的描述中,除非另有明确的规定和限定,术语“相连”、“连接”、“固定”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或成一体;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本技术中的具体含义。
76.在本技术中,除非另有明确的规定和限定,第一特征在第二特征之“上”或之“下”可以包括第一和第二特征直接接触,也可以包括第一和第二特征不是直接接触而是通过它们之间的另外的特征接触。而且,第一特征在第二特征“之上”、“上方”和“上面”包括第一特征在第二特征正上方和斜上方,或仅仅表示第一特征水平高度高于第二特征。第一特征在第二特征“之下”、“下方”和“下面”包括第一特征在第二特征正下方和斜下方,或仅仅表示第一特征水平高度小于第二特征。
77.在本实施例的描述中,术语“上”、“下”、“左”、“右”、等方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述和简化操作,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本技术的限制。此外,术语“第一”、“第二”仅仅用于在描述上加以区分,并没有特殊的含义。
78.以上实施例仅用以说明本技术的技术方案而非限定,参照较佳实施例对本技术进行了详细说明。本领域的普通技术人员应当理解,可以对本技术的技术方案进行修改或等同替换,而不脱离本技术技术方案的精神和范围,均应涵盖在本技术的权利要求范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1