脂质膜包裹的复合聚集体的纯化方法与流程
背景技术:
0、技术背景
1、术语“复合聚集体(complex assemblage)”在生物学领域中指结构上组织化的实体,其含有多于一种的生物分子,并且通常含有多于一类的生物分子,例如蛋白质、碳水化合物和核酸等。一些复合聚集物被脂质膜包围,例如细胞囊泡,细胞外囊泡和脂质包被的病毒(lipid-enveloped viruses)。大多数的尺寸范围在约30nm至约300nm,其中一些可达10倍或更大倍。
2、最近的实验表明,脂质膜包裹的化合物聚集体(lipid-membrane-enclosedcompound assemblages,lmcas)的未纯化制剂伴有一类包含其降解残留物的特殊污染物[1,2]。通过特定lmca的特异性蛋白质标记物的免疫染色来检测它们。尺寸排阻色谱法表明,大多数此类残留物的尺寸范围为约2nm至约50nm。
3、染色质代表了细胞培养收获物中一类已知污染物。它由含有宿主细胞dna和组蛋白的降解核小体阵列组成[3]。它通常继发结合rna和其他蛋白质,从而产生杂聚物(heteroaggregates),其中“杂聚物”一词被理解为多于一类生化物质的无组织复合物。已知细胞培养收获物中残留的染色质杂聚物存在于2nm至5微米以上的范围内。用0.45微米膜过滤可以将该范围的上限降低至约400nm。
4、最近的实验数据表明,染色质杂聚物的一特定子集包含lmca的降解残留物[4]。这种染色质杂聚物的扩展类别由其包含的给定种类化合物聚集体的特征性lmca膜蛋白标记物,连同其染色质成分中过量的表面可及核酸(surface-accessible nucleic acids)限定。过量核酸的表面可及性是这些杂聚物的关键限定特征。许多种类的lmca都包含核酸,但是只要lmca保持完整,核酸就被包裹在脂质膜内。包含lmca残留物的染色质杂聚物大小从小于100nm到大于1000nm不等[4]。
5、包含lmca残留物的染色质杂聚物对治疗用lmca的生产造成特殊的问题。这种杂聚物会导致免疫学测定中完整lmca的表观含量被夸大。这对于通过lmca膜蛋白识别lmca的亲和色谱法来说也是问题,因为含有这些蛋白的染色质杂聚物也会被捕获。lmca和含有lmca残留物的染色质杂聚物的尺寸重叠也使得基于尺寸的纯化方法无法将它们分离。
6、阴离子交换色谱法有将lmca与含有lmca残留物的染色质杂聚物分离的潜力,但其用途仅限于外部由核酸残留物(1-3)高度主导的杂聚物。此类杂聚物通常不会在氯化钠中洗脱,但完整的lmca会被洗脱。表面具有较少量核酸的含有lmca残留物的染色质杂聚物会与完整的lmca共洗脱[4](图1)。这对lcma治疗应用来说是重要的问题,因为全世界的监管机构都一直要求将污染的dna减少到极低的水平。
7、有时lmca会出现其他的纯化难点,即将外膜小叶中含有过量磷脂酰丝氨酸的lmca和外膜小叶中缺乏磷脂酰丝氨酸的lmca分开。外膜小叶中过量的磷脂酰丝氨酸是某一lmca源细胞发炎、感染、病变、垂死(dying)或死亡(dead)的指标[5]。目前还没有已知的色谱法可以将外膜表面没有磷脂酰丝氨酸的lcma和外膜表面有磷脂酰丝氨酸的lcma分离。
8、发明概述
9、本发明涉及从染色质杂聚物(包含样品中lmca的降解残留物)中分离脂质膜包裹化合物聚集体(lmca)的色谱法,该方法包括以下步骤:
10、-将样品与表面具有阳离子金属亲和配体的色谱材料接触,所述色谱材料带有三价铁、锰、钙或镁离子,并用平衡缓冲液平衡,
11、-施用梯度的含有非金属螯合盐的第一洗脱缓冲液,从而
12、-洗脱lmca。
13、在本发明的方法的实施例中,lmca可以选自:细胞囊泡、细胞外囊泡、非细胞囊泡、细胞器、外泌体、小细胞外囊泡、微囊泡,中细胞外囊泡、核糖体、线粒体、脂质包被的病毒或脂质包被的病毒样颗粒、流感病毒、冠状病毒、慢病毒、巨细胞病毒、脂质体及它们的组合。
14、在本发明方法的另一实施例中,非金属螯合盐是单价卤化物盐,特别是氯化钠。
15、在本发明方法的另一实施例中,所述样品可以是细胞培养收获物、已过滤的细胞培养收获物、已浓缩过滤的细胞培养收获物、含有lmca和染色质杂聚物的部分纯化的制剂,所述染色质杂聚物包含lmca残留物。
16、在本发明方法的另一实施例中,包含lmca降解残留物的染色质杂聚物在含有螯合盐的第二洗脱缓冲液中梯度洗脱。
17、在本发明方法的另一实施例中,所述第二洗脱缓冲液的螯合盐选自:金属磷酸盐、或金属柠檬酸盐、或乙二胺四乙酸(edta)的金属盐、或乙二醇-双(β-氨基乙基醚)-n,n,n',n'-四乙酸,也称为依他酸(egtazic acid,egta)的金属盐及它们的组合。
18、在本发明方法的另一实施例中,所述方法与至少一种减少染色质杂聚物含量的其他方法组合。
19、在本发明方法的另一实施例中,所述至少一种其他方法可以是用核酸酶处理和/或用带有阴离子色谱配体的固相处理。
20、在本发明的方法的另一实施例中,带有阴离子色谱配体的固相带有铁或锰离子。
21、在本发明方法的另一实施例中,样品与色谱材料接触,并在孵育时间后与色谱材料分离。
22、在本发明方法的另一实施例中,所述样品,特别是含有外泌体的细胞培养收获物可以通过切向流过滤进行渗滤。
23、在本发明方法的另一实施例中,所述阳离子金属亲和配体可以是三(2-氨基乙基)胺(tren)。
24、在本发明方法的另一实施例中,平衡缓冲液的ph范围在ph 5至ph 9,或ph 6至ph8,或优选ph 6.5至ph 7.5之间,其电导率值为1ms/cm至250ms/cm,或2ms/cm至100ms/cm,或3ms/cm至50ms/cm,或4ms/cm至20ms/cm,或优选5ms/cm至10ms/cm。
25、本发明是从染色质杂聚物中分离完整的脂质膜包裹的化合物聚集体(lmca)的色谱法,所述染色质杂聚物包含lmca的降解残留物。令人惊讶的是,阳离子金属亲和配体优选带有三价铁或锰离子,可以与非金属螯合盐(例如氯化钠)梯度洗脱完整的lmca。包含lmca降解残留物的染色质杂聚物被更牢固地保留。有些可以用螯合盐(例如磷酸钠)梯度洗脱。剩余的可以用氢氧化钠洗脱。本发明的扩展改变方式将本发明与一种或多种减少染色质杂聚物含量的其他方法组合,所述其他方法例如用核酸酶处理和/或用优选带有铁或锰离子的阴离子色谱配体的固相处理。
26、本发明的诸要素在以下非限制性实施例中说明:
27、在说明核心方法的一个实施例中,给阳离子金属亲和色谱柱负载用三价铁离子,然后平衡至大概的生理条件。将含有外泌体(lmcas)的过滤细胞培养收获物施用到平衡的阳离子金属亲和柱上,然后用平衡缓冲液洗涤该柱。完整的外泌体被氯化钠梯度洗脱。在该方法的可选扩展方式中,含有lmca残留物的染色质杂聚物可以用磷酸钠梯度洗脱。用naoh清洁色谱柱。
28、在说明该方法的进一步扩展改变形式的实施例中,给阴离子金属亲和固相负载三价铁离子,然后平衡至大概的生理条件。将含有外泌体的细胞培养收获物与固相接触,孵育1小时,然后与固相分离。主要的染色质子集,包含与lmca降解残留物相关的染色质杂聚物,仍然与带有三价铁的阴离子金属亲和固相结合,从而被去除。然后通过本发明的核心方法处理经处理的收获物。
29、在说明所述方法的进一步扩展改变形式的实施例中,通过切向流过滤对含有外泌体的细胞培养收获物作渗滤,使之处于最适合核酸酶的条件下。膜孔径是可以保留所需的lmca的最大孔径,以便可以通过孔去除较小的污染物。然后用核酸酶处理已渗滤的收获物。重新开始切向流过滤,以去除由核酸酶处理作用释放的核苷酸以及由dna裂解释放的组蛋白。如果需要,可以浓缩含外泌体的渗余物。然后通过本发明的核心方法处理经处理的收获物。
30、在说明该方法的化合物扩展改变形式的实施例中,给阴离子金属亲和固相负载三价铁离子,然后平衡至大概的生理条件。将含有外泌体的细胞培养收获物与固相接触,孵育1小时,然后与固相分离。主要的染色质子集,包含与lmca降解残留物相关的染色质杂聚物,仍然与带有三价铁的阴离子金属亲和固相结合,从而被去除。它们的去除有助于经处理收获物的可过滤性。将已处理的收获物浓缩,并通过切向流过滤将其渗滤至最适合核酸酶的条件。膜孔径是可以保留所需的lmca的最大孔径,以便可以通过孔去除较小的污染物。然后用核酸酶处理已渗滤的收获物。重新开始切向流过滤,以去除由核酸酶处理作用释放的核苷酸以及由dna裂解释放的组蛋白。如果需要,可以浓缩含外泌体的渗余物。然后通过本发明的核心方法处理经处理的收获物。
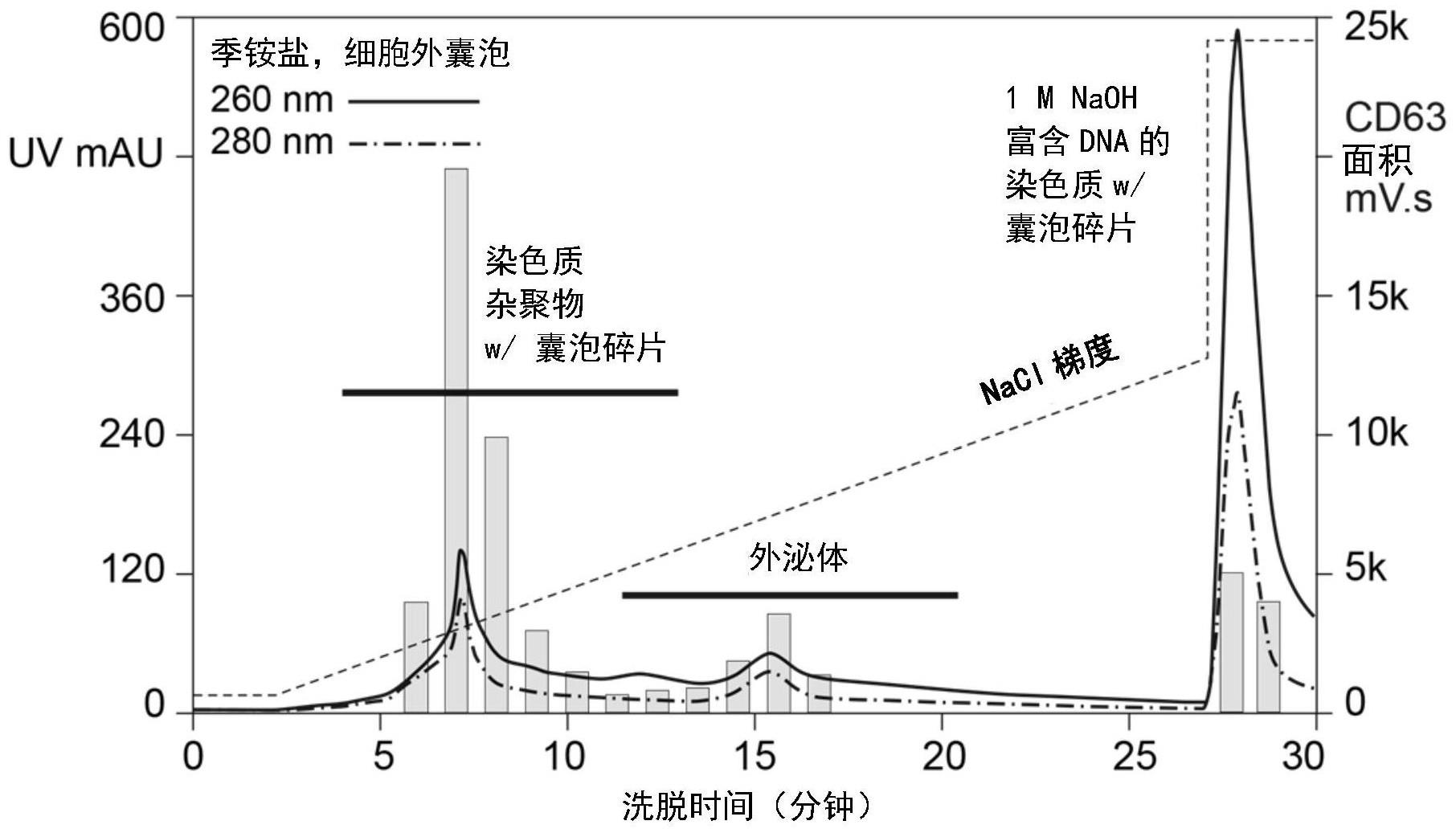
31、附图简要说明
32、图1.描绘了外泌体和外泌体片段-染色质混合物从阴离子交换色谱柱上的洗脱。
33、图2.描绘了外泌体和外泌体片段-染色质污染物从带有三价铁离子的阳离子金属亲和色谱柱上的洗脱,其中外泌体在氯化钠中梯度洗脱,而外泌体片段-染色质污染物在磷酸盐中梯度洗脱或随后在氢氧化钠中洗脱。
34、本发明的详细描述
35、在一个实施例中,有待通过本发明方法处理的lmca包括细胞囊泡,或细胞外囊泡,或非细胞囊泡或细胞器。在一个这样的实施例中,有待通过本发明方法处理的lmca包括外泌体,或小细胞外囊泡,或微囊泡,或中细胞外囊泡,或核糖体,或线粒体。在另一实施例中,有待通过本发明方法处理的lmca包括脂质包被的病毒或脂质包被的病毒样颗粒。在一个这样的实施例中,有待通过本发明方法处理的lmca包括流感病毒,或冠状病毒,或慢病毒,或巨细胞病毒,或其他脂质包被的病毒。
36、在一个实施例中,有待通过本发明方法处理的包含lmca的样品是已过滤的细胞培养收获物,或已浓缩过滤的细胞培养收获物,或含有所需lmca和染色质杂聚物的部分纯化的制剂,所述染色质杂聚物包含lmca残留物。在一个实施例中,所述样品是经处理减少核酸含量的细胞培养收获物。在样品经处理以减少核酸含量的实施例中,减少核酸含量的方法可以是用核酸酶处理。在样品经处理以减少核酸含量实施例中,减少核酸含量的方法可以是用带有金属离子的阴离子金属亲和固相处理。在一个这样的实施例中,所述阴离子金属亲和配体是亚氨基二乙酸(ida)。在另一个这样的实施例中,所述阴离子金属亲和配体是次氮基三乙酸(nta)。在一个这样的实施例中,用于负载阴离子金属亲和配体的金属离子优选三价铁或锰离子。在一个这样的实施例中,阴离子金属亲和配体共价连接的固相是颗粒、或纤维、或膜、或整料(monolith)、或其他构型、或混合构型,其中任何一种都可装入色谱柱中,包括色谱装置。
37、在一个实施例中,共价连接至固相、柱或柱填料的阳离子金属亲和配体是三(2-氨基乙基)胺(tren)。
38、在一个实施例中,阳离子金属亲和配体带有二价或三价金属离子,例如钙、镁、锰或优选三价铁。
39、在一个实施例中,将带金属离子的阳离子金属亲和固相平衡至ph范围在ph 5至ph9,或ph 6至ph 8,或优选ph 6.5至ph 7.5之间,以及电导率值为1ms/cm至250ms/cm,或2ms/cm至100ms/cm,或3ms/cm至50ms/cm,或4ms/cm至20ms/cm,或优选5ms/cm至10ms/cm。对于本领域的技术人员来说显而易见的是,对接近生理条件的偏好在一定程度上是为了维持所需lmca的稳定性。本发明方法的化学选择性,与lmca稳定性问题无关,在更宽的ph值和电导率范围内保持。
40、在一个实施例中,将含有非金属螯合盐的洗脱缓冲液流过柱子来洗脱lmca,其中所述盐是单价金属卤化物,例如氯化钠,或氯化钾,或其他单价金属卤化物,或乙酸钠或其他单价金属乙酸盐,或其他非螯合盐,优选氯化钠。在一个这样的实施例中,氯化钠的浓度在0.5m至2.0m,或0.75m至1.5m,或1.0m至1.25m,或0.8m至1.2m,或0.9m至1.1m范围内。在另一个这样的实施例中,氯化钠的浓度连续地或逐步地增加至0.5m至2.0m,或0.75m至1.5m,或1.0m至1.25m,或0.8m至1.2m,或0.9m至1.1m的终浓度范围。在任何这些实施例中,工作ph可以与平衡缓冲液的相同,优选在6.5至7.5的范围内。
41、在一个实施例中,含有lmca残留物的染色质杂聚物在洗脱lmca后的单独步骤中被洗脱。在一个这样的实施例中,含有lmca残留物的染色质杂聚物被具有螯合金属能力的盐洗脱。在一个这样的实施例中,含有lmca残留物的染色质杂聚物被500mm的磷酸钠,或1m的磷酸钾,或其他单价金属磷酸盐,或单价金属柠檬酸盐,或乙二胺四乙酸(ethylenediaminetetraacetic acid,edta)的单价金属盐,或乙二醇-双(β-氨基乙基醚)-n,n,n',n'-四乙酸,也称为依他酸(egtazic acid,egta),的单价金属盐或其组合梯度洗脱。在一些这样的实施例中,螯合盐可以与非螯合盐混合,例如单价金属卤化物盐或金属乙酸盐。
42、在一个实施例中,本发明的带金属的阳离子金属亲和柱可以在单次操作中作磷酸盐、柠檬酸盐、edta、egta或其组合的一步或梯度洗脱,而无需预先使用单价金属卤化物,或单价金属乙酸盐,或其他非螯合盐洗脱。
43、在一个实施例中,洗脱lmca可以一步进行,用足够高浓度的非螯合盐来洗脱大部分完整的lmca并将其浓缩在一个馏分中。在另一个实施例中,洗脱lmca可以在一系列步骤中进行,其中最终步骤中包含足够高浓度的非螯合盐,以洗脱大部分完整的lmca,而中间步骤包含连续增加的盐浓度,目的是将所需的完整的lmca与污染物分离。在另一个实施例中,洗脱lmca可以在所谓线性梯度的方法下进行,即非螯合盐的浓度连续增加至足以洗脱大部分完整lmca的终点浓度。
44、在一个实施例中,洗脱染色质杂聚物可以通过一步、一系列步骤,或线性梯度地增加螯合盐的浓度至足以洗脱目标物质的终点浓度来进行。
45、在一个实施例中,本发明的方法用于分级分离细胞外囊泡。在一个这样的实施例中,本发明的方法用于纯化外泌体。在一个这样的实施例中,完整的外泌体在氯离子存在下从负载铁的阳离子金属亲和柱,如tren柱中洗脱。在一个这样的实施例中,包含外泌体的残留物和/或其他细胞外囊泡物质的染色质杂聚物在磷酸根离子存在下洗脱。在涉及细胞外囊泡分级分离的另一个实施例中,本发明的方法用于将细胞外膜小叶中缺乏磷脂酰丝氨酸的细胞外囊泡(包含外泌体)和细胞外膜小叶中含有过量磷脂酰丝氨酸的细胞外囊泡(包含外泌体)分级分离。在一个这样的实施例中,细胞外膜小叶中缺乏磷脂酰丝氨酸的细胞外囊泡在氯化钠中洗脱,而细胞外膜小叶中含有过量磷脂酰丝氨酸的细胞外囊泡在磷酸钠中洗脱。在一个这样的实施例中,本发明的方法用于选择性地浓缩磷脂酰丝氨酸阳性外泌体,以提高(检测)磷脂酰丝氨酸阳性外泌体存在的诊断实验的敏感性和准确性。
46、在一个实施例中,本发明的方法用于从染色质杂聚物中分级分离所需的脂质包被的病毒,所述染色质杂聚物包含脂质包被病毒的降解残留物以及细胞外囊泡的降解残留物。
47、在一个实施例中,可以被进一步处理通过本发明方法处理的lmca以减少任何残留的污染物种类的含量。用于该目的的后续方法可以包括过滤法、沉淀法和色谱法。在一个实施例中,在后续纯化方法是色谱法的情况下,色谱法可以是尺寸排阻色谱法,或阴离子交换色谱法,或其他色谱法。
48、本领域的技术人员将理解,因为柱上的正电荷和三价铁离子对磷酸盐残基的高亲和力,本发明的负载三价铁离子的阳离子金属亲和柱对内毒素具有高亲和力。因此可以预期,相对于原始样品中的内毒素水平,用非螯合盐中洗脱的lmca将高度缺乏内毒素。
49、实施例
50、实施例1
51、通过本发明的方法分级分离细胞外囊泡
52、用三价铁离子负载阳离子金属亲和整料(tren),然后用15个柱体积(cv)的50mmhepes,20mm nacl,ph 7.0进行平衡。将含有外泌体(小细胞外囊泡(lmca))、染色质和杂聚物(包含染色质和降解的囊泡部分)的混合物的已过滤哺乳动物细胞培养收获物装载到色谱柱上。用平衡缓冲液将未结合的样品组分从柱上冲洗出来,然后通过一步法将柱子洗脱至1.0m氯化钠(50mm hepes,ph 7.0),持续5cv。用原始平衡缓冲液重新平衡该柱,之后进行第二次洗脱步骤,以500mm磷酸钠,ph 7.0为终点,并继续用5cv 500mm磷酸盐冲洗。将色谱柱恢复到原始平衡条件,然后用30cv 1m naoh和2m nacl清洁。色谱图如图2所示。一群细胞外囊泡在nacl中洗脱。尽管磷酸盐洗脱的电导率低于氯化物洗脱的,但第二个峰在磷酸盐中洗脱。这突出表明,磷酸盐洗脱会选择氯化钠无法去除的不同细胞外囊泡群体。该洗脱模式不同于阴离子交换色谱法(季铵盐的阴离子交换色谱法如图1所示)。
53、实施例2
54、从染色质杂聚物(包含lmca的降解残留物)中分离所需的外泌体群体(lcma)
55、用三价铁离子负载阳离子金属亲和整料(tren),然后用15cv的50mm tris,20mmnacl,ph 7.5平衡。将含有外泌体、染色质和杂聚物(包含染色质和降解的囊泡部分)的混合物的已过滤哺乳动物细胞培养收获物装载到色谱柱上。用平衡缓冲液将未结合的样品组分从柱中冲洗出来,用20cv线性梯度洗脱色谱柱至50mm tris,1.0m氯化钠,ph 7.0,然后在这些条件下继续冲洗5cv。然后用1m naoh加2m nacl清洗色谱柱。
56、实施例3
57、从磷脂酰丝氨酸阴性外泌体中分离磷脂酰丝氨酸阳性外泌体群体(lcma)
58、用三价铁离子负载阳离子金属亲和整料(tren),然后用15cv的50mm tris,20mmnacl,ph 7.5平衡。将含有磷脂酰丝氨酸阳性外泌体和磷脂酰丝氨酸阴性外泌体混合物的已过滤哺乳动物细胞培养收获物施加于色谱柱上。未结合的样品成分从色谱柱中冲洗出来。通过用50mm tris,1.0m氯化钠,ph 7.0冲洗步骤除去磷脂酰丝氨酸阳性外泌体,然后在这些条件下继续冲洗5cv。任选将柱子重新平衡至其原始平衡条件。磷脂酰丝氨酸阳性外泌体可以通过用1m磷酸钾洗脱色谱柱来回收。然后用1m naoh加2m nacl清洗色谱柱。
59、实施例4
60、从染色质杂聚物(包含lmca的降解残留物)中分离所需的脂质包被的病毒(lcma)
61、用三价铁离子负载阳离子金属亲和整料(tren),然后用15cv的50mm tris,20mmnacl,ph7.5平衡。将含有冠状病毒、染色质和杂聚物(包含染色质和降解的lmca残留物)的混合物的已过滤哺乳动物细胞培养收获物装载到色谱柱上。用平衡缓冲液将未结合的样品组分从柱中冲洗出来,用20cv线性梯度洗脱色谱柱至50mm tris,1.0m氯化钠,ph 7.0,然后在这些条件下继续冲洗5cv。然后用1m naoh加2m nacl清洗色谱柱。
62、实施例5
63、在进行本发明的纯化外泌体的方法之前减少染色质
64、将负载三价铁离子的含亚氨基二乙酸的颗粒平衡至20mm tris,50mm nacl,ph7.5。将它们与含有外泌体和污染物的已过滤细胞培养收获物以5%颗粒比例混合,并混合孵育2小时。使颗粒沉降,用0.45μm膜过滤器过滤上清液。去除固体有利于上清液的过滤,通过采用孔径范围在300kda至750kda的正切向流动过滤(tff),使其浓度达到20-100倍。在tff期间,将缓冲液组成变更为20mm tris,20mm nacl,ph 7.5,之后通过实施例2中所述的本发明方法处理样品。
65、实施例6
66、在进行本发明的纯化外泌体的方法之前减少染色质
67、将负载三价铁离子的含亚氨基二乙酸的颗粒平衡至20mm tris,50mm nacl,ph7.5。它们与含有外泌体和污染物的已过滤细胞培养收获物以5%颗粒比例混合,并混合孵育2小时。使颗粒沉降,用0.45μm膜过滤器过滤上清液。去除固体有利于上清液的过滤,通过采用孔径范围在300kda至750kda的正切向流动过滤,使其浓度达到20-100倍。在tff期间,将缓冲液组成变更为20mm tris,500mm氯化钠,5mm氯化镁,ph 7.5。用耐盐核酸酶处理样品,然后重新启动tff以除去释放的核苷酸、组蛋白和过量的镁离子,同时将缓冲液组成改变为50mm tris,20mm氯化钠,ph 7.5。在该步骤中,样品可以进一步被浓缩。通过实施例2中所述的本发明方法处理样品。
68、实施例7
69、在进行本发明的外泌体纯化方法后减少染色质
70、在进行实施例5或实施例6的方法之后,按照实施例2所述的本发明的方法,将样品稀释或缓冲液交换至接近50mm tris、20mm氯化钠、ph 7.5的条件。将强阴离子交换柱平衡到这些条件并装载样品。外泌体以20cv线性梯度至1m nacl从色谱柱中洗脱。然后用1mnaoh清洁色谱柱。其他处理步骤进一步降低染色质和其他污染物水平。
71、参考文献
72、本文所引用的所有参考文献都通过引用完全纳入,纳入程度与本文明确的观点不相抵触。
73、[1]k vrabec,t lojpur,p gagnon,外泌体纯化和过程监测的新兴工具(emergingtools for exosome purification and in-process monitoring),bioprocessinternational ebook,2019年3月22日,https://bioprocessintl.com/analytical/downstream-validation/emerging-tools-for-exosome-purification-and-in-process-monitoring
74、[2]p gagnon,k vrabic,t lojpur,a strancar,为外泌体纯化平台奠定基石(setting acornerstone for platform purification of exosomes),bioprocessinternational 18(2020)28-51,https://bioprocessintl.com/downstream-processing/separation-purification/setting-a-cornerstone-for-exosome-purification-platform
75、[3]p gagnon,r nian,j lee,l tan,sm abdul-latiff,cl lim,c chuah,x bi,ysyan,w zhang,ht gan,染色质与免疫球蛋白g和蛋白a的非特异性相互作用及其对纯化工作的影响(nonspecific interactions of chromatin with immunoglobulin g andprotein a,and their impact on purification performance),j chromatogr a 1340(2014)68-78。
76、[4]s staubach,p gagnon,k vrabec,t lojpur,s peljhan,b giebel,astrancar,以外泌体疗法为基础的工业工艺发展中的挑战:特征和管理多样性(challengesin industrial process development of exosome-based therapies:characterizingand managing diversity),bioprocess international,2020,https://bioprocessintl.com/analytical/downstream-development/classification-of-extracellular-vesicles-using-chromatography-for-exosome-therapy-production
77、[5]r sharma,x huang,r brekken,a schoit,检测磷脂酰丝氨酸阳性外泌体以诊断早期恶性肿瘤(detection of phosphatidylserine-positive exosomes fordiagnosis of early-stage malignancies),br j cancer 117(2017)545-552。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!