一种亚硫酸镁催化氧化剂的制备方法和用途
1.本发明涉及固体废物资源化技术领域,特别是涉及一种亚硫酸镁催化氧化剂的制备方法和用途。
背景技术:
2.湿法烟气脱硫(wfgd)是现阶段so2污染的主要控制技术,也是世界上唯一大规模商业化应用的脱硫方式,同时,其在经济效益、技术成熟度上占据着重要优势地位。目前控制so2排放的湿法脱硫工艺主要有如下几种:双碱法烟气脱硫技术、石灰石-石膏湿法脱硫技术、氧化镁烟气脱硫技术、氨法脱硫技术等。
3.湿式镁法脱硫多采用对冲式气液两相流反应方式,因此脱硫效率高,经验证其脱硫效率可高达98%以上,技术成熟,具有较高的运行可靠性。运行费用低,脱除同样的二氧化硫,氧化镁的用量仅是石灰石法碳酸钙用量的40%。但湿法烟气脱硫普遍存在的难题之一是脱硫副产物亚硫酸盐的回收和资源化问题,由于副产物成分过于复杂、重金属等有害物质含量过高及处理技术局限等问题致使绝大多数的脱硫副产物只能通过填埋废弃的方式被处置,只有少量通过加工后用于建筑材料、土壤改良、农用肥料等领域。脱硫副产物-亚硫酸盐大多采用非催化氧化的方式进行处理,氧化效率较低。因此,相关机构及学者将研究重心转移到催化剂的研发。
4.加入催化剂(金属离子)对亚硫酸盐进行催化氧化反应的过程中,亚硫酸盐氧化按照如下过程进行:
5.so
32-+me
z+
→
·
so
32-+me
(z-1)+
;
6.·
so
32-+o2→
·
so
5-;
7.so
32-+
·
so
5-→
so
3-+
·
so
52-;
8.so
32-+
·
so
52-→
2so
42-。
9.现今对于研究亚硫酸盐催化氧化,证实具有良好催化效果的催化剂一般为过渡金属(如锰、钴、铜、铁等),有时两种及以上金属离子的协同催化效果更显著。如中国专利cn107185581a、cn110420659a、cn110237864a都公开了亚硫酸镁催化剂方法,这些方法实现催化氧化同时提高了催化速率,但操作步骤繁杂,运行成本较高。而如何提高催化速率、简化操作步骤,降低运行成本成为本领域亟待解决的技术难题。
技术实现要素:
10.本发明的目的是提供一种亚硫酸镁催化氧化剂的制备方法和用途,通过原料及制备方法的调整,制备得到了一种催化速率较高的催化剂,所需工艺设备和过程控制简单,经济成本低,环境效益高,一举多得,是一种更为经济有效的亚硫酸镁催化氧化技术,为镁法脱硫的亚硫酸镁处理和回收利用开拓了新途径。
11.为实现上述目的,本发明提供了如下方案:
12.本发明的技术方案之一:一种亚硫酸镁催化氧化剂的制备方法,包括以下步骤:将
苯三甲酸、金属盐溶解后加入三乙胺,超声反应,得到所述亚硫酸镁催化氧化剂;
13.所述金属盐为钴盐和/或铁盐。
14.进一步地,所述苯三甲酸包括1,2,4-偏苯三甲酸或1,3,5-均苯三甲酸。
15.进一步地,所述钴盐为cocl2·
6h2o;所述铁盐为fecl3·
6h2o。
16.进一步地,所述1,2,4-偏苯三甲酸和金属盐的摩尔比为1:1。
17.进一步地,当金属盐为钴盐和铁盐时,钴盐和铁盐的摩尔比为1~3:1。
18.进一步地,所述超声处理的时间为6~10h。
19.进一步地,所述溶解采用的溶剂包括dmf、乙醇和水。
20.更进一步地,在所述超声反应后,还包括,在5000r/min~9000r/min速度下离心收集产物,用乙醇洗涤,并在50℃~80℃下干燥12h后,得到所述亚硫酸镁催化氧化剂。
21.本发明的技术方案之二:一种上述的制备方法制备得到的亚硫酸镁催化氧化剂。
22.本发明的技术方案之三:一种上述的亚硫酸镁催化氧化剂在亚硫酸镁处理和回收中的应用。
23.本发明公开了以下技术效果:
24.本发明制备得到的新型亚硫酸镁催化氧化剂为co/fe与1,2,4-偏苯三甲酸的络合物,该络合物在空气气氛的条件下,催化氧化亚硫酸镁,在催化剂为0.1g,亚硫酸镁为50g/l,操作温度为35℃~65℃,空气流速为1l/min,ph为6~10的条件下,催化速率为0.12mmol(l
·
s)-1
。本发明的工艺简单,投资小,易操作,且二次污染小,可用于镁法脱硫的副产物亚硫酸镁的催化氧化。
25.本发明制备得到的新型亚硫酸镁催化氧化剂具有3d7电子配置的co
2+
可以容纳离域so
32-较远的电子,从而在so
32-中产生电子空穴。因此产生
·
so
3-的自由基引发如下链式反应:
26.链式反应开始:so
32-+co
2+
→
·
so
3-+co-;
27.链式反应准备:
·
so
3-+o2→
·
so
5-;
28.·
so
5-+so
32-→
so
52-+
·
so
3-;
29.产物形成:so
52-+so
32-→
2so
42-;
30.链式反应终止:
·
so
5-+
·
so
5-→
内部产物;因此,催化速率较高。
附图说明
31.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
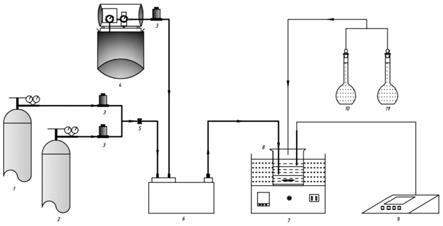
32.图1为本发明实施例制备亚硫酸镁催化氧化剂催化反应的设备流程图。
具体实施方式
33.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
34.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发
明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
35.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
36.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
37.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
38.以下实施例中的原料在熔炼前均经过烘烤处理。
39.实施例1
40.一种亚硫酸镁催化氧化剂的制备方法:
41.将1,2,4-偏苯三甲酸(tmla,0.75mmol)、cocl2·
6h2o(0.5625mmol)和fecl3·
6h2o(0.1875mmol)溶解在dmf(32ml)、乙醇(2ml)和去离子水(2ml)的混合溶液中,然后加入三乙胺(0.8ml),搅拌5min后室温下连续超声处理8h,在7000r/min速度下离心收集产物,用乙醇洗涤三次,并在60℃下干燥12h,得到亚硫酸镁催化氧化剂。
42.实施例2
43.同实施例1,区别在于,将cocl2·
6h2o(0.5625mmol)和fecl3·
6h2o(0.1875mmol)替换成cocl2·
6h2o(0.75mmol)。
44.实施例3
45.同实施例1,区别在于,将cocl2·
6h2o(0.5625mmol)和fecl3·
6h2o(0.1875mmol)替换成cocl2·
6h2o(0.375mmol)和fecl3·
6h2o(0.375mmol)。
46.实施例4
47.同实施例1,区别在于,将cocl2·
6h2o(0.5625mmol)和fecl3·
6h2o(0.1875mmol)替换成fecl3·
6h2o(0.75mmol)。
48.对比例1
49.将1,2,4-偏苯三甲酸(tmla,0.5mmol)、cocl2·
6h2o(0.5625mmol)和fecl3·
6h2o(0.1875mmol)溶解在dmf(32ml)、乙醇(2ml)和去离子水(2ml)的混合溶液中,然后加入三乙胺(0.8ml),搅拌5min后室温下连续超声处理8h,在7000r/min速度下离心收集产物,用乙醇洗涤三次,并在60℃下干燥12h,得到亚硫酸镁催化氧化剂。
50.制备得到的催化剂co-fe含量增加,活性金属量大于偏苯三甲酸上结合位点数量。
51.对比例2
52.同实施例1,区别在于,超声处理的时间为4h。
53.制备得到的催化剂,在用乙醇清洗的时候,活性金属co流失严重,催化反应转化率
减小。
54.对比例3
55.同实施例2,区别在于,将1,2,4-偏苯三甲酸(tmla,0.75mmol)替换成1,3,5-均苯三甲酸(btc,0.75mmol)。
56.效果例1
57.设备流程图见图1,图1中的1为氮气储存罐,2为氧气储存罐,3为质量流量计,4为空气压缩机,5为控制阀,6为气体混合罐,7为恒温水浴锅,8为反应装置,9为ph计,10和11为容量瓶。
58.在烧杯中加入200ml去离子水,然后将烧杯(反应装置),放于45℃恒温水浴锅中,以1l/min的速度将气体混合罐中的气体通入烧杯,打开磁力搅拌(200r/min)待温度稳定后,将0.1g亚硫酸镁催化氧化剂(实施例2制备)加入烧杯中,然后加入10g mgso3并计时,保持水溶液ph值为8(利用ph计监测ph值,利用容量瓶10中的1mol/l naoh和容量瓶11中的1mol/l hcl调节ph值),5min时取液2.5ml(溶液1),10min时取液2ml(溶液2),15min时取液1.5ml(溶液3),20min时取液1ml(溶液4),25min时取液0.6ml(溶液5),35min时取液0.3ml(溶液6),将溶液1~6分别置于100ml容量瓶内,加入1ml 1:1的hcl,定容摇匀。用量筒移取50ml置于100ml玻璃杯中,加入2.5ml稳定液,置于磁力搅拌器上,加入0.2g bacl2,搅拌1min后静置4min,利用分光光度计420nm波长下测吸光度,记录数据;
59.在催化反应过程中将空气压缩机压缩的空气通入气体混合罐,并通过质量流量计3控制空气的流入速度,为催化反应提供空气气氛;
60.在做氧分压实验的时候,通过质量流量计3及空气压缩机,将氮气从氮气储存罐1中通入气体混合罐6,氧气从氧气储存罐2中通入气体混合罐6,通过质量流量计3和控制阀5控制氧气、氮气流入气体混合罐6的速度,其中氮气和氧气的质量比为8:2,控制氧气含量从0到21%,来探究氧气对催化反应的影响。
61.稳定剂配制方法为:称取75g nacl,溶于300ml去离子水中,加入30ml浓hcl、50ml丙三醇(甘油)和100ml无水乙醇混合均匀即可;
62.1:1hcl配制方法为:浓盐酸与去离子水等体积混合即可得到。
63.计算催化氧化速率:
[0064][0065]
k:来表示不同反应条件下亚硫酸镁氧化成硫酸镁的转化程度(mol
·
l-1
·
s-1
)
[0066]cs(iv),t
:表示在时间为t的时候硫酸根的浓度(mol
·
l-1
)
[0067]cs(iv),t0
:表示在时间为t0的时候硫酸根的浓度(mol
·
l-1
),一般是反应开始的浓度为0。
[0068]
计算得到催化氧化速率为0.12mmol(l
·
s)-1
。
[0069]
将催化剂替换成实施例1制备得到的亚硫酸镁催化氧化剂,其他反应条件不变,催化氧化速率为0.098mmol(l
·
s)-1
;
[0070]
将催化剂替换成实施例3制备得到的亚硫酸镁催化氧化剂,其他反应条件不变,催化氧化速率为0.092mmol(l
·
s)-1
;
[0071]
将催化剂替换成实施例4制备得到的亚硫酸镁催化氧化剂,其他反应条件不变,催化氧化速率为0.012mmol(l
·
s)-1
;
[0072]
将催化剂替换成对比例3制备得到的亚硫酸镁催化氧化剂,其他反应条件不变,催化氧化速率为0.089mmol(l
·
s)-1
。
[0073]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1