微流控芯片及其应用
1.本发明涉及微流控芯片领域,尤其涉及微流控芯片及其应用。
背景技术:
2.低温保存技术是指低温保藏生物体的技术,能够显著延长生物样本的保存时间,已广泛应用于各类细胞产品(如血细胞、干细胞、菌种等)的长期保存。在细胞低温保存过程中,析出的冰晶会对细胞造成损伤。为了减少低温保存中的细胞损伤,在细胞低温保存之前,需要向细胞悬液中添加一定量的低温保护剂(如二甲基亚砜(dmso)、甘油、聚乙二醇等)。低温保护剂能够降低低温保存中的细胞损伤,然而低温保护剂通常具有一定的细胞毒性,也会导致细胞渗透性损伤。因此,使用低温保存的细胞之前,低温保护剂需要被清除。
3.近年来,随着微流控技术和软光刻技术的发展,能够精准操控微量液体的微流控芯片逐渐涌现。微流控芯片具有集成化、高通量、样本消耗少等优点,有望成为细胞低温保护剂高效清除的新兴平台。
4.然而,现有的低温保护剂清除方法(如一步或多步离心法,透析法、扩散法等)的清除能力较弱、细胞回收率较低,也无法清除微量细胞中的低温保护剂。
技术实现要素:
5.有鉴于此,本发明提供了微流控芯片及其应用。本发明提供的微流控芯片基于流动聚焦-膜分离技术实现,可用于清除细胞中的低温保护剂。本发明提供的微流控芯片能够连续地清除清除细胞低温保护剂,从而避免开放操作带来的细胞污染;能够高效地清除细胞低温保护剂,清除率可达95%以上;能够安全地清除细胞低温保护剂,不但极大减少了清除过程中的渗透压损伤,也避免了装置的机械损伤。本发明可通过并联或串联的方式扩展实现高通量的细胞洗涤,还可应用于清除细胞毒素或细胞外液中的磁纳米粒子。
6.为了实现上述发明目的,本发明提供以下技术方案:
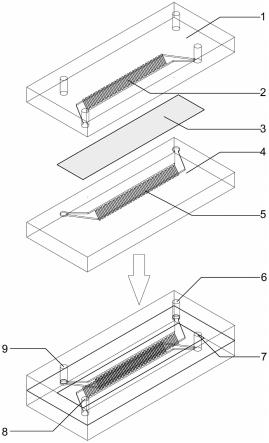
7.本发明提供了微流控芯片,包括:第一芯片1和第二芯片4;上述第一芯片1包括第一上表面、第一下表面;上述第二芯片4包括第二上表面、第二下表面;上述第一芯片1设置有第一入口8和第一出口7;上述第二芯片4设置有第二入口6和第二出口9;上述第一芯片1的上述第一下表面设置有第一通道2;上述第二芯片4的上述第二上表面设置有第二通道5;上述第一通道2和上述第二通道5分别设置有沟槽13阵列;上述第一通道2和上述第二通道5相向贴合;上述第一通道2和上述第二通道5中间设置有多孔膜3;上述第一芯片1、上述多孔膜3、上述第二芯片4从上到下依次排列。
8.在本发明的一些实施方案中,第一入口8、第一出口7、第二入口6和第二出口9相互独立。
9.在本发明的一些实施方案中,第一入口8为清洗液入口、第一出口7为清洗液出口、第二入口6为细胞悬液入口、第二出口为洗涤之后的细胞悬液即产物出口。
10.在本发明的一些实施方案中,上述第一芯片1和第二芯片4的形状包括方形和/或
多边形,材料包括聚甲基丙烯酸甲酯、聚碳酸酯、聚二甲基硅氧烷和/或玻璃中的一种或多种,第一芯片1和/或第二芯片4面积为1cm2~200cm2、总厚度为8mm~20mm。
11.在本发明的一些实施方案中,上述第一芯片1和第二芯片4的形状为长方形,材料为聚二甲基硅氧烷,长、宽、高分别为4cm、2cm、0.5cm。
12.在本发明的一些实施方案中,上述微流控芯片中所述第一通道2的深度小于所述第一芯片1的厚度,上述第二通道5的深度小于上述第二芯片4的厚度。
13.在本发明的一些实施方案中,上述第一通道2和/或第二通道5的深度为10~80μm。
14.在本发明的一些实施方案中,上述第一通道2和/或第二通道5的深度为40μm。
15.在本发明的一些实施方案中,上述微流控芯片中所述相向贴合的面积小于上述第一通道2和/或上述第二通道5的表面积。
16.在本发明的一些实施方案中,上述微流控芯片中上述沟槽13阵列中的沟槽13相互平行和间距相等。
17.在本发明的一些实施方案中,位于上述微流控芯片中的第一通道2表面的沟槽13阵列中的沟槽13,与其所在的第一通道2的长侧壁的夹角为20~70
°
,位于上述微流控芯片中的第二通道5的沟槽13阵列中的沟槽13,与第二通道5的长侧壁的夹角为20~70
°
。
18.在本发明的一些实施方案中,位于上述微流控芯片中的第一通道2的沟槽13阵列中的沟槽13,与其所在的第一通道2的长侧壁的夹角为30
°
,位于上述微流控芯片中的第二通道5的沟槽13阵列中的沟槽13,与第二通道5的长侧壁的夹角为30
°
。
19.在本发明的一些实施方案中,沟槽13阵列的结构,能够在通道中构建出涡旋的流场,加速通道内液体的混合和传质效率。
20.在本发明的一些实施方案中,上述微流控芯片中上述沟槽13阵列的沟槽13宽度为10~40μm,深度为10~40μm,间距为10~40μm。
21.在本发明的一些实施方案中,上述微流控芯片中上述沟槽13阵列的沟槽13宽度为25μm,深度为25μm,间距为25μm。
22.在本发明的一些实施方案中,上述微流控芯片中第一通道2中的沟槽13阵列与第二通道5中的沟槽13阵列尺寸独立。
23.在本发明的一些实施方案中,上述微流控芯片中上述多孔膜3覆盖上述第一通道2和上述第二通道5,不覆盖上述第一入口8、上述第一出口7、上述第二入口6和上述第二出口9。
24.在本发明的一些实施方案中,上述微流控芯片中上述多孔膜3的覆盖上述第一通道2和上述第二通道5,防止液体渗漏。
25.在本发明的一些实施方案中,上述多孔膜3的材质包括聚碳酸酯印迹蚀刻膜和/或聚二甲基硅氧烷多孔膜,上述多孔膜3的厚度为5~25μm,孔径为0.1~5μm。
26.在本发明的一些实施方案中,上述多孔膜3的孔径为0.8μm,材质为聚碳酸酯印迹蚀刻膜。
27.在本发明的一些实施方案中,上述微流控芯片中上述第一通道2和上述第二通道5的重叠部分为透析区10;
28.上述透析区10与上述第二通道5相对于上述透析区10的长侧壁之间为聚焦保持区11;
29.上述第二通道5的带有沟槽13阵列的部分中,除上述透析区10、上述聚焦保持区11之外为聚焦区12。
30.在本发明的一些实施方案中,上述微流控芯片中上述第一芯片1、上述多孔膜3、上述第二芯片4以聚二甲基硅氧烷预聚物和甲苯粘合,上述二甲基硅氧烷预聚物和上述甲苯的质量比为2:1。
31.在本发明的一些实施方案中,上述第一芯片1、上述第二芯片4采用软光刻方法制备,上述多孔膜3采用电子束蚀刻方法制备。
32.在本发明的一些实施方案中,采用多个上述微流控芯片串联和/或并联方式连接。
33.在本发明的一些实施方案中,上述微流控芯片在清除细胞低温保护剂、细胞毒素和/或磁纳米颗粒在细胞悬液中的一种或多种应用。
34.本发明提供了微流控芯片,包括:第一芯片1和第二芯片4;上述第一芯片1包括第一上表面、第一下表面;上述第二芯片4包括第二上表面、第二下表面;上述第一芯片1设置有第一入口8和第一出口7;上述第二芯片4设置有第二入口6和第二出口9;上述第一芯片1的上述第一下表面设置有第一通道2;上述第二芯片4的上述第二上表面设置有第二通道5;上述第一通道2和上述第二通道5分别设置有沟槽13阵列;上述第一通道2和上述第二通道5相向贴合;上述第一通道2和上述第二通道5中间设置有多孔膜3;上述第一芯片1、上述多孔膜3、上述第二芯片4从上到下依次排列。
35.本发明提供的微流控芯片,利用流动聚焦-膜分离技术清除细胞低温保护剂,从上述第一通道2中按一定流量注入洗涤液,同时从上述第二通道5中以相反方向注入细胞悬液,细胞悬液中的细胞在经过所述聚焦区12时被聚焦在远离透析区10的一侧,之后进入聚焦保持区11,在聚焦保持区11维持聚焦状态,直至流出芯片。同时,洗涤液在透析区10对细胞外液进行透析,使细胞外液中的低温保护剂扩散到洗涤液中,随洗涤液不断流出芯片,从而完成了低温保护剂的清除过程。由于细胞被聚焦在远离透析区10的一侧,这使得细胞经历的渗透压损伤大大降低,同时避免因多孔膜3捕获而导致的细胞损失,从而提高细胞回收率。此外,这种清除细胞悬液中低温保护剂的微流控芯片还可用于清除细胞毒素、洗涤细胞外液中的残留的磁纳米颗粒等情景,具有较好的通用性和便利性。
附图说明
36.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
37.图1示本发明实施例中提供的微流控芯片的三维结构示意图;
38.图2示本发明实施例中提供的微流控芯片的第一芯片1、第二芯片4以及组合后的平面结构示意图,其中第一芯片1的平面示意图对应(i),第二芯片4的平面示意图对应(ii),组合后的平面结构示意图对应(iii);
39.图3示本发明实施例中提供的微流控芯片的第一芯片1剖面及沟槽13结构示意图,其中(i)为第一芯片1结构平面示意图,其中虚折线代表剖切线,箭头代表投影方向,(ii)为剖面图及局部细节放大图;
40.图4示本发明实施例提供的微流控芯片截面结构示意图,其中(i)为平面视图,(ii)为横向截面示意图及局部细节放大图,(iii)为纵向截面示意图及局部细节放大图;
41.1示第一芯片,2示第一通道,3示多孔膜,4示第二芯片,5示第二通道,6示第二入口,7示第一出口,8示第一入口,9示第二出口,10示透析区,11示聚焦保持区,12是聚焦区,13示沟槽。
具体实施方式
42.本发明公开了微流控芯片及其应用。
43.应该理解,表述
“……
中的一种或多种”单独地包括每个在所述表述后叙述的物体以及所述叙述的物体中的两者或更多者的各种不同组合,除非从上下文和用法中另有理解。与三个或更多个叙述的物体相结合的表述“和/或”应该被理解为具有相同的含义,除非从上下文另有理解。
44.术语“包括”、“具有”或“含有”,包括其语法同义语的使用,通常应该被理解为开放性和非限制性的,例如不排除其他未叙述的要素或步骤,除非另有具体陈述或从上下文另有理解。
45.应该理解,只要本发明仍可操作,步骤的顺序或执行某些行动的顺序并不重要。此外,两个或更多个步骤或行动可以同时进行。
46.本文中的任何和所有实例或示例性语言如“例如”或“包括”的使用,仅仅打算更好地说明本发明,并且除非提出权利要求,否则不对本发明的范围构成限制。本说明书中的任何语言都不应解释为指示任何未要求保护的要素对于本发明的实践是必不可少的。
47.此外,用以界定本发明的数值范围与参数皆是约略的数值,此处已尽可能精确地呈现具体实施例中的相关数值。然而,任何数值本质上不可避免地含有因个别测试方法所致的标准偏差。因此,除非另有明确的说明,应当理解本公开所用的所有范围、数量、数值与百分比均经过“约”的修饰。在此处,“约”通常是指实际数值在一特定数值或范围的正负10%、5%、1%或0.5%之内。
48.本发明的实施例1~实施例6中,所用原料及试剂均可由市场购得。
49.下面结合实施例,进一步阐述本发明:
50.实施例1
51.具有如图1所示结构的一种微流控芯片包括:
52.微流控芯片的长、宽、高分别为4cm、2cm、0.5cm的长方形第一芯片1和第二芯片4;第一芯片1和第二芯片4的材质为聚二甲基硅氧烷。第一芯片1的第一下表面包括第一通道2,其深度为40μm,主体部分(即不含出入口的收缩状结构的部分)宽度为1mm,长度为1.5cm。第一芯片1的第一下表面的第一通道2中构造了倾斜沟槽13阵列,沟槽13宽度为25μm、深度为25μm,沟槽13轴向与第一通道2长侧壁夹角为60
°
,沟槽13之间间距为25μm,沟槽13阵列布满直通道部分。
53.如图2所示,第一芯片1包含四个通孔,其中,第一入口8和第一出口7分别为清洗液的入口和废液出口,第二入口6和第二出口9为细胞悬液的入口和洗涤后产物出口。
54.微流控芯片的第二芯片4的第二上表面的第二通道5,深度为40μm,主体部分(即不含出入口的收缩状结构的部分)宽度为1mm、长度为1.5cm。第二芯片4的第二上表面的第二通道5下表面设置有沟槽13阵列,沟槽13宽度为25μm、深度为25μm,结构与第一通道2中的沟槽13结构类似,但方向相反。如图2所示,细胞悬液从第二入口6引入,进入第二通道5,被清
洗后从第二出口9流出。
55.第一通道2和第二通道5重叠部分,即为透析区10,宽度为0.5mm、长度为1cm。
56.设置在第一芯片1和第二芯片4间的多孔膜3为孔径0.8μm的聚碳酸酯印迹蚀刻膜,形状为矩形,其大小可覆盖整个透析区10。
57.第一芯片1、第二芯片4,以及多孔膜3,彼此之间使用甲苯和pdms预聚物按1比2混合作为粘合剂和填充剂,对齐后粘合。
58.实施例2
59.在本发明的实施例中,第一通道2是位于第一芯片1的第一下表面的流动腔,第二通道5是位于第二芯片4第二上表面的流动腔。第一通道2、第二通道5形状类似,流动腔可分为两端的出入口部分和中间的主体腔部分。第一芯片1和第二芯片4之间夹有一层多孔膜3。第一芯片1和第二芯片4带有通道的一面相互贴合。第一芯片1和第二芯片4平行放置,在主体腔部分完全对齐重合后,再沿横向和纵向分别错开一段距离,从而实现主体腔部分重合的效果。第二通道5主体腔重合部分构成了透析区10,透析区10上游的流动腔构成了聚焦区12,透析区10邻近的流动腔(即第二通道5的主体腔中,除透析区10、聚焦区12外剩下的部分)构成了聚焦保持区11,如图2所示。
60.实施例3
61.在本发明的实施例中,所述第一通道2的深度小于所述第一芯片1的厚度,上述第二通道5的深度小于上述第二芯片4的厚度。第一通道2和第二通道5的重叠部分为透析区10,其位置和形状如图2中所示。
62.图2中,第一入口8为清洗液入口,第一出口7为清洗液出口。在本发明的实施例中,第一通道2为清洗液通道,不含低温保护剂的等渗清洗液从第一入口8按固定流速进入芯片,在透析区10与第二芯片4的第二通道5中的液体发生透析作用。在第一芯片1的第一通道2中,构造有平行的、长条状(横截面是矩形)的凸起,相邻的凸起之间形成沟槽13,多个等间距的、平行的沟槽13,构成沟槽阵列,其结构如图3和图4所示。
63.在第二芯片4的第二通道5中,也构造有平行的、长条状(横截面是矩形)的凸起,相邻的凸起之间形成所述的沟槽13,多个等间距的、平行的沟槽13,构成沟槽阵列,其结构如图3和图4所示。
64.实施例4
65.本发明提供的微流控芯片,包括设置在第二芯片4的第二上表面的第二通道5,第二通道5的深度小于第二芯片4的厚度。第二通道5为细胞悬液通道。如图2所示,第二入口6为细胞悬液入口,第二出口9为洗涤之后的细胞悬液(即产物)出口。聚焦区12,透析区10和聚焦保持区11的定义见图2。
66.本发明的实施例在实际操作运行时,细胞悬液从第二入口6以一定流速注入,在聚焦区12的沟槽13阵列结构的作用下被聚焦,再进入聚焦保持区11。细胞聚焦是指将细胞悬液中随机分布的细胞聚集到较窄的位置范围内,即通道的一侧。其原理如下:以第二通道5(细胞悬浮液通道)为例,在液体流动时,第二通道5中的斜沟槽13结构首先在第二通道5中构造出了沿着通道螺旋式前进的流场(流动模式);此外,沟槽13的宽度和深度,被设计为与细胞直径大小近似,这样,由于位阻效应,细胞被限制在通道主体中运动(不进入沟槽中),因此再流体曳力作用下发生横向迁移,直到聚集到通道的一侧。
67.细胞外液在透析区10与清洗液发生透析作用,从而实现了低温保护剂的清除。
68.在已有的、使用透析膜的低温保护剂清除装置中,由于细胞与多孔膜直接接触,细胞易被多孔膜吸附;此外,细胞在细胞悬液中呈随机分布,若直接接触低渗透的清洗液,剧烈的渗透压变化会导致其因吸水过度膨胀而破裂死亡。在本发明的实施例中,细胞悬液中的细胞在进行清洗之前,已被聚集到远离透析区10且无跨膜流动的一侧,因此没有被多孔膜3吸附的风险。同时,通过控制第一通道2中清洗液的流量,可以控制第二通道5的透析区10沿着流动方向的渗透压变化,从而控制细胞在低温保护剂清除过程中所经受的渗透压损伤。
69.聚焦保持区11的沟槽13阵列,是为了维持这种流场,以保持细胞聚集的状态不发生变化。在第一通道2(清洗液通道)中也带有沟槽13阵列结构,该结构不用于细胞聚焦,而是为了加快混合。本发明设计为清洗液流速与细胞悬液流速可调整的模式,从而可以通过调整清洗液的流量以精确控制渗透压变化,有望减少细胞渗透损伤。
70.实施例5
71.采用实施例1提供的微流控芯片进行raw264.7细胞低温保护剂的清除,具体过程为:
72.将含有20%(v/v)细胞冻存级dmso的磷酸盐缓冲液逐滴加入等量的raw264.7细胞悬液中,混合均匀,得到最终dmso含量为10%(v/v)的raw264.7细胞悬液(细胞密度106/ml),作为测试样品。使用磷酸盐缓冲液作为清洗液。
73.将测试样品,从实施例1的微流控芯片的第二通道5的第二入口6按5μl/min的流量注入,将不含dmso的磷酸盐缓冲液从实施例1微流控芯片的第一通道2的第一入口8以15μl/min的流量注入,在第一通2的第一出口7处以15μl/min的流量抽取废液。待流动稳定后,从第二通道5的第二出口9处收集样品。然后对收集到的细胞样品进行死活染色以分析细胞存活率和回收率,并测定dmso含量以分析dmso清除率。
74.实施例6
75.采用实施例1提供的微流控芯片进行ne-4c细胞低温保护剂的清除,具体过程为:
76.将含有20%(v/v)细胞冻存级dmso的磷酸盐缓冲液逐滴加入等量的ne-4c细胞悬液中,混合均匀,得到最终dmso含量为10%(v/v)的ne-4c细胞悬液(细胞密度106/ml),作为测试样品。使用磷酸盐缓冲液作为清洗液。
77.从实施例1微流控芯片的第二通道5的第二入口6按恒定流量注入测试样品,该流量记为qc,将磷酸盐缓冲液从实施例1微流控芯片的第一通道2的第一入口8按恒定的流量注入,记为qw,在第一通道2的第一出口7处以相同的流量qw抽取清洗废液。
78.待流动稳定后,从第二通道5的第二出口9处收集约40μl产物,对样品细胞使用钙黄绿素am和碘化丙啶进行死活染色以测得细胞存活率。使用血细胞计数器对出入口细胞密度进行计数。使用紫外分光光度计测定dmso含量以分析dmso清除率。
79.记未经处理的样品中dmso含量为ci,处理后的产物中细胞密度为co。则dmso清除率λ计算如下:
80.λ=(1-co/ci)
×
100%
81.记未经处理的样品中细胞密度为di,处理后的产物中细胞密度为do,未经处理的细胞样品的细胞存活率为si,处理后的产物的细胞存活率为so,则细胞回收率r计算如下:
82.r=(so×do
)/(si×di
)
×
100%
83.下表1-2分别给出了三种不同流速配置下,使用本发明实施例1所提供的微流控芯片用于清除载有dmso的ne-4c细胞悬液时的回收率和低温保护剂清除率相关数据。如上所述,qc、qw分别代表细胞悬液流速和清洗液(磷酸盐缓冲液)流量,单位为μl/min,n代表试验次数。
84.表1本发明实施例1清除ne-4c细胞中的dmso时的清除率
[0085][0086]
表2本发明实施例1清除ne-4c细胞中的dmso时的回收率
[0087][0088][0089]
实验结果表明,在使用本发明实施例1所提供的微流控芯片清除ne-4c细胞的低温保护剂时,再给定条件下低温保护剂清除率可达95%以上,细胞回收率可达90%以上
[0090]
由以上实施例可知,本发明提供了一种连续地清除细胞悬液中低温保护剂的微流控芯片,包括:第一芯片1和第二芯片4;第一芯片1包括第一上表面、第一下表面;第二芯片4包括第二上表面、第二下表面;第一芯片1设置有第一入口8和第一出口7;第二芯片4设置有第二入口6和第二出口9;第一芯片1的第一下表面设置有第一通道2;第二芯片4的第二上表面设置有第二通道5;第一通道2和第二通道5分别设置有沟槽13阵列,该沟槽阵列能够聚焦细胞、加快低温保护剂扩散,从而减少细胞损失、减轻细胞渗透性损伤;第一通道2和所述第二通道5相向贴合;第一通道2和第二通道5中间设置有多孔膜3,其一面覆盖第一通道2,另一面覆盖第二通道5;第一芯片1、多孔膜3、第二芯片4从上到下依次排列;第一通道2和第二通道5中的透析区10的液体通过多孔膜3发生物质交换,完成低温保护剂清除过程。基于本发明的原理,本发明提供的微流控芯片不仅可以连续、高效、安全地清除细胞低温保护剂,还可清除细胞毒素或细胞外液中的磁纳米粒子等物质,具有较好的通用性和便利性。
[0091]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1