一种微流控芯片及其制备方法与流程
1.本技术涉及微流控技术领域,更具体地说,它涉及一种微流控芯片及其制备方法。
背景技术:
2.微流控指的是使用微管道处理或操纵微小流体的系统所涉及的科学,具有微小化、集成化等特征,微流控装置通常被称为微流控芯片,也称微型实验室和微全分析系统,微流控芯片技术是把生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块微米尺寸的芯片上,自动完成分析全过程,在生物、化学、医学、流体、电子、材料、机械等领域具有较大的应用潜力。
3.相关的芯片毛细管电泳技术中,常利用微孔膜结构实现微流控芯片的样品预处理功能集成,使初级样品过滤、透析、浓缩集于一体,但是集成式的微流控芯片对加工材料和设备的要求较高,制备过程较为负载、繁琐,所以影响了发展应用;若利用普通的石英材料进行分离、分析时,为了获得较好的分离效果,常需要对微管道表面进行繁琐、复杂的修饰处理,从而提高其比表面积以及亲水毛细作用力,便于实现对样品的集成预处理,一般采用表面活性剂对石英材料表面进行涂层处理,但是过程中需要多次经历涂覆、清洗、高温处理等步骤,不仅耗时久、操作繁琐,而且成品品质不易保证。
4.因此,急需制备一种微流控芯片,使其不仅具有工艺简单、操作便捷的优点,而且能够实现样品预处理功能与分析检测功能的集成。
技术实现要素:
5.为了制备一种微流控芯片,使其不仅具有工艺简单、操作便捷的优点,而且能够实现样品预处理功能与分析检测功能的集成,本技术提供一种微流控芯片及其制备方法。
6.第一方面,本技术提供一种微流控芯片,采用如下的技术方案:
7.一种微流控芯片,包括基片、盖片、微孔层,微孔层位于基片和盖片之间;微孔层由微孔凝胶液固化而成,微孔凝胶液包括如下重量份原料:聚谷氨酸0.5-2份、水95-125份、交联剂0.2-0.6份、银纳米线0.05-0.1份、丝素蛋白溶液1-2.5份。
8.通过采用上述技术方案,基片、盖片、微孔层相配合,利用微孔层在基片和盖片之间的固化效果,使成品微流控芯片制备工艺简单、操作便捷。
9.聚谷氨酸、交联剂、银纳米线、丝素蛋白溶液相配合,聚谷氨酸在交联剂的作用下形成三维聚合网络,聚谷氨酸的侧链羧基能够与丝素蛋白溶液主链氨基、侧链氨基相配合,通过相互作用力,使得丝素蛋白负载在三维聚合网络结构表面;配合银纳米线较大的比表面积支撑作用,增加三维聚合网络结构表面积,进一步提高三维聚合网络结构的连通孔隙率(促进扩散)、亲水性,从而提高微孔层的亲水毛细作用力,便于实现样品预处理功能与分析检测功能的集成。
10.优选的,所述交联剂由重量比为1:1-3的羟基氧化铝和乙二醇二缩水甘油醚组成。
11.通过采用上述技术方案,聚谷氨酸、乙二醇二缩水甘油醚、丝素蛋白溶液、羟基氧
0.25,制得pmma液。
25.通过采用上述技术方案,pmma、pvac、微孔层相配合,进一步提高pmma基片与微孔层的粘结效果,使成品微流控芯片的微孔层与基片不易分离,并且进一步提高pmma基片的耐热性,使成品微流控芯片能够应用于热催化领域,扩宽微流控芯片的应用范围。
26.第二方面,本技术提供一种微流控芯片的制备方法,采用如下的技术方案:
27.一种微流控芯片的制备方法,包括以下步骤:
28.s1、制备模具,将pmma液浇筑到模具表面,pmma液固化后剥离模具,固化的pmma为基片,基片上设置有用于容纳微管道的空腔;
29.s2、制备带微管道的模板,模板上打通孔,模板与基片嵌合,微孔凝胶液通过通孔填充到模板和基片嵌合的腔体孔隙中,基片上空腔容纳微管道,微孔凝胶液固化后形成微孔层,剥离模板,微孔层与基片制得复合层;
30.s3、复合层与盖片通过热压键合,盖片上设置有若干与复合层上微管道连通的通孔,制得成品微流控芯片。
31.通过采用上述技术方案,首先制备用于容纳微管道的模具,然后将pmma液浇筑到模具表面,当pmma液固化后,pmma层与远离模具的一侧产生能够容纳微管道的空腔,该pmma层为基片,使基片能够容纳微管道。
32.然后将制得的基片与带有微管道的模板嵌合,模板上的微管道位于基片的空腔内,pmma液经通孔填充到通孔填充至模板和基片嵌合的腔体孔隙中,形成微管道和微孔层位于基片的空腔内;最后将盖片与复合层热压键合,使微孔层较为稳定的位于基片和盖片之间;待测样品通过盖片上通孔进入,然后逐渐与微孔层接触,实现样品的过滤、透析、浓缩等预处理,从而使成品微流控芯片不仅具有工艺简单、操作便捷的优点,而且能够实现样品预处理功能与分析检测功能的集成。
33.优选的,s2中模板为硅片,硅片上的微管道利用光刻结合湿法刻蚀制备而成。
34.通过采用上述技术方案,减少对硅片表面的损伤,并且刻蚀的选择性高、均匀度好。
35.优选的,s2中空腔的深度大于微管道的高度。
36.通过采用上述技术方案,微孔层底部与基片上空腔底部相接触,而微管道的底部不与基片直接接触,即基片上空腔底部与微管道底部之间留有距离,微孔层将微管道与基片之间隔离;试样通过盖片进入微管道内后,由于微管道与微孔层直接接触,在微孔层较好的亲水毛细作用条件下,便于试样在微管道、微孔层内实现预处理功能与分析检测功能。
37.综上所述,本技术具有以下有益效果:
38.1、基片、盖片、微孔层相配合,利用微孔层在基片和盖片之间的固化效果,使成品微流控芯片制备工艺简单、操作便捷。
39.2、聚谷氨酸、交联剂、银纳米线、丝素蛋白溶液相配合,聚谷氨酸在交联剂的作用下形成三维聚合网络,聚谷氨酸与丝素蛋白通过相互作用力,使丝素蛋白负载在三维聚合网络结构表面;配合银纳米线较大的比表面积支撑作用,增加三维聚合网络结构表面积,进一步提高三维聚合网络结构的连通孔隙率、亲水性,便于实现样品预处理功能与分析检测功能的集成。
40.3、聚谷氨酸、银纳米线、羟基氧化铝、丝素蛋白溶液相配合,在银纳米线的导热作
用下配合银纳米线为三维聚合网络结构中的连结效果,便于使微孔层实现热循环,能够缩短反应时间、提高分析效率,而羟基氧化铝使三维聚合网络结构具有较好的耐热性,在提高分离效率的同时保证微流控芯片的使用寿命。
具体实施方式
41.以下结合实施例对本技术作进一步详细说明。
42.微孔凝胶液的制备例
43.以下原料中的γ-聚谷氨酸购买于河北鸿韬生物工程有限公司,聚谷氨酸分子量20万;丝素蛋白购买于山东福旺嘉生物科技有限公司;银纳米线购买于上海茂果纳米科技有限公司,直径20nm,长度15μm;其他原料及设备均为普通市售。
44.制备例1:微孔凝胶液采用如下方法制备而成:
45.①
称取1kg聚谷氨酸,聚谷氨酸为γ-聚谷氨酸,将聚谷氨酸置于108kg水中溶解搅拌;然后添加0.08kg银纳米线,银纳米线的溶剂为n,n-二甲基甲酰胺,浓度为10mg/ml;再用hcl溶液调节ph至4.0,最后添加0.3kg乙二醇二缩水甘油醚继续搅拌,搅拌均匀后,制得初混液;
46.②
称取1.8kg质量分数10%的丝素蛋白溶液添加到初混液中搅拌均匀,丝素蛋白溶液为丝素蛋白水溶液,最后添加0.15kg羟基氧化铝继续搅拌均匀,制得微孔凝胶液。
47.制备例2:微孔凝胶液采用如下方法制备而成:
48.①
称取0.5kg聚谷氨酸,聚谷氨酸为γ-聚谷氨酸,将聚谷氨酸置于95kg水中溶解搅拌;然后添加0.05kg银纳米线,银纳米线的溶剂为n,n-二甲基甲酰胺,浓度为10mg/ml;再用hcl溶液调节ph至4.0,最后添加0.1kg乙二醇二缩水甘油醚继续搅拌,搅拌均匀后,制得初混液;
49.②
称取1kg质量分数10%的丝素蛋白溶液添加到初混液中搅拌均匀,最后添加0.1kg羟基氧化铝继续搅拌均匀,制得微孔凝胶液。
50.制备例3:微孔凝胶液采用如下方法制备而成:
51.①
称取2kg聚谷氨酸,聚谷氨酸为γ-聚谷氨酸,将聚谷氨酸置于125kg水中溶解搅拌;然后添加0.1kg银纳米线,银纳米线的溶剂为n,n-二甲基甲酰胺,浓度为10mg/ml;再用hcl溶液调节ph至4.0,最后添加0.48kg乙二醇二缩水甘油醚继续搅拌,搅拌均匀后,制得初混液;
52.②
称取2.5kg质量分数10%的丝素蛋白溶液添加到初混液中搅拌均匀,最后添加0.12kg羟基氧化铝继续搅拌均匀,制得微孔凝胶液。
53.pmma液的制备例
54.以下原料中的pmma购买于上海佳煜塑胶原料有限公司,品牌为德国赢创德固赛:其他原料及设备均为普通市售。
55.制备例4:pmma液采用如下方法制备而成:
56.称取1kgpmma热熔后添加0.14kg热熔的pvac混合搅拌均匀,制得pmma液。
57.制备例5:pmma液采用如下方法制备而成:
58.称取1kgpmma热熔后添加0.05kg热熔的pvac混合搅拌均匀,制得pmma液。
59.制备例6:pmma液采用如下方法制备而成:
60.称取1kgpmma热熔后添加0.25kg热熔的pvac混合搅拌均匀,制得pmma液。
61.实施例
62.以下原料中的光刻胶购买于上海紫一试剂厂的su-8光刻胶,品牌:克拉玛尔;其他原料及设备均为普通市售。
63.实施例1:一种微流控芯片:
64.基片、盖片、微孔层,微孔层位于基片和盖片之间;
65.制备方法为:
66.s1、制备模具,模具上设置有凸块,将制备例4制备的pmma液浇筑到模具表面,pmma液固化后剥离模具,固化的pmma为基片,基片厚度为2mm,模具的凸块位置使基片与模具接触一侧表面产生空腔,空腔的深度为300μm,空腔能够容纳微管道;
67.s2、取粗硅片,依次经清洗、烘干、旋涂光刻胶、软烘、光刻、后烘、显影、硬烘、湿法刻蚀处理,旋涂光刻胶采用转速为2000r/min的旋转甩胶机涂覆,采用hf进行湿法刻蚀,刻蚀速率为100nm/min,制得带微管道的模板,微管道的高度为100μm;模板上打通孔,然后将模板与基片嵌合,基片上的空腔靠近模板一侧,微管道位于空腔内部,微管道四周不与基片表面相接处,而且微管道的高度小于基片空腔的深度,制备例1制备的微孔凝胶液经模板上的通孔注入到模板和基片嵌合的腔体孔隙中,pmma液固化后形成微孔层,微孔层平均孔径为5μm,微管道位于微孔层内,微孔层位于基片空腔内,剥离模板,微孔层表面形成微管道缝隙,微管道缝隙与基片底部之间的距离为2mm,即微孔层与基片制得复合层,复合层厚度2mm;
68.s3、取粗硅片,依次经清洗、烘干、旋涂光刻胶、软烘、光刻、后烘、显影、硬烘、湿法刻蚀处理,制得盖片,盖片厚度为2mm;复合层与盖片接触,使微孔层表面为盖片相接触,微管道形成的缝隙位于盖片与微孔层之间,复合层与盖片通过自动键合机在110℃、压力20kn的条件下热压键合45s,盖片上开设有直径为0.5mm的通孔,通孔包括进样孔、出样孔以及废液孔,进样孔、出样孔、废液孔与复合层上微管道相连通,制得成品微流控芯片。
69.实施例2:本实施例与实施例1的不同之处在于:
70.微孔凝胶液选用制备例2制备的微孔凝胶液;pmma液选用制备例5制备的pmma液,盖片为玻璃片。
71.实施例3:本实施例与实施例1的不同之处在于:
72.微孔凝胶液选用制备例3制备的微孔凝胶液;pmma液选用制备例6制备的pmma液。
73.实施例4:本实施例与实施例1的不同之处在于:
74.交联剂原料中以同等质量的乙二醇二缩水甘油醚替换羟基氧化铝。
75.实施例5:本实施例与实施例1的不同之处在于:
76.微孔凝胶液制备过程中:
77.称取1kg聚谷氨酸,0.3kg乙二醇二缩水甘油醚、108kg水、0.08kg银纳米线、1.8kg质量分数10%的丝素蛋白溶液、0.15kg羟基氧化铝混合搅拌均匀,用hcl溶液调节ph至4.0,制得微孔凝胶液。
78.实施例6:本实施例与实施例1的不同之处在于:
79.微孔凝胶液制备过程中:
80.①
称取1.8kg质量分数10%的丝素蛋白溶液添加到108kg水中混合搅拌,丝素蛋白
溶液为丝素蛋白水溶液,然后添加0.08kg银纳米线,银纳米线的溶剂为n,n-二甲基甲酰胺,浓度为10mg/ml;再用hcl溶液调节ph至4.0,然后添加0.3kg乙二醇二缩水甘油醚继续搅拌,搅拌均匀后,制得初混液;
81.②
称取1kg聚谷氨酸添加到初混液中搅拌均匀,聚谷氨酸为γ-聚谷氨酸,最后添加0.15kg羟基氧化铝继续搅拌均匀,制得微孔凝胶液。
82.实施例7:本实施例与实施例1的不同之处在于:
83.微孔凝胶液制备过程中:
84.①
称取1kg聚谷氨酸,聚谷氨酸为γ-聚谷氨酸,将聚谷氨酸置于108kg水中溶解搅拌,然后添加0.08kg银纳米线,银纳米线的溶剂为n,n-二甲基甲酰胺,浓度为10mg/ml;再用hcl溶液调节ph至4.0,然后添加0.15kg羟基氧化铝继续搅拌,搅拌均匀后,制得初混液;
85.②
称取1.8kg质量分数10%的丝素蛋白溶液添加到初混液搅拌搅拌均匀,丝素蛋白溶液为丝素蛋白水溶液,最后添加0.3kg乙二醇二缩水甘油醚继续搅拌均匀,制得微孔凝胶液。
86.实施例8:本实施例与实施例1的不同之处在于:
87.微孔凝胶液制备过程中:银纳米线的溶剂为水。
88.实施例9:本实施例与实施例1的不同之处在于:
89.微孔凝胶液制备过程中:
90.①
称取1kg聚谷氨酸,聚谷氨酸为γ-聚谷氨酸,将聚谷氨酸置于108kg水中溶解搅拌;再用hcl溶液调节ph至4.0,最后添加0.3kg乙二醇二缩水甘油醚继续搅拌,搅拌均匀后,制得初混液;
91.②
称取1.8kg质量分数10%的丝素蛋白溶液添加到初混液中搅拌均匀,丝素蛋白溶液为丝素蛋白水溶液,最后添加0.15kg羟基氧化铝、0.08kg银纳米线,银纳米线的溶剂为n,n-二甲基甲酰胺,浓度为10mg/ml,继续搅拌均匀,制得微孔凝胶液。
92.实施例10:本实施例与实施例1的不同之处在于:
93.pmma液原料中以同等质量的pmma替换pvac。
94.实施例11:本实施例与实施例1的不同之处在于:
95.交联剂为戊二醛。
96.对比例
97.对比例1:本对比例与实施例1的不同之处在于:
98.微孔凝胶液在制备过程中,原料中以同等质量的聚谷氨酸替换丝素蛋白溶液。
99.对比例2:本对比例与实施例1的不同之处在于:
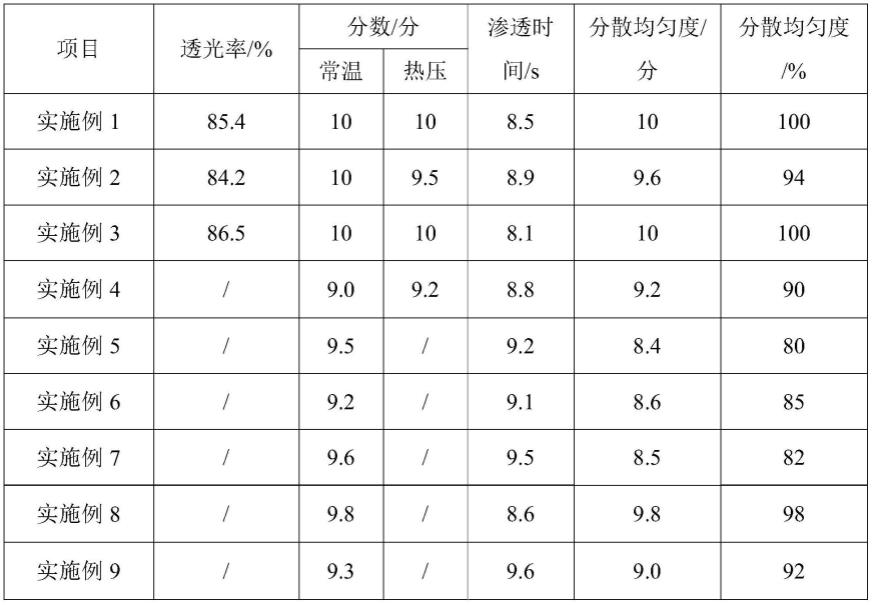
100.微孔凝胶液在制备过程中,原料中以同等质量的丝素蛋白溶液替换聚谷氨酸。
101.对比例3:本对比例与实施例1的不同之处在于:
102.微孔凝胶液在制备过程中,原料中未添加银纳米线。
103.性能检测试验
104.1、透光率
105.分别采用实施例1-3的制备方法制备微流控芯片,采用透光率雾度测定仪(购买于济南赛成电子科技有限公司,型号wgt-s),分别检测实施例1-3制备的微流控芯片的透光率,记录数据。
106.2、强度检测
107.分别采用实施例1-11以及对比例1-3的制备方法制备微流控芯片;
108.采用体视显微镜观察微孔层的孔隙情况,将微流控芯片上多余通孔封堵,仅保留2个通孔,通过其中一个通孔对微流控芯片加压,在0.5mpa压力下注入去离子水评判实施例1-9.11以及对比例1-3制备的微流控芯片中微孔层的孔隙变化情况,评分标准如下:孔隙结构无变化(10分)
→
孔隙结构部分被打通,使得孔隙结构连通,孔隙率降低,导致结构明显被破坏(0分),此条件下的评分记为常温分数。
109.采用体视显微镜观察微孔层的孔隙情况,将微流控芯片上多余通孔封堵,仅保留2个通孔,通过其中一个通孔对微流控芯片加压,在100℃、3mpa压力下观察基片、微孔层、盖片之间的连结关系,记录实施例1-4、实施例10、对比例1-3制备的成品微流控芯片是否发生形变以及出现层剥离的情况,评分标准如下:无形变、无层剥离现象(10分)
→
形变严重、各层相互剥离(0分),此条件下分数记为热压分数。
110.3、细胞检测
111.分别采用实施例1-9、11以及对比例1-3的制备方法制备微流控芯片,在102kpa条件下注射血液,采用体视显微镜观察血液在微通道内的流动情况,记录流经微通道所用的时间,并记录细胞分离情况,红细胞、血小板、白细胞分散均匀度高,细胞间无粘结,分数10分
→
红细胞、血小板、白细胞分散均匀度差,各细胞之间堵塞粘结0分。
112.4、微生物检测
113.分别采用实施例1-9以及对比例1-3的制备方法制备微流控芯片,利用荧光标记大肠杆菌对微流控芯片的微生物分离效果进行检测;
114.检测方法如下:大肠杆菌(购买于中国典型培养物保藏中心cctcc),将pegfp1质粒转入大肠杆菌,挑选出阳性克隆,扩大培养后用30%无菌甘油与菌液等比例混合,制得荧光标记大肠杆菌菌株;荧光标记大肠杆菌菌株接种到含有100mg/l氨苄和100μg/l异丙基-β-d-硫代吡喃半乳糖苷的lb液体培养基中,37℃过夜培养,培养后的细菌样品进行计数,细胞浓度为8.5*106个/ml,制得菌液;将50μl的稀释液添加到芯片上,芯片在室温下,静置5min,当样品溶液完全变干后,观察微孔层各腔室内细菌的分布情况,记录分布均匀度,即分布均匀100%
→
分布不均匀,产生严重聚集20%。
115.表1性能测试表
[0116][0117][0118]
结合实施例1和实施例2-3并结合表1可以看出,本技术制备的微流控芯片具有较好的透光率,无论在常温压力、热压条件下分数均较高,则机械强度较好,水分子渗透时间较短,细胞、微生物分散均匀度较高;说明聚谷氨酸、乙二醇二缩水甘油醚、丝素蛋白溶液、羟基氧化铝相配合,使微孔层具有较好的机械强度以及较好的亲水毛细作用,能够缩短渗透时间,并且使成品微流控芯片生物相容性较好,基片、盖片、微孔层相配合,不仅使成品微流控芯片制备工艺简单、操作便捷,而且便于实现样品预处理功能与分析检测功能的集成。
[0119]
结合实施例1和实施例4-11并结合表1可以看出,实施例4中交联剂原料中未添加羟基氧化铝,相比于实施例1,实施例4制备的成品微流控芯片在常温压力以及热压条件下分数均低于实施例1,水分子渗透时间长于实施例1,细胞、微生物分散均匀度小于实施例1;说明聚谷氨酸、乙二醇二缩水甘油醚、丝素蛋白溶液、羟基氧化铝相配合,形成比表面积较大、孔隙率较多的网络结构,便于实现细胞、微生物的分离;而羟基氧化铝粘附在三维聚合网络结构表面及孔隙内部,提高三维网络结构的机械强度以及耐热性,当受到进样注射压力时,不易发生结构形变,以保证实现样品预处理功能与分析检测功能的集成。
[0120]
实施例5微孔凝胶液制备过程中,聚谷氨酸、乙二醇二缩水甘油醚、丝素蛋白溶液、
羟基氧化铝一次性混合搅拌,实施例6微孔凝胶液在制备过程中,将丝素蛋白溶液与聚谷氨酸添加顺序调换,实施例7微孔凝胶液在制备过程,将羟基氧化铝与乙二醇二缩水甘油醚的添加顺序调换,相比于实施例1,实施例5、6、7制备的成品微流控芯片常温压力条件下分数低于实施例1,水分子渗透时间长于实施例1,细胞、微生物分散均匀度小于实施例1;说明限定聚谷氨酸、乙二醇二缩水甘油醚、丝素蛋白溶液、羟基氧化铝的添加顺序,便于促进三维聚合网络结构的形成,同时提高三维网络结构的机械强度,使微孔层具有较好的亲水毛细作用力以及较好的强度,从而使成品微流控芯片便于实现样品预处理功能与分析检测功能的集成。
[0121]
实施例8微孔凝胶液制备过程中,银纳米线的溶剂为水,相比于实施例1,实施例8制备的成品微流控芯片常温压力条件下分数低于实施例1,水分子渗透时间长于实施例1,细胞、微生物分散均匀度小于实施例1;说明银纳米线、n,n-二甲基甲酰胺、聚谷氨酸相配合,进一步提高聚合网络结构内部亲水作用力,从而使微流控芯片便于实现样品预处理功能与分析检测功能的集成。
[0122]
实施例9微孔凝胶液制备过程中,银纳米线与羟基氧化铝一同添加,相比于实施例1,实施例9制备的成品微流控芯片常温压力条件下分数低于实施例1,水分子渗透时间长于实施例1,细胞、微生物分散均匀度小于实施例1;说明银纳米线与羟基氧化铝一同在混合后期加入,银纳米线在聚合网络结构表面,不便于吸引细胞、微生物快速穿透聚合网络结构,从而影响分离效率和分散程度。
[0123]
实施例10的pmma液原料中以同等质量的pmma替换pvac,相比于实施例1,实施例10制备的成品微流控芯片热压条件下分数低于实施例1;说明pmma、pvac相配合,提高pmma基片的耐热性,使成品微流控芯片受热压条件下不易发生形变以及剥离现象,从而使成品微流控芯片能够应用于热催化领域,扩宽微流控芯片的应用范围。
[0124]
实施例11交联剂为戊二醛,相比于实施例1,实施例11制备例的成品微流控芯片强度差于实施例1,说明羟基氧化铝、乙二醇二缩水甘油醚相配合能够提成品微流控芯片的强度,并缩短待测样品在微流控芯片的扩散时间。
[0125]
结合实施例1和对比例1-3并结合表1可以看出,对比例1微孔凝胶液在制备过程中,原料中以同等质量的聚谷氨酸替换丝素蛋白溶液,对比例2微孔凝胶液在制备过程中,原料中以同等质量的丝素蛋白溶液替换聚谷氨酸,相比于实施例1,对比例1、2制备的成品微流控芯片无论常温压力条件下还是热压条件下分数均低于实施例1对应分数值,水分子渗透时间长于实施例1,细胞、微生物分散均匀度小于实施例1;说明聚谷氨酸、丝素蛋白溶液相配合,便于形成比表面积较大的三维网络结构,从而提高微孔层的亲水毛细作用以及生物相容性,同时聚谷氨酸、丝素蛋白溶液、pmma液相配合,通过较高的粘结强度,使得成品微流控芯片机械强度较好,从而使微流控芯片便于实现样品预处理功能与分析检测功能的集成的同时,具有较好的机械强度和耐热性。
[0126]
对比例3原料中未添加银纳米线,相比于实施例1,对比例3制备的成品微流控芯片无论常温压力条件下还是热压条件下分数均低于实施例1对应分数值,水分子渗透时间长于实施例1,细胞、微生物分散均匀度小于实施例1;说明银纳米线较大的比表面积,能够促进三维聚合网络的形成,并保持较大的连通孔隙结构,促进细胞、微生物实现分离。
[0127]
本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人
员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1