一种单细胞分选微流控芯片的制作方法
1.本实用新型属于微流控和细胞分选技术领域,涉及一种单细胞分选微流控芯片。
背景技术:
2.细胞是生命活动的基本单位,基于单细胞水平的研究能够在更深层次上揭示生命活动的发展规律。单细胞分选是单细胞研究的基础和关键。目前,单细胞分选主要有微针吸取法、显微切割、有限稀释法、微孔阵列和基于微流控的分选方法。当前方法面临着操作难度大、效率低、细胞损伤及多细胞获取等问题,不利于后续分析。因此,单细胞研究中亟需一种操作简单、细胞损伤小、高单细胞率及高通量的高效单细胞分选微流控芯片。
技术实现要素:
3.鉴于以上所述现有技术的缺点,本实用新型的目的在于提供一种单细胞分选微流控芯片,用于解决现有技术中单细胞分选方法操作难度大、效率低、细胞损伤及多细胞获取等问题。
4.为实现上述目的及其他相关目的,本实用新型提供一种单细胞分选微流控芯片,包括:
5.细胞供应槽;
6.微柱阵列,位于所述细胞供应槽中并包括多根间隔设置的微柱,所述微柱阵列将所述细胞供应槽分隔为注入区与流出区;
7.多个分立设置的捕获单元,所述捕获单元包括细胞输送通道、单细胞捕获通道、绕行通道、废液排出通道及单细胞导出通道,其中,所述细胞输送通道的入口与所述细胞供应槽相接,且所述注入区、所述流出区及所述细胞输送通道依次连通,所述细胞输送通道的出口、所述绕行通道的入口及所述单细胞导出通道的入口相连以组成三通结构,所述绕行通道包括依次相连的流入段、绕行段及流出段,所述流入段与所述流出段的流向相反,所述单细胞捕获通道的入口与所述流入段的管壁相接,所述单细胞捕获通道的出口与所述流出段的管壁相接,所述废液排出通道的入口与所述绕行通道的出口相连,所述废液排出通道的出口设有液体流动驱动部件,所述单细胞导出通道的出口设有单细胞导出部件。
8.可选地,所述单细胞分选微流控芯片包括衬底层及位于所述衬底层表面的流道层,所述细胞供应槽、所述细胞输送通道、所述单细胞捕获通道、所述绕行通道、所述废液排出通道及所述单细胞导出通道均位于所述流道层中。
9.可选地,所述微柱阵列包括第一子阵列及第二子阵列,所述注入区位于所述第一子阵列与所述第二子阵列之间,所述流出区包括第一流出子区及第二流出子区,所述第一流出子区位于所述第一子阵列远离所述注入区的一侧,所述第二流出子区位于所述第二子阵列远离所述注入区的一侧。
10.可选地,所述单细胞分选微流控芯片包括分别位于所述细胞供应槽两侧的第一捕获单元组与第二捕获单元组,所述第一捕获单元组与所述第二捕获单元组均包括多个分立
设置的多个所述捕获单元,所述第一捕获单元组与所述第一流出子区相接,所述第二捕获单元组与所述第二流出子区相接。
11.可选地,所述单细胞捕获通道的入口尺寸大于所述单细胞捕获通道的出口尺寸,且所述单细胞捕获通道的出口尺寸设置为小于单个待分选细胞的通过尺寸。
12.可选地,所述单细胞捕获通道的流阻小于所述绕行段的流阻,且所述单细胞捕获通道设置为仅能容纳单个待分选细胞。
13.可选地,所述细胞输送通道、所述绕行通道及所述单细胞导出通道的通过尺寸设置为仅允许单个待分选细胞通过。
14.可选地,所述单细胞导出通道与所述绕行通道的所述流入段位于同一条直线上。
15.可选地,所述液体流动驱动部件包括热泡打印喷嘴、压电喷嘴、pdms微阀、电磁阀及蠕动泵中的一种,所述单细胞导出部件包括热泡打印喷嘴、压电喷嘴、pdms微阀、电磁阀及蠕动泵中的一种。
16.可选地,所述绕行段来回弯折至少一次。
17.如上所述,本实用新型的单细胞分选微流控芯片包括细胞供应槽、微柱阵列及多个分立设置的捕获单元,其中,所述微柱阵列将所述细胞供应槽分隔为注入区与流出区,多个分立设置的所述捕获单元分别与所述细胞供应槽的流出区相接,每个捕获单元均设有各自的液体流动驱动部件,使得每个捕获单元的液体流动可单独控制,不会随捕获单元数量的增加而导致整体流阻显著增大,从而使得捕获单元的数量不受限制或限制更少,实现更高的通量。本实用新型可通过匹配捕获通道和绕行通道的流阻比例,使捕获通道的流阻小于绕行通道的流阻,同时捕获位置的尺寸设计为仅能容纳单个细胞,实现单细胞的轻松拦截,提高单细胞的捕获率。微柱阵列避免了多细胞团和杂质对后续通道的堵塞,保证了单细胞分选的流畅性。单细胞分选微流控芯片的流道层可选用二氧化硅膜或非光敏干膜,避免传统干膜的自发荧光干扰问题。
附图说明
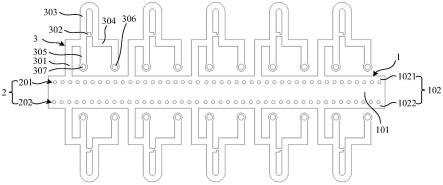
18.图1显示为本实用新型的单细胞分选微流控芯片中流道的平面布局图。
19.图2显示为所述捕获单元捕获单细胞时的示意图。
20.图3显示为利用所述单细胞导出部件带动液体流动以将被捕获的单细胞拉离捕获位置的示意图。
21.元件标号说明
22.1细胞供应槽
23.101注入区
24.102流出区
25.1021第一流出子区
26.1022第二流出子区
27.2微柱阵列
28.201第一子阵列
29.202第二子阵列
30.3捕获单元
31.301细胞输送通道
32.302单细胞捕获通道
33.303绕行通道
34.304废液排出通道
35.305单细胞导出通道
36.306液体流动驱动部件
37.307单细胞导出部件
38.4单细胞
具体实施方式
39.以下通过特定的具体实例说明本实用新型的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本实用新型的其他优点与功效。本实用新型还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本实用新型的精神下进行各种修饰或改变。
40.请参阅图1至图3。需要说明的是,本实施例中所提供的图示仅以示意方式说明本实用新型的基本构想,遂图式中仅显示与本实用新型中有关的组件而非按照实际实施时的组件数目、形状及尺寸绘制,其实际实施时各组件的型态、数量及比例可为一种随意的改变,且其组件布局型态也可能更为复杂。
41.实施例一
42.本实施例中提供一种单细胞分选微流控芯片,请参阅图1,显示为该单细胞分选微流控芯片中流道的平面布局图,所述单细胞分选微流控芯片中包括细胞供应槽1、微柱阵列2及多个分立设置的捕获单元3,其中,所述微柱阵列2位于所述细胞供应槽1中并包括多根间隔设置的微柱,所述微柱阵列2将所述细胞供应槽1分隔为注入区101与流出区102,所述捕获单元3包括细胞输送通道301、单细胞捕获通道302、绕行通道303、废液排出通道304及单细胞导出通道305,其中,所述细胞输送通道301的入口与所述细胞供应槽1相接,且所述注入区101、所述流出区102及所述细胞输送通道301依次连通,所述细胞输送通道301的出口、所述绕行通道303的入口及所述单细胞导出通道305的入口相连以组成三通结构,所述绕行通道303包括依次相连的流入段、绕行段及流出段,所述流入段与所述流出段的流向相反,所述单细胞捕获通道302的入口与所述流入段的管壁相接,所述单细胞捕获通道302的出口与所述流出段的管壁相接,所述废液排出通道304的入口与所述绕行通道303的出口相连,所述废液排出通道304的出口设有液体流动驱动部件306,所述单细胞导出通道305的出口设有单细胞导出部件307。
43.作为示例,所述单细胞分选微流控芯片包括流道层,所述细胞供应槽1、所述细胞输送通道301、所述单细胞捕获通道302、所述绕行通道303、所述废液排出通道304及所述单细胞导出通道305均位于所述流道层中。
44.作为示例,所述流道层选用二氧化硅膜或非光敏干膜,可以避免流道层自身的荧光干扰问题,其中,所述非光敏干膜可以选用旋涂玻璃(spinonglass,简称sog,是一种聚氧硅烷类旋涂材料)、非光敏环氧树脂、非光敏聚酰亚胺等材料。
45.具体的,当对具有不同荧光特性的细胞进行分选时,由于本实用新型的单细胞分
选微流控芯片采用二氧化硅薄膜或者非光敏干膜用于芯片流道层的制作,可以避免传统干膜自身荧光对细胞分选的影响,进一步拓展芯片的功能。
46.作为示例,所述微柱的材质可以是硅或二氧化硅。所述微柱阵列2用于拦截杂质和多细胞团,防止其堵塞后续通道。
47.作为示例,所述微柱阵列2包括第一子阵列201及第二子阵列202,所述注入区101位于所述第一子阵列201与所述第二子阵列202之间,所述流出区102包括第一流出子区1021及第二流出子区1022,所述第一流出子区1021位于所述第一子阵列201远离所述注入区101的一侧,所述第二流出子区1022位于所述第二子阵列202远离所述注入区101的一侧。
48.作为示例,所述单细胞分选微流控芯片包括分别位于所述细胞供应槽1两侧的第一捕获单元组与第二捕获单元组,所述第一捕获单元组与所述第二捕获单元组均包括多个分立设置的多个所述捕获单元3,所述第一捕获单元组与所述第一流出子区1021相接,所述第二捕获单元组与所述第二流出子区1022相接。
49.作为示例,所述单细胞捕获通道302的入口尺寸大于所述单细胞捕获通道302的出口尺寸,且所述单细胞捕获通道302的出口尺寸设置为小于单个待分选细胞的通过尺寸,从而使得单细胞进入所述单细胞捕获通道302之后无法通过所述单细胞捕获通道302的出口排出。
50.作为示例,所述单细胞捕获通道302的流阻设置为小于所述绕行段的流阻,从而确保流过的细胞优先流向所述单细胞捕获通道302并实现单细胞拦截。本实施例中,所述单细胞捕获通道302设置为仅能容纳单个待分选细胞,细胞拦截后,所述单细胞捕获通道302的流阻增加,后续细胞优先流向所述绕行通道303,确保所述单细胞捕获通道302中的单细胞拦截精度。
51.具体的,可通过调整通道尺寸、通道长度、通道的图形等来控制通道的流阻,例如,同样的通过尺寸与图形,通道长度越长,流阻越大。
52.作为示例,所述绕行段来回弯折至少一次以增大流阻。本实施例中,所述绕行端呈u型,所述单细胞捕获通道302大致呈直线型,所述单细胞导出通道305呈直线型,所述单细胞导出通道305与所述绕行通道303的所述流入段位于同一条直线上。
53.作为示例,所述细胞输送通道301、所述绕行通道303及所述单细胞导出通道305的通过尺寸设置为仅允许单个待分选细胞通过。
54.作为示例,所述液体流动驱动部件306包括热泡打印喷嘴、压电喷嘴、pdms(聚二甲基硅氧烷)微阀、电磁阀及蠕动泵中的一种,所述单细胞导出部件307包括热泡打印喷嘴、压电喷嘴、pdms微阀、电磁阀及蠕动泵中的一种。
55.本实施例中,所述液体流动驱动部件306优选采用热泡打印头,其包括与所述废液排出通道304的出口相连的喷嘴及集成在通道底部的加热膜,利用加热膜的瞬间高温使上方的液体气化,从而产生气泡推动液体流动并从喷嘴喷出,接着后续液体进行补充。采用热泡打印头作为所述液体流动驱动部件306可以避免外接驱动设备(如注射泵)的引入。
56.本实施例中,所述单细胞导出部件307也优选采用热泡打印头,其包括与所述单细胞导出通道305的出口相连的喷嘴及集成在通道底部的加热膜,利用加热膜的瞬间高温使上方的液体气化,从而产生气泡推动液体流动将单细胞拉离捕获位置,并使被捕获的单细胞移动到加热膜上方从喷嘴喷出而实现单细胞导出。采用热泡打印头作为所述单细胞导出
部件307不仅可以实现单细胞的快速、高通量的导出,还对细胞的伤害较小,可以实现单细胞的轻柔导出。
57.作为示例,所述单细胞分选微流控芯片还包括衬底层,所述流道层位于衬底层表面,所述热泡打印头的加热膜制作于所述衬底层表面。
58.作为示例,所述衬底层的材质包括硅,其中可制作有所需的电路元件与线路。由于所述流道层选用二氧化硅层、旋涂玻璃层、非光敏环氧树脂材料层或非光敏聚酰亚胺材料层,不仅可以避免流道层自身的荧光干扰问题,还可以与硅衬底良好结合,并易于在硅衬底上采用微纳工艺加工流道层以形成所需的流道,例如可以先在所述衬底层上形成第一流道层,并图形化所述第一流道层以得到所需流道,再在所述第二流道层上形成第二流道层以封闭所述第一流道层中的流道。
59.如上所述,本实施例的单细胞分选微流控芯片包括细胞供应槽、微柱阵列及多个分立设置的捕获单元,其中,所述微柱阵列将所述细胞供应槽分隔为注入区与流出区,可以避免多细胞团和杂质对后续通道的堵塞,保证单细胞分选的流畅性,多个分立设置的所述捕获单元分别与所述细胞供应槽的流出区相接,每个捕获单元均设有各自的液体流动驱动部件,使得每个捕获单元的液体流动可单独控制,不会随捕获单元数量的增加而导致整体流阻显著增大,从而使得捕获单元的数量不受限制或限制更少,实现更高的通量。通过匹配捕获通道和绕行通道的流阻,可高效率实现单细胞的捕获。通过热泡打印头为细胞悬液流动和细胞导出提供驱动力,可以使细胞导出更加便捷高效。利用二氧化硅薄膜或者非光敏干膜代替传统干膜进行流道层制作,可以避免传统干膜自身荧光对细胞分选的影响,拓展芯片的功能,适用于对具有不同荧光特性的细胞进行分选。本实施例的微流控芯片可采用成熟的半导体加工工艺进行制作,集成度高,为单细胞分选的高通量提供保障。
60.实施例二
61.本实施例中提供一种单细胞分选方法,包括以下步骤:
62.s1:提供实施例一中所述的单细胞分选微流控芯片,将待分选细胞的悬浮液经由所述注入区101通入到所述细胞供应槽1中;
63.s2:通过所述液体流动驱动部件306驱动所述悬浮液形成连续的流动,其中,所述悬浮液经过所述微柱阵列2过滤掉杂质和多细胞团后依次流入所述流出区102与所述捕获单元3,当单细胞进入所述单细胞捕获通道302被拦截后,所述单细胞捕获通道302流阻增大,后续细胞由所述绕行通道流入所述废液排出通道并被排出;
64.s3:所述单细胞捕获通道302捕获到单细胞后,通过所述单细胞导出部件307带动液体流动以将被捕获的单细胞拉离捕获位置并导出。
65.具体的,所述微柱阵列2避免了多细胞团和杂质对后续通道的堵塞,保证了单细胞分选的流畅性。单细胞分选的过程分为单细胞捕获过程和单细胞导出过程,先利用所述液体流动驱动部件306和所述单细胞捕获通道302完成单细胞的捕获,然后利用所述单细胞导出部件307完成单细胞的导出,请参阅图2及图3,其中,图2显示为所述捕获单元3捕获单细胞4时的示意图,图3显示为利用所述单细胞导出部件307带动液体流动以将被捕获的单细胞4拉离捕获位置的示意图。
66.具体的,利用热泡打印头作为细胞悬液流动和单细胞导出的动力源,可以避免引入外接驱动设备,使细胞导出更加便捷高效。
67.具体的,当采用热泡打印头作为所述单细胞导出部件307时,加热膜加热液体产生气泡推动液体流动的这一过程将单细胞4带离拦截位置(所述单细胞捕获通道302),并将单细胞4从喷嘴喷出到指定容器内,实现细胞收集。热泡打印头具有响应快、驱动力强、便于控制、易于集成和微型化的优点,为单细胞便捷高效的分选提供了保障。
68.作为示例,对于某种特定的细胞,可利用移液枪或其它合适的设备将该细胞的悬浮液通入到所述微流控芯片中,所述微柱阵列过滤掉杂质和多细胞团,确保后续通道中的单细胞流动。当细胞流过捕获单元时,由于所述单细胞捕获通道的流阻小于所述绕行通道的流阻,细胞优先拦截在所述单细胞捕获通道中,导致所述单细胞捕获通道流阻增大,后续细胞只能由所述绕行通道流向所述废液排出通道,保证单细胞的捕获精度。捕获单元的设计与细胞尺寸息息相关。当细胞尺寸发生变化时,改变捕获通道的宽度,使捕获位置仅能容纳单个细胞,同时,改变绕行通道的长度,使其流阻大于改变后捕获通道的流阻,即能实现不同尺寸的单细胞捕获。细胞捕获后,触发所述单细胞导出部件,将细胞从喷孔喷出,实现单细胞的收集。多个所述捕获单元可呈阵列式排布并可同时控制,因此可以实现单细胞的快速、高通量的分选。
69.综上所述,本实用新型的单细胞分选微流控芯片包括细胞供应槽、微柱阵列及多个分立设置的捕获单元,其中,所述微柱阵列将所述细胞供应槽分隔为注入区与流出区,多个分立设置的所述捕获单元分别与所述细胞供应槽的流出区相接,每个捕获单元均设有各自的液体流动驱动部件,使得每个捕获单元的液体流动可单独控制,不会随捕获单元数量的增加而导致整体流阻显著增大,从而使得捕获单元的数量不受限制或限制更少,实现更高的通量。本实用新型可通过匹配捕获通道和绕行通道的流阻比例,使捕获通道的流阻小于绕行通道的流阻,同时捕获位置的尺寸设计为仅能容纳单个细胞,实现单细胞的轻松拦截,提高单细胞的捕获率。微柱阵列避免了多细胞团和杂质对后续通道的堵塞,保证了单细胞分选的流畅性。单细胞分选微流控芯片的流道层可选用二氧化硅膜或非光敏干膜,避免传统干膜的自发荧光干扰问题。所以,本实用新型有效克服了现有技术中的种种缺点而具高度产业利用价值。
70.上述实施例仅例示性说明本实用新型的原理及其功效,而非用于限制本实用新型。任何熟悉此技术的人士皆可在不违背本实用新型的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本实用新型所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本实用新型的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1