一种微流控芯片及其应用
本说明书涉及核酸检测,特别涉及一种微流控芯片及其应用。
背景技术:
1、1983年pcr(聚合酶链式反应)技术的发明为分子生物学带来了技术上的巨大突破,目前已成为分子生物学最常用也最重要的一项技术,其应用范围从基因扩增到基因克隆、传染病源检测、遗传鉴定等。
2、pcr的发展进程总体而言可分为三代。第一代pcr技术采用利用凝胶电泳来进行终点分析以获得定性结果。第二代pcr技术是实时荧光qpcr技术,它利用荧光探针监测每个循环后的扩增进程来实现半定量。qpcr中定量信息需要通过循环阈值(ct)来获得,循环阈值是在标准荧光曲线上信号高于背景的一个点。因此需要利用标准曲线来定量未知浓度的样品,另外不完全的扩增效率会影响ct值,进而限制该技术绝对定量的准确性。数字pcr(dpcr)技术也被称为第三代pcr技术,是一种高灵敏检测和绝对定量的新方法。与传统的pcr相比,数字pcr增加了对反应体系进行分隔的操作,将几十微升的反应体系分隔成了数万个微小独立反应体系,稀释过的核酸模板在分隔过程中随机分装入这数万个反应体系中,根据泊松分布,有一些反应体系中含有一个或多个模板分子,而剩下的反应体系则不含有模板分子。经过扩增反应达到了pcr最终平台期后,含有模板分子的反应体系会变成阳性,而不含有模板分子的则保持为阴性。柏松统计原理如下公式所示,
3、λ=-ln(1-p)
4、其中λ是每个反应单元内的目标dna分子的平均数量,p是阳性液滴的比例,再通过液滴体积和数量的估计,从而得到定量靶标dna浓度的估计值。
5、dpcr相较于qpcr有着很明显的优势。首先dpcr不需要依赖标准曲线和ct值来定量未知样品的浓度,而只需统计阴阳液滴的比例就能做到绝对定量靶标dna。其次dpcr的结果不依赖于pcr的扩增效率,因此准确性会相对提高。目前已有文献报道,dpcr有高于qpcr500倍的灵敏度。另外dpcr具有很高的灵敏度和特异性,对突变基因和变异病毒的检测也非常准确。新型冠状病毒的流行衍生出了delta、lambda以及omicron等变异株病毒,并已经出现在全球90多个国家,如何快速准确的诊断病毒特别是变异株,对治疗和防疫工作具有重要意义。基于dpcr的高灵敏度、高准确性以及抗干扰能力强等优点,更多的实验室和医院将目光投向dpcr技术。
6、由于dpcr是基于泊松分布的原理,其动态范围也受柏松统计原理的限制。当所有液滴中的dna分子都大于1,也就是当所有液滴都为阳性液滴时,此时泊松统计失效,达到了检测上限。由于此特点,dpcr的动态范围往往与液滴数量在同一数量级,约为105拷贝左右,qpcr的动态范围在109拷贝左右。然而当医院进行病毒检测时,病人的病毒载量往往过于高,以至于超出了dpcr的动态检测范围,无法不稀释样本而达到绝对定量病毒载量,病毒载量通常是衡量病灶严重程度的重要指标,因此目前医院最常用的检测手段依然是qpcr技术。为了更早且更精确的检测出病毒以及其他罕见基因突变和变异株病毒,对于扩大动态范围的dpcr研究是十分有必要的。
7、目前为止也有许多工作努力提高dpcr的动态检测范围,有通过调节分装体积来实现的,rustem实验室发明的滑动芯片通过改变反应腔室的容积来达到扩大反应的动态范围的目的,容积大的腔室可用于检测低浓度样本模板量,贡献检测下限,而容积小的腔室可用于检测高浓度样本模板,贡献检测上限,但缺点是动态范围仍然只有106拷贝左右并且腔室数量不到1000个,数据可靠性不够。
8、还有通过稀释来实现增加动态范围的,但是稀释方法仍然是手动稀释再进行分装入液滴。garsteckid实验室设计的数字液滴集落形成单位通过在样品制备时将样品手动稀释成十个数量级,再通过这些样品分装入液滴,随后在液滴中孵育,最后对液滴的荧光信号进行分析,从而实现动态范围的增加,但显然该操作的步骤过于繁琐,不具有实际应用价值。因此,一种可以拓宽现有dpcr系统动态范围并实际应用的方法亟待被开发。
技术实现思路
1、为了解决上述问题,本技术提供一种适用于连续稀释液滴数字pcr(serialdilution droplet digital pcr,sd3pcr)的微流控芯片。
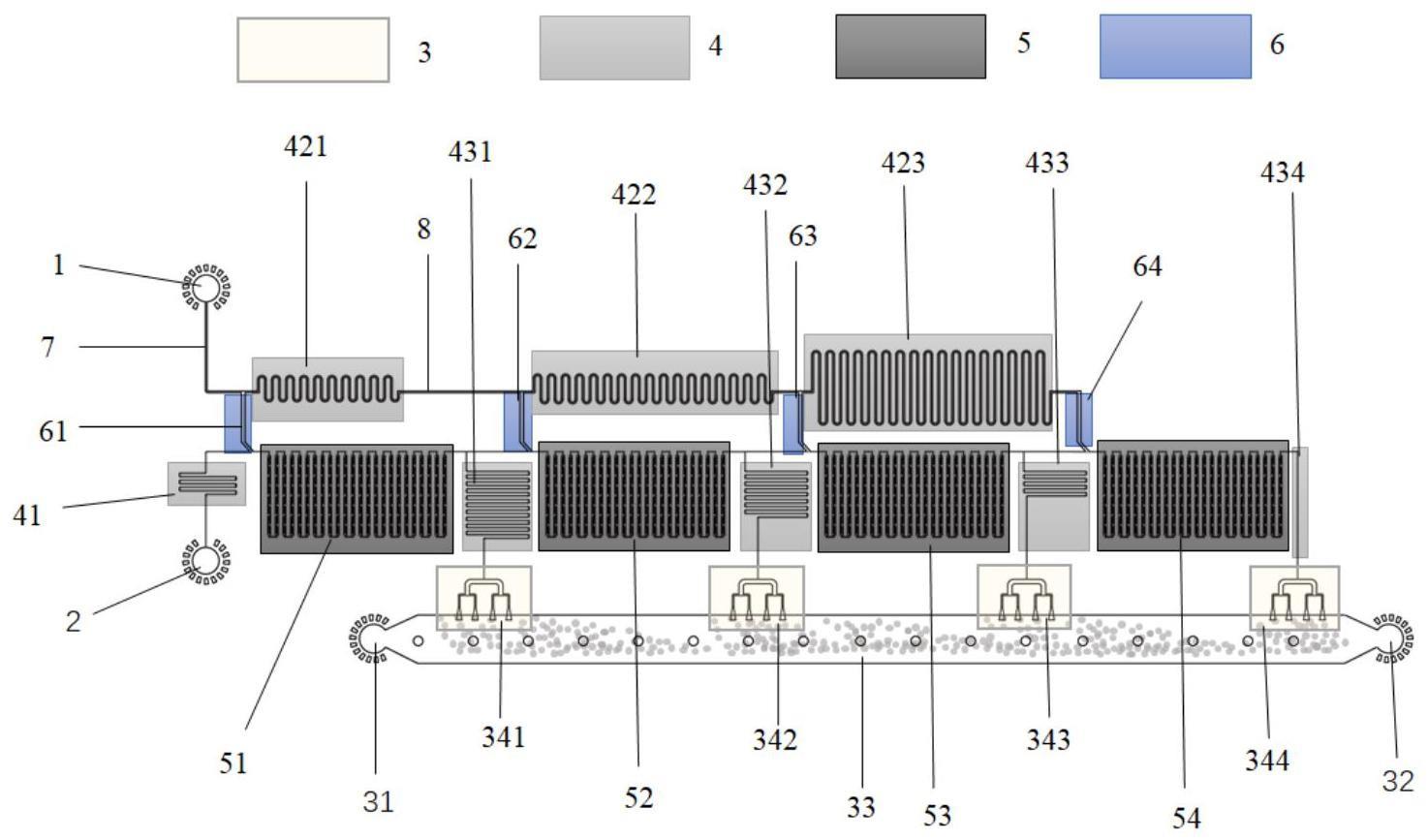
2、本技术提供一种微流控芯片,所述微流控芯片上设置有稀释液入口、待稀释液入口、管道流阻、混沌微型混合器、阶梯乳化液滴生成器;所述pcr预混液与所述样品和荧光指示剂溶液分别通过稀释液入口、待稀释液入口进入微流控芯片的管道流阻中;所述管道流阻包括稀释液入口管道流阻、蛇形稀释剂管道流阻和稀释模块出口管道流阻;所述混沌微型混合器通过所述稀释模块出口管道流阻与阶梯乳化液滴生成器连通。
3、本技术还提供一种数字pcr检测定量系统,包括上述的微流控芯片、液滴温度循环装置、光学成像与检测装置;所述微流控芯片用于将样本溶液进行稀释和包埋进入液滴;所述液滴温度循环装置用于对所述液滴进行温度循环以完成所述样本溶液的pcr扩增;所述光学成像与检测装置用于对完成pcr扩增的液滴进行荧光信号采集并绘制相应散点图以计算得到所述样本溶液的模板数量。
4、本技术还提供一种数字pcr定量检测方法,包括以下步骤:a.使用上任意项所述的微流控芯片将样本溶液进行稀释和包埋进入液滴;b.将液滴内样本溶液进行pcr反应;c.测量和编码液滴的pcr荧光值和指示剂荧光值;d.解码液滴的荧光值,区分液滴并计算初始拷贝数。
5、本技术还提供上述的微流控芯片、上述的数字pcr检测定量系统在制备数字pcr检测产品中的用途。
6、本说明书提出的微流控芯片,带来的有益效果包括但不限于:(1)生成液滴数量能够达到1~+∞个,使数据更可靠;(2)在保证液滴数量的同时得到四类浓度不同的液滴,四类液滴通过指示剂荧光信号区分,通过对数稀释初始样本来提高数字pcr的动态范围;(3)实现对样品溶液的连续稀释,从而扩大了ddpcr的动态检测范围至1×107。
7、附图说明
8、本技术将以示例性实施例的方式进一步说明,这些示例性实施例将通过附图进行详细描述。这些实施例并非限制性的,其中:
9、图1为根据本技术一些实施例所示的微流控芯片设计示意图;
10、图2为根据本技术一些实施例所示的微流控芯片设计示意图;
11、图3为根据本技术一些实施例所示的微流控芯片设计示意图;
12、图4为根据本技术一些实施例所示的微流控芯片设计示意图;
13、图5为根据本技术一些实施例所示的微流控芯片设计示意图;
14、图6为根据本技术一些实施例所示的阶梯乳化液滴部件实拍图;
15、图7为根据本技术一些实施例所示的pcr预混液和样品和荧光指示剂溶液的交界处实拍图;
16、图8为根据本技术一些实施例所示的微流控芯片设计示意图(a)和对应器件简化图(b);
17、图9为根据本技术一些实施例所示的混沌微型混合器5的表征荧光显微镜照片,aa’和bb’分别对应通道的入口和出口;
18、图10为根据本技术一些实施例所示的混沌微型混合器5中aa’和bb’处的荧光强度分布图;
19、图11为根据本技术一些实施例所示的液滴滴落(dripping)状态示意图;
20、图12为根据本技术一些实施例所示的液滴喷射(jetting)状态示意图;
21、图13为根据本技术一些实施例所示的数字pcr的流程图;
22、图14为根据本技术一些实施例所示的稀释不同浓度的荧光溶液的稀释曲线图;
23、图15为根据本技术一些实施例所示的荧光溶液预期浓度和实际浓度的正交对比图;
24、图16a为根据本技术一些实施例所示的四类液滴的明场实拍图;
25、图16b为根据本技术一些实施例所示的四类液滴的荧光场实拍图;
26、图16c为根据本技术一些实施例所示的四类液滴荧光值分布图;
27、图16d为根据本技术一些实施例所示的四类液滴的直径分布图;
28、图17为根据本技术一些实施例所示的hpv16质粒在对数稀释数字pcr和普通数字pcr的结果图;
29、图18为根据本技术一些实施例所示的使用sd3pcr系统检测hpv16质粒的结果图。
- 还没有人留言评论。精彩留言会获得点赞!