一种电化学合成6-叠氮甲基菲啶类化合物的方法与流程
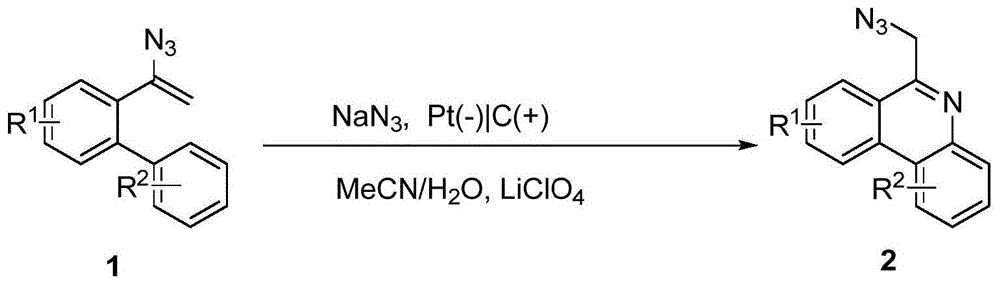
本发明涉及一种电化学合成6-叠氮甲基菲啶类化合物的方法,属于化学合成
技术领域:
。
背景技术:
:6-叠氮甲基菲啶类化合物的结构如下(其中r1,r2为不同取代位置的官能团或氢原子)。在有机合成领域,菲啶类化合物是一种十分常见的含氮杂环化合物,在具有生物活性的天然产物,药物,功能性材料等领域均有较广的应用。叠氮甲基则是一种十分重要且常见的官能团,在化学反应中,叠氮甲基可以通过一系列的转化变为氨基,氮杂环,氰基,酰胺,羧基等多种官能团,从而实现不同化合物的制备。目前制备6-叠氮甲基菲啶类化合物的方法较少,常规的方法是先制备出6-甲基菲啶,之后用nbs(溴代丁二酰亚胺)使甲基上的氢被溴取代,再用叠氮化钠与其反应从而得到6-叠氮甲基菲啶类化合物(参考文献:e.a.weitz,j.y.chang,a.h.rosenfield,v.c.pierre,.aselectiveluminescentprobeforthedirecttime-gateddetectionofadenosinetriphosphate[j].jamchemsoc2012,134,16099-16102.),反应路线如下。常规制备6-叠氮甲基菲啶类化合物的方法,其缺点包括反应路线长,步骤复杂,所需要时间长,成本高,反应条件强烈,对仪器设备要求高等问题。因此,发展一种反应条件温和、合成步骤简单且成本低的方法合成6-叠氮甲基菲啶类化合物具有重要意义。技术实现要素:本发明提供了一种以联苯乙烯叠氮和叠氮化钠为原料,乙腈和水混合溶液作为溶剂,利用电化直接制备出6-叠氮甲基菲啶类化合物的方法。本发明合成步骤简单,解决了常规合成方法高成本,所需时间长的问题,该反应只需要在室温下进行,不需要150℃高温,条件温和。由于电化学反应只需要通电,不需要复杂的光化学反应设备,对仪器设备要求低,另外,电能是直接应用在反应中,不需要经过能量转化,也一定程度上降低了反应成本。本发明的第一个目的是提供一种电化学合成6-叠氮甲基菲啶类化合物的制备方法,所述合成方法通式如下:式中r1为醚、芳香基、脂肪基和卤素取代的烷基,r2为脂肪基,卤素和卤素取代的烷基。在一种实施方式中,所述合成方法的步骤包括:(1)将烯烃叠氮类化合物1,叠氮化钠按摩尔比1:(1.5~2)的比例加入到电解池中,再向其中加入乙腈和水的混合溶液,乙腈和水的体积比为(10~15):1;(2)搅拌步骤(1)中的混合物,使其溶解,插入两个电极,正极用石墨电极,负极用铂电极,通2.2v-2.5v的恒压直流电,通电时间为3-5个小时,反应结束后,加水搅拌,萃取,干燥,纯化,得到6-叠氮甲基菲啶类化合物2。在一种实施方式中,所述合成方法中烯烃叠氮类化合物1为:2-(1-叠氮乙烯基)-5-甲基-1,1'-联苯,2-(1-叠氮乙烯基)-4-氯-1,1'-联苯,2-(1-叠氮乙烯基)-4-三氟甲基-1,1'-联苯,2-(1-叠氮乙烯基)-3'-甲氧基-1,1'-联苯,2-(1-叠氮乙烯基)-4'-三氟甲基-1,1'-联苯,2-(1-叠氮乙烯基)-1-苯基萘中的一种。在一种实施方式中,所述合成方法通式中r1为3-ome,3-cf3,r2为3-me,4-cl,4-cf3。在一种实施方式中,所述合成方法中乙腈和水按10:1的体积比混合。在一种实施方式中,所述合成方法中烯烃叠氮类化合物的浓度为0.05mol/l。在一种实施方式中,所述合成方法中电化的反应条件为:通2.3v的恒压直流电,通电3个小时。在一种实施方式中,所述合成方法中萃取使用的萃取剂是乙酸乙酯。在一种实施方式中,所述合成方法纯化的方法为柱层析分离法。本发明的有益效果:(1)本发明以联苯乙烯叠氮与叠氮化钠作为原料,乙腈和水混合溶液作为溶剂,电化学方法来制备得到6-叠氮甲基菲啶类化合物,收率不低于70%;(2)本发明反应使用的是不分隔的电解池,相较于传统6-叠氮甲基菲啶类化合物的合成方法,该方法对仪器设备要求不高,反应条件温和、合成步骤短,反应所需时间短,操作步骤简单,节约能源,成本低,可以应用在科研、医疗、工业等领域。附图说明图1电化学合成6-叠氮甲基菲啶类化合物的合成通式。图2实施例1中6-叠氮甲基菲啶的氢核磁共振谱图。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。所有试剂均为市售,在没有进一步处理的情况下使用。所有的烯烃叠氮类化合物均是根据已有文献方法合成的(e.g.mackay,a.studer,.electron-catalyzedfluoroalkylationofvinylazides[j].chem.-eur.j.2016,22:13455-13458.)。收率的计算方法:收率的计算方法:收率=目的产物(实际)生成量/目的产物的理论生成量×100%。核磁测试方法:称取一定质量的终产品放置在核磁管中,用氘代试剂cdcl3溶解,用aduanceiii核磁共振仪在25℃下进行1hnmr测试,1h的共振频率为400mhz。实施例16-叠氮甲基菲啶的制备在5ml的无隔膜电解池里加入2-(1-叠氮乙烯基)-1,1'-联苯44.2mg(0.2mmol),叠氮化钠19.5mg(0.3mmol),高氯酸锂42.6mg(0.4mmol),用4ml的乙腈和水混合溶剂(乙腈和水体积比为10:1)溶解,以铂片(10×10×0.1mm)作为阴极电极,石墨(10×10×0.1mm)作为阳极电极,通2.3v直流恒压电,反应3小时,反应毕,取出反应液加入分液漏斗,加水20ml,用乙酸乙酯萃取水相,用无水硫酸钠干燥有机相,再用柱层析分离萃取、干燥后的反应液得到黄色固体38.84mg,即16-叠氮甲基菲啶38.84mg,计算收率为83%。得到的产物结构式如下:图2为6-叠氮甲基菲啶的氢核磁共振谱图,由6-叠氮甲基菲的氢核磁共振谱图可以看出,各氢的化学位移与目标产物6-叠氮甲基菲相符,说明获得了终产品。1hnmr(400mhz,cdcl3)δ8.63(d,j=8.3hz,1h),8.54(d,j=8.1hz,1h),8.18(t,j=7.4hz,2h),7.85(t,j=7.7hz,1h),7.80–7.63(m,3h),4.96(s,2h).13cnmr(151mhz,cdcl3)δ154.85,143.25,133.26,130.90,130.28,128.90,127.67,127.49,125.73,124.34,124.28,122.61,122.03,54.52。实施例2:不同乙腈和水的体积比对制备6-叠氮甲基菲啶的影响在实施例1的基础上,进一步探究不同乙腈和水体积比对制备6-叠氮甲基菲啶的影响,将乙腈和水按照体积比5:1、7:1、10:1、20:1进行混合,其他反应条件与实施例1相同,分别制备6-叠氮甲基菲啶,结果见表1。由表1可知,当乙腈和水的体积比为5:1时,产物质量仅为16.38mg,收率仅为35%,逐渐增大乙腈和水的体积比时,产物的质量和收率也逐渐提高,当乙腈和水的体积比为10:1时,产物质量达到38.84mg,收率达到83%。继续增大乙腈和水的体积比,产物的质量和收率又降低,当乙腈和水的体积比为20:1时,产物质量为26.68mg,收率为57%。表1乙腈和水的体积比产物质量收率5:116.38mg35%7:126.21mg56%10:138.84mg83%20:126.68mg57%实施例3:不同电化电压对制备6-叠氮甲基菲啶的影响在实施例1的基础上,进一步探究不同电化电压对制备6-叠氮甲基菲啶的影响。将通电电压设置为1.5v、1.8v、2.3v、2.5v、3v,其他反应条件与实施例1相同,分别制备6-叠氮甲基菲啶,结果见表2。由表2可知,当电化电压为1.5v时,产物质量为2.34mg,收率仅为5%,逐渐增大电化电压时,产物的质量和收率也逐渐提高,当电化电压增加到2.3v时,产物质量达到38.84mg,收率达到83%。进一步增大电化电压时,产物的质量和收率又开始降低,当电化电压增加到2.5v时,产物质量为18.25mg,收率为39%。表2电化电压产物质量收率1.5v2.34mg5%1.8v15.44mg33%2.3v38.84mg83%2.5v30.42mg65%3v18.25mg39%实施例49-甲基-6-叠氮甲基菲啶的制备在5ml的无隔膜电解池里加入5-甲基-2-(1-叠氮乙烯基)-1,1'-联苯47.0mg(0.2mmol),叠氮化钠19.5mg(0.3mmol),高氯酸锂42.6mg(0.4mmol),用4ml的乙腈和水混合溶剂(乙腈和水体积比为10:1)溶解,以铂片(10×10×0.1mm)作为阴极电极,石墨(10×10×0.1mm)作为阳极电极,通2.3v直流恒压电,反应3小时,反应毕,取出反应液加入分液漏斗,加水20ml,用乙酸乙酯萃取水相,用无水硫酸钠干燥有机相,再用柱层析分离萃取、干燥后的反应液得到黄色固体36.2mg,即9-甲基-6-叠氮甲基菲啶36.2mg,计算收率为73%。得到的产物结构式如下:1hnmr(400mhz,cdcl3)δ8.50(d,j=7.9hz,1h),8.37(s,1h),8.16(d,j=8.1hz,1h),8.03(dt,j=8.4,2.5hz,1h),7.71(t,j=7.6hz,1h),7.64(t,j=7.6hz,1h),7.49(dd,j=8.4,2.4hz,1h),4.91(t,j=1.9hz,2h),2.68–2.50(m,3h).13cnmr(151mhz,cdcl3)δ154.66,143.40,141.40,133.39,130.17,129.37,128.75,127.23,125.57,124.15,122.43,122.23,122.01,54.49,22.31。实施例56-叠氮甲基-8-氯菲啶的制备在5ml的无隔膜电解池里加入2-(1-叠氮乙烯基)-4-氯-1,1'-联苯51.0mg(0.2mmol),叠氮化钠19.5mg(0.3mmol),高氯酸锂42.6mg(0.4mmol),用4ml的乙腈和水混合溶剂(乙腈和水体积比为10:1)溶解,以铂片(10×10×0.1mm)作为阴极电极,石墨(10×10×0.1mm)作为阳极电极,通2.3v直流恒压电,反应3小时,反应毕,取出反应液加入分液漏斗,加水20ml,用乙酸乙酯萃取水相,用无水硫酸钠干燥有机相,再用柱层析分离萃取、干燥后的反应液得到黄色固体40.7mg,即6-叠氮甲基-8-氯菲啶40.7mg,计算收率为76%。得到的产物结构式如下:1hnmr(400mhz,cdcl3)δ8.57(dd,j=8.9,2.4hz,1h),8.50(d,j=7.9hz,1h),8.24–8.11(m,2h),7.84–7.73(m,2h),7.70(t,j=7.6hz,1h),4.93(d,j=1.5hz,2h).13cnmr(151mhz,cdcl3)δ153.84,143.16,133.68,131.65,131.50,130.43,129.26,127.95,125.23,125.17,124.37,123.67,121.92,54.46。实施例68-三氟甲基-6-叠氮甲基菲啶的制备在5ml的无隔膜电解池里加入4-三氟甲基-2-(1-叠氮乙烯基)-1,1'-联苯57.8mg(0.2mmol),叠氮化钠19.5mg(0.3mmol),高氯酸锂42.6mg(0.4mmol),用4ml的乙腈和水混合溶剂(乙腈和水体积比为10:1)溶解,以铂片(10×10×0.1mm)作为阴极电极,石墨(10×10×0.1mm)作为阳极电极,通2.3v直流恒压电,反应3小时,反应毕,取出反应液加入分液漏斗,加水20ml,用乙酸乙酯萃取水相,用无水硫酸钠干燥有机相,再用柱层析分离萃取、干燥后的反应液得到黄色固体47.1mg,即8-三氟甲基-6-叠氮甲基菲啶47.1mg,计算收率为78%。得到的产物结构式如下:1hnmr(400mhz,cdcl3)δ8.74(d,j=8.7hz,1h),8.55(d,j=8.2hz,1h),8.44(s,1h),8.22(d,j=8.1hz,1h),8.04(d,j=8.7hz,1h),7.82(t,j=7.6hz,1h),7.73(t,j=7.6hz,1h),4.99(s,2h).13cnmr(101mhz,cdcl3)13cnmr(151mhz,cdcl3)δ154.80,143.85,135.42,130.52,130.14,129.45(q,j=32.8hz),128.11,126.76(q,j=3.2hz),123.85(q,j=272.5hz),123.73,123.64,123.30(q,j=4.0hz),122.38,54.40.19fnmr(377mhz,cdcl3)δ-62.22。实施例76-叠氮甲基-1-甲氧基菲啶的制备在5ml的无隔膜电解池里加入2-(1-叠氮乙烯基)-3’-甲氧基-1,1'-联苯50.2mg(0.2mmol),叠氮化钠19.5mg(0.3mmol),高氯酸锂42.6mg(0.4mmol),用4ml的乙腈和水混合溶剂(乙腈和水体积比为10:1)溶解,以铂片(10×10×0.1mm)作为阴极电极,石墨(10×10×0.1mm)作为阳极电极,通2.3v直流恒压电,反应3小时,反应毕,取出反应液加入分液漏斗,加水20ml,用乙酸乙酯萃取水相,用无水硫酸钠干燥有机相,再用柱层析分离萃取、干燥后的反应液得到黄色固体42.8mg,即6-叠氮甲基-1-甲氧基菲啶42.8mg,计算收率为81%。得到的产物结构式如下:1hnmr(400mhz,cdcl3)δ8.57(d,j=8.3hz,1h),8.18(d,j=8.2hz,1h),8.10(d,j=8.9hz,1h),7.93–7.80(m,2h),7.72(t,j=7.8hz,1h),7.37(dd,j=8.9,2.7hz,1h),4.95(s,2h),4.02(s,3h).13cnmr(101mhz,cdcl3)δ158.85,152.23,138.51,132.77,131.67,130.47,127.75,125.78,125.46,124.53,122.63,118.73,102.98,55.69,54.58。实施例83-三氟甲基-6-叠氮甲基菲啶的制备在5ml的无隔膜电解池里加入4’-三氟甲基-2-(1-叠氮乙烯基)-1,1'-联苯57.8mg(0.2mmol),叠氮化钠19.5mg(0.3mmol),高氯酸锂42.6mg(0.4mmol),用4ml的乙腈和水混合溶剂(乙腈和水体积比为10:1)溶解,以铂片(10×10×0.1mm)作为阴极电极,石墨(10×10×0.1mm)作为阳极电极,通2.3v直流恒压电,反应3小时,反应毕,取出反应液加入分液漏斗,加水20ml,用乙酸乙酯萃取水相,用无水硫酸钠干燥有机相,再用柱层析分离萃取、干燥后的反应液得到黄色固体49.5mg,即3-三氟甲基-6-叠氮甲基菲啶49.5mg,计算收率为82%。得到的产物结构式如下:1hnmr(400mhz,cdcl3)δ8.64(dd,j=14.8,8.4hz,2h),8.49(d,j=1.9hz,1h),8.22(dd,j=8.2,1.2hz,1h),7.94(ddd,j=8.3,7.0,1.3hz,1h),7.87(dd,j=8.5,1.9hz,1h),7.82(ddd,j=8.2,7.0,1.2hz,1h),4.99(s,2h).13cnmr(151mhz,cdcl3)δ156.47,142.52,132.37,131.46,130.70(q,j=32.7hz),128.85,127.78(q,j=4.1hz),126.50,125.83,124.84,124.01(d,j=272.3hz),123.27(q,j=3.3hz),123.06,122.96.19fnmr(565mhz,cdcl3)δ-62.28。实施例96-叠氮甲基苯并[k]菲啶的制备在5ml的无隔膜电解池里加入2-(1-叠氮乙烯基)-1-苯基萘54.2mg(0.2mmol),叠氮化钠19.5mg(0.3mmol),高氯酸锂42.6mg(0.4mmol),用4ml的乙腈和水混合溶剂(乙腈和水体积比为10:1)溶解,以铂片(10×10×0.1mm)作为阴极电极,石墨(10×10×0.1mm)作为阳极电极,通2.3v直流恒压电,反应3小时,反应毕,取出反应液加入分液漏斗,加水20ml,用乙酸乙酯萃取水相,用无水硫酸钠干燥有机相,再用柱层析分离萃取、干燥后的反应液得到黄色固体42.0mg,即6-叠氮甲基苯并[k]菲啶42.0mg,计算收率为74%。得到的产物结构式如下:1hnmr(400mhz,cdcl3)δ9.10(dd,j=6.4,3.5hz,1h),8.98(d,j=8.4hz,1h),8.30(dd,j=8.3,1.4hz,1h),8.09–8.01(m,2h),7.98(d,j=8.8hz,1h),7.79(ddd,j=8.3,7.0,1.3hz,1h),7.72(ddd,j=9.7,7.4,5.1hz,3h),5.04(s,2h).13cnmr(151mhz,cdcl3)δ153.89,145.22,134.74,132.48,130.17,129.12,128.83,128.70,128.53,128.47,128.06,127.09,127.06,124.56,123.23,121.74,54.92。虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1