从低纯度原料电解生产高纯度锂的制作方法
从低纯度原料电解生产高纯度锂
背景技术:
1.锂的密度在标准条件下在金属中是最低的,这种特性使它在轻合金中具有吸引力。锂也被广泛用作生产有机锂的化学试剂。近几十年来,用于便携式电子产品、电动汽车和大型能源系统的锂离子电池(lib)迎来了爆发式增长,导致锂消耗量的显著增加。虽然目前商用lib没有直接使用金属锂作为电极材料,但锂金属阳极对于下一代有高能量密度的可充电电池(例如全固态锂金属电池和锂硫电池)是必不可少的。预计未来几十年对金属锂的需求将显著增长。锂资源的可持续性问题越来越受到学术研究界和产业界的关注。从低品位盐湖和海水中回收锂,可能为锂资源的可持续发展提供切实可行的解决方案。
2.需要改进从国家资源中提纯锂的方法,特别是那些具有低纯度锂的资源。
3.发明概述在一些实施例中,本发明提供用于从锂盐(包括具有低浓度锂盐的锂盐)中提纯锂的装置和方法。这种方法不需要先提纯天然来源的锂盐。此外,工作温度显著降低。因此,与常规方法相比,本技术显著降低了锂提纯的成本和时间。
4.因此,根据本发明的一个实施例,提供了一种电解方法,包括电解包含锂盐的熔融组合物,其中阳极与熔融组合物接触,阴极通过能够传导锂离子的固体电解质与熔融组合物隔开,其中固体电解质允许锂离子而不允许其他原子通过。
5.在一些实施例中,传导锂离子的固体电解质包含石榴石(garnet)型氧化物,例如掺杂钽的li7la3zr2o
12
。石榴石型氧化物的例子包括li7‑
x
la3ta
x
zr2‑
x
o
12
,其中x为0.1至1.0,或优选为0.4至0.6。具体例子包括但不限于li
6.4
la3ta
0.6
zr
1.4
o
12
、li
6.5
la3ta
0.5
zr
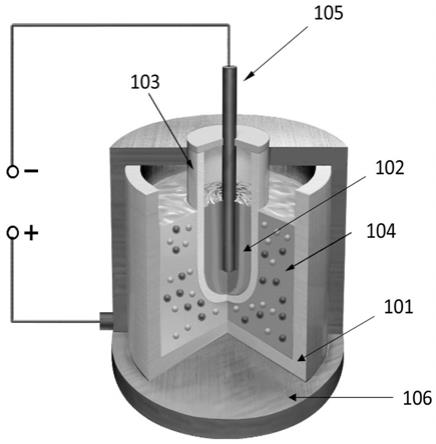
1.5
o
12
和li
6.6
la3ta
0.4
zr
1.6
o
12
。
6.固体电解质可以以任何物理形式存在,例如以圆柱体或板的形式存在,只要它将熔融组合物与阴极隔开。在一些实施例中,固体电解质的横截面厚度为0.05 cm到0.6 cm,优选为0.15 cm到0.4 cm。在一些实施例中,固体电解质有大于97%的相对密度。
7.在一些实施例中,熔融组合物中的锂盐包含licl。在一些实施例中,熔融组合物包含少于99.7%、小于97%、小于50%、小于1%或更低浓度的锂盐(例如,licl)。在一些实施例中,熔融组合物进一步包含铝盐,例如alcl3。锂与铝的摩尔比优选为20:1到1:1。
8.在一些实施例中,还提供了一种用于提纯锂的装置,包括:用于储存熔融电解质的电解质室;包含金属铝的阳极,当被包括时放置成与电解质接触;阴极室,用于存储熔融锂;固体电极,当被包括时放置成与熔融锂接触;位于电解质室和阴极室之间的固体电解质,其中固体电解质允许锂离子而不允许任何其他原子通过。
附图说明
9.本文所述附图仅用于说明目的。附图并不旨在限制本发明的范围。
10.图1说明了用于提纯锂的电解装置。
11.图2a
‑
b比较了可用于提纯锂的常规电解装置(a)和新型电解装置(b)。a.传统电解装置示意图。b.使用llzto固体电解质的新型电解装置示意图。
12.图3a
‑
d说明了本发明的电解装置及其物理/电特性。a.电解装置的示意图。不锈钢外壳用作阳极集电器,不锈钢棒用作阴极集电器。b.电解装置的数码照片。c. llzto固体电解质管的数码照片。d. llzto固体电解质在40℃至280℃的离子电导率。
13.图4a
‑
d显示了电解锂的生产。a.电解过程的电压分布。电解质由licl(1.09 g)、nacl(0.25 g)、kcl(0.32 g)、mgcl2(0.41 g)和alcl3(1.14 g)组成。锂离子的质量分数为5.5%。b.a中电解过程的效率。c.电解过程的电压分布。电解质由licl(1.27 g)、libr(0.087 g)、lii(0.134 g)、na2so4(0.142 g)和alcl3(1.33 g)组成。d.c中电解过程的效率。两种电解过程的电流密度均为5 ma cm
‑2。工作温度为240℃。
14.图5a
‑
b显示了从低锂离子浓度的熔盐中提取锂。a.电解过程的电压分布。电解质由licl(0.01g)、nacl(1.75g)、kcl(0.30g)、mgcl2(0.57g)和alcl3(4.00g)组成。电流密度为1 ma cm
‑2,工作温度为240℃。b.电解过程前和后电解质中锂离子的质量变化。
15.图6a
‑
b显示了低成本电解锂的生产。a.电解过程的电压分布。电解质由工业级licl(1.41g)和alcl3(0.57g)组成。b.a中电解过程的效率。电解过程的电流密度为5 ma cm
‑2。工作温度为240℃。
16.图7显示了llzto固体电解质的扫描电子显微镜图像。
17.图8显示了llzto固体电解质的x射线衍射图案。
18.现在详细参考本发明的某些实施例。虽然描述了本发明的某些实施例,但是应当理解,并不打算将本发明的实施例限制到所公开的实施例。相反,对本发明实施例的引用旨在涵盖可包括在由所附权利要求所定义的本发明实施例的精神和范围内的替代、修改和等效方案。
19.详细说明出于以下描述的目的,应当理解,本发明提供的实施例可以采用各种可选的变化和步骤顺序,除非明确相反指出。此外,除在实施例中或另有指示外,所有表示,例如说明书和权利要求书中所用成分的量的数字,应理解为在所有情况下均被术语“约”修饰。因此,除非明确指出相反,否则以下说明书和所附权利要求书中所述的数值参数是近似值,可根据要获得的期望特性而变化。至少,并不是试图将等效原则的应用限制在权利要求的范围内,每个数字参数至少应根据所报告的有效数字的数量通过应用普通的舍入技术来解释。
20.尽管阐述本发明的广泛范围的数值范围和参数是近似值,但是在具体实施例中阐述的数值被尽可能精确地报告。然而,任何数值都固有地包含一定的误差,这些误差必然是由在其各自的测试测量中发现的标准偏差引起的。
21.此外,应当理解,本文所述的任何数字范围意在包括其中所包含的所有子范围。例如,“1到10”的范围意在包括介于(且包括)所述约1的最小值与所述约10的最大值之间的所有子范围,即具有等于或大于约1的最小值和等于或小于约10的最大值。并且,在该应用中,“或”的使用意味着“和/或”,除非另有特别说明,即使在某些情况下可能会明确使用“和/或”。
22.锂金属的工业生产依赖于高纯度氯化锂的电解。因此,获得高纯度氯化锂的高度复杂性和成本严重限制了锂的可持续生产。在一些实施例中,本发明提供了能够以低成本从低纯度氯化锂制备高纯度锂的新装置和方法,而无需制备常规工艺所需的高纯度氯化锂。
23.在一些实施例中,新方法利用具有固态电解质的电解系统。在一些实施例中,固态电解质可传导锂离子并允许锂离子通过。然而,固态电解质不允许其他原子(特别是阳离子和其他金属原子)通过。
24.例如,一个实施例提供了一种电解方法,包括电解包含锂盐的熔融组合物,其中阳极与熔融组合物接触,阴极通过固体电解质与熔融组合物隔开。阴极可包括熔融锂,其总量将在电解过程中增加。
25.利用固体电解质的高锂离子选择性,这种方法能够直接从高纯度或低纯度的锂源中提取高纯度锂。如实验实施例所示,从具有超低浓度锂(例如0.06 wt.%)的混合盐中获得高纯度锂,表明即使来自卤水的天然盐也可以用作生产高纯度电解锂的可持续来源。
26.这里描述的新技术至少有两个显著的优点。首先,它表明可以以低成本获得高纯度锂。获得如本文所述的电解锂的成本估计仅为常规金属锂方法的20%。其次,在本技术中,可以使用比常规电解工艺更低的电解温度。更有趣的是,当将alcl3添加到熔融组合物中时,电解过程的操作温度可从400℃降低到240℃。
27.考虑到近90%的可采锂资源沉积在卤水中,从卤水中回收锂是获得锂金属最重要的方法之一。金属锂的工业生产需要电解从自然资源中提取和提纯的熔融licl
‑
kcl盐(图2a)。在此过程中,采用熔融licl作为电解锂的原料来源和离子导电电解质,因此需要高纯度licl和kcl来保证锂金属产品的纯度。否则,杂质阳离子,如na
+
、mg
2+
和al
3+
将与锂金属一起沉积在阴极上(图2a)。在此过程中,licl的纯度应高于99.3%,才能生产出高纯度的锂金属。
28.licl的提纯是非常复杂和昂贵的。特别是部分盐湖卤水mg/li比值高,给锂的回收带来困难。此外,licl
‑
kcl混合盐具有350℃以上的高熔点。因此,工作温度高于400℃。此外,阳极处还会产生氯气,腐蚀设备。然而,本技术没有这样的缺点。
29.在一些实施例中,本发明还提供适于在本发明方法中使用的装置。在一个实施例中,提供了一种用于提纯锂的装置,包括用于存储熔融电解质的电解质室;包含(或至少部分覆盖)金属铝的阳极,当被包括时放置成与电解质接触;用于存储熔融锂的阴极室;固体电极,当被包括时放置成与熔融锂接触;位于电解质室和阴极室之间的固体电解质。在一些实施例中,固体电解质允许锂离子而不允许任何其他原子通过。
30.图1提供了适合于本发明方法的电化学装置的实施例的示意图,其中填充了熔融电解质/组合物和熔融锂。所述装置包括包含锂金属或锂金属合金的阴极102,以及作为包含锂盐的熔融组合物104或电连接到所述熔融组合物的圆柱体101的阳极。管103的形式的固体电解质将阴极102和熔融组合物104分开。此外,该装置可包括与阴极102接触并与正极106电连接的阴极集电器105。熔融组合物104与也可以用作阳极集电器的圆柱体101接触。
31.固体电解质的形式可以是末端开放的圆柱体或一端封闭的圆柱体。圆柱体的一个或两个开放端可以用材料密封,这种材料能够在工作条件下(例如温度低于600℃)并且在0℃到600℃的温度循环期间以及在暴露于熔融锂、熔融锂合金和熔融锂盐时保持密封的完整性。
32.除了图1所示的配置之外,电化学设备的其他配置也是可能的。例如,在图2b中,阳极、固体电解质和/或阴极可以是将阳极和阴极隔开的平行板的形式。
33.固体电解质可以包括能够传导锂离子的材料。优选地,固体电解质不允许其他原
子或离子通过,特别是可能污染纯化锂的其他金属原子或离子。固体电解质在使用过程中保持阳极和阴极之间的分离。例如,固体电解质可包含锂离子传导氧化物、锂离子传导磷酸盐、锂离子传导硫化物或任何前述物质的组合。
34.合适的锂离子传导氧化物的实例包括石榴石型氧化物、锂超离子导体(lisicon)型氧化物、钙钛矿型氧化物和任何前述物质的组合。
35.锂离子传导氧化物可包含石榴石型氧化物,例如掺杂钽的li7la3zr2o
12
。石榴石型氧化物可包含li7‑
x
la3zr2‑
x
ta
x
o
12
,其中x可例如为0.1至1.0、0.2至0.9、0.3至0.8或0.4至0.6。
36.石榴石型氧化物可包括li
6.5
la3zr
1.5
ta
0.5
o
12
。石榴石型氧化物可包括li
6.4
la3zr
1.4
ta
0.6
o
12
(此处也称为“llzto”)。石榴石型氧化物可包括li
6.6
la3zr
1.6
ta
0.4
o
12
。石榴石型氧化物可包括li
6.5
la3zr
1.5
ta
0.5
o
12
。
37.合适的锂超离子导体(lisicon)型氧化物包括例如li
14
znge4o
16
。合适的钙钛矿型氧化物包括例如li
3x
la
2/3
‑
x
tio3和la
(1/3)
‑
x
li
3x
nbo3,其中x可为例如0.1至1.0、0.2至0.9、0.3至0.8或0.4至0.7。
38.合适的锂离子传导磷酸盐的实例包括li
1.4
al
0.4
ti
1.6
(po4)3、lizr2(po4)3、lisn2(po4)3和li
1+x
al
x
ge2‑
x
(po4),其中x例如可为0.1至1.0、0.2至0.9、0.3至0.8或0.4至0.7。
39.合适的锂离子传导硫化物的实例包括li2s
‑
sis2、li2s
‑
ges2‑
p2s5及其组合。
40.本发明提供的llzto固体电解质可具有大于96%、大于97%、大于98%或大于99%的密度。例如,llzto固体电解质可具有96%至99.9%、97%至99.9%、98%至99.9%或98%至99%的密度。
41.本发明提供的llzto固体电解质可以通过使用高压冷等静压和喷雾造粒来制备。
42.由本发明提供的llzto固体电解质具有的横截面厚度可以为例如 0.1 cm到0.6 cm、0.15 cm到0.5 cm或0.2 cm到4 cm。
43.在一些实施例中,阴极包含熔融锂。阳极中的熔融锂盐可包括可从人工或自然资源获得的任何一种或多种锂盐。在一些实施例中,锂盐包含licl。
44.如上所述,licl的纯度不必像常规技术中所要求的那样非常高。在一些实施例中,熔融组合物包含少于99.7%的锂盐。在一些实施例中,熔融组合物包含少于99.5%、99%、98%、97%、95%、90%、80%、75%、60%、50%、40%、30%、20%、10%、5%、1%、0.5%、0.1%或0.01%的锂盐。在一些实施例中,熔融组合物包含少于99.7%、99.5%、99%、98%、97%、95%、90%、80%、75%、60%、50%、40%、30%、20%、10%、5%、1%、0.5%、0.1%或0.01%的licl。
45.在一些实施例中,熔融组合物进一步包含铝盐,例如alcl3。铝盐可以天然存在于锂盐中,或者可以在电解之前或期间添加。在一些实施例中,在熔融组合物中,锂与铝的摩尔比为20:1至1:1。在一些实施例中,熔融组合物中锂与铝的摩尔比为20:1至2:1、20:1至3:1、20:1至4:1、20:1至5:1、20:1至6:1、20:1至7:1、20:1至8:1、19:1至2:1、19:1至3:1、19:1至4:1、19:1至5:1、19:1至6:1、19:1至7:1、19:1至8:1、18:1至2:1、18:1至3:1、18:1至4:1、18:1至5:1、18:1至6:1、18:1至7:1、18:1至8:1、17:1至2:1、17:1至3:1、17:1至4:1、17:1至5:1、17:1至6:1、17:1至7:1、17:1至8:1、16:1至2:1、16:1至3:1、16:1至4:1、16:1至5:1、16:1至6:1、16:1至7:1、16:1至8:1、15:1至2:1、15:1至3:1、15:1至4:1、15:1至5:1、15:1至6:1、15:1至7:1、15:1至8:1、14:1至2:1、14:1至3:1、14:1至4:1、14:1至5:1、14:1至6:1、14:1至
7:1、14:1至8:1、13:1至2:1、13:1至3:1、13:1至4:1、13:1至5:1、13:1至6:1、13:1至7:1、13:1至8:1、12:1至2:1、12:1至3:1、12:1至4:1、12:1至5:1、12:1至6:1、12:1至7:1、12:1至8:1、11:1至2:1、11:1至3:1、11:1至4:1、11:1至5:1、11:1至6:1、11:1至7:1、11:1至8:1、10:1至2:1、10:1至3:1、10:1至4:1、10:1至5:1、10:1至6:1、10:1至7:1、10至8:1、9:1至2:1、9:1至3:1、9:1至4:1、9:1至5:1、9:1至6:1、9:1至7:1、9:1至8:1、8:1至2:1、8:1至3:1、8:1至4:1、8:1至5:1、8:1至6:1、或8:1至7:1。
46.阴极集电器可以包括任何合适的材料,例如不锈钢、铜、铜合金、碳、石墨或上述任何材料的组合。阴极集电器在暴露于熔融锂和/或熔融锂合金时可以是惰性的。
47.阳极集电器可以包括任何合适的材料,例如不锈钢、铜、铜合金、碳、石墨或上述任何材料的组合。在一些实施例中,阳极集电器包括金属铝,其可存在于与含有锂盐的熔融组合物直接接触的表面上。
48.在操作条件下,这些方法中使用的电化学装置可以加热到熔融温度以上,以便在操作期间将锂或锂盐熔融。例如,在操作条件下,电池的温度可以低于600℃、低于500℃、低于400℃、低于300℃或低于250℃,并且高于锂和/或锂盐的熔点。
49.在使用过程中,可以使用密封剂来保持阳极/阴极材料。密封剂可以是膏状或垫圈的形式。期待垫圈材料在电化学电池的使用条件下不会降解并保持可行的密封。在200℃至600℃或200℃至300℃的温度范围内长期暴露于阳极和阴极材料后,合适的垫圈材料不会显著降解。合适的垫圈材料包括弹性体,例如硅酮、全氟醚、聚四氟乙烯和聚环氧化合物。
50.在一些实施例中,电化学设备还连接到或配备有用于向设备提供热量的加热元件。
实施例
51.实施例1使用固体电解质从低纯度来源一步电解生产高纯度锂本实施例描述了一种使用固态电解质(例如石榴石型li
6.4
la3ta
0.6
zr
1.4
o
12
(llzto))作为两个熔融电极之间的隔离层,从低成本和低纯度licl制备高纯度电解锂的新方法。利用固体电解质的高锂离子选择性,本实施例通过电解低纯度licl(~95 wt.%)直接获得高纯度金属锂(锂含量>99.7 wt.%)。该实例进一步证明了从低浓度锂(0.06 wt.%)的混合盐中提取锂,表明来自卤水的天然盐可以用作生产电解锂的可持续来源。
52.从licl中提取金属锂的新方法提供了至少两个显著的优点。首先,它表明可以以低成本获得高纯度锂。电解锂的成本估计仅为现有金属锂方法的20%。其次,在新方法中,可以使用比常规工艺更低的电解温度。更有趣的是,当添加alcl3时,电解过程的操作温度可从400℃降低到240℃。
53.方法石榴石型llzto电解质的工艺。将li2co3(sinopharm chemical reagent co., ltd,99.99%)、la2o3(sinopharm chemical reagent co., ltd,99.99%)、zro2(aladdin,99.99%)和ta2o5(ourchem,99.99%)以li
6.5
la3zr
0.5
ta
1.5
o
12
的摩尔比充分混合(添加20%过量的la2o3),然后在900℃加热6小时。将所得粉末充分球磨12小时,然后在220 mpa冷等静压下压入u型管中90秒。然后,将覆盖有相同母粉的管在空气中在1140℃退火16小时。所有热处
理均在氧化铝坩埚(>99% al2o3)中进行,坩埚上覆盖有矾土盖。
54.电解装置的构造。首先将金属锂(0.1g)放入llzto管中,然后移入箱式炉(mti)中在300℃下1小时使其熔化。然后将混合盐放入不锈钢
‑
铝壳中,移入箱式炉(mti)在150℃下60分钟,使其熔化为液态。将上述装有液态锂的llzto管置于240℃的熔盐中。将直径为1 mm的不锈钢棒插入液态锂中作为阴极集电器。整个装配过程在氩气手套箱中进行。
55.电化学测量。电解过程的电化学测试在温度为240℃的箱式炉(mti)中进行。所有设备都被装入电解测试(land 2001 ct电池测试仪)中,并在1 ma/cm2至10 ma/cm2的电流密度下充电。
56.表征。用阿基米德法测量llzto管的相对密度。用merlin compact zeiss扫描电子显微镜通过扫描电子显微镜研究所有样品的微观结构。使用配备有cuk
α
辐射源的d/max
‑
2500衍射仪(日本rigaku)评估制造材料的x射线衍射(xrd)图。采用宽带介电谱仪(novocool)进行阻抗谱测量(频率范围:10 mhz
ꢀ‑ꢀ
40 hz;交流电压:10mv;温度:40
‑
280℃)。用icp
‑
ms测量法(elan
‑
drc
‑
e)测定了电解锂和商业锂的纯度。
57.结果与分析本实施例展示了一种基于锂离子固体电解质生产电解锂的新方法。以li
6.4
la3ta
0.6
zr
1.4
o
12
(llzto)陶瓷为固体电解质和隔层,低纯度熔融licl
‑
alcl3盐为电解原料,得到高纯度的电解金属锂(图2b)。
58.结果表明,工业级氯化锂(~95 wt.%)可作为生产高纯电解锂(>99.7 wt.%)的原料。工业级licl的成本远低于高纯licl。因此,用本方法生产的金属锂的成本估计仅为国际金属锂价格的20%。从低浓度licl(<0.4 wt.%)的混合盐中提取锂也得到证实。锂离子的浓度(0.06 wt.%)与从盐水中获得的天然盐的浓度相同。在该超低浓度下,80%以上的锂离子被还原为金属锂,说明该方法可以直接从卤水中的天然盐中提取锂。
59.电解装置的示意图如图3a所示,其数码照片如图3b所示。作为电解装置的重要组成部分,llzto陶瓷管(图3c、7和8)在240℃时表现出38 ms cm
‑2的高电导率,比室温时高出约100倍(图3d)。固体电解质的离子导电性在电解系统中不是问题。llzto陶瓷管还具有~99%的的相对密度,防止了液体电极的泄漏。由于阴极(熔融锂)和电解质(熔融盐)都是液体,固体电解质和阴极或电解质之间的界面是液
‑
固界面。因此,在电解过程中,界面保持良好的接触。以上事实表明,llzto管可以作为电解装置的电解质和隔层。
60.llzto固体电解质的高选择性为了证明llzto陶瓷管的高选择性,采用licl、nacl、kcl、mgcl2和alcl3组成的混合盐作为电解质。钠离子和钾离子是licl原料中常见的杂质。常规方法中,以卤水为原料提取licl时,镁离子与锂离子难以分离。在本发明的方法中,添加了alcl3以降低混合盐的熔点。金属铝也用作阳极,因此电解反应方程式可表示为:al + 3li
+ + 4cl
‑
ꢀ→ꢀ
3li + [alcl4]
‑
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1)只有锂离子能穿透固体电解质(图2b),其他阳离子不能参与电解反应。用少量商业锂连接llzto陶瓷管和集电器。电解过程的电压分布如图4a所示。初期电解电压约为~1.85v,并保持稳定,直到容量达到500 mah时。截止电压为2v,最终容量为583.5 mah。为了防止熔盐对不锈钢外壳的腐蚀,将截止电压设置为2v。如果583.5 mah的容量100%是由于锂金属沉积造成的,则这将转化为0.151g锂金属。在实践中,获得了0.145 g金属锂,锂金属库
仑效率为96.0%(图4b)。这种差异可能是由于称重误差和少量的副反应造成的。最后阶段的电解电压升高是由于电解质中锂离子浓度下降引起的。根据混合盐(1.09 g)中licl的初始质量,本实施例提取了约82%的锂。
[0061]
为了测试得到的电解锂的纯度,进行了电感耦合等离子体质谱(icp
‑
ms)测量。采用相同的方法测定了纯度为99.7%的商业金属锂作为比较。如表1所示,商业锂和电解锂的纯度几乎相同。电解锂中杂质(钠、钾、镁、铝)的浓度非常低,与商业锂的浓度相近。镧、钽和锆元素的浓度极低(<0.01ppm),表明llzto固体电解质对熔融锂具有很高的化学稳定性。值得注意的是,得到的电解锂纯度约为99.7%。考虑到熔盐中锂离子的初始质量分数(5.5%),电解后锂离子浓度提高了17倍以上。获得的高纯度的锂离子电池证实了llzto固体电解质的高选择性和高质量。
[0062]
表1.电解锂、商业锂和超纯水的icp
‑
ms测量结果
[0063]
其他阴离子,包括br
‑
、i
‑
和so
42
‑
也被添加到电解液中,并测试阴离子对电解过程的影响。电解过程的电压分布如图4c所示。电解电压稳定在1.75v。当容量达到430 mah时,电解过程停止。如果100%的容量是由于锂金属沉积造成的,则混合盐中近50%的锂离子将被还原,得到0.112g锂。在实践中,获得了0.107 g金属锂,这为锂金属沉积提供了95.5%的库仑效率(图4d)。根据icp
‑
ms测量结果(表2),阴离子对所得锂纯度的影响可忽略不计。氯元素主要来源于icp
‑
ms测定所用的超纯水。
[0064]
表2.电解锂、商业锂和超纯水的icp
‑
ms测量结果
[0065]
从低浓度锂离子原料中提取锂从含低浓度锂离子的卤水中提取锂是一项具有挑战性的工作。为了测试固体电解质的提取能力,本实施例根据盐湖卤水的阳离子比例制备混合盐。锂离子的初始浓度仅为0.06wt%,是中国几个盐湖的平均水平。如图5a所示,最终容量为7.77 mah,略高于理论值(6.28 mah)。这种差异主要是由副反应引起的。电解后,将残余盐溶解在100 ml超纯水中,用于icp
‑
ms测量。溶液中残留有2.58 ppm的锂元素,表明84.2%的锂离子被提取形成金属锂(图5b)。所得锂金属的纯度与市售高纯度锂金属的纯度相同(表3)。经过电解处理后,锂元素的浓度提高了1500倍以上。这一结果证明了我们的固体电解质法可以直接从天然盐中提
取锂。
[0066]
表3.从低锂离子浓度混合盐中获得的电解锂的icp
‑
ms测量结果
[0067]
低成本生产电解锂通过使用锂基固体电解质作为锂离子选择性层,可以用含有大量钠离子、镁离子、钾离子和铝离子的低纯licl作为原料生产高纯金属锂。由于低纯度licl价格相对较低,使用它作为原料有可能大大降低电解锂的生产成本。为了说明这种方法的潜力,使用工业级licl(~95 wt.%)和alcl3(摩尔比8:1)作为电解质来生产电解锂。电解电压分布如图6a所示。电解电压稳定在~1.7v。为避免产生al2cl6气体,当电解液中licl与alcl3的摩尔比降至1:1时,停止电解过程。原则上65.6%的锂离子将被还原为金属锂,得到0.156g金属锂。在实践中,获得了0.148g金属锂,为理论值的94.8%(图6b)。测定了金属锂生产中常见杂质的浓度,结果如表4所示。电解锂和商业锂的杂质浓度没有明显差异。最令人兴奋的结果是,电解锂金属中的镁杂质含量非常低。由于镁与锂离子半径相近,传统的分离方法很难将镁从锂中分离出来。然而在这种情况下,由于其二价电荷,mg
2+
离子在锂固体电解质中扩散非常缓慢。考虑到超纯水中的杂质,得到的电解锂纯度约为99.7%。
[0068]
表4.电解锂、商业锂和超纯水的icp
‑
ms测量结果
[0069]
本实施例验证了一种利用固体电解质生产电解锂的新方法。由于固体电解质的高选择性,可以使用含有大量其他金属阳离子的低纯度licl作为原料生产高纯度金属锂。与传统电解法生产高纯锂使用的高纯licl相比,低纯度工业级licl的价格要低得多。该方法大大降低了电解锂的成本。此外,在电解液中添加alcl3有效地降低了电解装置的工作温度,避免了腐蚀性cl2的产生。最值得注意的是,锂离子固体电解质的高选择性对那些具有挑战性的杂质(如镁离子)具有突出的分离效果。因此,高镁/锂比的盐湖卤水可以作为低成
本的锂回收源,进一步降低电解锂的成本。本实施例实现了从超低浓度锂离子的混合盐中提取锂,使从天然盐中回收锂成为可能。
[0070]
最后,应当注意,存在实现本发明公开的实施例的替代方法。因此,本实施例被认为是说明性的而不是限制性的。此外,权利要求不限于本发明给出的细节,并且有权获得其全部范围和等效范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1