一种以过渡金属氧化物纳米颗粒为催化剂的流态式电催化体系及其构筑方法和应用
本发明属于电催化技术领域,具体涉及一种以过渡金属氧化物纳米颗粒为催化剂的流态式电催化体系及其构筑方法和应用。
背景技术:
常温常压氮还原合成氨一直以来是一个具有吸引力却又极具挑战性的课题。目前,工业合成氨依然依赖于超过百年历史的哈珀-波施(haber-bosch)法。但是,这一过程需要消耗大量的天然气和能源,同时释放大量co2温室气体,不利于环境和能源的可持续发展。近年来,常温常压电化学氮还原反应(nrr)合成氨因为操作条件温和、水作氢源、无co2排放等优点而受到越来越多的关注。然而,由于n2分子极其稳定和析氢反应(her)的激烈竞争,目前电催化氮还原技术仍面临着氨产率和电流效率很低的问题,离实际应用还很遥远。因此,迫切需要开发高效的nrr电催化剂和电催化体系,以推进工业合成氨发展。小尺寸的过渡金属氧化物纳米颗粒催化剂因可以暴露更多的反应活性位点(面、边、角等),近年来在电催化nrr领域展现出不错的前景。然而,目前所报道出的nrr性能还十分有限。这可能是因为这些氧化物纳米颗粒作为电催化剂时,通常需要通过粘黏剂负载到导电基体上作为工作电极使用。这种电极负载方式一方面限制了催化剂的负载量,导致暴露的活性位点受限;另一方面在反应过程中还可能会引发纳米颗粒的失活、脱落和团聚,导致活性位点进一步减少。基于这些限制因素的考虑,构筑一种可以更高效地利用催化剂的反应活性位点,无需受电极负载面积限制的新型的电催化体系具有重要意义。
技术实现要素:
针对现有技术的不足,本发明的目的是提供一种以过渡金属氧化物纳米颗粒为催化剂的流态式电催化体系,该体系能够避免传统电极负载催化体系的上述不足之处,更高效地发挥纳米颗粒催化剂的催化性能。
本发明的另一个目的是提供上述以过渡金属氧化物纳米颗粒为催化剂的流态式电催化体系的构筑方法,包括以下步骤:
采用液相激光熔蚀法制备得到的小尺寸的过渡金属氧化物纳米颗粒,具体方法为:利用激光熔蚀放置在水中的过渡金属靶材,得到小尺寸的过渡金属氧化物纳米颗粒胶体;优选的,所述过渡金属靶材为co、mo、ti、zn或ni,对应的,制得的过渡金属氧化物纳米颗粒为co3o4、moo3、tio2、zno或nio;所述激光为非聚焦激光,激光参数为:波长为532nm、脉宽6ns、能量300mj;
将过渡金属氧化物纳米颗粒胶体与电解液混合后得到阴极池电解液;
在设有阴极池和阳极池的电解反应装置中,向阴极池中加入阴极池电解液,阴极池中安装有阴极工作电极和参比电极;所述阳极池中安装有对电极,向阳极池中加入电解液,即得到以过渡金属氧化物纳米颗粒为催化剂的流态式电催化体系。优选的,所述阴极工作电极为钛网、碳布、碳纸或玻碳电极等;所述电解液为na2so4溶液、koh、naoh、hcl、h2so4等中的一种;所述对电极和参比电极分别使用商业碳布和ag/agcl参比电极。
作为优选的技术方案,所述电解反应装置放置在磁力搅拌器上,所述阴极池中放置有搅拌子。通过搅拌子对阴极池进行搅拌,加速过渡金属氧化物纳米颗粒在电解液中的随机运动过程,使其充分反应。
本发明的第三个目的是提供上述所述的以过渡金属氧化物纳米颗粒为催化剂的流态式电催化体系在电催化合成氨中的应用,包括以下步骤:首先向电解反应装置中通入惰性气体以排除电解液和体系中含有的空气,然后继续通入氮气进行电催化反应即能够制备得到氨气。过渡金属氧化物的催化原理示意图如图1所示。首先氧化物纳米颗粒会在溶液中预吸附n2分子,伴随着磁子的搅拌,吸附着n2的氧化物纳米颗粒随机运动,与阴极工作电极(比如钛网)发生碰撞,接受h+/e-电子对的进攻,发生电子转移生成nh3分子,最后吸附着nh3分子的氧化物在溶液中发生nh3的脱附,重新变成氧化物纳米颗粒,参与下一轮催化反应。
与现有技术相比,本发明具有以下有益效果:
(1)本发明采用液相激光熔蚀法制备得到的小尺寸的过渡金属氧化物纳米颗粒,操作方法可控且成本低廉、工艺简单;制备得到的过渡金属氧化物纳米颗粒表面干净,无需配体;激光快速淬冷和独特的光热效应特点赋予所制备的纳米颗粒尺寸小,且具有高活性、高反应性等特点,作为催化剂使用,可以为电化学反应提供大量的活性位;该方法对于制备小尺寸的过渡金属氧化物纳米颗粒具有普适性,可以根据使用不同的过渡金属靶材制备得到相应的氧化物纳米颗粒。
(2)相比于通过粘黏剂将催化剂负载到导电基体上制备成催化剂电极的传统负载方式,本发明中构筑了一种流态式电催化体系,可以更高效地利用氧化物纳米颗粒催化剂的反应活性位,不受导电基底有限的负载面积的限制;催化剂高度分散在电解液中,避免了在基底中脱落、失活、团聚等现象导致的活性位点减少;催化剂对反应物的吸附和产物的脱附可以发生在溶液相中,避免了电场存在的干扰,加快了反应动力学。
(3)本发明中的流态式电催化体系具有普适性,适用于在溶液中可以高度分散的小尺寸纳米颗粒催化剂,且适用于多种电化学合成反应。相比于传统负载方式,流态式的催化剂的电化学性能得到了极大地提升。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他附图。
图1为本发明提供的流态式电催化体系中过渡金属氧化物纳米颗粒催化原理示意图;
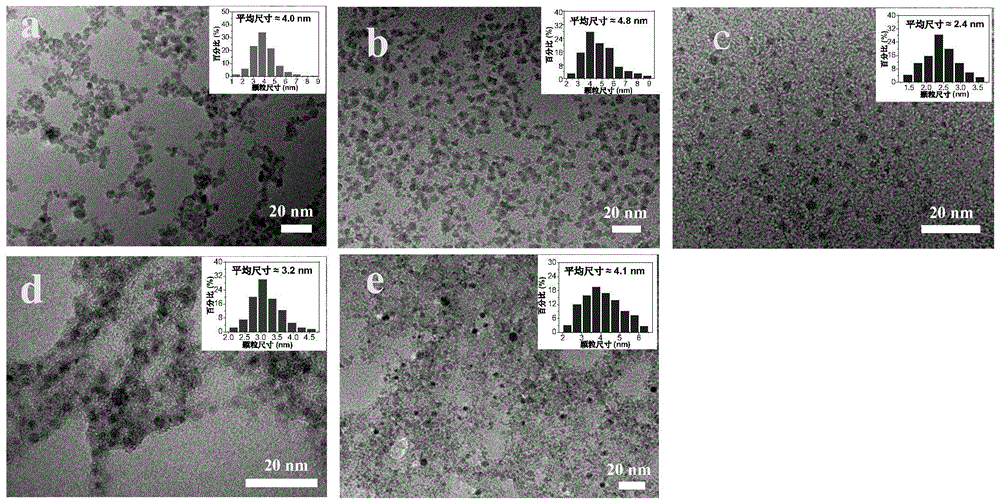
图2分别为本发明实施例所制备的过渡金属氧化物纳米颗粒co3o4、moo3、tio2、zno和nio的透射电镜照片;
图3分别为本发明实施例所制备的过渡金属氧化物纳米颗粒co3o4、moo3、tio2、zno和nio的xrd图谱;
图4为本发明实施例所制备的过渡金属氧化物纳米颗粒co3o4、moo3、tio2、zno和nio的电子顺磁共振图谱;
图5为本发明构筑的流态式电催化体系用于电化学合成氨的反应装置示意图;
图6为本发明实施例中制备的co3o4纳米颗粒电催化剂在流态式电催化体系下,分别在氩气和氮气饱和的0.1mna2so4电解液中的极化曲线图;
图7为本发明实施例中制备的co3o4纳米颗粒电催化剂在流态式电催化体系下不同外加电位对应的电化学nrr的氨产率和法拉第效率图;
图8为本发明实施例中制备的co3o4纳米颗粒电催化剂在传统电极负载体系(co3o4/cc)下不同外加电位对应的电化学nrr的氨产率和法拉第效率图;
图9为本发明实施例中制备的co3o4纳米颗粒电催化剂在流态式电催化体系和传统电极负载体系下不同外加电位对应的电化学nrr的氨产率对比图;
图10为本发明实施例中制备的过渡金属氧化物co3o4、moo3、tio2、zno和nio电催化剂分别在流态式电催化体系下,在氩气和氮气饱和的0.1mna2so4电解液中的极化曲线图;
图11为本发明实施例中制备的过渡金属氧化物co3o4、moo3、tio2、zno和nio电催化剂在流态式电催化体系下电化学nrr的最优氨产率和法拉第效率对比图。
附图标记:1-质子交换膜,2-阴极池,3-阳极池,4-进气口,5-出气口,6-阴极工作电极,7-参比电极,8-对电极,9-搅拌子,10-过渡金属氧化物纳米颗粒。
具体实施方式
为了便于理解本发明,下面将结合具体的实施例对本发明进行更全面的描述。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明的公开内容理解的更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。
以过渡金属氧化物纳米颗粒为催化剂的流态式电催化体系的构筑方法,包括以下步骤:
将打磨清洗后的过渡金属靶材放置于盛有20ml去离子水的聚四氟乙烯器皿中,再置于转速为10rmp的旋转台上,利用波长532nm、脉宽6ns、能量300mj的非聚焦激光对靶材熔蚀5分钟,得到过渡金属氧化物纳米颗粒胶体。具体的,当过渡金属靶材分别为co、mo、ti、zn、ni时,对应的制得的过渡金属氧化物纳米颗粒分别为co3o4、moo3、tio2、zno、nio;
以上述制得的过渡金属氧化物纳米颗粒胶体为电催化剂,构筑了一种流态式电催化体系,包括以下步骤:
选用ph值为10.5的0.1mna2so4溶液为电解液,将过渡金属氧化物纳米颗粒胶体与电解液混合后得到阴极池电解液;
参考图5,电解反应装置选用h-型电化学反应池,其包括通过质子交换膜1(nafion117膜)隔开的阴极池2和阳极池3;阴极池3具有进气口4,阳极池3具有出气口5;阴极池2中设有阴极工作电极6和参比电极7,阳极池3中设有对电极8;阴极工作电极6采用100目、4×4cm的钛网集流体,向阴极池中加入阴极池电解液,向阳极池中加入na2so4电解液,即得到以过渡金属氧化物纳米颗粒为催化剂的流态式电催化体系。其中,对电极和参比电极分别使用商业碳布和ag/agcl参比电极。为使催化剂充分参与反应,将电解反应装置放置在磁力搅拌器上,并向阴极池中放置搅拌子9。通过搅拌子对阴极池进行搅拌,加速过渡金属氧化物纳米颗粒10在电解液中的随机运动过程,使其充分反应。
结果分析
下面结合具体的结果分析包括氧化物的形貌、结构和采用流态式电催化体系的合成氨效果对本发明的技术方案进行更加清楚完整的说明。实验结果如下:
(1)采用透射电子显微镜对本发明实施例所制备的过渡金属氧化物co3o4、moo3、tio2、zno和nio进行观察拍摄,从而得到如图2a-e所示的透射电镜图片,插图为相应的尺寸分布。由图2a-e可以看出,本发明实施例所制备的过渡金属氧化物co3o4、zno、moo、tio2、nio均呈现出纳米颗粒形貌,尺寸分别为4.0nm、4.8nm、2.4nm、3.2nm及4.1nm。
(2)采用x射线衍射仪对本发明实施例所制备的过渡金属氧化物进行结构分析,从而得到如附图3所示的x射线衍射图谱。由附图3a-e可以看出,本发明实施例所制备的过渡金属氧化物分别属于立方晶系co3o4(jcpdsno.43-1003)、六方晶系zno(jcpdsno.36-1451)、六方晶系moo3(jcpdsno.05-0508)、四方晶系tio2(jcpdsno.21-1272)和立方晶系nio(jcpdsno.47-1049)
(3)采用电子顺磁共振波谱仪在室温下对本发明实施例所制备的过渡金属氧化物进行表面氧空位分析,从而得到如附图4所示的电子顺磁共振光谱。由附图4可以看出,五种氧化物均表现出不同强度的在g=2.007位置处的特征峰,表明本发明实施例用激光熔蚀所制备的过渡金属氧化物表面都含有不同程度的氧空位,其中moo3的氧空位含量最高。
(4)本发明实施例所构筑的流态式电催化体系用于电化学nrr采用h-型电化学反应池,如附图5所示,以co3o4纳米颗粒作为电催化剂为例,0.1mg的co3o4纳米颗粒均匀地分散在0.1mna2so4中得到阴极电解液(40ml),将其置于阴极池中,通过搅拌子不断搅拌阴极电解液。0.1mna2so4(40ml)置于阳极池中。氮气(经纯化装置纯化去除nox和nh3污染源)以100~150ml·min-1的气体流速从进气口4通入整个反应装置中持续20min,电解液和反应装置中的空气从出气口5排出,然后将气体流速调节为25ml·min-1进行电化学nrr实验。线性扫描伏安法(lsv)在扫描速度为5.0mv·s-1时进行测试。
所有工作电极施加的测试电位(vs.ag/agcl)转化为标准氢电势电位(vs.rhe):e(rhe)=e(ag/agcl)+0.059ph+0.197。从阴极池和阳极池导出反应电解液用靛酚蓝分光光度法和核磁共振氢谱对产物氨进行检测,计算产物氨产率利用公式:rnh3(μgh-1mgcat.-1)=(χ(nh3)×v)/t×m;计算产物氨的法拉第效率利用公式:fe(%)=(3×n(nh3)×f)/q×100%,式中,χ(nh3)为电解液中nh3的浓度,单位为μgml-1;v为电解液体积,单位为ml;t为电化学nrr反应时间,单位为h;m为电催化剂的质量,单位为mg;n(nh3)为对应的氨摩尔量;f为法拉第常数(96485);q为测试过程中的电子转移数量。
图6为本发明制得的co3o4纳米颗粒电催化剂以流态方式分散在电解液,钛网集流体在氩气和氮气饱和na2so4电极液中的极化曲线图。从图中可以看出,电解液中不加入本发明制得的co3o4纳米颗粒电催化剂,钛网集流体本身几乎没有氮气电化学还原活性,而电解液中加入本发明制得的co3o4纳米颗粒电催化剂,该催化剂表现出优异的氮气电化学还原活性。
图7为采用流态式电催化体系本发明制得的co3o4纳米颗粒电催化剂应用于氮气电化学还原反应时不同外加电位对应的氨产率和法拉第效率。由图可知,在-0.20v(vs.rhe)电位下,氨产率达到235.0μgh-1mgcat.-1,法拉第效率达到16.3%,表明流态式co3o4纳米颗粒电催化剂具有优异的nrr活性。
为了证明本发明构筑的流态式电催化体系的优势,将本发明制得的含有0.1mg的co3o4纳米颗粒胶体中加入5wt%的nafion溶液,随后进行水浴超声处理,直到形成均匀的悬浮液,涂覆在商业碳布(1cm×1cm)上,在60℃下干燥2h,制备成co3o4/cc电极,用于电极负载体系电化学nrr反应。附图8为采用电极负载式电催化体系本发明制得的co3o4/cc催化剂电极应用于氮气电化学还原反应时不同外加电位对应的氨产率和法拉第效率。由图可知,在-0.30v(vs.rhe)电位下,氨产率达到49.6μgh-1mgcat.-1,法拉第效率达到5.2%。表明电极负载方式下co3o4纳米颗粒电催化剂也表现出一定的nrr活性。附图9为两种体系下本发明制得的co3o4纳米颗粒电催化剂在不同外加电位对应的氨产率对比。由图9可知,流态式体系下co3o4纳米颗粒电催化剂的氨产率大大提高,证明了流态方式的巨大优势。
(5)为了证明本发明实施例所构筑的流态式电催化体系对于小尺寸纳米颗粒催化剂具有普适性,以钛网为集流体,本发明实施例所制备的过渡金属氧化物co3o4、moo3、tio2、zno和nio作为电催化剂均以流态方式测试其电化学nrr性能。附图10为本发明制得的co3o4、moo3、tio2、zno及nio纳米颗粒电催化剂分别以流态方式分散在电解液,钛网集流体在氩气和氮气饱和na2so4电极液中的极化曲线图。从图中可以看出,电解液中不加入本发明制得的过渡金属氧化物纳米颗粒电催化剂,钛网集流体本身没有氮气电化学还原活性,而电解液中分别加入本发明制得的co3o4、moo3、tio2、zno和nio纳米颗粒电催化剂,氮气饱和电解液下的阴极电流都增大。说明流态方式下的这些氧化物纳米颗粒催化剂都表现出一定的氮气电化学还原活性。其中moo3纳米颗粒测得的电流增大的最多,而zno测得的电流增加的最小,这和氧化物自身的电催化nrr活性有关。附图11为co3o4、moo3、tio2、zno和nio这5种氧化物的最优氨产率和法拉第效率对比图。由图可知,5种氧化物表现出来的nrr性能并不相同,其中moo3纳米颗粒性能最好,而zno纳米颗粒性能最差。这不仅表明了流态方式对小尺寸纳米颗粒具有普适性,且证明了电化学性能好坏与纳米颗粒自身的活性有关。
综上可见,本发明实施例的过渡金属氧化物纳米颗粒不仅制备方法简单,而且所构筑的流态式电催化体系能够更充分的利用所制备的氧化物纳米颗粒所暴露的活性位,极大地提高了其电化学nrr活性。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!