一种N-羟基邻苯二甲酰亚胺催化电解合成芴酮的方法
一种n
‑
羟基邻苯二甲酰亚胺催化电解合成芴酮的方法
技术领域
1.本发明涉及一种利用n
‑
羟基邻苯二甲酰亚胺作为电催化剂,电解苯甲酰肼产生芴酮的新方法,该策略尚未见文献报道。和以往的芴酮合成方法相比,本发明所保护的合成方法以电子作为清洁的氧化剂,无需昂贵的过渡金属催化剂或者光催化剂,无需有毒有害的化学氧化剂的参与,反应的副产物为无毒害的氮气,因此该方法具有绿色、环保的显著优势。
背景技术:
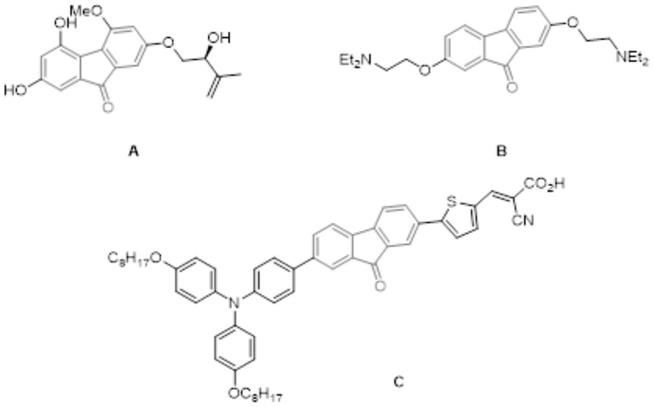
2.芴酮类化合物广泛存在于天然产物和药物分子中,近些年以芴酮为核心结构的药物分子不断被开发出来。比如化合物a具有很好的抗hiv病毒的活性;化合物b为替洛隆(tilorone),在临床上是一种广谱的抗病毒药物,对多种动物肿瘤有明显的抑制作用,同时它也是一个低分子的干扰素诱导剂。此外,芴酮类化合物还广泛应用于发光材料中。比如化合物c作为一类重要的发光染料,广泛被应用于太阳能电池中。
[0003][0004]
鉴于芴酮类化合物的重要用途,其高效合成是有机合成化学和药物化学的研究热点之一。目前,合成芴酮常用的策略有三种:1)以昂贵的过渡金属作为催化剂,通过偶联反应合成芴酮;2)以有毒有害的过氧化物或者(nh4)2s2o8作为强氧化剂,通过酰基自由基途径合成芴酮;3)以昂贵的染料或者ir复合物作为催化剂,在光照下通过自由基历程合成芴酮。虽然上述方法为芴酮的合成提供了便捷的途径,但是昂贵的过渡金属催化剂或者光催化剂的使用,让上述方法不适用于大规模合成。此外,有毒有害的化学氧化剂的使用对生产设备和操作技术提出了更高的要求。
[0005]
由于电解反应直接使用电子作为清洁的氧化还原试剂,可以避免昂贵的过渡金属催化剂的使用,避免有毒有害的化学氧化剂的使用,因此电解合成被认为是一类绿色的合成手段。借助于电解反应,我们开发了一类电解合成芴酮的新方法。该方法以n
‑
羟基邻苯二甲酰亚胺作为电催化剂,通过电解苯甲酰肼产生苯甲酰基自由基,然后经由自由基环化过程高效合成芴酮。和以往的芴酮合成方法相比,本发明所保护的合成方法以电子作为清洁
的氧化剂,无需昂贵的过渡金属催化剂或者光催化剂,无需有毒有害的化学氧化剂的参与,且该反应的副产物为无毒害的氮气,因此该方法具有绿色、环保的显著优势。截止到目前,该方法尚未见文献报道,具有很高的创新性。
技术实现要素:
[0006]
本发明是提供一种n
‑
羟基邻苯二甲酰亚胺作为催化剂,2,4,6
‑
三甲基吡啶作为碱性添加剂,邻苯基苯甲酰肼作为酰基自由基的前体,通过电解反应一步法合成芴酮的新方法。本发明操作简单,反应条件温和,以清洁的电子代替化学氧化剂,具有经济绿色的显著优势。
[0007]
本发明的实验步骤如下:
[0008]
在单室电解槽内部分别加入邻苯基苯甲酰肼类化合物(ii),在n
‑
羟基邻苯二甲酰亚胺类物质催化剂、支持电解质、2,4,5
‑
三甲基吡啶碱性添加剂和溶剂存在的条件下,恒电压下反应1
‑
4个小时即得到如结构式i所示的芴酮类化合物;
[0009][0010]
其中,r1代表
‑
h、卤素、烷基;r2代表
‑
h、卤素、烷基。
[0011]
上述方法中,恒压为3v的恒电压;反应要在溶剂存在时进行;
[0012]
所述的n
‑
羟基邻苯二甲酰亚胺催化剂选自n羟基
‑3‑
氯邻苯二甲酰亚胺,n羟基
‑4‑
氯邻苯二甲酰亚胺,ddq,tempo中的任意一种;
[0013]
催化剂的用量优选为邻苯基苯甲酰肼:n
‑
羟基邻苯二甲酰亚胺的摩尔比1:0.1
‑
1:1;
[0014]
所述的支持电解质选自高氯酸锂、四丁基氯化铵、高氯酸铵、四丁基六氟磷酸铵中的任意一种;
[0015]
支持电解质的用量优选为邻苯基苯甲酰肼:支持电解质的摩尔比 1:1
‑
1:4;
[0016]
所述的碱性添加剂优选为亚硫酸氢钠、2,6
‑
二甲基吡啶,碳酸氢钠,特戊酸钠、2,4,6
‑
三甲基吡啶中的一种;
[0017]
碱性添加剂的用量优选为邻苯基苯甲酰肼:碱性添加剂的摩尔比 1:0.05
‑
1:0.3;
[0018]
所述的溶剂为乙腈、甲醇、四氢呋喃、二甲亚砜中任意选取一种,优选为乙腈;
[0019]
所述的电极阳极为石墨毡电极、铂网电极、铂片电极,石墨片电极、碳棒电极、优选为石墨毡电极;
[0020]
所述的电极阴极为石墨毡电极、铂网电极、铂片电极,石墨片电极、碳棒电极、优选为铂网电极;
[0021]
所述的温度为20℃
‑
60℃,优选为50℃;
[0022]
优选邻苯基苯甲酰肼下电解液中的浓度为0.01
‑
1mol/l。
[0023]
本发明中,所述电化学氧化反应的后处理采用本领域公知的常用方法。
[0024]
本发明具有以下优点:
[0025]
1)本发明方法利用电解作为绿色合成手段,首次实现了苯甲酰肼到苯甲酰基自由基的转变,然后利用酰基自由基的分子内环化反应高效合成芴酮。该方法目前尚未见文献报道,具有很高的创新性。
[0026]
2)本发明方法使用清洁的电子作为氧化剂,代替有毒有害的化学氧化剂,反应副产物为无毒害的氮气,因此本发明方法的“三废”排放低,是清洁生产的典型案例,符合国家对绿色化学的发展要求。
[0027]
3)本发明方法所使用的工作电极是廉价的石墨电极,和以往使用昂贵的过渡金属催化剂合成方法相比,该方法能够明显地降低生产成本。
具体实施方式
[0028]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0029]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0030]
下面结合实施例对本发明作进一步说明,但本发明并不限于以下实施例。
[0031]
实施例1:芴酮的电化学合成
[0032]
在单室电解池中分别加入原料邻苯基苯甲酰肼(0.3mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和2,4,6
‑
collidine (0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v 进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50 ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:61%。
[0033][0034]1h nmr(400mhz,cdcl3):δ7.64(dt,j=7.3,1.0hz,1h),7.51
–ꢀ
7.41(m,2h),7.28(ddd,j=8.5,5.4,1.9hz,1h).
13
c nmr(100mhz, cdcl3):δ193.9,144.4,134.7,134.1,129.0,124.3,120.3.
[0035]
实施例2:2
‑
氟芴酮的电化学合成
[0036]
在单室电解池中分别加入原料4
‑
氟
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、 n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和 2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:70%。
[0037][0038]1h nmr(400mhz,cdcl3):δ7.63(d,j=7.3hz,1h),7.63(d,j= 7.3hz,1h),7.51
–
7.42(m,3h),7.53
–
7.37(m,3h),7.34
–
7.24(m, 2h),7.39
–
7.19(m,2h),7.14(td,j=8.5,2.5hz,1h),7.14(td,j=8.5, 2.5hz,1h).
13
c nmr(100mhz,cdcl3):δ192.4(d,j=2.2hz),163.5 (d,j=246hz),143.9(d,j=2.2hz),140.1(d,j=3hz),136.3(d,j=7 hz),135.0,134.3(d,j=2.2hz),128.7,124.5,121.6(d,j=8hz),120.8 (d,j=23hz),120.1,111.9(d,j=24hz).
19
f nmr(376mhz,cdcl3): δ
‑
111.7.
[0039]
实施例3:2
‑
甲基芴酮的电化学合成
[0040]
在单室电解池中分别加入原料4
‑
甲基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、 n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和 2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:58%。
[0041][0042]1h nmr(400mhz,cdcl3)δ7.60(dt,j=7.4,1.0hz,1h),7.46
–ꢀ
7.39(m,3h),7.33(d,j=7.5hz,1h),7.26
–
7.20(m,2h),2.35(s, 3h).
13
c nmr(100mhz,cdcl3)δ194.1,144.6,141.8,139.2,135.1, 134.6,134.4,134.2,128.6,124.9,124.2,120.11,119.97,21.4.
[0043]
实施例4:2
‑
甲氧基芴酮的电化学合成
[0044]
在单室电解池中分别加入原料4
‑
甲氧基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、 n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和 2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:55%。
[0045][0046]1h nmr(400mhz,cdcl3):δ7.64
–
7.56(m,1h),7.47
–
7.36(m, 3h),7.23
–
7.17(m,
2h),6.98(dd,j=8.2,2.5hz,1h),3.86(s,3h).
13
cnmr(100mhz,cdcl3):δ193.8,160.8,144.9,137.0,135.9,134.8,134.3,127.9,124.3,121.4,120.2,119.6,109.4,55.7.
[0047]
实施例5:2
‑
异丙基芴酮的电化学合成
[0048]
在单室电解池中分别加入原料4
‑
异丙基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:50%。
[0049][0050]1hnmr(400mhz,cdcl3):δ7.65(d,j=7.3hz,1h),7.57(d,j=1.6hz,1h),7.51
–
7.42(m,3h),7.36(dd,j=7.6,1.6hz,1h),7.27(ddd,j=7.3,6.3,2.6hz,1h),2.96(dt,j=13.8,6.9hz,1h),1.29(d,j=6.9hz,6h).
13
cnmr(100mhz,cdcl3):δ194.3,150.5,144.7,142.2,134.7,134.5,134.4,132.9,128.6,124.3,122.4,120.3,120.0,34.1,23.9.
[0051]
实施例6:2
‑
叔丁基芴酮的电化学合成
[0052]
在单室电解池中分别加入原料4
‑
叔丁基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:60%。
[0053][0054]1hnmr(400mhz,cdcl3)δ7.73(d,j=1.8hz,1h),7.65(d,j=7.3hz,1h),7.55
–
7.40(m,4h),7.32
–
7.22(m,1h),1.36(s,9h).
13
cnmr(100mhz,cdcl3)δ194.5,152.8,144.6,141.8,134.7,134.5,134.2,131.6,128.6,124.3,121.6,120.1,120.0,35.1,31.2.
[0055]
实施例7:2
‑
异丁基芴酮的电化学合成
[0056]
在单室电解池中分别加入原料4
‑
异丁基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基
苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:52%。
[0057][0058]1hnmr(400mhz,cdcl3):δ7.65(d,j=7.4hz,1h),7.52
–
7.39(m,4h),7.27(dd,j=8.5,4.6hz,2h),2.51(d,j=7.2hz,2h),1.90(m,1h),0.94(d,j=6.6hz,6h).
13
cnmr(100mhz,cdcl3):δ194.3,144.7,143.2,142.1,135.4,134.7,134.4,134.3,128.6,125.0,124.2,120.1,120.0,45.2,30.2,22.3.hrms(esi)m/z:[m+h+]calcdforc17h17o+:237.1274,found:237.1276.
[0059]
实施例8:2
‑
(4
‑
戊基环己基)芴酮的电化学合成
[0060]
在单室电解池中分别加入原料4
‑
(4
‑
戊基环己基)
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:60%。
[0061][0062]1hnmr(400mhz,cdcl3):δ7.64(d,j=7.3hz,1h),7.55(d,j=1.2hz,1h),7.50
–
7.45(m,2h),7.44(dd,j=7.0,4.3hz,1h),7.33(dd,j=7.5,1.6hz,1h),7.27(ddd,j=7.4,6.0,2.4hz,1h),2.51(tt,j=12.1,2.8hz,1h),1.91(d,j=10.2hz,4h),1.58
–
1.39(m,2h),1.39
–
1.19(m,10h),1.16
–
0.99(m,2h),0.92(t,j=7.0hz,3h).
13
cnmr(100mhz,cdcl3):δ194.3,149.5,144.6,142.2,134.6,134.4,133.4,128.6,124.2,122.8,120.2,120.0,44.6,37.3,37.2,34.1,33.4,32.23,26.7,22.7,14.2.hrms(ei)m/z:[m+h+]calcdfor333.2213,found:333.2209.
[0063]
实施例9:1
‑
甲基芴酮的电化学合成
[0064]
在单室电解池中分别加入原料3
‑
甲基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:60%。
[0065][0066]1hnmr(400mhz,cdcl3)δ7.64(d,j=7.4hz,1h),7.53
–
7.44(m,2h),7.39
–
7.26(m,3h),7.06(dd,j=6.2,1.3hz,1h),2.65(s,3h).
13
cnmr(100mhz,cdcl3)δ195.1,144.8,143.9,139.5,134.4,134.3,134.0,131.9,130.9,128.9,123.9,120.0,117.9,17.8.
[0067]
实施例10:1,3
‑
二甲基芴酮的电化学合成
[0068]
在单室电解池中分别加入原料3,5
‑
二甲基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:68%。
[0069][0070]1hnmr(400mhz,cdcl3)δ7.65
–
7.60(m,1h),7.51
–
7.42(m,2h),7.28(td,j=7.0,1.9hz,1h),7.17(s,1h),6.86(s,1h),2.60(s,3h),2.39(s,3h).13cnmr(101mhz,cdcl3)δ194.76(s),145.22(s),145.01(s),143.76(s),139.41(s),134.94(s),134.07(s),132.32(s),128.76(d,j=10.0hz),123.72(s),
13
cnmr(100mhz,cdcl3)δ194.8,145.2,145.0,143.8,139.4,135.0,134.1,132.3,128.8,128.7,123.7,119.9,118.9,22.0,17.8.
[0071]
实施例11:2
‑
三氟甲基芴酮的电化学合成
[0072]
在单室电解池中分别加入原料4
‑
三氟甲基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:54%。
[0073][0074]1hnmr(400mhz,cdcl3):δ7.85(s,1h),7.70(dd,j=22.7,7.0hz,2h),7.64
–
7.49(m,3h),7.47
–
7.31(m,1h).
13
cnmr(100mhz,cdcl3):δ192.0,147.4,143.0,135.1,134.3(d,j=19.2hz),131.6(q,j=4hz),131.3(q,j=23hz),130.2,124.7,123.7(q,j=
270hz),121.2 (q,j=3hz),121.1,120.5.
19
f nmr(376mhz,cdcl3):δ
‑
62.8.
[0075]
实施例12:3
‑
甲氧基芴酮的电化学合成
[0076]
在单室电解池中分别加入原料5
‑
甲氧基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和 2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:53%。
[0077][0078]1h nmr(400mhz,cdcl3)δ7.60(t,j=7.9hz,2h),7.48
–
7.41(m, 2h),7.32
–
7.24(m,1h),6.98(d,j=2.2hz,1h),6.72(m,1h),3.89(s, 3h).
13
c nmr(100mhz,cdcl3)δ192.7,165.4,147.0,143.3,135.3, 134.2,129.3,127.1,126.2,123.8,120.2,113.0,107.1,55.8.
[0079]
实施例13:2
‑
氯芴酮的电化学合成
[0080]
在单室电解池中分别加入原料4
‑
氯
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、 n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和 2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:62%。
[0081][0082]1h nmr(400mhz,cdcl3):δ7.63(d,j=7.4hz,1h),7.56(s,1h), 7.52
–
7.44(m,2h),7.44
–
7.38(m,2h),7.30(m,1h).
13
c nmr(100 mhz,cdcl3):δ192.4,143.6,142.5,135.6,135.0,134.2,133.9,129.3, 124.61,124.58,121.4,120.4.
[0083]
实施例14:3
‑
甲基芴酮的电化学合成
[0084]
在单室电解池中分别加入原料5
‑
甲基
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、 n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和 2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc 检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm 清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目
标产物。收率:68%。
[0085][0086]1h nmr(400mhz,cdcl3)δ7.65
–
7.55(m,1h),7.50(d,j=7.5hz, 1h),7.45
–
7.39(m,2h),7.24(m,2h),7.03(d,j=7.3hz,1h),2.38(s, 3h).
13
c nmr(100mhz,cdcl3)δ193.5,145.8,144.7,144.3,134.7, 134.4,131.8,129.5,128.9,124.2,124.0,121.2,120.1,22.1.
[0087]
实施例15:3
‑
氟芴酮的电化学合成
[0088]
在单室电解池中分别加入原料5
‑
氟
‑
1,1
‑
联苯
‑
2甲酰肼(0.3mmol)、 n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和 2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc 检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm 清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:50%。
[0089][0090]1h nmr(400mhz,cdcl3)δ7.73
–
7.62(m,2h),7.51(q,j=7.3hz, 2h),7.39
–
7.31(m,1h),7.19(dd,j=8.3,2.0hz,1h),6.96(m,1h). 13
c nmr(100mhz,cdcl3)δ192.1,167.3(d,j=255hz),147.5(d,j =10hz),142.8(d,j=2.4hz),134.7,134.7,130.2(d,j=2.7hz),129.8, 126.4(d,j=10.2hz),124.3,120.6,115.5(d,j=23.3hz),108.4(d,j= 24.4hz).
19
f nmr(376mhz,cdcl3)δ
‑
102.8.
[0091]
实施例16:2
‑
甲基芴酮的电化学合成
[0092]
在单室电解池中分别加入原料4
‑
甲基
‑
1,1
’‑
联苯
‑
2甲酰肼(0.3mmol)、 n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol)和 2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc 检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm 清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:57%。
[0093][0094]1h nmr(400mhz,cdcl3)δ7.64(dt,j=7.4,1.0hz,1h),7.50
–
7.44(m,3h),7.39(d,j=7.6hz,1h),7.31
–
7.22(m,2h),2.38(s,3h). 13
c nmr(100mhz,cdcl3)δ194.2,144.7,
141.8,139.3,135.1,134.7, 134.4,134.3,128.6,125.0,124.2,120.1,120.0,21.4.
[0095]
实施例17:2,6
‑
二甲基芴酮的电化学合成
[0096]
在单室电解池中分别加入原料4’,5
‑
二甲基
‑
1,1
’‑
联苯
‑
2甲酰肼(0.3 mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol) 和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:56%。
[0097][0098]1h nmr(400mhz,cdcl3):δ7.48(d,j=7.5hz,1h),7.41(s,1h), 7.29(t,j=4.9hz,1h),7.25
–
7.19(m,2h),7.03
–
6.99(m,1h),2.38(s, 3h),2.35(s,3h).
13
c nmr(100mhz,cdcl3)δ193.9,145.7,145.0, 141.6,139.1,134.9,134.8,131.9,129.1,124.8,124.1,120.9,119.9,22.2, 21.4.
[0099]
实施例18:2,7
‑
二甲基芴酮的电化学合成
[0100]
在单室电解池中分别加入原料4,4
’‑
二甲基
‑
1,1
’‑
联苯
‑
2甲酰肼(0.3 mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol) 和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:56%。
[0101][0102]1h nmr(400mhz,cdcl3)δ7.44(s,2h),7.34(d,j=7.5hz,2h), 7.25(m,2h),2.37(s,6h).
13
c nmr(100mhz,cdcl3)δ194.5,142.0, 138.7,135.1,134.5,124.9,119.8,21.4.hrms(esi)m/z:[m+h+]calcd for c15h13o+:209.0961,found:209.0953.
[0103]
实施例19:2
‑
氟
‑6‑
二甲基芴酮的电化学合成
[0104]
在单室电解池中分别加入原料4
’‑
氟
‑5‑
甲基
‑
1,1
’‑
联苯
‑
2甲酰肼(0.3 mmol)、n
‑
羟基邻苯二甲酰亚胺(0.075mmol,25mol%)、liclo4(1mmol) 和2,4,6
‑
collidine(0.05mmol,17%)。以乙腈(5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为铂网(1.0
×
1.0cm2)。在50℃水浴条件下搅拌通电,电压为3v进行反应,tlc检测反应的进程。当tlc检测原料邻苯基苯甲酰肼消失后停止通电,停止反应。将反应体系用dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈。茄型瓶中的固体进行柱层析分离得到目标产物。收率:58%。
[0105][0106]1h nmr(400mhz,cdcl3)δ7.53(d,j=7.6hz,1h),7.42(dd,j= 8.1,4.5hz,1h),7.33
–
7.27(m,1h),7.26(s,1h),7.13(td,j=8.6,2.5 hz,1h),7.06(d,j=7.5hz,1h),2.42(s,3h).
13
c nmr(100mhz, cdcl3)δ192.2,163.5(d,j=249.6hz),146.31,144.26(s),140.0(d,j= 3.0hz),136.9(d,j=7.2hz),132.0(d,j=2.6hz),129.2,124.6,121.4 (d,j=7.9hz),121.1,120.5(d,j=23.3hz),111.8(d,j=23.6hz),22.2. 19f nmr(376mhz,cdcl3)δ
‑
111.9.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1