一种催化剂及其制备方法和应用
本发明属于催化剂的,具体涉及一种催化剂及其制备方法和应用。
背景技术:
1、目前,单金属原子(sa)基催化剂的数量有限,并且在电催化还原二氧化碳、电解水制氢和氧还原等燃料电池领域缺乏应用。单金属原子催化剂制备目前往往需要较高的成本,工艺复杂,并且产量较低,如等离子涂层,激光解吸,气相沉积,以及高温或高压工艺。当使用现有工艺将金属原子负载到碳上时,会发生原子的团聚,进而形成纳米颗粒甚至形成团簇,限制了其应用。
2、自工业革命开始以来,二氧化碳排放量几乎一直在持续增加。二氧化碳的增加引起了人们的关注,因为它被认为是温室气体的来源之一,而温室气体与全球变暖等问题有关。因此,人们希望从环境中减少二氧化碳,或在二氧化碳释放到环境之前从源头上对其进行处理。用电化学方法将二氧化碳转化为化学品和燃料是解决co2及排放问题的非常有吸引力的方法,特别是在风能和太阳能等低成本可再生能源可用的情况下。
3、将co2转化为燃料通常采用高温气相异相催化。例如,co2在200℃以上的氢气氛围下,通过水-气转移反应催化转化为co,或者在高压氢气环境下(50-100pa)通过cu/zno/al2o3催化生成甲醇。由于多相催化需要高温高压,增加了转化系统和制造过程的复杂性和成本。此外,化工厂需要较高的占地面积和能耗,且难以规模化生产,适用于中小型操作。理想情况下,二氧化碳还原应该在低温和低压下运行,从而实现大量生产,此外,催化系统应可以实现放大化生产,从而匹配co2在不同规模下的转化能力。
4、电催化co2还原反应(co2rr)可以实现在水相环境温度和压力下将二氧化碳转化为燃料,使其成为一个理想反应。电催化剂由催化基底(如碳)支撑具有催化活点的材料组成,催化反应一般在催化剂材料的表面和孔内进行,催化剂的微孔强度也会增加多孔碳载体内的co2停留时间,这可能会改变反应的路径和产物。最重要的是,催化剂表面的功能性和催化活性中心的性质对催化活性和选择性起着关键作用。
5、目前的研究中co2rr催化剂结构主要包括块体材料、纳米材料或金属团簇,这些催化剂中通常使用昂贵的金属作为催化剂。例如,目前应用较多的金属是ru、pt和au,它们的自然储量极低导致成本增加。这类co2rr催化剂的主要缺点是由于其制备所用的技术或材料过于昂贵而缺乏可扩展性,因此,这些催化剂无法作为可行的商业产品,以经济有效的方式规模化量产。
6、目前电催化剂技术的另一个局限是低选择性、低效率和低稳定性。此外,目前大多数co2rr催化剂只能将co2转化为c1产物,如co、甲烷、甲酸或甲醇。对于co2的电催化转化为燃料或化学产品,需要在可控的条件下最好是在(如电压)生成单一物质纯度较高的产物,从而简化产物分离,降低收集成本。然而现有技术的催化剂无法接近100%的选择性制备单一的多碳产物。
7、稳定性是co2rr电催化剂的另一个重要标准。由于金属需要溶解到水溶液介质中,因此许多现有技术的电催化剂稳定性较差。此外,人们更希望将co2转化为更高的碳氢化合物(c2或更高的碳氢化合物,如乙醇),因为作为燃料或更有价值的化学中间体,更高的碳氢化合物通常具有较高的热值。现有技术尚未证明co2rr转化为c2或更高的产品可以达到接近100%的选择性。所有这些现有催化剂的内在缺陷仍然需要克服。
8、因此,需要开发一种性能更好的催化剂。
技术实现思路
1、为解决现有技术中出现的问题,本发明提供了一种催化剂及其制备方法和应用。本发明使用熔碱金属(锂、钠、钾、铷、铯)法制备碳负载的原子级分散金属催化剂或金属氧化物催化剂,这些催化剂作为电催化剂应用时被证明具有高效率和低过电位,对两个或两个以上碳的醇和碳氢化合物的形成具有高度选择性和高度稳定性。根据实施例,成功得到具有高选择性和高效率的乙醇、乙酸、乙二醇、丙醇、异丙醇、丙三醇和丙酮,对于co2转化适用范围较广。因此,本发明在二氧化碳电化学还原中提供了一种操作简单可实现高能量密度和高价值碳氢化合物的形成,以及二氧化碳的高效转化的原子分散催化剂的制备方法与应用。同时本发明的催化剂还可以作为电解水制氢和氧还原燃料电池的催化剂。
2、为解决上述技术问题,本发明采用如下解决方案:
3、本发明的第一个方面是提供一种催化剂,所述催化剂包括载体和活性组分;
4、活性组分选自具有催化剂作用的金属、具有催化剂作用的金属氧化物中的至少一种;其中,活性组分中的金属原子在所述载体上呈原子级分散。
5、在本发明所述的催化剂中,优选地,
6、所述活性组分选自过渡金属、主族金属和镧系金属、锕系金属中的至少一种;和/或,
7、所述载体选自碳载体、金属氧化物载体中的至少一种;和/或,
8、所述催化剂中活性组分和/或载体上修饰有含氧官能团;优选所述含氧官能团包括-oh,-coh,-cooh;和/或,
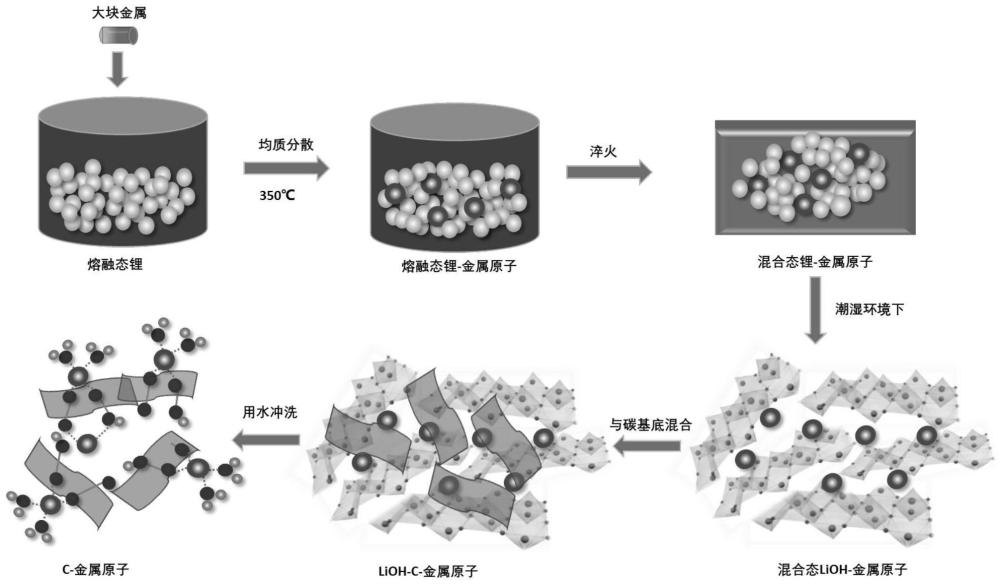
9、催化剂中,活性组分和载体的质量比值为(0.01%~50%);优选为(0.01%~10%)
10、优选地,
11、所述碳载体中的碳选自碳粉、炭黑(优选vulcan xc-72),科琴黑,石墨烯,碳纳米管、金属有机骨架化合物烧结后形成的碳载体中的至少一种;和/或,
12、所述金属氧化物载体中的金属氧化物选自碱金属氧化物,碱土金属氧化物,主族金属氧化物、过渡金属氧化物、镧系金属氧化物;更优选选自al2o3、tio2、ceo2中的至少一种;
13、在本发明所述的催化剂中,优选地,
14、所述载体的表面积≥20m2/g,优选为20m2/g至800m2/g;和/或,
15、活性组分选自mg,ca,sr,ba,b,al,ga,in,tl,ge,sn,pb,as,sb,bi,se,te,po,sc,ti,v,cr,mn,fe,co,ni,cu,zn,y,zr,nb,mo,tc,ru,rh,pd,ag,cd,la系,ac系,hf,ta,w,re,os,ir,pt,au,hg中的至少一种;
16、优选地,活性组分选自具有催化剂作用的金属为熔点低于300℃的金属;优选为mg,ca,sr,ba,b,al,ga,in,tl,ge,sn,pb,as,sb,bi,se,te,po,cu,zn,mo,tc,ru,rh,pd,ag,cd,la系,ac系,hf,ta,w,re,os,ir,pt,au,hg中的至少一种
17、更进一步优选地,
18、活性组分选自具有催化剂作用的金属为双金属或多金属;其中的技术可包括但不限于mg,ca,sr,ba,b,al,ga,in,tl,ge,sn,pb,as,sb,bi,se,te,po,sc,ti,v,cr,mn,fe,co,ni,cu,zn,y,zr,nb,mo,tc,ru,rh,pd,ag,cd,la系,ac系,hf,ta,w,re,os,ir,pt,au,hg等双金属或多金属与熔融态锂而形成li-m1-m2(m1-第一金属,m2-第二金属)或li-多金属熔体。
19、本发明的第二个方面提供一种催化剂的制备方法,包括以下步骤:
20、(1)在无水无氧条件下将化合物a添加到熔融态碱金属中分散均匀;冷却形成碱金属-化合物a的固体;其中,化合物a选自具有催化剂作用的金属、具有催化剂作用的金属氧化物中的至少一种;
21、(2)将碱金属-化合物a的固体中的碱金属转化为碱金属氢氧化物,形成化合物a-碱金属氢氧化物固体;将化合物a-碱金属氢氧化物固体与载体混合均匀后,得到混合物;除去混合物中的碱金属氢氧化物,干燥,得到所述催化剂;
22、优选用于权利要求本发明的第一个方面任一项所述的催化剂的制备。
23、在本发明所述的催化剂的制备方法中,优选地,
24、步骤(1)中,
25、化合物a选自催化剂的活性组分或催化剂的活性组分对应的氧化物中的至少一种;和/或,
26、所述碱金属选自锂、钠、钾、铷或铯中的至少一种,可作为熔融介质将上述金属溶解成固溶体。在首选实施例中,由于锂的熔点和沸点之间的跨度最大,因此作为熔融介质添加到熔体中的一种或多种金属(通常称为锂熔体);和/或,
27、化合物a和碱金属的质量比为(0.01%~50%):1;优选为(0.01%~10%):1;和/或,
28、分散均匀的方式为超声分散;
29、优选地,化合物a选自催化剂的活性组分对应的氧化物时,选自nio、fe3o4中的至少一种。
30、在本发明所述的催化剂的制备方法中,优选地,
31、碱金属-化合物a的固体的制备方法,包括如下步骤:
32、步骤一:锂-催化金属熔体的制备
33、方法一:
34、(1)锂在坩埚中在惰性气氛手套箱中加热到180.5℃的熔点以上,并保持在1330℃的沸点以下。将大块金属cu固体熔于熔融态锂中,使用超声波均质器确保cu金属单原子均匀分散,锂熔体保持0.5~10小时,然后将锂溶体倒在干净的不锈钢板上快速淬火,熔融体在20分钟内冷却。
35、方法二:
36、(1)钠在坩埚中在惰性气氛手套箱中加热到97.7℃的熔点以上,并保持在883℃的沸点以下。将大块金属cu固体熔于熔融态锂中,使用超声波均质器确保cu金属单原子均匀分散,锂熔体保持0.5~10小时,然后将锂溶体倒在干净的不锈钢板上快速淬火,熔融体在20分钟内冷却。
37、方法三:
38、(1)钾在坩埚中在惰性气氛手套箱中加热到64℃的熔点以上,并保持在759℃的沸点以下。将大块金属cu固体熔于熔融态锂中,使用超声波均质器确保cu金属单原子均匀分散,锂熔体保持0.5~10小时,然后将锂溶体倒在干净的不锈钢板上快速淬火,熔融体在20分钟内冷却。
39、方法四:
40、(1)铷在坩埚中在惰性气氛手套箱中加热到39℃的熔点以上,并保持在688℃的沸点以下。将大块金属cu固体熔于熔融态锂中,使用超声波均质器确保cu金属单原子均匀分散,锂熔体保持0.5~10小时,然后将锂溶体倒在干净的不锈钢板上快速淬火,熔融体在20分钟内冷却。
41、在本发明所述的催化剂的制备方法中,优选地,
42、步骤(1)中,
43、化合物a添加到熔融态碱金属中,保持碱金属熔融态的时间为0.5~10小时;和/或,
44、冷却的时间≤20分钟;和/或,
45、化合物a的形态为块体、粉末、锭、丝和碎片中的至少一种。
46、在本发明所述的催化剂的制备方法中,优选地,
47、步骤(2)中,
48、将碱金属-化合物a的固体放在潮湿的空气中,使碱金属转化为碱金属氢氧化物;和/或,
49、碱金属-化合物a的固体中的化合物a和载体的质量比为(0.01~50%):1;优选为(0.01%~10%):1;和/或,
50、将化合物a-碱金属氢氧化物固体与载体通过机械的方式混合均匀;和/或,
51、利用水与化合物a-碱金属氢氧化物固体中的碱金属氢氧化物反应,以除去混合物中的碱金属氢氧化物,干燥,得到所述催化剂。
52、在本发明所述的催化剂的制备方法中,优选地,
53、步骤(2)中,
54、将碱金属-化合物a的固体切割成小块,放在潮湿的空气中;潮湿的空气中空气相对湿度(rh)为50%至100%;和/或,
55、机械的方式为通过研磨的方式混合均匀;和/或,
56、干燥的方式为在50-100℃进行真空干燥。
57、在本发明中所述切割成小块,也可以使用其他机械方法,将固溶体缩小尺寸或分解成更细的碎片,以促进与水分和空气的相互作用。
58、所述催化基底材料中的载体的表面积大于20m2/g。例如可在20m2/g至800m2/g的范围内。载体可以是商业碳载体,如vulcan xc-72,科琴黑,石墨烯,碳纳米管,普通商业化碳粉、炭黑,金属氧化物,高比表面积的碳,也可以是基于高表面积材料,例如但不限于金属-有机框架和多孔有机聚合物衍生的碳载体等满足金属原子可以均匀地分散在具有高比表面积和高孔隙率的载体碳基质上。由于使用碳基质载体可以保证金属原子(单金属或多金属)在以上支架均匀分布,以避免或减少团聚。
59、在本发明所述的催化剂的制备方法中,优选地,
60、化合物a-碱金属氢氧化物固体的制备方法,包括:
61、将冷却的步骤(1)得到的化合物a-碱金属固体从手套箱中取出并切成小块,放在潮湿的环境中碱金属被转化为碱金属氢氧化物;
62、混合金属、碱金属氢氧化物与载体进行混合研磨成10目至3000目的尺寸。
63、在本发明所述的催化剂的制备方法中,优选地,
64、除去混合物中的碱金属氢氧化物的方法,包括:
65、对混合均匀的材料使用大量的去离子水进行冲洗,碱金属氢氧化物被水选择性浸出,一方面滤出易溶于水的碱金属氢氧化物,另一方面,可以创造一种浓缩的碱性溶液,通过形成-oh,-cooh,-co等官能团修饰碳表面。这样的官能团,反过来又有助于将单个金属原子(金属)或者金属氧化物以高度分散的状态锚定在催化基底表面上。
66、洗涤后的材料在30~150℃真空烘箱中干燥去除水分得到碳负载或活性组分的催化剂。
67、本发明的第三个方面是提供一种如本发明的第一个方面任一项所述的催化剂或者本发明的第二个方面任一项所述的方法制备的催化剂作为电催化剂的应用,优选作为用于co2还原的电催化剂的应用、电解水制氢的电催化剂的应用、作为燃料电池的氧还原电催化剂的应用中的至少一种。
68、在本发明所述的应用中,优选地,
69、所述催化剂作为co2还原制乙醇的电催化剂的应用;和/或,
70、所述催化剂作为co2还原制丙酮的电催化剂的应用;和/或,
71、所述催化剂作为co2还原制乙酸的电催化剂的应用;和/或,
72、所述催化剂作为co2还原制甲酸的电催化剂的应用;和/或,
73、所述催化剂作为co2还原制乙二醇的电催化剂的应用;和/或,
74、所述催化剂作为co2还原制丙三醇的电催化剂的应用;和/或,
75、所述催化剂作为co2还原制异丙醇的电催化剂的应用;和/或,
76、所述催化剂作为co2还原制co的电催化剂的应用。
77、更进一步优选地,
78、活性组分cu用于将co2转化为乙醇,异丙醇,乙二醇,丙三醇,异丙醇,活性组分au用于将co2转化为co,活性组分rh用于将co2转化为乙酸,活性组分sn、in、bi用于将co2转化为乙醇活性组分,ag,pd用于将co2转化为丙酮。特别强调的是,活性组分金属单原子可以直接以锭、线、粉末、碎片等形式形成,而不是传统的湿化学制备方法涉及溶解金属盐或金属水溶液或有机溶液中的络合物,之后进行干燥还原等步骤。本发明在惰性气氛下,过渡金属分散到碱金属如热锂溶液中,熔融态锂的温度在180℃到1330℃之间,即位于锂熔点和沸点之间。对于其他用于熔体的碱金属,温度范围也在它们各自的熔点和沸点之间。
79、在本发明所述的应用中,优选地,单原子、锂熔法方法派生的电催化剂在组成上不同,其中它们由分布良好的单原子组成。首先,电催化剂的成分中含有pt、pd、au、ag、ir、ru、rh、cu、zn、cd、hg、sc、y、ni、lu、cu和rh等金属,是最优的。
80、该催化剂具有以下优点:
81、1、本发明制备的催化剂在水介质中具有活性和稳定性。其中,高表面积的碳载体增加了稳定性,因为碳不易在低过电位下降解。最重要的是,根据本发明的制备方法,在碱性氢氧化物lioh的冲洗过程中,产生了高水平的含氧官能团,如-oh,-coh,-cooh。这种含氧官能团在催化反应中充当锚定位点,使金属原子保持高度分散状态。因此,本发明催化剂具有长时间的稳定性。这种结构特点优于不引入含氧官能团的传统co2rr催化剂。区别于传统方法制备的催化剂中的金属在催化反应过程中会发生迁移和团聚,导致金属团簇的团聚改变催化活性。
82、2、本发明的催化剂在实际应用中具有高选择性以及降低过电位来实现产物高法拉第效率,克服现有电催化剂产品选择性低和法拉第效率低的缺点。本发明中金属以原子状态分散在基底的催化剂,是达到高法拉第效率和高产品选择性的原因。这是由于高度分散的金属在具有有效电荷和质量转移的催化基底上产生的。上述制备负载金属单原子催化剂应用在co2rr中都远高于先前报道催化剂的选择性。这也说明了熔锂过程和后处理,如lioh被水浸出,在不降低载体导电性的情况下,产生了由氧修饰碳水化合物表面锚定的高度分散的金属。
83、3、本发明制备的金属单原子可以应用于各种催化基底,如碳材料,金属氧化物,薄膜,半导体。
84、4、本发明使用地球上储量较高的过渡金属和非过渡金属材料,成本低。
85、5、本发明的催化剂很容易与传统电解槽设计相结合。且本发明中所产生的碱性氢氧化物等副产物可以循环使用,实现生产工艺零排放。
86、6、本发明中所制备的负载金属单原子催化剂的纯度可达到100%。
87、7、本发明制备方法易于规模化。根据本文所述实施例制备的金属-碳上催化剂使用商业碳载体,同时易于应用在多孔基质或电极表面。对于工业应用来说,高选择性对于降低分离成本和产品产率至关重要。本发明中这种高选择性的部分原因是与现有技术中的金属晶体相比,在单个原子位点上存在不同的催化机制。单金属位点可通过独特的顺序催化步骤和相邻单原子位点的协同催化步骤生产最终产物,比现有技术提供的金属晶体催化剂具有更好的反应机理控制。此外,金属-支架的相互作用可以通过优化金属加载和支架表面修饰进行微调。
- 还没有人留言评论。精彩留言会获得点赞!