一种选择性富集和鉴定N-连接糖肽的方法与流程
本发明属于蛋白质组学研究方向糖基化蛋白质组学技术领域,具体涉及基于氨基化学的选择性富集N-连糖肽的方法及其应用。
背景技术:
在真核生物中,蛋白质糖基化作为一种最普遍且最重要的翻译后修饰,参与了细胞凋亡,免疫应答,细胞-细胞相互作用,配体-受体相互作用以及疾病的发生发展等生命过程。目前,临床上所用的疾病标志物大多是糖基化蛋白质,如肝癌的标志蛋白-甲胎蛋白(AFP),恶性肿瘤的标志物-癌症抗原125(cancer antigen 125),以及前列腺癌的标志物—前列腺癌特异抗原(PSA)等等。因此,对于糖蛋白的全面深入研究具有非常重要的意义。
在糖基化蛋白质组分析中,高效液相色谱-质谱联用是大规模分析糖蛋白或者糖肽的一种有效平台。当生物样品直接进行质谱分析时,由于相对于非糖肽或非糖蛋白而言,糖肽或糖蛋白的含量很低,并且糖肽或糖蛋白的离子信号强度往往会被非糖肽或糖蛋白的离子信号所抑制,因而在进行蛋白质糖基化分析时,对糖肽或糖蛋白进行预分离和富集是很有必要的。
目前,主要有三类方法用于富集糖肽或糖蛋白,包括凝集素亲和色谱法(文献1.Kaji,H.et al.Nat.Biotechnol.2003,21,667-672;文献2.Kim,J.Y.et al.Anal.Chem.2014,86,7650-7657.),亲水作用色谱法(文献3.Chen,R.et al.J.Proteomics 2014,103,194-203;文献4.Zhu J.et al.Anal.Chem.2012,84,5146-5153.),以及通过糖链与材料的功能基团共价链接的化学方法(文献5.Zhang,H.et al,Nat.Biotechnol.2003,21,660-666;文献6.Xu,Y.W.et al.Anal.Chem.2009,81,503-508.)。与色谱方法相比,化学方法的明显优势是其高特异性(文献7.Sun,B.Y.et al.J.Proteome Res.2014,13,2705-2714.)。酰肼化学法是富集糖肽或糖蛋白较为有效的化学方法,该方法的主要原理是用高碘酸钠氧化糖链上的顺式邻二醇生成醛,然后与固定在材料上的肼共价结合,从而达到分离富集糖肽或糖蛋白的效果。但是商品化的酰肼琼脂糖微球在溶液体系中难分散且难分离,价格也较昂贵(文献8.Zhang,Y.et al.Anal.Chem.2013,85,5535-5541.)。在本发明中,我们利用较廉价的氨基微球富集糖肽。
伯胺和醛基之间的还原氨化反应已经在蛋白质和多肽的分析中广泛应用,如在定量蛋白质组学中广泛使用的二甲基标记反应(文献9.Boersema,P.J.et al.Nat.Protoc.2009,4,484-494.)和蛋白质的固定化反应(文献10.Lee,C.H.et al.Nano Today 2009,4,165-179.)。其原理是,氨基和醛基之间形成席夫碱并被还原试剂如氰基硼氢化钠还原成稳定的仲胺或叔胺。因此,像酰肼化学法一样,也可以用氨基微球去富集分离高碘酸钠氧化后的糖肽,我们称之为氨基化学法。但是,氨基 化学法存在一个比较显著的问题,即样品中肽段的末端氨基和侧链氨基也能与氧化后的糖链上的醛基形成席夫碱,并被加入的还原试剂还原,这就对氨基微球富集糖肽造成较大的干扰(图1中的插图),大大降低了氨基化学法的效率。在本发明中,我们在用高碘酸钠氧化糖链之前,首先利用甲醛封闭肽段上的伯胺基团,糖链氧化后生成的醛基就可以最大限度的与微球上的氨基反应,从而大大提高了氨基化学法富集糖肽的效率。
技术实现要素:
本发明的目的在于提供一种可以简便、高效、高通量分析复杂生物样品中N-糖蛋白质组信息的方法。
本发明提供的方法是基于肽段上的伯胺基团可以与甲醛发生还原氨化反应,以及微球上的氨基可以与高碘酸钠氧化后的糖链上的醛基发生还原氨化反应,从而将糖肽从复杂样品中富集分离出来,然后通过质谱分析得到样品的糖蛋白质组信息。该方法可以总的表述为,基于两次还原氨化反应的氨基化学法用于高通量分析样品中的N-糖蛋白质组信息;与此相对应,肽段上伯胺基团不被封闭的氨基化学法可以称之为基于一次还原氨化反应的氨基化学法。
本发明采用如下技术方案:
首先,取生物样品,用胰蛋白酶Trypsin酶解,并用甲醛封闭肽段的末端氨基和侧链氨基,然后用高碘酸钠溶液氧化糖肽上的糖链生成醛基,之后利用氨基微球富集氧化后的糖肽并用肽糖苷酶PNGase F处理,最后对释放的N-糖肽进行质谱分析,以得到样品中的N-糖基化位点,N-糖肽,及对应的糖蛋白信息。
具体包含以下步骤,
1)取生物样品,溶解在含6-8M Urea和50-100mM TEAB的缓冲溶液中,加入终浓度为10-20mM DTT,37-60℃水浴中1-2h,然后加入终浓度为20-40mM IAA,20-25℃避光反应40-60min;生物样品在缓冲溶液的浓度为1-10mg/mL;
2)步骤1)结束后得到的样品,用含50-100mM TEAB的水溶液按将Urea浓度稀释至0.5-1M的比例稀释,然后加入与全蛋白质量比为1/50-1/25的胰蛋白酶Trypsin,37℃水浴中酶解12-16h,得到肽段溶液;
3)向步骤2)结束后得到的肽段溶液依次加入与肽段质量比为1/100-1/200的4-8wt%CH2O/H2O和与肽段质量比为5/1-10/1的新鲜配制的0.6-1.2M NaBH3CN水溶液,25℃反应1-2h;
4)向步骤3)得到的肽段溶液中加入与体系总体积的体积比为1/50-1/100的8-16wt%氨水,再加入甲酸调pH至2-3,然后用C18固相萃取柱除去溶液中的小分子,将得到的肽段洗脱液冷冻干燥;
5)将步骤4)得到的肽段溶解在含10-15mM高碘酸钠(氧化剂)、80-100mM NaAC和130-150mM NaCl的缓冲溶液中,使肽段在溶液中的浓度为0.5-1mg/mL。20-25℃避光氧化1-1.5h。然后加入Na2S2O3以终止氧化,使Na2S2O3在体系中的终浓度为20-30mM。20-25℃反应15-30min;
6)取氨基微球(SiO2@NH2),以含80-100mM NaAC和130-150mM NaCl的缓冲溶液洗离2-3次,然后加入步骤5)得到的肽段溶液中,加入的氨基微球自身体积与溶液的体积比为1∶5-1∶6,20-25℃震荡10-20min后,再加入NaBH3CN至NaBH3CN在体系中的终浓度为0.1-0.2M,然后置于20-25℃摇床内富集10-12h;
7)步骤6)得到的产物以14000-15000g离心3-5min,弃去上清液。得到的氨基微球依次以1.0-1.5M NaCl溶液、80-90%ACN/H2O(v/v)、50-100mM NH4HCO3溶液和水各洗离3-4次,以洗去非特异性吸附的肽段,并分散在10-20mM的TEAB缓冲溶液中,氨基微球自身所占体积与TEAB溶液的体积比为1∶4-1∶5,再加入与肽段质量比为500Unites/mg-1000Unites/mg的PNGase F,,然后置于37℃摇床内酶切10-12h;
8)步骤7)得到的混合液以14000-15000g离心3-5min,取上清,即得到富集的N-糖肽样品,然后直接以MALDI-TOF/TOF MS或LC-MS/MS分析,得到样品中的N-糖基化位点、N-糖肽及对应的糖蛋白信息。
步骤1)所述的含6-8M Urea和50-100mM TEAB的缓冲溶液的pH为7.5-8.0;步骤2)所述的含50-100mM TEAB的水溶液的pH为7.5-8.0;步骤7)所述的10-20mM TEAB溶液的pH为7.5-8.0。
步骤5)所述的含10-15mM高碘酸钠、80-100mM NaAC和130-150mM NaCl的缓冲溶液的pH为5.3-5.5。
步骤4)所述的用C18固相萃取柱除去溶液中的小分子,具体操作为:(1)0.1%TFA淋洗,洗去Urea、TEAB、CH2O、NaBH3CN和甲酸铵等小分子;(2)80%ACN,0.1%TFA/H2O(v/v)洗脱肽段,冷冻干燥后备用。
该方法能同时获取相应的糖蛋白、糖肽和糖基化位点的鉴定结果,可以用于糖基化修饰的蛋白质组学分析。
所述的基于两次还原氨化反应的氨基化学法,所用的糖肽富集材料为商品化的氨基修饰的二氧化硅微球(5μm)(Sugg Parkway,Greenville,U.S.A.)。
所述的基于两次还原氨化反应的氨基化学法,是在胰蛋白酶酶解后的多肽层次上富集样品中的糖肽。
所述的基于两次还原氨化反应的氨基化学法,在用高碘酸钠氧化糖链之前,首先利用甲醛封闭肽段上的伯胺基团,其原理也是还原氨化反应。
所述的基于两次还原氨化反应的氨基化学法,所用的高碘酸钠在体系中的终浓度为10mM,氧化条件为25℃下避光氧化1h.
所述的基于两次还原氨化反应的氨基化学法,可按如下步骤进行(如图1所示):即将待分析的样品用胰蛋白酶酶解成多肽,紧接着用甲醛和氰基硼氢化钠封闭多肽上的伯胺基团,以C18SPE柱除去小分子(除去的小分子为Urea、TEAB、CH2O、NaBH3CN和甲酸铵等。),得到封闭后的多肽。然后用高碘酸钠氧化糖链上的顺式邻二醇生成醛基,加入氨基微球和氰基硼氢化钠富集糖肽。最后,将富集到的N-糖肽用肽糖苷酶PNGase F酶切释放并进行质谱分析,得到样品中的 N-糖蛋白质组信息。
所述的基于两次还原氨化反应的氨基化学法,其特征在于:在用高碘酸钠氧化糖链之前,首先用甲醛封闭多肽上的伯胺基团,从而提高了氨基化学富集糖肽的效率,增加了N-糖基化蛋白质组的覆盖度。
本发明的优点:
本发明所述方法具有明显的优点:简便,高效,高通量。还原氨化反应已在蛋白质组学分析中广泛应用,但将氨基材料用于富集糖肽的报道还很少。氨基二氧化硅微球具有材料廉价易得,在水相中易分散,易分离,富集特异性高等优点。本发明的实验流程是在多肽层次上运用氨基化学法,在鸟枪法蛋白质组学中具有很高的普适性;本发明首次运用两次还原氨化反应实现样品中N-糖肽的富集分离,结合高分辨率的RPLC-MS/MS分析,提高了N-糖基化蛋白质组的鉴定覆盖度。
附图说明
下面结合附图及实施方式对本发明作进一步详细的说明:
图1为所述的基于两次还原氨化反应的氨基化学法的实验流程图。
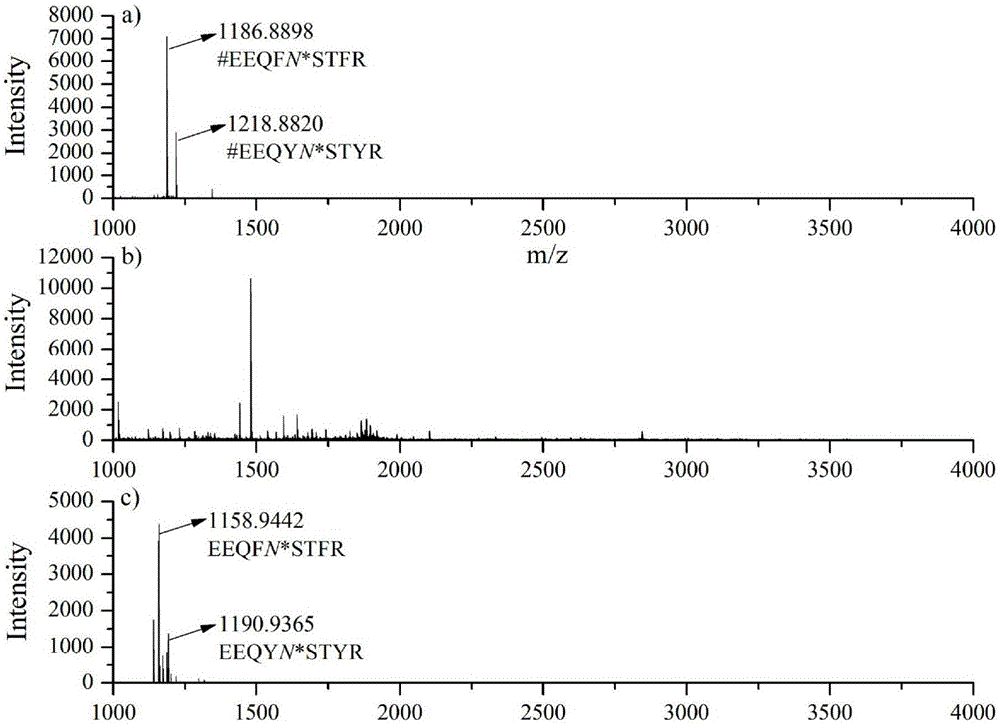
图2为验证所述的基于两次还原氨化反应的氨基化学法的可行性的MALDI-TOF质谱图。样品为标准糖蛋白IgG和非糖蛋白BSA按1∶1摩尔比混合后的胰蛋白酶酶解液。a)基于两次还原氨化反应的氨基化学法;b)直接分析酶解液;c)基于一次还原氨化反应的氨基化学法。注:#表示肽段上伯胺基团被甲醛封闭;N*表示N-糖基化位点。
图3为基于两次还原氨化反应的氨基化学法和基于一次还原氨化反应的氨基化学法用于人肝癌患者血清中N-糖基化位点鉴定的结果比较。a)基于两次还原氨化反应的氨基化学法两次实验重复的鉴定结果;b)基于一次还原氨化反应的氨基化学法两次实验重复的鉴定结果;c)两种方法的总鉴定结果的比较。
具体实施方式
实施例中使用以下材料与试剂:
人免疫球蛋白(human serum immunoglobulin G,IgG),牛血清白蛋白(Bovine serum albumin,BSA),高碘酸钠(sodium periodate),二硫苏糖醇(1,4-dithiothreitol,DTT),碘代乙酰胺(iodacetamide,IAA),胰蛋白酶(trypsin),α-氰基-4-羟基肉桂酸(α-cyno-4-hydroxycinnamic acid,CHCA),三乙基碳酸氢铵缓冲液(triethylammonium bicarbonate buffer,TEAB),甲醛(formaldehyde,CH2O),氰基硼氢化钠(NaBH3CN)和13C氘代甲醛(deuterated-13C-formaldehyde,13CD2O)均是购自Sigma公司(IL,U.S.A.)。氨基二氧化硅微球(amine-functionalized beads,5μm,SiO2@NH2)购自Fuji Silysia化学试剂公司(Greenville,U.S.A.)。肽糖苷酶(Peptide-N-glycosidase F,PNGase F)购自New England Biolabs公司(MA,U.S.A.)。实验用水经购自Millipore公司(MA,U.S.A.)的Milli-Q水处理系统纯化。其他试剂均为分析纯或更高纯度。
实施例1
验证所述的基于两次还原氨化反应的氨基化学法的可行性:
人免疫球蛋白(IgG)是一种简单易得的糖蛋白,牛血清白蛋白(BSA)是一种常用的标准非糖蛋白。利用本发明所述的基于两次还原氨化反应的氨基化学法富集分离两者的肽段混合物中的N-糖肽。实验流程如下:
1.IgG和BSA按摩尔比1:1混合的200μg样品溶解在96μL 100mM TEAB缓冲液中(pH 8.0),在沸水中加热失活10min后,冷至25℃,加入4μg胰蛋白酶,37℃水浴中酶解12h;
2.向得到的肽段溶液中加入20μL 4wt%CH2O/H2O和新配制的20μL 0.6M NaBH3CN水溶液,25℃摇床内反应1h;
3.加入30μL 8wt%氨水猝灭标记反应,再加入50μL甲酸调pH至2-3,以实验室自制的C18SPE柱除去小分子。收集洗脱液后,冷冻干燥,得到肽段伯胺基团被封闭的样品;
4.将样品复溶在450μL含100mM NaAC和150mM NaCl的缓冲溶液中(pH5.5),然后加入新配制的50μL 100mM NaIO4水溶液,即NaIO4在体系中的终浓度为10mM,25℃摇床中避光氧化1h后,加入125μL 100mM NaS2O3水溶液猝灭氧化反应20min;
5.称SiO2@NH2微球20mg,以含100mM NaAC和150mM NaCl的缓冲液洗离3次后,将微球转移至氧化后的样品中,25℃摇床中振荡10min后,再加入新鲜配制的NaBH3CN水溶液至NaBH3CN在体系中的终浓度为0.1M,然后置于25℃摇床中富集12h。
6.得到的产物以14000g离心3min,弃去上清。得到的氨基微球依次以1.5MNaCl溶液,80%ACN(ACN和H2O的体积比),100mM NH4HCO3水溶液和水各洗离3次,以洗去非特异性吸附的肽段,并分散在500μL 10mM TEAB中,再加入500Unites PNGase F,然后置于37℃摇床内酶切12h。
7.得到的混合液以14000g离心5min,取出上清,即得到富集的N-糖肽样品,然后直接以MALDI-TOF-MS分析。
分析结果:
如图2a)所示,谱图中只有IgG中两条被甲醛封闭的去掉糖链的N-糖肽峰(#EEQYN*STFR和#EEQYN*STYR),几乎没有杂峰,而且峰强分别大于7000和3000;对于酶解液直接分析的结果如图2b)所示,谱图中有多条肽段,看不出糖肽的峰,显然,所述基于两次还原氨化反应的氨基化学法能从复杂肽段混合液中高选择性的富集N-糖肽。为了比较,基于一次还原氨化反应的氨基化学法也用来富集同样的样品,质谱结果如图2c)所示,谱图中也主要是IgG的两条去糖链的N-糖肽峰(EEQYN*STFR和EEQYN*STYR),但是峰强度只有4000多和1000多,而且还有一些杂峰。与图2a)相比,说明肽段上伯胺基团被封闭的氨基化学法对N-糖肽的富集特异性更高。另一方面,在用相同样品量分析的情况下,图2a)中N-糖肽的峰强约是图2c)中的2倍,说明基于两次还原氨化反应的氨基化学法富集到了更多的N-糖肽,其相对回收率更高。
实施例2
我们将所述的基于两次还原氨化反应的氨基化学法与基于一次还原氨化反应的氨基化学法同时用于分析人肝癌血清中的N-糖蛋白质组信息,并比较两种方法鉴定到的N-糖基化位点的结果。
本实验所用的人肝癌血清由大连医科大学附属第二医院(大连,中国)提供。样品的取得和使用完全合法,并符合该院伦理委员会的相关规定。血清样品用基于两次还原氨化反应的氨基化学法的实验流程如下:
1.取15μL(含1mg左右蛋白)血清一份,用含8M Urea和100mMTEAB的缓冲液(pH 8.0)稀释至92μL,加入8μL 1M的DTT,60℃水浴中反应1h以打开二硫键,然后加入0.74mg的IAA,25℃避光反应40min以封闭巯基;
2.用100mM TEAB稀释Urea浓度至1M,然后加入25μg胰蛋白酶,37℃水浴中酶解16h;
3.向得到的肽段溶液依次加入100μL8wt%CH2O/H2O和新鲜配制的100μL0.6M NaBH3CN水溶液,25℃反应1h以封闭肽段的末端氨基和侧链氨基;
4.加入20μL 16wt%氨水以终止封闭反应,用FA调pH至2.5,然后用实验室自制的C18固相萃取柱除去溶液中的小分子,将得到的肽段洗脱液冷冻干燥;
5.接下来的实验操作同实施例1标准蛋白实验流程的4-7步,不同的是,氨基微球用量为30mg,PNGase F酶用量为1000Unites。
分析结果:
我们用两种方法同时平行做了两次实验重复,得到四个样品,即每个方法有Isolation 1和Isolation 2,如图3a和3b,并且每个样品又同时做了两次质谱重复,图中每个Isolation给出的为两次质谱重复取并集后的结果。
从图中可以看出,基于两次还原氨化反应的氨基化学法将两次实验重复的结果取并集后,共鉴定到264个非冗余的N-糖基化位点(对应256条N-糖肽和147个糖蛋白),而基于一次还原氨化反应的氨基化学法经过同样的实验后,只鉴定到了126个非冗余的N-糖基化位点(对应122条N-糖肽和84个糖蛋白),说明前一种方法显著提高了血清中N-糖基化位点的鉴定覆盖度。将两种方法鉴定到的N-糖基化位点比较后,发现有91个位点被同时鉴定到,如图3c所示,也就是说,基于一次还原氨化反应的氨基化学法鉴定到的位点中有72%(91/126)被基于两次还原氨化反应的氨基化学法鉴定到,体现了本发明所述的基于两次还原氨化反应的氨基化学法的优越性。
结论
本发明发展的基于两次还原氨化反应的氨基化学法可以简便、高效、高通量的鉴定复杂生物样品中的N-连接糖肽,能同时得到对应的N-糖基化位点及其糖 蛋白信息。本发明提供了一种酰肼化学法之外,可供选择的化学法去研究N-糖蛋白质组学。本发明的另一些明显的优点是,氨基二氧化硅微球易购得,在实验室也容易制备,成本较低,使用方便。总之,本发明为N-糖蛋白质组学的研究提供了一种新的化学方法。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于包括轻质、选择性支撑的纺织部件的鞋类物品的部件的制造方法与工艺
- 用于选择性地破坏视频编码中的预测的方法和系统与制造工艺
- 双流准恒包络正交频分复用系统中基于空闲子载波的频偏估计及补偿方法与制造工艺
- 一种可选择性识别Cr3+的金属‑有机框架及其制备方法与制造工艺
- 选择性降低卷烟烟气中CO释放量的负载型烟基功能材料的制备方法及应用与制造工艺
- 一种用于C2H2/CO2和C2H2/CH4高效选择性分离吸附的双重贯穿金属有机框架材料及其制备方法与制造工艺
- 选择性寻求最佳扭矩目标的动力总成及控制方法与制造工艺
- 一种FTO薄膜表面选择性一步制备波纹结构的方法与制造工艺
- 一种干扰上报的方法及装置与制造工艺
- 一种干扰管理的方法及系统与制造工艺