一种蝉花的检测方法与流程
本发明涉及一种中药的检测方法,特别涉及一种蝉花的检测方法。
背景技术:
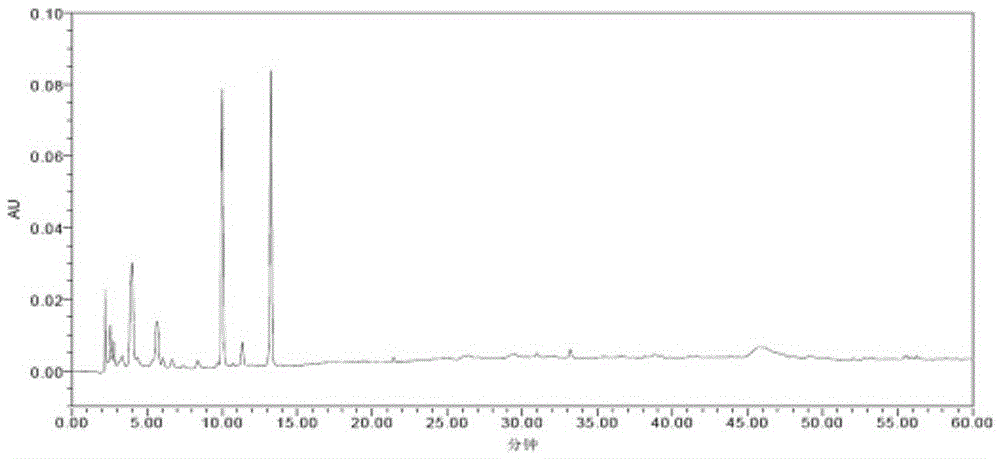
:蝉花(IsariacicadaeMiquel)属于真菌界、子囊菌门、盘菌亚门、粪壳菌纲、肉座菌目、虫草科、棒束孢属(Isaria)。蝉花是我国名贵的中药材,是寄生在蝉(俗称“知了”)上的一种虫草菌。其药用已有1000多年历史,是我国传统的名贵药材之一,具有多方面的药用价值。主要成分有:腺苷、虫草多糖、虫草酸(甘露醇)、虫草素、尿嘧啶、甾醇、生物碱、维生素、无机盐、矿物质元素等。蝉花具有调节人体免疫的功能,提高食欲,促进睡眠,增强自身抗病的能力。在这些成分当中,虫草多糖具有独特的生物活性,具有抗肿瘤、抗菌、抗病毒、抗辐射、抗衰老等功效,免疫调节作用成为研究开发的热点。腺苷能抑制中枢神经元的兴奋性,可以扩张冠状及周围血管、增加冠状动脉血流量、降低血压、减慢心率等作用。腺苷还具有抗血小板聚集、抗辐射和抗肿瘤等作用。不仅如此,蝉花中的活性成分ISP-1具有双向免疫调节活性,可以大大的提高器官移植手术的成功率,对患者的康复也有着明显的积极效果。目前,国内已有一些对腺苷含量测定的报道。如《中华人民共和国药典》2010版第一部及《保健食品检验与评价技术规范》中华人民共和国卫生部2003版均有涉及,但本专利发明人在进行蝉花样品腺苷测定的验证试验时发现上述方法腺苷的提取及处理方法会导致腺苷的提取率偏低且干扰较多。因此本专利对样品的提取及处理方法等进行了改进。改进后腺苷的提取率提高数倍,不仅方法简单方便干扰较少,而且可以适用于蝉花子实体(孢梗束)、蝉花孢子粉、蝉花菌质等蝉花各个部位及其相 关制剂,结果令人满意。技术实现要素:本发明的目的在于提供一种蝉花的检测方法。本发明的目的是通过如下技术方案实现的:一种蝉花的检测方法,该方法采用高效液相色谱法,包括如下步骤:步骤a,色谱条件:以乙腈-磷酸二氢盐溶剂系统为流动相,等度洗脱;步骤b,对照品溶液的制备:取腺苷对照品,加溶剂制成对照品溶液;步骤c,供试品溶液的制备:取蝉花待测品,加溶剂提取制得供试品溶液;和步骤d,测定:分别吸取对照品与供试品溶液,注入液相色谱仪,测定。进一步,步骤a流动相比例为乙腈:磷酸二氢盐溶液=(5-15):(85-95);更进一步,流动相比例为乙腈:磷酸二氢盐溶液=(5-10):(85-90);更进一步,流动相比例为乙腈:磷酸二氢盐溶液=5:95。进一步,步骤a所述磷酸二氢盐溶液浓度为0.02~0.05mol/L;更进一步,为0.04mol/L;更进一步,所述磷酸二氢盐为磷酸二氢钾或磷酸二氢钠。进一步,步骤b所述溶剂为体积分数为20%~50%甲醇水溶液。进一步,步骤b所述对照品溶液的浓度为20~30μg/mL。进一步,步骤c所述提取溶剂为水。进一步,步骤c加水提取后,提取液加入甲醇;更进一步,甲醇加入量为至甲醇含量达到20%~50%;更进一步,至甲醇含量达到30%~50%;更进一步,至甲醇含量达到40%~50%;更进一步,至甲醇含量达到50%;所述百分比为体积百分比。进一步,步骤c所述提取方法为加热提取、回流提取或超声提取。更进一步,步骤c供试品溶液的制备方法为:取蝉花待测品,加入20~30倍量(g/mL)的水超声提取,提取液加甲醇至甲醇含量为50%,过滤,取续滤液即得。进一步,该检测方法的检测波长为200~300nm;更进一步,检测波长为260nm。进一步,该检测方法的流动相流速为0.5~2mL/min-1,柱温30~40℃;更进一步,该检测方法的流动相流速为1mL/min-1,柱温35℃。进一步,步骤c所述蝉花待测样品为蝉花子实体、蝉花孢子粉或蝉花菌质中的任意一种,或以任意一种上述物质为原料经提取得到的提取物,或提取物经精制纯化得到的有效部位,或提取物/有效部位按常规制剂工艺制成的临床上可接受制剂。其中,所述提取方法为本领域常规提取方法,如浸渍提取、超声提取、回流提取、渗漏提取等;所述精制纯化工艺包括萃取、过大孔树脂柱、凝胶柱、反向色谱柱等;所述制剂包括胶囊剂、片剂、颗粒剂、散剂、口服液、丸剂等制剂。附图说明图1流动相为甲醇-水梯度洗脱的色谱图;图1A:流动相为甲醇-水梯度洗脱的对照品的液相色谱图;图1B:流动相为甲醇-水梯度洗脱的供试品的液相色谱图;图2流动相为甲醇-水梯度洗脱的色谱图;图2A:流动相为甲醇-水梯度洗脱的对照品的液相色谱图;图2B:流动相为甲醇-水梯度洗脱的供试品的液相色谱图;图3流动相为甲醇-水(1:9)等度洗脱的色谱图;图3A:流动相为甲醇-水(1:9)等度洗脱的对照品的液相色谱图;图3B:流动相为甲醇-水(1:9)等度洗脱的供试品的液相色谱图;图4流动相为甲醇-乙腈-水(5:5:90)等度洗脱的色谱图;图4A:流动相为甲醇-乙腈-水(5:5:90)等度洗脱的对照品的液相色谱图;图4B:流动相为甲醇-乙腈-水(5:5:90)等度洗脱的供试品的液相色谱图;图5流动相为乙腈-水梯度洗脱的色谱图;图5A:流动相为乙腈-水梯度洗脱的对照品的液相色谱图;图5B:流动相为乙腈-水梯度洗脱的供试品的液相色谱图;图6流动相为乙腈-0.04mol/L磷酸二氢钾溶液(5:95)等度洗脱的色谱图;图6A:流动相为乙腈-0.04mol/L磷酸二氢钾溶液(5:95)等度洗脱的对照品的液相色谱图;图6B:流动相为乙腈-0.04mol/L磷酸二氢钾溶液(5:95)等度洗脱的供试品的液相色谱图;图7标准曲线图;图8实施例8蝉花子实体的色谱图;图9实施例8蝉花孢子粉的色谱图;图10实施例8蝉花菌质的色谱图;图11~19实施例9、13~20的色谱图实验例1流动相的筛选1、仪器和材料1.1仪器WatersSymmetryC185μm4.6*250mm;Waters高效液相色谱仪(1525二元高压泵;2998二极管阵列检测器;2707自动进样器;Empower2操作软件)。SB25-12DT超声波清洗仪(宁波新芝生物科技股份有限公司);AL104型电子天平(梅特勒-托利多仪器上海有限公司);MilliporeSimplicity超纯水仪(美国Millipore公司);H1650台式高速离心机(湘仪离心机仪器有限公司);1.2试剂乙腈(HPLC级,4L/瓶,LOT116824,Fisher);甲醇(HPLC级,4L/瓶,LOT120511,Fisher);甲醇(AR,500mL/瓶,20120627,国药集团化学试剂有限公司);无水乙醇(AR,500mL/瓶,20120111,国药集团化学试剂有限公司);磷酸(AR,500mL/瓶,T20100416,国药集团化学试剂有限公司);磷酸二氢钾(AR,500g/瓶,F20100413,国药集团化学试剂有限公司);腺苷标准品(20mg/支,110879-200202,中国食品药品检定研究院);屈臣氏蒸馏水(4.5L/瓶,20111116,上海加州斯帕克林饮用水有限公司);1.3实验材料蝉花子实体[所述蝉花已在中国微生物菌种保藏管理委员会普通微生 物中心(简称CGMCC)注册保藏,保藏号为CGMCCNo.3453]。2、方法与结果2.1色谱及检测条件流动相:①甲醇-水梯度洗脱,甲醇10%→100%;②甲醇-水梯度洗脱,甲醇10%→22%;③甲醇-水(1:9)等度洗脱;④甲醇-乙腈-水(5:5:90)等度洗脱;⑤乙腈-水梯度洗脱,乙腈5%→100%;⑥乙腈-0.04mol/L磷酸二氢钾溶液(5:95)等度洗脱;进样量:10μL;流速:1mL/min;柱温:35℃;检测波长:260nm。2.2对照品溶液的制备:取腺苷对照品适量,精密称定,加50%甲醇水溶液制成25μg/mL的溶液,即得。2.3供试品溶液的制备:取蝉花子实体粉末0.2g,精密称定,精密加入纯水10mL,超声(40KHz)处理30分钟,取出,10000转/分钟离心3分钟,取上清液过0.22μm微孔滤膜,取续滤液,即得。2.4测定法:分别吸取相同体积的对照品与供试品溶液,注入液相色谱仪,测定,记录色谱图。结果见图1-6及表1。表1各流动相系统下的腺苷分离度流动相附图洗脱时间分离度对称因子理论塔板数①图11h---②图230min1.61.111.4×104③图330min1.91.099.1×103④图41h---⑤图51h---⑥图615min3.61.128.4×103考察结果表明,甲醇-水流动相系统:甲醇10%→100%梯度洗脱分离度差;甲醇10%→22%梯度洗脱和甲醇-水(1:9)等度洗脱,洗脱时间均为30min,分离度分别为1.6和1.9,基本满足分离度的要求;乙腈-水流动相系统,各组分过早被洗脱,该系统梯度和等度洗脱均不可行;乙腈-磷酸二氢钾溶液(5:95)流动相系统,洗脱时间是15min,分离度3.6,显著高于甲醇-水流 动相系统,洗脱时间少于甲醇-水流动相系统,因此确定乙腈-磷酸二氢钾溶液为最佳流动相系统。实验例2方法学考察1、仪器和材料同实施例1。2、方法与结果2.1色谱及检测条件流动相:乙腈-0.04mol/L磷酸二氢钾(5:95)等度洗脱;进样量:10μL;流速:1mL/min;柱温:35℃;检测波长:260nm。2.2对照品溶液的制备:取腺苷对照品适量,精密称定,加50%甲醇水溶液制成25μg/mL的溶液,即得。2.3供试品溶液的制备:取0.2g蝉花子实体粉末,精密称定,置20mL具塞试管,精密加入5mL蒸馏水,超声(40KHz)处理30分钟,取出,立即精密加入5mL甲醇,混匀,过0.22μm微孔滤膜,取续滤液,即得。2.4测定法:分别吸取相同体积的对照品与供试品溶液,注入液相色谱仪,测定,记录色谱图。2.5精密度考察2.5.1日内精密度精密称量0.4g、0.5g、0.6g样品粉末各4份,共12份,按2.3项下制备供试品溶液并测定腺苷含量。用3个浓度12个测定结果评价日内精密度。12个测定结果平均值1.065mg/g,RSD%为1.92%<2%,说明日内重复性良好。2.5.2日间精密度精密称量0.4g、0.5g、0.6g样品粉末各3份,按2.3项下制备供试品溶液并测定腺苷含量,重复做3次(非连续3天,但在半月内)。用3个浓度27个测定结果评价3次日间精密度。27个测定结果平均值1.088mg/g,RSD%为1.84%<2%,说明日间重复性良好。2.6稳定性考察精密称量0.4g、0.5g、0.6g样品粉末各3份,共9份,按2.3项下制备供试品溶液,分别于室温放置0小时、60小时和7天后,测定腺苷含量,用3个浓度的27个测定结果评价供试品溶液稳定性。27个测定结果结果的平均值1.110mg/g,RSD%为2.0%,说明溶液在7天内稳定性良好。2.7线性关系考察精密称量腺苷标准品21.0mg,用50%甲醇溶液溶解、稀释、定容至20mL,得1050μg/mL标准溶液,分别精密移取适量1050μg/mL标准溶液,加50%甲醇溶液分别配制成5.25μg/mL、10.5μg/mL、21.0μg/mL、31.5μg/mL、42.0μg/mL、52.5μg/mL、78.75μg/mL和105.0μg/mL对照品溶液,注入高效液相色谱仪测定峰面积积分值。以对照品溶液浓度(μg/mL)为横坐标X,峰面积积分值(微伏·秒)为纵坐标Y,绘制标准曲线(见图7),得回归方程为Y=3.04×104X-5.62×103,R2=0.9999,说明在5.25μg/mL~105μg/mL范围内,腺苷溶液浓度与峰面积积分值呈良好的线性关系。2.8加样回收率精密称量腺苷标准品16.3mg,用50%甲醇溶解、稀释、定容至20mL,得0.815mg/mL腺苷标准溶液。精密移取0.815mg/mL腺苷标准溶液0.5mL,用50%甲醇溶解、稀释、定容至20mL,得20.4μg/mL腺苷标准溶液。精密称量0.4g、0.5g、0.6g样品粉末各3份,共9份,按供试品溶液制备方法制备3个浓度的供试品溶液,9份溶液各精密移取1mL,精密加入20.4μg/mL腺苷标准溶液1mL,混匀,测定腺苷含量。取1.065mg/g为供试品已知腺苷含量,根据回收率计算公式计算高中低3个浓度溶液的回收率。精密称量0.4g、0.5g、0.6g样品粉末各3份,共9份,每份加入0.815mg/mL腺苷标准溶液0.65mL,按待验证方法测定腺苷含量。取1.065mg/g为供试品已知腺苷含量,根据回收率计算公式计算高中低3个浓度的回收率。(C-A)/B*100%式中A:供试品所含被测成分量;B:加入对照品量;C:实测值。供试品溶液加样回收率结果:低浓度平均回收率103.0%,中浓度平均 回收率99.8%,高浓度平均回收率100.3%,总平均回收率101.0%,RSD%为1.71%,回收率在99%~103%,说明不考虑样品提取过程的情况下,测定方法准确度良好。供试品加样回收率结果:低浓度平均回收率99.2%,中浓度平均回收率102.2%,高浓度平均回收率98.0%,总平均回收率99.8%,RSD%为2.16%,回收率在98%~102%,说明待验证方法准确度较好。上述验证表明,本发明腺苷含量测定方法,适用于蝉花子实体腺苷含量测定,方法准确、可靠,能获得被检测样品的实际数据和结果。具体实施方式实施例1一种用于蝉花检测的样品制备方法,该方法包括如下步骤:取蝉花子实体粉末0.2g,精密称定,置20mL具塞试管,精密加入5mL蒸馏水,超声(40KHz)处理30分钟,取出,立即精密加入5mL甲醇,混匀,过0.22μm微孔滤膜,取续滤液,即得。实施例2与实施例1样品制备方法基本相同,区别在于精密加入4.5mL甲醇,提取方法为回流提取30min。实施例3与实施例1样品制备方法基本相同,区别在于精密加入4mL甲醇。实施例4与实施例1样品制备方法基本相同,区别在于精密加入3mL甲醇。实施例5与实施例1样品制备方法基本相同,区别在于精密加入2mL甲醇。实施例6与实施例1样品制备方法基本相同,区别在于样品原料为蝉花孢子粉。实施例7与实施例1样品制备方法基本相同,区别在于样品原料为蝉花菌质。实施例8按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量:色谱及检测条件:SymmetryC18(Waters,4.6mm×250mm,5μm,L.N.0264313291);以乙腈-0.04mol/L磷酸二氢钾(5:95)为流动相等度洗脱;流速1.0mL/min;检测波长260nm;柱温35℃;对照品溶液的制备:取腺苷对照品适量,精密称定,加50%甲醇水溶液制成25μg/mL的溶液;测定:分别精密吸取对照品溶液与供试品溶液各10μL,注入高效液相色谱仪,测定,即得。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备蝉花子实体供试品溶液色谱图见图8;按实施例6方法制备的蝉花孢子粉供试品溶液色谱图见图9;按实施例7方法制备的蝉花菌质供试品溶液色谱图见图10。图8~10表明本发明样品制备方法适用于蝉花子实体、孢子粉、菌质中腺苷的检测。实施例9按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,检测条件、对照品溶液制备和测定方法与实施例8相同,区别在于流动相6:94的乙腈-0.04mol/L磷酸二氢钾;制备对照品溶液所用溶剂为45%甲醇水溶液。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备供试品溶液色谱图见图11。图11表明流动相比例调整为6:94不影响腺苷色谱峰的分离效果,能够实现对本发明对腺苷的检测。实施例10按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测 样品中腺苷的含量,检测条件、对照品溶液制备和测定方法与实施例8相同,区别在于流动相8:92的乙腈-0.04mol/L磷酸二氢钾;制备对照品溶液所用溶剂为40%甲醇水溶液。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。实施例11按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,检测条件、对照品溶液制备和测定方法与实施例8相同,区别在于流动相10:90的乙腈-0.04mol/L磷酸二氢钾;制备对照品溶液所用溶剂为30%甲醇水溶液。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。实施例12按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,检测条件、对照品溶液制备和测定方法与实施例8相同,区别在于流动相15:85的乙腈-0.04mol/L磷酸二氢钾;制备对照品溶液所用溶剂为20%甲醇水溶液。实施例13按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,色谱条件、对照品溶液制备和测定方法与实施例8相同,区别在于检测波长为255nm。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备供试品溶液色谱图见图12。图12表明检测波长调整为255nm不影响腺苷色谱峰的分离效果,能够实现本发明对腺苷的检测。实施例14按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,色谱条件、对照品溶液制备和测定方法与实施例8相同,区别在于检测波长为265nm。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备供试品溶液色谱图见图13。图13表明检测波长调整为265nm不影响腺苷色谱峰的分离效果,能够实现本发明对腺苷的检测。实施例15按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,色谱条件、对照品溶液制备和测定方法与实施例8相同,区别在于流速为1.2mL/min。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备供试品溶液色谱图见图14。图14表明流速调整为1.2mL/min不影响腺苷色谱峰的分离效果,能够实现本发明对腺苷的检测。实施例16按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,色谱条件、对照品溶液制备和测定方法与实施例8相同,区别在于流速为0.8mL/min。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备供试品溶液色谱图见图15。图15表明流速调整为0.8mL/min不影响腺苷色谱峰的分离效果,能够实现本发明对腺 苷的检测。实施例17按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,色谱条件、对照品溶液制备和测定方法与实施例8相同,区别在于柱温为30℃。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备供试品溶液色谱图见图16。图16表明柱温调整为30℃不影响腺苷色谱峰的分离效果,能够实现本发明对腺苷的检测。实施例18按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,色谱条件、对照品溶液制备和测定方法与实施例8相同,区别在于柱温为40℃。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备供试品溶液色谱图见图17。图17表明柱温调整为40℃不影响腺苷色谱峰的分离效果,能够实现本发明对腺苷的检测。实施例19按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,色谱条件、对照品溶液制备和测定方法与实施例8相同,区别在于色谱柱型号为ZORBAXEclipseXDB-C18(Agilent,4.6mm×250mm,5μm)。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备供试品溶液色谱图见图18。图18表明色谱柱型号的改变不影响腺苷色谱峰的分离效果,能够实现本发明对腺苷的检测。实施例20按实施例1~7任一方法制备供试品溶液,采用高效液相色谱法检测样品中腺苷的含量,色谱条件、对照品溶液制备和测定方法与实施例8相同,区别在于色谱柱型号为SymmetryshieldRP18(Waters,4.6mm×250mm,5μm)。测定结果显示实施例1~7任一方法制备的供试品溶液采用本实施例高效液相色谱法进行测定,其腺苷色谱峰峰形良好,无拖尾,无干扰峰,能够实现对腺苷的检测。其中,按实施例1方法制备供试品溶液色谱图见图19。图19表明色谱柱型号的改变不影响腺苷色谱峰的分离效果,能够实现本发明对腺苷的检测。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1