用于鉴定孕酮受体亚型的系统及方法与流程
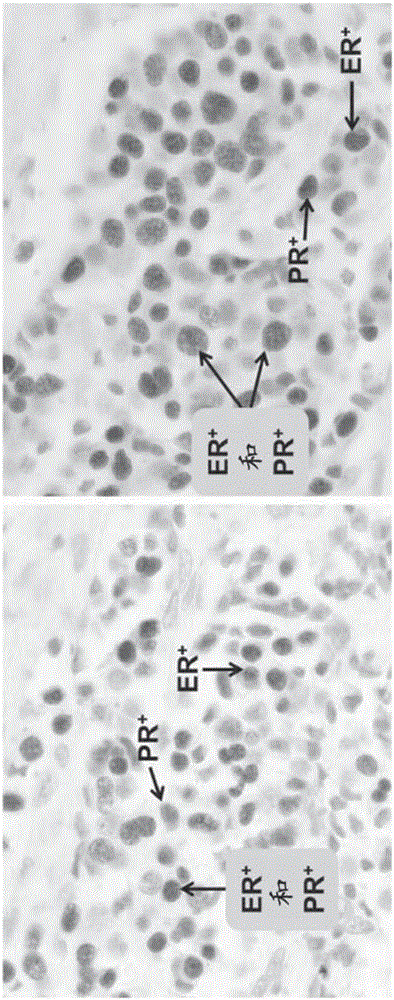
本申请要求2014年4月8日提交的美国临时专利申请系列第61/976,872号的优先权。以上提及的申请通过引用如全文被重述一样并入本文。三阴性乳腺癌(TNBC)指不表达雌激素受体(例如,雌激素受体α(ERα))、孕酮(progesterone)受体(PR)及HER2/neu的乳腺癌(BC)肿瘤。患有TNBC的患者对用于BC的目前治疗(例如,激素治疗和抗-HER2治疗)的响应有限。鉴于对于TNBC的有限的治疗选择,诊断准确度在确定用于患者的适当的治疗中是重要的考虑因素。PR已被用作用于雌激素受体(ER)的替代标志物,指示未检测到的ER的存在。目前的诊断工具尚未针对PR作为用于直接治疗性治疗的靶。孕酮受体(PR)属于类固醇受体家族(核受体家族的亚组),并且是孕酮作用的中介体(mediator)。PR是在激素调控的组织中起关键作用的配体活化的转录因子,并且在人类中作为两种主要形式;孕酮受体A(PRA)和孕酮受体B(PRB)来表达。在常规的乳腺癌组织样本的免疫组织化学(IHC)测试中,识别两种PR同种型(例如,PR亚型A(PRA)和PR亚型B(PRB))所共有的表位的双特异性抗体(Ab)被用来确定PR的存在。因此,在某些情况下,尽管(1)人类乳腺癌的多样化以及(2)可避开用单个双特异性抗-PR抗体的检测的PRA表位和PRB表位的存在,使用目前临床诊断工具确定PR状态依赖于识别PRA和PRB两者的单个双特异性抗体。在结合的孕激素(progestin)配体,诸如孕酮的存在下,PR在特定位点被磷酸化,成为二聚体,与许多不同的细胞成分(例如,p300及类固醇受体共激活因子)形成复合体,并与被称为孕酮应答元件(PRE)的特定DNA序列结合,以引发DNA转录成RNA。已知PR的这些复杂的生物调制在癌症中是异常的,在癌症中,例如,异常的PR磷酸化可经由备用的生物学途径发生。因此,PRA和PRB在乳腺癌及其他癌症中被差异改变,且针对被以特定方式修饰的PR同种型的双特异性抗体将缺失其对于PRA或PRB的灵敏度和特异性似乎是合理的。因此,标准的诊断方法可能未能检测到PRA和PRB,导致TNBC的不正确或错误分类。与正常乳腺组织相比之下,PRA和PRB表达的水平不以等比存在。通过免疫印迹分离的PR同种型的相对表达似乎是恶性肿瘤中的预示(Hopp等,ClinCancerRes.2004Apr15;10(8):2751-60))。,肿瘤可以是在PRA和PRB表达方面异质的-相同肿瘤中的不同细胞可表达不同的PR亚型。(Mote等,ErnstScheringFoundationProceedings,第1卷.77-107页,2008).这些恶性细胞还可差异表达ERα(Zukiwski等,ProcASCO,摘要号118076,2013),但ERα和PR在单独癌细胞中的重叠表达是低的。本文提及的出版物通过引用以其整体并入。每个PR同种型具有不同的生理作用。PR具有中心DNA结合结构域和羧基末端配体结合结构域。当与PRA相比时,PRB具有在其N-末端处的另外的164个氨基酸。两种同种型在其他方面相同。(BreastCancerRes2002,4:187-190)。在多种条件下,同种型是磷酸化的,如在图1中所示。对于类固醇受体的标准测试已显示原发性BC通常是ERα阳性的和PR阳性的。PR常规地用已被选择以检测PRA和PRB两者的双特异性抗体测定。通过该方法,20%的ERα-阳性的BC是PR阴性的,而约5%的PR-阳性的BC是ERα阴性的。三阴性BC被定义为ERα、PR和HER2/neu阴性。在通过标准IHC测试技术的原理中,TNBC是PRA和PRB两者阴性的。三阴性乳腺癌表型确定的准确度部分地取决于抗体检测PRA和PRB两者表达的能力。存在指向PRB可能在乳腺癌中被独特改变,且PRA和PRB两者用单个抗体的常规检测可能错过PRA或PRB的改变的表达的事实的生物学因素。取决于抗体的灵敏度/特异性,真正的三阴性BC表型可能避开使用一个单独的Ab检测PRA表位和PRB表位两者的检测,这可导致向患者提供不正确信息。概述一方面提供了鉴定孕酮受体阳性肿瘤的方法,所述方法通过以下进行:获得疑似是来自患者的致瘤的或癌性的组织样品,使用用于检测PRA的至少一种第一抗体和用于检测PRB的至少一种第二抗体鉴定该组织样品中的孕酮受体阳性细胞,并且如果PRA的存在或PRB的存在被检测到则确定该组织样品是孕酮受体阳性的。其他方面提供了鉴定三阴性表型的方法,所述方法通过以下进行:获得疑似是来自患者的致瘤的或癌性的BC组织样品,使用用于检测PRA的至少一种第一抗体和用于检测PRB的至少一种第二抗体鉴定该组织样品中的孕酮受体阳性细胞,使用用于检测雌激素受体的至少一种抗体检测雌激素受体α(ERα)的存在,使用用于确定HER2/neu的存在的至少一种经过验证的测试(例如,免疫组织化学、原位杂交)检测HER2/neu的存在,并且如果PRA、PRB、ERα及HER2/neu的存在未被检测到则确定该组织样品是三阴性表型。又其他方面提供了抑制易受抗孕激素的生长抑制影响的肿瘤的生长的方法,所述方法通过以下进行:获得疑似是来自患者的致瘤的或癌性的组织样品,使用用于检测PRA的至少一种第一抗体和用于检测PRB的至少一种第二抗体鉴定该组织样品中的孕酮受体阳性细胞,如果PRA的存在或PRB的存在被检测到则确定该组织样品是孕酮受体阳性的,如果PRA的存在或PRB的存在被检测到则该组织样品是孕酮受体阳性的,并且如果该组织样品被确定为孕酮受体阳性的则施用抗-内分泌疗法(例如,抗孕激素)。另外的方面提供了一种用于将肿瘤分类为孕酮阳性的系统,所述系统包含组织样品以及能够检测PRA的至少一种第一抗体或抗体结合片段和能够检测PRB的至少一种第二抗体或抗体结合片段,其中该至少一种第一抗体或抗体结合片段和该至少一种第二抗体或抗体结合片段被用来确定肿瘤是否为PRA阳性、或PRB阳性、或者PRA阳性和PRB阳性两者。另一个方面提供了一种用于鉴定孕酮阳性肿瘤的试剂盒,所述试剂盒包含能够检测PRA的至少一种第一抗体或抗体结合片段和能够检测PRB的至少一种第二抗体或抗体结合片段。附图简述当结合其中标记字符标识相应术语的附图考虑时,本公开内容的特征和性质将依据下文陈述的详细描述变得更明显。图1示出了PRA和PRB同种型受体结构域以及翻译后修饰;且图2示出了乳腺癌组织中PRA和PRB与雌激素受体α的双重染色。详细描述以下公开的方法及装置可以既被一般地又被特定地描述。应该注意,当描述特定于一个方面时,该方面不应该以任何方式限制本文描述的方面的范围。本文引用的所有参考文献在此通过引用以其整体并入。在一个方面,两种同种型-特异性PRAb被用来充分表征PR状态。在该实例中,具有可得的临床和实验室测试数据的520个存档的BC样本从OscarLambretCancerCenter,Lille,France获得。HER2状态先前已被确定。IHC使用抗-ERα、抗-PRA和抗-PRBAb来进行。在该实例中,ERα和PR阳性肿瘤被定义为,使用指示的抗体具有≥1%染色的肿瘤细胞的肿瘤。对归档的BC组织的3-4μm切片进行IHC。使用标准方法学(例如,http://www.dako.com/us/ar38/p105760/prod_products.htm)制备用于免疫染色的样品。产生标准的苏木精,以用于IHC。通过用同种型对照小鼠IgG1或用单独的抗体稀释液(洗涤缓冲液阴性对照)代替一抗获得阴性对照。获得520个归档的乳腺癌肿瘤并再测试ERα、PRA和PRB。71个病例通过再测试被确定是ERα阴性的,并且根据患者记录为HER2阴性。还用2种PR双特异性抗体测试71个Erα阴性和HER2阴性的病例,并且这些病例中的50个具有可用于用多个抗体完整测试的足够的组织。表1-用于IHC的抗体抗体克隆浓度PRANovacastra161:500/1:100PRBNovacastraSANS271:500/1:100双特异性PgR6361:50双特异性1A61:100在测试的双特异性抗体中,比起用1A6抗体,Pg636在品质上具有更好的染色,并且更多BC被鉴定为PR阳性(36%对32%)。相对于Pg636或1A6的PRA和PRB的检测呈现于表2和3中。发现50个病例中的27个使用所有的PR抗体都是“真正的”三阴性。在本实例中,双特异性抗体提供了与单独的PRA和PRB抗体相同的结果。50个病例中的13个通过所有的抗体测试都为PR阳性,然而,50个病例中的10个对于PRA、PRB、Pg636或1A6显示不一致的结果。表2:在50个BC样本中,使用双特异性抗体对PRA同种型特异性抗体的PR阳性样品的列联表如下文所示,用PRA同种型特异性抗体(PRANovacastra16)检测的PRA阴性样品和PRA阳性样品的百分比在括号内示出,而用Pg636和1A6双特异性抗体检测的PR阴性和阳性样品的数目在括号外示出。表3:在50个BC样本中,使用双特异性抗体对PRA同种型特异性抗体的PR阳性的列联表如下文所示,用PRA同种型特异性抗体(PRANovacastraSANS27)检测的PRB阴性样品和PRB阳性样品的百分比在括号内示出,而用Pg636和1A6双特异性抗体检测的PR阴性和阳性样品的数目在括号外示出。表4-来自用不同PR抗体的测试的不一致的数据P6361A6PRAPRB阴性阴性阴性阳性阴性阴性阴性阳性阴性阴性阴性阳性阴性阴性阳性阳性阴性阳性阳性阴性阳性阴性阴性阴性阳性阴性阳性阴性阳性阳性阴性阴性阳性阳性阴性阴性阳性阳性阳性阴性表4示出了用不同PR抗体测试具有不一致的数据的10个病例。如下文在表4中所示,使用双特异性抗体(Pg636和1A6)被分类为PR阴性的样品使用针对PRA和针对PRB的同种型特异性抗体被分类为PRB阳性、PRA阳性、或PRB阳性和PRA阳性两者。取决于用于IHC测试的PR抗体,在测试的50个样品中,37个可潜在地被分类为三阴性。十个病例具有不一致的PR结果。在一个方面,PRA和PRB同种型特异性抗体的使用可揭示是PR阳性但在之前使用双特异性抗体被鉴定为三阴性表型的那些BC病例。在一个方面,由PRB(同种型特异性)和Pg636(双特异性)捕获的信息是不一致的。例如,当Pg636指示样品是PR阴性的时,该样品在5个病例的4个中是PRB阳性的。当Pg636指示样品是PR阳性的时,该样品在5个病例的5个中是PRB阴性的。因此,由双特异性抗体提供的诊断信息是不正确的。在另一个方面,同种型特异性PR抗体的使用鉴定了使用PR双特异性抗体被分类为PR阴性并因此具有三阴性表型的PR阳性BC组织样品。因此,PRA和PRB同种型特异性抗体的使用是检测使用双特异性抗体可能未被检测到的PR阳性肿瘤的重要的方法。因此,患有先前未被检测到的PR阳性组织样品的患者可适合于用抗内分泌疗法,包括抗孕激素的治疗。表5-患者群体的PR和ER状态如在表5中所示,确定了来自OscarLambretCancerCenter,Lille,France440的520名患者的PR和ER状态。如果样品是PRA或PRB阳性的,则该样品被认为是PR阳性的。在359个ER阳性病例中,41个(9%)是PR阴性的-比使用双特异性抗体预期的20%少了11%。11%代表使用双特异性抗体被确定为PR阴性但事实上通过使用PRA和PRB抗体被确定为PR阳性的样品。因此,11%来自可适合于用抗内分泌疗法,包括抗孕激素,治疗的患者。使用双特异性抗体,这些患者将不被鉴定为PR阳性,并且因此将具有关于治疗选择的不完整的信息。在一个方面,提供了将抗孕激素施用至易受用抗孕激素的治疗影响的患者的方法。在该方面,乳腺组织样品从具有乳腺癌的患者获得,在该组织样品中的孕酮受体阳性细胞使用用于检测PRA的至少一种第一抗体和用于检测PRB的至少一种第二抗体来鉴定,如果PRA的存在或PRB的存在被检测到,则该组织样品被鉴定为孕酮受体阳性。ERα的存在使用用于检测雌激素受体的至少一种抗体来确定,并且如果该组织样品被确定为孕酮受体阳性和雌激素受体阳性,则抗孕激素被施用至患者。除非另有指明,如本文使用,术语“抗体(antibody)”或“抗体(antibodies)”指结合特定抗原的免疫球蛋白,并且包括,但不限于,多克隆抗体、单克隆抗体、嵌合抗体或人源化抗体、Fab片段或结合抗原的至少一部分的任何其他片段。“抗体(Antibodies)”包括任何类的抗体或免疫球蛋白,包括,但不限于,呈任何构型的IgG、IgA、IgM、IgD、IgE以及分泌的免疫球蛋白(例如,两个相同重链和两个轻链、单链抗体、二链抗体)。本文描述的方面提供了鉴定孕酮受体阳性肿瘤的方法,所述方法通过以下进行:获得疑似是来自患者的致瘤的或癌性的组织样品,使用用于检测PRA的至少一种第一抗体和用于检测PRB的至少一种第二抗体鉴定该组织样品中的孕酮受体阳性细胞,并且如果PRA的存在或PRB的存在被检测到则确定该组织样品是孕酮受体阳性的。另外的方面提供了鉴定三阴性表型乳腺癌肿瘤的方法,所述方法通过以下进行:获得疑似是来自患者的致瘤的或癌性的组织样品,使用用于检测PRA的至少一种第一抗体和用于检测PRB的至少一种第二抗体鉴定该组织样品中的孕酮受体阳性细胞,使用用于检测雌激素受体α的至少一种抗体检测雌激素受体α的存在;使用用于确定HER2/neu的存在的至少一种经过验证的测试检测HER2/neu的存在,并且如果PRA、PRB、ERα;雌激素受体及HER2/neu的存在未被检测到则确定该组织样品是三阴性表型。又另外的方面提供了用于将肿瘤分类为孕酮阳性的系统,所述系统包含组织样品以及能够检测PRA的至少一种第一抗体和能够检测PRB的至少一种第二抗体,其中该至少一种第一抗体和该至少一种第二抗体被用来确定肿瘤是否为PRA阳性、或PRB阳性、或者PRA阳性和PRB阳性两者。还提供了用于鉴定孕酮阳性肿瘤的试剂盒,所述试剂盒包含能够检测PRA的至少一种第一抗体和能够检测PRB的至少一种第二抗体。在该方面,试剂盒还可包含检测PRA和PRB所需要的试剂。在另一个方面,用于本文描述的方面的组织样品从乳腺组织获得。在另一个方面,第一抗体和第二抗体是同种型特异性抗体(例如,PRANovacastra16、PRBNovacastra16)。另外的方面提供了将抗孕激素施用至易受抗内分泌疗法治疗影响的患者的方法,所述方法通过以下进行:获得来自具有乳腺癌的患者的BC样品,使用用于检测PRA的至少一种第一抗体和用于检测PRB的至少一种第二抗体鉴定该组织样品中的孕酮受体阳性细胞,如果PRA的存在或PRB的存在被检测到则确定该组织样品是孕酮受体阳性的,使用用于检测雌激素受体的至少一种抗体检测雌激素受体α的存在,并且如果该组织样品被确定为是孕酮受体阳性的和雌激素受体α阳性的则将抗-内分泌疗法施用至患者。在该方面,抗内分泌疗法包括抗孕激素。另外的方面提供了抑制易受抗孕激素的生长抑制影响的肿瘤的生长的方法,所述方法通过以下进行:获得疑似是来自患者的致瘤的或癌性的组织样品,使用用于检测PRA的至少一种第一抗体和用于检测PRB的至少一种第二抗体鉴定该组织样品中的孕酮受体阳性细胞,如果PRA的存在或PRB的存在被检测到则确定该组织样品是孕酮受体阳性的,并且如果该组织样品被确定为是孕酮受体阳性的则将抗-孕激素施用至患者。在另一个方面,抗孕激素选自由以下组成的组:奥那司酮(onapristone)、洛那立生(lonaprisan)、米非司酮(mifepristone)、PF-02413873、特拉司酮(telapristone)、利洛司酮(lilopristone)、ORG2058、apoprisnil、乌利司他(ulipristal)、ZM172406、ZM150271、ZM172405和阿来司酮(aglepristone)。奥那司酮,(例如,(8S,11R,13R,14S,17S)-11-[4-(二甲基氨基)苯基]-17-羟基-17-(3-羟丙基)-13-甲基-1,2,6,7,8,11,12,14,15,16-十氢环戊二烯并[a]菲-3-酮)具有以下化学结构:其他抗孕激素包括:孕前3-(6,6-乙烯-17B-羟基-3-氧代-17A-孕甾-4-烯-17A-YL)丙酸G-内酯、3-(6,6-乙烯-17.β.-羟基-3-氧代-17.α.-孕甾-4-烯-17.α.-基)丙酸.γ.-内酯以及以下:米非司酮(10S,11S,14S,15S,17R)-17-[4-(二甲基氨基)苯基]-14-羟基-15-甲基-14-(丙-1-炔基-1-基)四环[8.7.0.0^{2,7}.0^{11,15}]十七-1,6-二烯-5-酮利洛司酮(11-β,17-β,17(z))-丙基);雌甾-4,9-二烯-3-酮、11-(4-(二甲基氨基)苯基)-17-羟基-17-(3-羟基-1-p;11β-[4-(二甲基氨基)苯基]-17β-羟基-17-[(Z)-3-羟基-1-丙烯基]雌甾-4,9-二烯-3-酮ORG2058(8R,9S,10R,13S,14S,16R,17S)-16-乙基-17-(2-羟基乙酰基)-13-甲基-2,6,7,8,9,10,11,12,14,15,16,17-十二氢-1H-环戊二烯并[a]菲-3-酮洛那立生(8S,11R,13S,14S,17S)-11-(4-乙酰基苯基)-17-羟基-13-甲基-17-(1,1,2,2,2-五氟乙基)-1,2,6,7,8,11,12,14,15,16-十氢环戊二烯并[a]菲-3-酮Asoprisnil(8S,11R,13S,14S,17S)-11-[4-[(E)-肟基甲基]苯基]-17-甲氧基-17-(甲氧基甲基)-13-甲基-1,2,6,7,8,11,12,14,15,16-十氢环戊二烯并[a]菲-3-酮乌利司他(8S,11R,13S,14S,17R)-17-乙酰基-11-[4-(二甲基氨基)苯基]-17-羟基-13-甲基-1,2,6,7,8,11,12,14,15,16-十氢环戊二烯并[a]菲-3-酮PF-024138734-[3-环丙基-1-(甲磺酰基甲基)-5-甲基-1H-吡唑-4-基]氧基,-2,6-二甲基苄腈阿来司酮(8S,11R,13S,14S,17R)-11-(4-二甲基氨基苯基)-17-羟基-13-甲基-17-[(Z)-丙-1-烯基]-1,2,6,7,8,11,12,14,15,16-十氢环戊二烯并[a]菲-3-酮:另外的抗孕激素包括以下:ZM172406–(R)-N-(3-氯-4-氰基苯基-3,3,3-三氟-2-羟基-2-甲基丙酰胺:ZM172405–(S)-N-(3-氯-4-氰基苯基)-3,3,3-三氟-2-羟基-2-甲基丙酰胺:ZM150271-N-(3-氯-4-氰基苯基)-3,3,3,-三氟-2-羟基-2-甲基丙酰胺:在另外的方面,抗孕激素可以以每日约10mg至约200mg的量被施用至患者。任选地,也可将抗肿瘤化合物(例如,依维莫司、曲妥单抗、TM1-D、抗-HER2药物、贝伐单抗、紫杉醇(paclitaxel)、多西他赛(docetaxel)、紫杉烷类、多柔比星(doxorubicin)、脂质体多柔比星、聚乙二醇化脂质体多柔比星、蒽环类、蒽二酮(anthracenediones)、卡铂、顺铂、5-FU、吉西他滨、环磷酰胺、抗雌激素、选择性雌激素受体调节剂、芳香酶抑制剂和抗雄激素)在用抗孕激素治疗的同时、之前或之后施用至患者。实施例实施例1设计半定量PR/APRIHC测定来鉴定在赘生组织和周围正常组织中的孕酮受体(PR)和活化的孕酮受体(APR,如通过聚集体PR染色明显的)表达,该赘生组织和周围正常组织被福尔马林固定和石蜡包埋(FFPE),以用于组织学评价。提议的测定将:1)检测位于表达PR的细胞的细胞质和细胞核中的PR-A和PR-B同种型两者以及2)通过评价亚核定位来区分这些受体的活化的和未活化的形式。已开发了利用FFPE原发性子宫内膜样癌样本来评价和分析PR的亚核分布的IHC技术。在该测定中使用对应于PR-A和PR-B的两种抗-PR抗体;分别为Novocastra克隆16和Novocastra克隆SAN27。技术和试剂两者形成提议的IVD的基础。将对通过手术切除或活组织检查从各个单独的患者获得的三个单独的切片机肿瘤切片进行PR/APR的检测和分析。一个切片机切片用于两种抗-PR抗体(PR-A和PR-B)以及同种型对照抗体的每个。这两种抗-PR抗体都结合其各自在正常细胞和赘生细胞两者的细胞核中的呈活化和非活化形式两者的PR靶。由于PR-A和PR-B的表达和细胞核分布变化并且在癌组织样本包括子宫内膜样癌中是不一致的,采用对于两种同种型的抗体是有必要的。用特异性PR抗体染色的三个单独的载玻片将通过光学显微镜来检查和分析,以半定性地鉴定以下的存在和相对表达:1)在肿瘤样本中的PR;PR状态的解释将使用常规0、+1、+2、+3等级基于各PR-A和PR-B染色的载玻片在用于整体染色的低放大倍率下的多个视野的独立检查,将+2或更大报告给委托医师作为PRpos;以及2)在肿瘤样本中的APR(活化的孕酮受体);APR状态的解释将基于各PR-A和PR-B染色的载玻片在用于PRpos细胞的百分比的高放大倍率(至少60x物镜与至少0.9的NA)下的多个视野的独立的检查,这显示出细胞核聚焦模式符合APR,其中将在预期的临床试验中确定的%报告给委托医师作为APRpos。表6:对BOND-III的PR/APRIHC方案实施例2单独的试剂:(1)在缓冲液中的脱石蜡试剂,(2)洗涤缓冲液,(3)对于结构识别的复染色(例如,苏木精),(4)在缓冲液中的Novocastra克隆16,用于PRA检测,(5)在缓冲液中的Novocastra克隆SANS27,用于PRB检测,(6)含缀合至酶(例如,辣根过氧化物酶)的二抗的缓冲液,该二抗针对各检测抗体的FAB片段,(7)用于酶缀合抗体的底物溶液,以及(8)停止酶活性的猝灭溶液。设备:自动、高级载玻片染色装置。方案:(在优化的时间和温度进行所有的步骤)(1)两个(2)3-4μm载玻片将通过切片机从FFPE块制备,(2)将每个安装在自动、高级的载玻片染色器中,(3)使用试剂脱石蜡步骤,(4)洗涤步骤,(5)与复染剂孵育,(6)洗涤步骤,(7)每载玻片与一种一抗孵育(例如,克隆16和SANS27),(8)洗涤步骤,(9)与二抗-酶缀合物孵育,(10)洗涤步骤,(11)与检测底物孵育,(12)洗涤步骤,(13)分析,(14)来自每个样本的两个抗-PR-染色的载玻片,连同一个苏木精/伊红染色的载玻片将通过至少两位有资质的病理学家对于PR表达和APR状态进行解释,(15)以高分辨率扫描载玻片且得到的图像可用于会诊。不是本文描述的每个要素都是必需的。事实上,本领域技术人员将发现发明人意图仅由权利要求书限定的本文描述的方法的许多另外的用途及变型。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 禽流感病毒H5N1亚型Re-5株阳性血清和阴性血清标准物质及制备方法
- 5亚型Na<sup>+</sup>/H<sup>+</sup>交换泵(NHE5)抑制剂在改善记忆保持(memory retention)中的用途的制作方法
- Hiv-1亚型间(c/b’)基因组和其用途的制作方法
- 一种基于rt-lamp技术的h3亚型流感快速检测分型方法
- Hiv-1亚型间(c/b’)基因组和其用途的制作方法
- PCV2、PRV与SIV H9亚型多重SYBR Green Ⅰ实时荧光PCR引物及其检测方法
- 一株hiv-1 crf01_ae亚型毒株及其应用的制作方法
- CSFV、PRRSV、PCV2与SIV H9亚型多重SYBR Green Ⅰ实时荧光PCR引物及其检测方法
- PRRSV、SIV H9亚型与PCV2多重SYBR Green Ⅰ实时荧光PCR引物及其检测方法
- 一种含hiv-1 crf01-ae亚型rt基因的杂交免疫缺陷质粒、病毒及应用的制作方法