本发明涉及使用了埋入于薄膜中的细孔的生物聚合物分析方法,特别是DNA、蛋白质的分析方法。
背景技术:
如果1分子的生物聚合物通过埋入于厚度数~数十nm程度的薄膜中的直径0.9nm~数nm程度的细孔(以下,称为纳米孔),则纳米孔周边部的电特性会对应于生物聚合物的单体序列图案而变化为图案状。利用这一点,近年来正积极研究进行生物聚合物的单体序列解析的方法。关于纳米孔,常常以将含有电解质的溶液配置于薄膜两侧的形态使用。通过在该薄膜的表面和背面施加电压而产生电位差,从而能够使含有电解质的溶液通过纳米孔。着眼于电特性即此时产生的离子电流,以生物聚合物通过纳米孔时所观察到的离子电流的变化量根据单体种类的不同而不同为原理的方式被认为最有前景(图2)。除了离子电流之外,广泛已知以如下为原理的方式:在纳米孔部形成一对电极,利用流过该电极间的隧道电流,在生物聚合物通过纳米孔时所观测到的隧道电流量根据单体种类的不同而不同。任何方式均无需如以往那样的与生物聚合物的片段化相伴随的化学操作而能够直接读取生物聚合物。生物聚合物为DNA时是新一代DNA碱基序列解析系统,生物聚合物为蛋白质时是氨基酸序列解析系统,各自均作为能够解读比以往长得多的序列长度的系统而受到期待。
作为纳米孔设备,存在生物孔和固体孔两种,生物孔使用在埋入于脂质双层膜的中心具有细孔的蛋白质,固体孔是对利用半导体加工工艺形成的绝缘薄膜加工细孔而成。就生物孔而言,通过将埋入于脂质双层膜中的改性蛋白质(耻垢分枝杆菌孔蛋白A(Mycobacterium smegmatis porin A,MspA)等)的细孔(直径1.2nm,厚度0.6nm)作为生物聚合物检测部来测量离子电流的变化量。然而,由于该细孔厚度大于单体1分子单位(作为DNA的单体的核酸的邻接距离为0.34nm),因此对于离子电流变化量而言,多个单体分子的信息会混在一起。除了该空间分解能力不足之外,由于利用蛋白质,因此蛋白质的细孔部会因溶液条件、环境条件而变性,从而使设备劣化。从稳定性、寿命的观点出发,存在设备的稳健性低这样的课题。另一方面,就固体孔而言,可形成由石墨烯、二硫化钼那样的单分子层构成的薄膜。只要为它们的厚度,就能够确保为了读取单体1分子单位的充分的空间分解能力。此外,与蛋白质不同,具有在各种各样的溶液条件、环境条件下材料稳定,设备的稳健性高这样的优点。除此之外,能够利用半导体加工工艺来将纳米孔部并列化,从上述那样的优点出发,固体孔作为比生物孔更加优异的设备而受到关注。
关于将作为生物聚合物的DNA链搬送至纳米孔的方法,最广泛使用将产生离子电流的电位差直接作为驱动力而使生物聚合物电泳的方法。然而,如图3所示,电泳导致的DNA链的纳米孔通过速度非常快,因此仅得到多个单体分子的信号混在一起的信号值,为了实现序列解析,需要使通过速度变慢的技术。具体而言,优选能够延迟至100μs/单体1分子单位以上的通过速度,但现状为0.01~1μs/单体1分子单位的通过速度,需要实现至少100倍至10000倍程度的速度延迟。如果能够如此地将通过速度变慢,则能够仅取得单体1分子的信号将成为可能。
为了解决该课题,设计了各种各样的方法。研究了多种调整溶液物性的方法,例如,尝试了添加高浓度甘油而使溶液粘度的上升,增大与电泳时的DNA链的拉伸力相反方向的摩擦力,从而使纳米孔通过速度变慢的方法(非专利文献1)。此外,验证了通过在溶液中添加锂离子,使DNA链的表观负电荷减少,从而使电泳时的拉伸力变小而延迟纳米孔通过速度的方法(非专利文献2)。
作为调整溶液物性以外的方法,研究了在设备侧下工夫的方法。例如,验证了对纳米孔自身下工夫的方法。作为简单的方法,已知通过使纳米孔的直径变小从而使DNA链通过纳米孔时的摩擦力增大,使纳米孔通过速度变慢的方法(非专利文献3)。此外,研究了在设备中设置新的结构体的方法。专利文献1中,公开了在以二维状流路构成的纳米孔设备中,设置二维形状的障碍物的方法。上述专利文献1中,公开了在加工有纳米孔的薄膜的两侧,设置有规则地隔开距离而配置的纳米尺寸的障碍物群(圆柱等)的结构。作为其他障碍物的例子,明示了由聚合物、树脂、无机系多孔体、小珠构成的凝胶材料。提及了由于在电泳时生物聚合物与障碍物碰撞而产生阻碍泳动的方向上的摩擦力,因此纳米孔通过速度降低。非专利文献4中,公开了作为障碍物的其他实现方法,在纳米孔上游侧设置无规则地多层层叠而成的树脂材质的纳米线群的结构。提及了利用由电泳时生物聚合物与纳米线碰撞产生的摩擦力来使纳米孔通过速度降低。
现有技术文献
专利文献
专利文献1:日本特开2014-074599号公报
非专利文献
非专利文献1:D.Fologea等人.Nano Lett.,2005,5(9),1734.
非专利文献2:S.W.Kowalczyk等人.Nano Lett.,2012,12(2),1038.
非专利文献3:R.Akahori等人.Nanotechnology,2014,25,275501.
非专利文献4:A.H.Squires等人.J.A.C.S.,2013,135(44),16304.
技术实现要素:
发明所要解决的课题
以往的方法存在延迟效果不充分这样的课题。
在上述添加甘油等而调整以粘度为代表的溶液物性的方法中,公开了例如以双链DNA为对象作为生物聚合物的情况,添加前后的通过时间达到延迟至多5倍的程度为止。除此之外,由于生物聚合物通过时添加物也同时通过,因此还存在单体1分子单位的不同单体种类的信号值差变小,单体种类的检测变得困难这样的课题。添加锂离子的方法中也同样,公开了例如以单链DNA为对象作为生物聚合物的情况,添加前后的延迟效果为10倍程度。
以往利用障碍物进行的生物聚合物的纳米孔通过速度的延迟方法中,公开了例如以双链DNA为对象作为生物聚合物的情况,延迟效果达到15倍程度为止。因此,以生物聚合物与障碍物碰撞为原理的方法的延迟效果也不充分。
因此,利用任何手法均无法将生物聚合物的纳米孔通过速度充分延迟至能够进行单体序列解析的速度以下,期待其他方法的开发。
本发明是鉴于上述课题而完成的,其目的在于,通过导入新的延迟原理,从而提供一种将生物聚合物的纳米孔通过速度大幅地延迟化、能够稳定地进行生物聚合物中的单体序列解析的生物聚合物分析系统。
用于解决课题的方法
本发明的代表性方式是如下的生物聚合物分析设备,其具备可容纳含有生物聚合物和电解质的溶液的两个槽、分别配置于两个槽的一对电极、具有纳米孔且以经由纳米孔而连通两个槽的方式配置于两个槽之间的薄膜、以及载置于薄膜的三维结构体;并且,三维结构体具有空隙,空隙形成使溶液从纳米孔通至三维结构体之上的流路,流路的表面具有可吸附生物聚合物的官能团,在对一对电极施加电压时,在至少以纳米孔为中心、以生物聚合物捕捉长度为半径的半球范围内,三维结构体不会再分散于溶液。
本说明书中,不会再分散的定义是,在与溶液接触的条件下,三维结构体的一部分不会因溶剂化、布朗运动或施加电压时的电泳等而剥离。
发明效果
根据本发明,通过在三维结构体中的流路表面存在吸附生物聚合物的官能团,从而在生物聚合物因电泳或扩散现象而接近至流路表面附近时,生物聚合物热力学吸附于流路表面。该吸附状态与生物聚合物在溶液内因溶剂化或电离而自由扩散的状态相比,自由能稳定,因而发生。此时的吸附力相对于电泳时的生物聚合物的拉伸力作为相反方向的作用力而发挥作用。该吸附力的强弱能够通过调整修饰于流路表面的官能团的种类和溶液条件而任意地控制,并且能够将生物聚合物的纳米孔通过速度调整至能够进行单体序列解析的速度带域。
此外,提供吸附力的结构体在施加电压时不会再分散于溶液中。由此能够维持稳定的流路形状,能够在各种各样的溶液条件及环境条件下提供对应的稳健性高的生物聚合物分析设备。
上述以外的课题、构成及效果通过以下实施方式的说明即可了解。
附图说明
图1是表示生物聚合物分析设备的一例的示意图;
图2是以离子电流的变化量根据单体种类的不同而不同为原理的生物聚合物序列解析方法的概念图;
图3是表示由生物聚合物的纳米孔通过速度过快带来的课题的概念图;
图4是表示生物聚合物的吸附过程的示意图;
图5是生物聚合物捕捉长度的说明图;
图6是表示生物聚合物分析设备的另一形态的纳米孔附近的截面示意图;
图7是设备内的三维结构体的俯视图;
图8是表示设备内的三维结构体的纳米孔周边部的立体示意图;
图9是表示设备内的三维结构体的纳米孔周边部的截面示意图;
图10是强调表示三维结构体中的流路的纳米孔周边部的截面示意图;
图11是表示另一三维结构体的纳米孔周边部的截面示意图;
图12是表示另一三维结构体的纳米孔周边部的截面示意图;
图13是表示另一三维结构体的纳米孔周边部的截面示意图;
图14是表示另一三维结构体的纳米孔周边部的截面示意图;
图15是表示另一三维结构体的纳米孔周边部的截面示意图;
图16是表示另一三维结构体的纳米孔周边部的截面示意图;
图17是表示另一三维结构体的纳米孔周边部的截面示意图;
图18是表示另一三维结构体的纳米孔周边部的截面示意图;
图19是表示另一三维结构体的纳米孔周边部的截面示意图;
图20是表示另一三维结构体的纳米孔周边部的截面示意图;
图21是表示生物聚合物分析系统的一例的概略图;
图22是纳米孔开口前的薄膜的截面示意图;
图23是纳米孔开口前的薄膜的截面示意图;
图24是表示使样本回收和速度延迟一体化的分析方案的一例的图;
图25是表示使样本回收和速度延迟一体化的分析方案的示意图;
图26是表示生物聚合物检测的典型例的图。
具体实施方式
以下,参照附图说明本发明的实施方式。
图1是表示根据本发明的生物聚合物分析设备的一例的示意图。
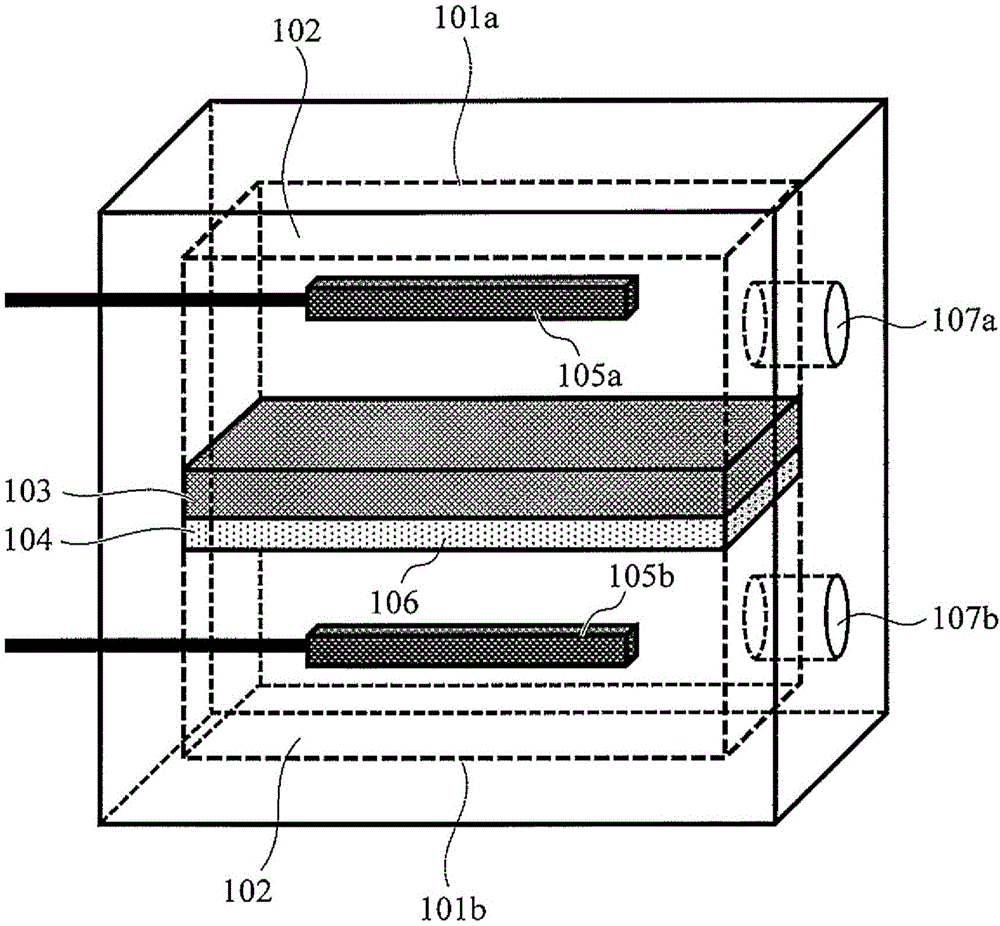
本设备具有可容纳溶液102的两个槽101a、101b,具备纳米孔106(详细情况记载于图5之后)的薄膜104,载置于薄膜上的三维结构体103,以及一对电极105a、105b。两个槽中所容纳的溶液含有电解质,只要至少任一方的槽的溶液中含有生物聚合物109即可。薄膜104以经由纳米孔106而连通两个槽101a、101b的方式配置于两个槽101a、101b之间。如图1所示,两个槽优选具备用于导入溶液的溶液注入口107a、107b。即使没有溶液注入口,也可将液滴滴下于设备表面,以开放状态进行生物聚合物测定。三维结构体中具备空隙108(详细情况记载于图7之后),该空隙形成可使溶液从纳米孔通至三维结构体之上的流路。如图4所示,在该流路表面具备可吸附生物聚合物的官能团110。此外,该三维结构体具有在施加电压时、在以纳米孔为中心的半球内的范围不会再分散于溶液中的刚性性质。该半球的半径为以下所定义的生物聚合物捕捉长度r。
[式1]
d:纳米孔的直径
μ:生物聚合物的电泳迁移率
L:薄膜的厚度
D:生物聚合物的扩散系数
ΔV:产生于两个电极间的电压差
作为生物聚合物,其对象为由作为单体的核酸构成的单链DNA、双链DNA、RNA、寡核苷酸等和由作为单体的氨基酸构成的多肽等。测量时优选形成高次结构解散而成的直链状高分子的形态。以下,示出使用单链DNA作为生物聚合物时的形态,但也可应用除此之外的生物聚合物。作为溶液的溶剂,最优选的是可稳定地溶解生物聚合物的水。作为上述溶剂中所含的电解质,可举出钾离子、钠离子、锂离子、钙离子、镁离子、氟化物离子、氯化物离子、溴化物离子、碘化物离子、硫酸离子、碳酸离子、硝酸离子、铁氰酸离子、亚铁氰酸离子等。作为电极的材质,可举出碳、金、铂、银、氯化银等,只要是可用于电化学测量的电极就没有特别限制。
作为纳米孔106,只要是单链DNA可通过的最小尺寸即直径0.9nm至10nm程度即可,薄膜的厚度只要是数至数十nm程度即可。薄膜的材质只要是可通过半导体微细加工技术来形成的材质即可,典型地,是氮化硅、氧化硅、氧化铪、二硫化钼、石墨烯等即可。纳米孔可利用电子射线照射、脉冲电压施加法来形成。这样的方法在文献(M.Wanunu,Physics of Life Reviews(生命物理学评论),2012,9,125.)、文献(I.Yanagi,Scientific Reports(科学报告),2014,4,5000.)中已被详细公开。
作为可吸附生物聚合物的官能团110,例如在以DNA、RNA、寡核苷酸等为对象的情况下,可举出硅烷醇基。已熟知核酸对于硅烷醇基是通过促溶效应而吸附的,代表性地,使用表面具有硅烷醇基的玻璃的例子在文献(B.Volgenstein等人,Proc.Natl.Acad.Sci.USA,1979,76,615.)中已被详细公开。为了诱导由上述促溶效应引起的吸附,只要在水溶液中含有带来促溶效应的分子即可。作为带来促溶效应的分子,优选为硫氰酸离子(SCN-)、磷酸二氢离子(H2PO4-)、硫酸氢离子(HSO4-)、碳酸氢离子(HCO3-)、碘化物离子(I-)、氯化物离子(Cl-)、硝酸离子(NO3-)、铵离子(NH4+)、铯离子(Cs+)、钾离子(K+)、胍盐离子、四甲基铵离子等。已知越是酸性条件,促溶效应表现越强,优选调整为如下溶液条件:促溶效应充分表现的pH1以上,促溶效应开始表现的pH10以下。此外,已知离子强度越增大,促溶效应表现越强,在以氯化物离子为例的情况下,优选如下调整溶液条件:促溶效应开始表现的10mM以上,促溶效应充分表现的饱和氯化钾溶液的离子强度(约3.4M)以下。这些溶液条件已被记载于例如文献(P.E.Vandeventer等人,J.Phys.Chem.B,2012,116(19),5661.)中。
作为可吸附生物聚合物的官能团的其他例子,可举出电离为阳离子的官能团。已知,由于DNA、RNA等核酸在水溶液中带负电,因此通过与带正电的阳离子分子通过静电相互作用进行吸附。作为带电为阳离子的官能团,优选为伯氨基、仲氨基、叔氨基、季铵基、吡啶基、亚氨基、咪唑基、吡唑基、三唑基等。电离为阳离子的官能团虽然存在多种,但优选在水溶液中保持稳定的形态,并且不具有与生物聚合物的化学反应性。在利用电离为阳离子的官能团的情况下,优选溶液的pH比电离为阳离子的官能团的pKa小,以便稳定地电离成阳离子。例如,伯氨基的pKa以9~11的范围存在,作为代表性伯胺的乙基胺的pKa为10.5。因此,通过将溶液pH调整为10.5以下,能够使乙基胺完全电离成阳离子,使DNA等确实地向流路表面吸附。
通过在上述流路表面具备上述官能团,从而如图4所示当生物聚合物通过电泳或扩散现象接近至流路表面附近时,生物聚合物热力学吸附于流路表面。该吸附状态与生物聚合物在溶液内溶剂化或电离而进行自由扩散的状态相比,自由能更加稳定,因而发生。此时的吸附力相对于电泳时对生物聚合物的拉伸力作为相反方向的作用力而发挥作用。由于该吸附力,电泳时对生物聚合物的拉伸力减小,从而能够延迟通过纳米孔的速度。该吸附力的强弱可通过调整修饰于流路表面的官能团的种类和溶液条件而任意地进行控制,从而能够将生物聚合物的纳米孔通过速度容易地调整至可进行单体序列解析的速度带域。由纳米孔周围产生的电位梯度引起的对DNA的拉伸力已在文献(U.F.Keyser等人,Nature Physics(自然物理),2006,2,473.)中详细记载,已知为0.24pN/mV。另一方面,就对生物聚合物的吸附力而言,例如,通过使用原子力显微镜所进行的调查,DNA对硅烷醇基的吸附力为约55pN,这已被记载于文献(F.Kuhner,Langmuir,2006,22,11180.)中。此外,通过同样的调查,DNA对阳离子基(电离的伯氨基)的吸附力为约200pN,这已被记载于文献(M.Erdmann等人,Nature Nanotechnology(自然纳米技术),2010,5,154.)中。因此,通过任意地调整这些拉伸力和吸附力,从而能够实现期望的生物聚合物的纳米孔通过速度。
生物聚合物捕捉长度r是指,如图5所示,以纳米孔周围(半径r的半球范围)产生的电位梯度为驱动力,能够将生物聚合物通过电泳进行搬送的实际距离。生物聚合物捕捉长度由式1所定义。关于生物聚合物捕捉长度,在文献(M.Wanunu等人,Nature Nanotechnology(自然纳米技术),2010,5,160.)中已被详细公开。当生物聚合物109通过扩散过程而接近至以纳米孔106为中心位置、以该生物聚合物捕捉长度为半径的半球附近时,对生物聚合物产生由电泳引起的朝向纳米孔的拉伸力。因此,为了将生物聚合物的通过速度变慢,在上述半球的范围内,必须存在具备可吸附生物聚合物的官能团的上述流路。除此之外,为了实现稳定的生物聚合物检测,在施加电压时,需要具备在上述半球的范围内上述结构体不会再分散于溶液中的性质。反之,由于上述半球的范围外是对于生物聚合物的速度延迟没有贡献的区域,因此如后述那样通过限制结构体的区域,能够进行提高生物聚合物的捕捉效率等这样的改善。
为了至少可使生物聚合物通过,上述流路的最小截面积需要为生物聚合物的分子截面积以上,上述流路的最大截面积需要为空隙间的最大截面积以下。可通过单链DNA的最小的纳米孔直径为0.9nm,这已被记载于文献(K.Venta等人,ACS Nano,2013,7(5),4629.)中。因此,该情况下的分子截面积为0.81nm2。此外,为了使生物聚合物可有效地吸附于流路表面,优选流路的最大截面积小于式2所定义的生物聚合物的平均自由程S(维度为距离)所形成的截面积。
[式2]
这里,D为生物聚合物的扩散系数,t为纳米孔附近的平均滞留时间。
例如,对于单链DNA(30个碱基的聚胸腺嘧啶)的情况,扩散系数为118μm2/s,这已被记载于文献(Q.Wang等人,ACS Nano,2011,5(7),5792.)中,纳米孔附近的平均滞留时间为700ms,这也已被记载于文献(G.Ando等人,ACS Nano,2012,6(11),10090.)中。根据式2,此时的单链DNA的平均自由程为9μm。因此,用于单链DNA在进入纳米孔前与官能团110吸附一次以上的流路的最大截面积为81μm2。由上,该情况下的流路的截面积优选为0.81nm2以上81μm2以下。这里以生物聚合物为单链DNA,举出了合适的截面积范围的例子。该截面积范围会根据生物聚合物、溶液的离子成分、粘性等发生变化,即使上述以外的范围也可充分获得本发明的效果。
此外,上述流路的截面积的上限更优选为以生物聚合物捕捉长度为半径的圆的面积以下。通过将生物聚合物吸附的流路的范围限定在生物聚合物捕捉长度的范围内,能够提高生物聚合物的检测频率、缩短解析时间且进行低浓度的生物聚合物分析。
在将作为检测对象的生物聚合物设为DNA的情况下,通过将上述流路的截面积的上限设为DNA聚合酶、DNA解旋酶、外来体(尺寸数nm以上且数十nm以下)的分子截面积以下,可获得不同的效果。从实际样本提取的DNA有可能附着有上述的蛋白质或结构体,或者作为夹杂物混入。在使用比这些物质尺寸小的纳米孔进行分析的情况下,如果为它们附着于DNA的状态,则DNA通过纳米孔时有时会堵塞,从而无法继续解析。因此,通过限制上述流路的最大截面积,将这些物质筛落或者仅使不附着这些物质的DNA通过,会获得可顺利实施分析的效果。
此外,通过将上述流路的截面积的上限设定为DNA的高次结构的截面积以下,可获得同样的效果。对于DNA的情况,已知例如鸟嘌呤在连续的序列中形成高次结构(四聚体,尺寸:2.6nm以上10nm以下)。因此,通过设定上述限制,将形成高次结构的DNA解开为直链或仅使单体的DNA通过,可顺利地实施分析。
图6是表示本发明的生物聚合物分析设备的另一形态的纳米孔附近的截面示意图。图6中以将多个纳米孔并列化为特征。如图1所示,在仅使用单独的纳米孔来构成设备的情况下,对于一个纳米孔,只要具备一个三维结构体、一组两个电极即可。另一方面,如图6所示将多个纳米孔并列化而用作设备的情况下,需要对于各个纳米孔106将一个三维结构体103载置于具有纳米孔的薄膜104。可以将浸渍于一方溶液侧的电极(典型地为接地的电极)105a用作共用电极、在另一方溶液侧对于各个纳米孔设置一个独立的电极105b。共用电极侧的溶液102a对于各个纳米孔106需要是共用的溶液,就相对于共用电极为相对侧的溶液102b而言,对于各个纳米孔106需要具备一个独立的溶液。另外,确保各溶液的独立性的隔板优选为绝缘性的材质,例如优选为聚二甲基硅氧烷、氧化硅等。通过这样的构成,各纳米孔没有电化学性的相互干涉,可独立地实施生物聚合物分析,能够提高生物聚合物分析的分析量。
[实施例1]
作为实现具备上述性质的三维结构体的生物聚合物分析设备的一个形态,图7中示出了从垂直于设备的上方看到的纳米孔周边部的图。此外,图8是沿图7的截面A切断的纳米孔周边的立体示意图,图9是纳米孔周边的截面示意图。
本实施例的特征在于,三维结构体以多个粒子111在薄膜104上层叠一层而成型。这里,在图9中,由斜线表示的区域是沿截面A切断的成型而成的粒子的截面部,由灰色表示的环状的区域是位于空隙内侧的成型后的粒子的一部分。该粒子间的空隙108形成使含有生物聚合物和电解质的溶液通过至纳米孔的流路112。图10中用粗线强调表示了流路112。这里,电压梯度仅在以纳米孔106为中心位置、以生物聚合物捕捉长度r为半径的半球113的范围内发生。因此,在存在于本结构体中的多个空隙内,只有存在于上述半球113的范围内、且连接至纳米孔106的空隙形成上述流路。上述粒子的表面修饰有可吸附生物聚合物的官能团。上述多个成型后的粒子在至少上述半球的范围内设为非球状的形状,以便不会在施加电压时发生电泳而从薄膜表面剥离并再分散于溶液中。该形态的优点之一在于,可提高生物聚合物向上述流路表面吸附的概率。这是因为,三维结构体由粒子成型,从而能够提高充分大的比表面积。粒子的平均直径设定得越小,空隙越变小,从而越能够使生物聚合物的吸附概率提高。另一方面,空隙设定得越小,离子通过时的电阻值越上升,所得的离子电流越减少,从而会无法得到信号值其本身。因此,生物聚合物的吸附概率与电阻值存在权衡的关系。粒子的平均直径优选为10nm以上1000nm以下。另外,粒子有可能阻塞纳米孔,为此粒子与纳米孔必须为点接触,那样的概率非常低,因此实用上不会成为问题。万一存在被粒子阻塞的纳米孔时,不将该纳米孔用于分析。
另一优点是容易使用粒子进行制造。通过将分散有粒子的溶液涂布于薄膜上且仅将溶剂蒸发去除,能够制造由粒子成型的三维结构体。关于涂布溶液的方法,可使用浸涂、旋涂、利用电泳的涂布等。特别是,浸涂不仅简便,而且粒子可借助溶剂的表面张力向薄膜表面自组化而密集地配置,因此是优选的方法。这样的方法在例如文献(X.Ye等人,Nano Today(今日纳米),2011,6,608.)中已被公开。作为涂布后将溶剂蒸发去除的方法,优选为加热蒸发的方法。此时,通过适当选择粒子的材质,可使各粒子变形。这样的方法在例如文献(A.Kosiorek等人,Small,2005,1,439.)中已被公开。变形前,粒子彼此仅限于点接触,是会因施加电压而进行电泳的不稳定的结构体,因此需要实施该变形处理。经过该变形处理,球状的粒子发生粒子彼此的推挤而如图9所示变形为非球状,从而粒子彼此变为面接触。由此,具有可形成能够承受施加电压时对粒子的拉伸力的稳定的结构体这样的效果。优选地,此时的粒子的形状形成多面体以使邻接的粒子彼此相互强接触。这样的多面体可通过加热压接而得到,且已被记载于例如文献(Z.Q.Sun等人,Langmuir,2005,21(20),8987.)中。
作为实现上述三维结构体的粒子,需要从成型性、溶液分散性这两点选定。从成型性的观点出发,优选为可变形的材质,例如优选为聚苯乙烯、聚乳酸等树脂;二氧化硅、氧化钛等陶瓷;金、银等金属。从溶液分散性的观点出发,优选具有高ZETA电位值,以使粒子彼此获得充分的斥力。特别是,前述二氧化硅在表面被带负电的硅烷醇基覆盖,可实现用于粒子在水中独立分散的充分的ZETA电位值,因此是优选的材料。
粒子表面需要施加可吸附生物聚合物的官能团,可在向薄膜涂布前施加于粒子表面,也可在涂布后通过化学反应处理来施加。
作为使用由粒子成型而成的三维结构体的其他优点,可举出能够形成网眼状的流路。通常,生物聚合物、特别是单链DNA在溶液中不形成直链状,而是成为折叠而成的高斯链状的形态。如果为这样的形状,则在通过纳米孔时,单链DNA可能被薄膜部牵连而无法进行顺畅的检测。根据本实施例,单链DNA的分子内的多个部位被吸附于网眼状流路,从而可获得松开成直链状的形态的效果。因此,能够利用纳米孔进行顺畅的生物聚合物检测。
为了提高生物聚合物的吸附效果,优选三维结构体中粒子所占的体积占有率高于粒子彼此以最密填充结构进行点接触时的占有率。在层叠一层粒子的情况下,如果以将三维结构体从正上方向薄膜投影的图形的面积占有率进行考虑则容易明白。特别是,成型前的粒子为球状形状且投影图形的各粒子中心勾勒出正三角形的格子的情况下,面积占有率优选大于点接触的理论值即此外,成型前的粒子为球状形状且投影图形的各粒子中心勾勒出正四边形的格子的情况下,面积占有率优选大于点接触的理论值即π/4。
本实施例中,流路的最小截面积是指,上述半球范围内的、变形的粒子间的空隙中形成连接至纳米孔的流路的空隙的最小截面积。通过使用具有数nm以上的粒径的粒子,能够确保上述生物聚合物的分子截面积以上的截面积。同样地,流路的最大截面积是指,上述半球范围内的、变形的粒子间的空隙中形成连接至纳米孔的流路的空隙的最大截面积。此外,空隙的最大截面积是指,三维结构体中变形的粒子间的全部空隙中的最大截面积。因此,在上述半球的范围之外,会因粒子一部分缺失等导致空隙的最大截面积可能大于流路的最大截面积。然而,这样的部位是对生物聚合物的分析没有影响的区域,因此实用上不会成为问题。本定义在下述说明的实施例2~6、9中也同样。
[实施例2]
图11是表示本发明的生物聚合物分析设备中另一形态的三维结构体的纳米孔周边部的截面示意图。图11所示的实施例的特征在于,使图9的邻接的粒子彼此一体化。
图9中示出了粒子变形后的三维结构体的例子,但成型性也可通过利用化学反应、材料向表面层叠而进行邻接粒子彼此的一体化来实现。例如,在粒子材质为树脂的情况下,可通过加热至玻璃化转变温度以上,从而在树脂发生塑性变形而接触时使树脂的分子链彼此络合而一体化。作为树脂,优选为聚苯乙烯树脂等。这样的方法已被记载于文献(A.Kosiorek等人,Small,2005,1,439.)中。此外,在粒子材质为二氧化硅、氧化钛等陶瓷的情况下,也可通过烧结反应这样的化学反应来实现,能够使粒子彼此牢固地一体化。这样的烧结二氧化硅粒子的方法已被记载于例如文献(T.V.Le等人,Langmuir,2007,23(16),8554.)中。也可通过向粒子间的空隙导入单体而使其进行聚合反应来使树脂层叠,从而一体化。单体可为无机也可为有机。此外,通过从粒子表面开始表面接枝聚合,也能够实现同样的结构。作为其他的方法,有利用原子层沉积法(atomic layer deposition)来覆盖粒子表面的方法。通过使粒子彼此一体化,有能够实现不会进一步再分散的稳定的三维结构体、实现稳健性高的设备的效果。
[实施例3]
图12是表示本发明的生物聚合物分析设备中另一形态的三维结构体的纳米孔周边部的截面示意图。图9中示出了粒子层叠一层而成的三维结构体的例子,但图12中所示的实施例示出了粒子层叠多层而成的三维结构体的例子。通过进行多层层叠,比表面积随着层叠而增大,因此上述生物聚合物的吸附概率提高,可得到进一步的延迟效果。此外,网眼状流路的长度进一步增大,因此上述解开为直链的效果进一步提高,能够实现更顺利的检测。
多层层叠的方法有调整粒子分散溶液的粒子浓度或在图9中调整的层叠一层而成的三维结构体上进行多次同样的处理的方法。这样的方法已被记载于例如文献(P.Jiang等人,Chem.Mater.,1999,11(8),2132.)中。在该层叠结构中,也通过与实施例1或实施例2同样地使形状变形为非球状或使粒子彼此一体化,能够实现不会再分散的稳定的结构体。
[实施例4]
图13是表示本发明的生物聚合物分析设备中的另一形态的三维结构体的纳米孔周边部的截面示意图。在如图13所示的实施例中,示出了在图12中使用具有不同尺寸的两种粒子而形成三维结构体的例子。通过使用大小不同的两种粒子,小粒子会自排列而配置于大粒子间的空隙中,从而能够将比表面积进一步增大而提高生物聚合物的吸附概率。
这样的方法已被记载于文献(K.W.Tan等人,Langmuir,2010,26(10),7093.)中。该结构体也能够如上所述通过使粒子变形或一体化而实现不会再分散于溶液中的结构体。此外,由于粒子彼此的接触面积增大,因此也有结构体更加不易再分散而稳定化的效果。这里示出了两种尺寸的粒子多层层叠的例子,粒子的尺寸为3种以上也无妨。
[实施例5]
图14是表示本发明的生物聚合物分析设备中的另一形态的三维结构体的纳米孔周边部的截面示意图。本实施例的特征在于,使用具有不同尺寸的两种粒子,形成与图13不同形态的三维结构体。
图14中示出了将小粒子载置于薄膜上作为第一层、且将大粒子层叠于其上作为第二层的例子。通过如此地排列粒子,除了能够实现生物聚合物的延迟效果以外,还能够实现基于聚合物长度的过滤。发生如下的现象:具有短的聚合物长度的生物聚合物在第二层的大粒子间的空隙中由于自身的流体力学半径小,因此能够通过第二层而到达第一层,但具有长的聚合物长度的生物聚合物由于自身的流体力学半径大,因此被第二层的大粒子间的空隙吸附而无法到达第一层。因此,通过控制第一层和第二层的粒子尺寸,能够选择性地检测出仅具有期望范围的聚合物长度的生物聚合物。另外,使粒子的大小从第一层至最上层带梯度地逐渐变大的结构也是有效的。该层叠结构中,也通过与实施例1或实施例2同样地使形状变形为非球状或使粒子彼此一体化,能够实现不会再分散的稳定的结构体。
[实施例6]
图15是表示本发明的生物聚合物分析设备中的另一形态的三维结构体的纳米孔周边部的截面示意图。图15所示的实施例的特征在于,在例如图12中示出的三维结构体的周围具备具有大于三维结构体厚度的的壁114。
通过在三维结构体的周围配置壁,优点有两点。第一点是,通过在周围具有壁而能够限制三维结构体的可动区域,因此具有抑制三维结构体向溶液再分散的效果。第二点是能够提高生物聚合物的检测频率从而缩短解析时间的效果。通过将壁的高度以及宽度设为与生物聚合物捕捉长度大体同等或其以下,能够将三维结构体限制于生物聚合物捕捉长度的范围内。通过设为这样的构成,与结构体相互作用的生物聚合物可同时借助电位梯度被吸引至纳米孔。因此,可使进入纳米孔的生物聚合物的频率提高。除了解析时间缩短以外,还具有能够检测出更低浓度的生物聚合物的效果。壁面的高度、宽度即使大于生物聚合物捕捉长度也可得到上述效果。
此外,如图16所示,通过设置第二薄膜115,从而壁的开口部的面积小于薄膜的面积的结构也是有效的。通过这样地设为朝向溶液侧的面积逐渐变小的结构,从而具有能够更有效地控制三维结构体的可动区域、能够抑制向溶液的再分散的效果。这样的结构已被记载于文献(I.Yanagi,Scientific Reports(科学报告),2014,4,5000.)中,例如可利用以下那样的方法来制造。首先,将氧化硅等的可被氢氟酸溶液等蚀刻的层设置于开口有纳米孔106的薄膜104上,其次设置不易被上述溶液蚀刻的材质(氮化硅等)的层。然后通过一般的干式蚀刻形成贯通上述两层的孔。此时将工序停止,从而能够制造如图15所示的具有壁的结构。进一步使用氢氟酸等蚀刻溶液进行湿式蚀刻,从而可蚀刻的层被削成半球状,能够提供具有图16那样的壁结构的设备。此时,粒子的涂布作为最后的工序通过实施例1所示的方法来进行。
[实施例7]
图17是表示本发明的生物聚合物分析设备中的另一形态的三维结构体的纳米孔周边部的截面示意图。本实施例的特征在于,是与图9、图12相反的结构,将粒子变为空隙部、空隙部变为主体部的反蛋白石结构用于三维结构体。
本实施例的结构本质上是与图9及图12同等的结构,因此利用本结构也能够实现与图9及图12同样的效果。反蛋白石结构已被记载于文献(J.H.Moon等人,Chem.Rev.,2010,110,547.)中。本结构可通过以下方法来得到。首先,使粒子自排列而配置为有规律的结构后,不使粒子变形或一体化地而将单体(有机、无机均可)填充于粒子间空隙、并进行聚合反应而形成主体116。然后,使用仅能够溶解粒子部分的溶剂进行将粒子部分溶解去除的处理。最后,为了对结构体表面进行官能团处理,浸渍于包含例如具有伯胺的硅烷偶联剂等反应性强的表面处理剂的溶液,并且用醇等进行洗涤。如此地将粒子用作模具而形成的反蛋白石结构的优点在于,能够在实现与粒子填充的情况同等的表面积的同时,将溶液部分的体积进一步变大而降低电阻值。因此,能够确保更高的离子电流值,因而具有测量的高灵敏度化的效果。作为用于本结构的主体形成中的材料,优选为聚苯乙烯、二氧化硅等。就本结构而言,由于三维结构体作为主体而一体化,因此能够实现不会再分散于溶液中的稳定的结构体。
本实施例中,流路的最小截面积是指,在以上述式1所表示的生物聚合物捕捉长度r为半径的半球范围内的、在成为模具的粒子状的空隙内,形成连接至纳米孔106的流路的空隙的最小截面积。与实施例1的情况同样,通过将具有数nm以上的粒径的粒子用作模具,能够确保生物聚合物的分子截面积以上的截面积。同样地,流路的最大截面积是指,上述半球范围内的、在成为模具的粒子状的空隙内,形成连接至纳米孔的流路的空隙的最大截面积。此外,空隙的最大截面积是指,成为模具的粒子状的全部空隙中的最大截面积。
[实施例8]
图18是表示本发明的生物聚合物分析设备中的另一形态的三维结构体的纳米孔周边部的截面示意图。图18中,作为三维结构体的最简单的例子,示出了在具有纳米孔106的第一薄膜104上,载置有在纳米孔的正上方具有空隙的第二薄膜117的例子。
本实施例容易控制空隙108的截面积和薄膜117的厚度,并且具有容易控制生物聚合物的吸附概率这样的优点。空隙108可利用电子射线照射来开口成为期望尺寸的空隙,并且能够以未在第一薄膜104开口有纳米孔的状态对第一薄膜104和第二薄膜117同时开口得到纳米孔106和空隙108。该第二薄膜117能够通过半导体微细加工技术来形成。这样的薄膜的材料是能够通过半导体加工技术来形成的材料,优选为介电常数低从而使得静电容量变低的材质,例如二氧化硅等。通过如此地降低静电容量,从而能够在进行高频测量时减小依赖于具有频率响应性的静电容量的干扰,能够更稳定地进行生物聚合物检测。本实施例也与实施例7同样,在形成三维结构体后通过化学反应处理而在表面形成官能团。作为进行官能团处理的方法,与实施例7同样,可举出浸渍于包含具有伯胺的硅烷偶联剂等的溶液,且用醇等进行洗涤的方法。作为半导体微细加工技术用的材料,通过使用不溶解于水溶液的氧化硅、氮化硅进行制作,能够实现不会再分散于溶液的稳定的结构体。
本实施例中,流路的最小截面积是指,在以上述式1所表示的生物聚合物捕捉长度r为半径的半球范围内的、具有空隙108的第二薄膜117的空隙的最小截面积。通过将第二薄膜的空隙的直径设为1nm以上,能够确保生物聚合物的分子截面积以上的截面积。同样地,流路的最大截面积是指,上述半球范围内的具有空隙的第二薄膜117的空隙108的最大截面积。该实施例中,流路的截面积与空隙的截面积完全一致。
[实施例9]
图19是表示本发明的生物聚合物分析设备中的另一形态的三维结构体的纳米孔周边部的截面示意图。至此的实施例中,示出了三维结构体全部仅载置于薄膜的单侧的例子,但本实施例的特征在于,载置于两侧。由此,能够得到进一步的延迟效果。图19中示出了将图12所示的三维结构体载置于薄膜104的两侧的例子。
由于纳米孔周围的电位梯度在入口侧和出口侧两方产生,因此通过在纳米孔106的入口侧和出口侧两方设置三维结构体,在任一侧均能够减小生物聚合物109的拉伸力,实现进一步的延迟效果。图19中在薄膜的两侧同等地载置了三维结构体,但三维结构体即使是图9~18的实施例中的任一组合、其变形例也无妨。此外,仅在出口侧载置三维结构体也无妨。该层叠结构中,也通过与实施例1或实施例2同样地使形状变形为非球状或使粒子彼此一体化,能够实现不会再分散的稳定的结构体。
[实施例10]
图20是本发明的生物聚合物分析设备中的另一形态的三维结构体的纳米孔周边部的截面示意图。本实施例的特征在于,三维结构体的厚度小于生物聚合物捕捉长度。这里作为一例,示出了图9的实施例。
通过如此地限制三维结构体的厚度,可得到与实施例6同样的效果。即,与三维结构体相互作用的生物聚合物109可同时借助电位梯度被吸引至纳米孔106。因此,能够提高进入纳米孔的生物聚合物的频率。除了解析时间缩短以外,还具有能够检测出更低浓度的生物聚合物的效果。本实施例在图9~图19中说明的任一结构中均能够应用。关于三维结构体的厚度,对于图9、图11的情况,可通过粒径来控制,对于图12~16、图19的情况,可通过粒径及层叠数来控制,对于图17的情况,可通过去除对象的粒径和层叠数来控制,对于图18的情况,可通过薄膜厚度来控制。该层叠结构中,也通过与实施例1或实施例2同样地使形状变形为非球状或使粒子彼此一体化,能够实现不会再分散的稳定的结构体。
关于流路以及空隙的截面积的定义与实施例1中说明的内容相同。
[实施例11]
图21是表示使用了本发明的生物聚合物分析设备的生物聚合物分析系统的一例的概略图。本系统典型地由如下装置构成:图1所示的生物聚合物分析设备118、对生物聚合物分析设备的一对电极之间流动的离子电流进行测量的离子电流测量装置119、将离子电流测量装置119的输出信号转换为数字信号的模拟数字输出转换装置120、处理由模拟数字输出转换装置120供给的信号的数据处理装置121、显示由数据处理装置121得到的处理结果的数据显示输出装置122、输入输出辅助装置123。典型地,离子电流测量装置中搭载有电流电压转换型高速放大电路,数据处理装置中搭载有演算装置、临时存储装置、非挥发性存储装置。为了降低外部干扰,生物聚合物分析设备部优选用法拉第笼覆盖。
[实施例12]
也可在将三维结构体载置于未开口有纳米孔的状态的绝缘薄膜上后开口得到纳米孔。通过对绝缘薄膜连续施加脉冲状的电压而能够开口得到期望直径的纳米孔的技术已被记载于文献(I.Yanagi,Scientific Reports(科学报告),2014,4,5000.)中。本发明的三维结构体保有接续至薄膜的空隙,与该薄膜接触的空隙部成为电阻值最低的部位。因此,在连续施加上述脉冲电压时,电压在与该薄膜接触的空隙部集中,从而能够开口得到纳米孔。
作为一例,本实施例的开口纳米孔的方法是在薄膜与空隙接触的部位开口纳米孔的方法,具有:将载置有三维结构体的绝缘体薄膜的表面及背面浸渍于包含电解质的溶液中的工序,所述三维结构体是具有空隙的三维结构体且该空隙在表面具有可吸附生物聚合物的官能团;在浸渍了薄膜的表面的溶液和浸渍了背面的溶液中浸渍一对电极的工序;对一对电极施加脉冲状的电压的工序。
作为具体例,图22中示出了使用图9中未开口有纳米孔的薄膜104的情况。该构成中,通过在薄膜与成型后的粒子未接触的部位使电压集中而开口纳米孔,能够得到与图9同等的结构。以往的利用电子射线照射的开口工序中,有时上述三维结构体成为遮蔽物而使电子射线无法到达薄膜,因此优选在开口工序后配置三维结构体。如果使用本工序,则在三维结构体的载置前后,在任意时间均能够开口纳米孔。除此之外,通过控制与薄膜接触的空隙部,还能够控制开口纳米孔的位置。例如,如图23所示,如果使用具有图15中例示的由粒子成型而成的三维结构体和壁面的设备,则能够使电压在不与粒子接触并且离开壁面的部位集中,在由箭头图示的位置开口纳米孔。本工序在实施例1~10及图9~图20中说明的任一结构中均可应用。由于上述说明的理由,在施加电压时三维结构体不会再分散,纳米孔开口前后结构体不会劣化,能够提供稳定的设备。
关于本实施例中的流路以及空隙的截面积的定义与实施例1中说明的内容相同。
[实施例13]
在使用粒子形成来三维结构体的情况下,还能够实现将从样本回收靶标生物聚合物和速度延迟这两者一体化了的生物聚合物分析设备。图24中示出了本实施例方案的概念流程,图25中示出了方案顺序的示意图。
首先,向溶解有靶标生物聚合物的样本溶液导入分散有粒子的溶液(S11),该粒子具有吸附靶标生物聚合物的官能团。导入后,等待充分的时间经过,以便生物聚合物充分地吸附于粒子表面(S12)。充分的时间经过后,利用超离心分离而仅将吸附了靶标生物聚合物的粒子选择性地回收(S13)。在使用磁粒子的情况下,能够利用磁场而仅将粒子回收。回收后,将由吸附了靶标生物聚合物的粒子成型而成的图9~图16或图19、图20的三维结构体载置于具有纳米孔的薄膜上(S14)。最后在如图21所示的生物聚合物分析系统中组装上述制作的设备,施加电压而进行生物聚合物检测(S15)。本工序中,为了使粒子回收顺利进行,优选使用粒子材质中带有顺磁性的铁素体等磁性粒子。
即,本实施例的分析方法具有:使用表面具有可吸附靶标生物聚合物的官能团的多个粒子,从样本吸附回收靶标生物聚合物的工序;在具有纳米孔的薄膜上载置由上述粒子成型而成的具有空隙的三维结构体的工序;将具有纳米孔的薄膜浸渍于包含电解质的溶液,在夹着薄膜而配置的两个电极间施加电压的工序;基于靶标生物聚合物通过纳米孔时的离子电流的变化来分析靶标生物聚合物的工序。此时,三维结构体的空隙形成使包含电解质的溶液从纳米孔通至三维结构体之上的流路,在施加电压时,在至少以纳米孔为中心、以式1所定义的生物聚合物捕捉长度r为半径的半球范围内,不会再分散于溶液。
本实施例中,由于能够预先将生物聚合物配置于纳米孔附近,因此能够提高检测频率。因此,具有解析时间缩短以及能够检测低浓度的生物聚合物的效果。另外,由于实施例1~6、9、10中说明的理由,三维结构体不会再分散于溶液,能够进行稳定的测量。关于本实施例中的流路及空隙的截面积的定义与实施例1说明的内容相同。
[实施例14]
以下,示出使用了图21所示的生物聚合物分析系统的生物聚合物的分析例。作为生物聚合物分析设备,使用具有图15所示的三维结构体的设备。作为薄膜,使用具有直径2nm的纳米孔的由氮化硅形成的薄膜。作为粒子,使用表面被硅烷醇基覆盖的直径100nm、50nm的二氧化硅纳米粒子和表面被伯氨基覆盖的直径50nm的二氧化硅纳米粒子。关于三维结构体,在将上述粒子利用浸涂涂布后,通过加热干燥进行成型。此外,作为对照实验,还准备了仅由氮化硅形成的薄膜构成的分析设备,该薄膜未载置三维结构体且具有直径2nm的纳米孔。作为生物聚合物,使用人工合成的5000碱基长度的多聚腺苷酸(polyA)。作为溶液,使用溶解了1M氯化钾的水溶液。作为用于搬送生物聚合物的电位差,施加1V。
图26中示出了利用上述实施例的生物聚合物分析系统进行的生物聚合物检测的典型例。未载置三维结构体的设备中,polyA的典型的通过速度为0.01μs/单体1分子单位。另一方面,载置了图15所示的三维结构体的设备中,在使用表面被硅烷醇基覆盖的直径100nm的二氧化硅纳米粒子时为0.46μs/单体1分子单位,在使用直径50nm的二氧化硅纳米粒子时为4.6μs/单体1分子单位。此外,在使用表面被伯氨基覆盖的直径50nm的二氧化硅纳米粒子时为230μs/单体1分子单位。因此,确认到通过使用本发明的设备且调整为最适的条件,与未使用三维结构体的情况相比,能够实现100倍至10000倍的充分的速度延迟。
通过组合本发明的生物聚合物分析设备、薄膜中单分子层的材质(石墨烯等)和例如文献(A.H.Laszlo,Nature Biotechnology(自然生物技术),2014,June25)中所公开的溶液条件、分析条件,能够将生物聚合物、特别是单链DNA的纳米孔通过速度充分延迟,得到依赖于单体序列的信号图案。通过基于来自所得的信号图案的依赖于单体种类的信号值差进行解析,能够解析生物聚合物中的单体序列图案。
予以说明的是,本发明并不限定于上述实施例,可包括多种多样的变形例。例如,上述实施例是为了更好地理解本发明而进行的详细说明,并不一定限定为具备说明的全部构成。此外,可以将某一实施例的构成的一部分替换成其他实施例的构成,此外,可以在某一实施例的构成中加入其他实施例的构成。此外,对于各实施例的构成的一部分而言,可以进行其他构成的追加、删除、替换。
符号说明
101:槽;102:溶液;103:三维结构体;104:薄膜;105:电极;106:纳米孔;107:溶液注入口;108:空隙;109:生物聚合物;110:官能团;111:粒子;112:流路;114:壁;115:第二薄膜;116:主体;117:具有空隙的第二薄膜;118:生物聚合物分析设备;119:离子电流测量装置;120:模拟数字输出转换装置;121:数据处理装置。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:后藤佑介;芳贺孝信;
- 技术所有人:株式会社日立高新技术;
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、邢老师:1.机械设计及理论 2.生物医学材料及器械 3.声发射检测技术。
- 2、王老师:1.数字信号处理 2.传感器技术及应用 3.机电一体化产品开发 4.机械工程测试技术 5.逆向工程技术研究
- 3、王老师:1.机器人 2.嵌入式控制系统开发
- 4、张老师:1.机械设计的应力分析、强度校核的计算机仿真 2.生物反应器研制 3.生物力学
- 5、赵老师:检测与控制技术、机器人技术、机电一体化技术
- 如您是高校老师,可以点此联系我们加入专家库。
- 还没有人留言评论。精彩留言会获得点赞!