一种小分子芯片、其制备方法和应用与流程
本发明属于生物芯片
技术领域:
,特别涉及一种小分子芯片、其制备方法和应用。
背景技术:
:在生物芯片发展的初期,其主要的研究对象是dna芯片,经过这些年的发展,生物芯片的范围已经远远超出了dna芯片本身。目前,生物芯片的分类方法有很多种,按照生物芯片的结构特点,可将生物芯片分为微阵列芯片和微流控芯片。微阵列芯片主要包括小分子芯片、dna芯片、蛋白质芯片、细胞芯片和组织芯片等。这些芯片上固定的分子分别是小分子、dna、蛋白质等。它们的工作原理都是基于生物分子之间的亲和结合作用,例如,核酸分子的碱基配对作用、抗原和抗体的结合作用等。生物芯片所表达的信息可以说是一种不可见且不易读懂的电信号和光信号代码,只有通过生物芯片检测技术及相关硬件设备的扫描检测与翻译才能转换成视觉图像和数值化信息,常见的生物芯片检测方法有荧光显微检测方法、激光共焦扫描方法、ccd成像扫描检测方法、光纤传感器、化学发光检测方法、电化学检测方法、表面等离子共振吸收检测方法或金胶银染检测法等。小分子芯片的芯片表面上固定有小分子化合物,针对小分子芯片中小分子与靶标的结合情况的检测常用的检测方法为表面等离子共振吸收检测方法,这依赖于表面等离子体共振(surfaceplasmonresonance,spr)技术。spr技术在检测小分子芯片中小分子与靶标的结合情况中的应用具有以下优点:①样品无需进行标记,对样品成分无特殊要求;②检测到的信息是活性分子之间的相互作用;③实时监测小分子与靶点的结合过程,并可计算出动力学及亲和力数据。目前,小分子芯片的研究主要有两个方向,一方面是小分子微阵列载体表面的化学修饰技术或者小分子化合物固定技术;另一方面是小分子芯片的实际应用。随着科学技术的发展,人们已经越来越重视小分子芯片的实际应用的研究,已经成功地将小分子芯片应用于各个生物
技术领域:
,例如,药物筛选、蛋白质配体的筛选、蛋白质与小分子之间的相互作用的研究、酶抑制剂筛选、酶活性图谱研究、食品和临床检测及细胞表面与小分子的相互关系的研究等。随着生活水平的提高,很有必要对各种疾病做出积极预防和及早诊断,尤其是危害大、破坏性强的传染性疾病,例如,疟疾、禽流感等。目前针对这些疾病的检测主要是通过检测其病原体进行的,检测方法包括:病原学检测、免疫学检测和核酸检测。但是现有的这些检测方法操作复杂、检测所需时间长、工作量大,不利于疾病的预防、及时诊断和控制,所以急需一种新的检测方法,而利用小分子芯片检测待测生物样品中有无病原体的存在无疑是理想的检测方法之一。针对疟疾的病原体疟原虫,研究发现疟原虫天冬氨酸蛋白酶ii(plasmepsinii)是疟原虫生存所必须的蛋白酶之一,所以可以以该蛋白酶作为检测靶标以实现利用小分子芯片检测疟原虫。针对禽流感病毒,其血凝素蛋白(hemagglutinin,ha蛋白)是介导禽流感病毒吸附和穿入宿主细胞而发挥致病作用的重要蛋白,所以也可以以ha蛋白作为检测标靶以实现利用小分子芯片对禽流感病毒的检测。目前还没有相关小分子芯片的报道。技术实现要素:有鉴于此,本发明的发明目的在于提供一种小分子芯片、其制备方法和应用。该小分子芯片中的小分子化合物可以与疟原虫天冬氨酸蛋白酶ii蛋白或血凝素蛋白相结合,可以用于检测待测样品中的疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白,检测过程操作 简单,检测结果准确,重现性好,所需时间短,省时省力,可用于制备检测疟原虫天冬氨酸蛋白酶ii和/或血凝素蛋白的产品。为了实现本发明的发明目的,本发明采用如下的技术方案:本发明提供了一种小分子芯片,其包括芯片和小分子化合物,该芯片包括光交联剂;小分子化合物通过光交联剂与芯片连接;小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐。本发明首先通过高通量药物筛选实验从几千个小分子化合物中筛选出来十个化合物,其中六个化合物,即(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮、(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐、3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐、6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉、2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮、2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮,能够与疟原虫天冬氨酸蛋白酶ii相互作用;另外四个化合物,即5h-二苯并[b,f]氮杂卓-5-甲酰胺、2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐、5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐、1-乙基-3-哌啶基二苯乙酸酯盐酸盐,能够与血凝素蛋白相互作用。之后将这十个小分子化合物用于构建小分子芯片,获得芯片后,考察了芯片的重现性和实际应用,得小分子芯片可用于检测待测样品中的疟原虫天冬氨酸蛋白酶ii和/或血凝素蛋白,检测过程操作简单、重现性好、所需时间短,省时省力,可用于制备检测疟原虫天冬氨酸蛋白酶ii和/或血凝素蛋白的产品。优选地,本发明提供的小分子芯片还包括空白对照,该空白对照通过光交联剂与芯片连接。在本发明的一些实施例中,本发明提供的小分子芯片中的空白对照为在制备小分子芯片时溶解小分子化合物所用的溶剂。在本发明的另外一些实施例中,本发明提供的小分子芯片中的空白对照为dmso。优选地,本发明提供的小分子芯片中的小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。更为优选地,本发明提供的小分子芯片中的小分子化合物为以下化合物中的一种或两种:2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。优选地,本发明提供的小分子芯片中的小分子化合物为以下化合物中的一种或多种:5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐。优选地,本发明提供的小分子芯片中的芯片为二维光交联芯片或三维光交联芯片。在本发明的一些实施例中,本发明提供的小分子芯片中,二维光交联芯片包括固体支持物、两端修饰的聚乙二醇和光交联剂;两端修饰的聚乙二醇为一端由铆定基团修饰,另一端由结合基团修饰的聚乙二醇,固体支持物与铆定基团连接,光交联剂与结合基团连接;铆定基团选自-sh、-s-s-或-sicl3;结合基团选自-cooh、-oh、-nh2或-och3。在本发明的另外一些实施例中,本发明提供的小分子芯片中,三维光交联芯片包括固体支持物、引发组合物、引发单体和光交联剂;引发单体通过引发组合物与固体支持物连接;光交联剂与引发单体连接,引发组合物包括引发剂和稀释剂,引发剂为双硫醇引发剂。本发明还提供了一种小分子芯片的制备方法,该小分子芯片包括芯片和小分子化合物,该芯片包括光交联剂;小分子化合物通过光交联剂与芯片连接;其中的小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐;该制备方法包括:取小分子化合物与有机溶剂混合,点样于芯片,干燥后,经光交联,失活未结合位点,即得。优选地,本发明提供的制备方法中的小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。更为优选地,本发明提供的制备方法中的小分子化合物为以下化合物中的一种或两 种:2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。优选地,本发明提供的制备方法中的小分子化合物为以下化合物中的一种或多种:5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐。优选地,本发明提供的制备方法中的有机溶剂为dmso。优选地,本发明提供的制备方法中的光交联反应所用的光为紫外光。更为优选地,本发明提供的制备方法中的光交联反应所用紫外光的波长为340nm~380nm。在本发明的一些实施例中,本发明提供的制备方法中的光交联反应所用紫外光的波长为365nm。优选地,本发明提供的制备方法中失活未结合位点所用的溶剂为乙醇胺。在本发明的一些实施例中,本发明提供的制备方法,包括以下步骤:步骤1:取小分子化合物与有机溶剂混合,点样于芯片,20℃~30℃条件下干燥;步骤2:取干燥好的含有小分子化合物的芯片,在紫外光照射下,小分子化合物与芯片上的光交联剂发生交联反应,固定小分子化合物;步骤3:去除未固定的小分子化合物,干燥后,用乙醇胺失活未结合位点;将流通池置于芯片之上,即得;其中的小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐。本发明还提供了一种小分子芯片在制备检测疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白的产品中的应用,该小分子芯片包括芯片和小分子化合物,该芯片包括光交联剂;小分子化合物通过光交联剂与芯片连接;其中的小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐。本发明还提供了一种小分子芯片在制备检测疟原虫天冬氨酸蛋白酶ii蛋白的产品中的应用,该小分子芯片包括芯片和小分子化合物,该芯片包括光交联剂;小分子化合物通过光交联剂与芯片连接;其中的小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。优选地,本发明的小分子芯片在制备检测疟原虫天冬氨酸蛋白酶ii蛋白的产品中的应用中的小分子化合物为以下化合物中的一种或两种:2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。本发明还提供了一种小分子芯片在制备检测血凝素蛋白的产品中的应用,该小分子芯片包括芯片和小分子化合物,该芯片包括光交联剂;小分子化合物通过光交联剂与芯片连接;其中的小分子化合物为以下化合物中的一种或多种:5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐。本发明还提供了一种非诊断目的的利用小分子芯片检测疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白的方法,该小分子芯片包括芯片和小分子化合物,该芯片包括光交联剂;小分子化合物通过光交联剂与芯片连接;其中的小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐;该检测方法包括:活化该小分子芯片,加入生物样品,经表面等离子体共振检测,获得生物样品的spr信号,与空白对照的spr信号作对比,如果生物样品具有显著(p<0.05)的spr信号, 表明生物样品中含有疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白。优选地,本发明提供的检测疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白的方法中活化所用试剂为甘氨酸和盐酸的混合溶液或氢氧化钠水溶液。在本发明的一些实施例中,本发明提供的检测疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白的方法中活化所用试剂为甘氨酸和盐酸的混合溶液,该试剂的ph值为2.0。优选地,本发明提供的检测疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白的方法中用到的表面等离子体共振检测技术具体为表面等离子体共振成像技术。本发明还提供了一种非诊断目的的利用小分子芯片检测疟原虫天冬氨酸蛋白酶ii蛋白的方法,该小分子芯片包括芯片和小分子化合物,该芯片包括光交联剂;小分子化合物通过光交联剂与芯片连接;其中的小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;活化该小分子芯片,加入生物样品,经表面等离子体共振检测,获得生物样品的spr信号,与空白对照的spr信号作对比,如果生物样品具有显著(p<0.05)的spr信号,表明生物样品中含有疟原虫天冬氨酸蛋白酶ii蛋白。优选地,本发明提供的检测疟原虫天冬氨酸蛋白酶ii蛋白的方法中的小分子化合物为以下化合物中的一种或两种:2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。优选地,本发明提供的检测疟原虫天冬氨酸蛋白酶ii蛋白的方法中活化所用试剂为甘氨酸和盐酸的混合溶液或氢氧化钠水溶液。在本发明的一些实施例中,本发明提供的检测疟原虫天冬氨酸蛋白酶ii蛋白的方法中活化所用试剂为甘氨酸和盐酸的混合溶液,该试剂的ph值为2.0。优选地,本发明提供的检测疟原虫天冬氨酸蛋白酶ii蛋白的方法中用到的表面等离子体共振检测技术具体为表面等离子体共振成像技术。本发明还提供了一种非诊断目的的利用小分子芯片检测血凝素蛋白的方法,该小分子芯片包括芯片和小分子化合物,该芯片包括光交联剂;小分子化合物通过光交联剂与芯片连接;其中的小分子化合物为以下化合物中的一种或多种:5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐;该检测方法包括:活化该小分子芯片,加入生物样品,经表面等离子体共振检测,获得生物样品的spr信号,与空白对照的spr信号作对比,如果生物样品具有显著(p<0.05)的spr信号,表明生物样品中含有血凝素蛋白。优选地,本发明提供的检测血凝素蛋白的方法中活化所用试剂为甘氨酸和盐酸的混合溶液或氢氧化钠水溶液。在本发明的一些实施例中,本发明提供的检测血凝素蛋白的方法中活化所用试剂为甘 氨酸和盐酸的混合溶液,该试剂的ph值为2.0。优选地,本发明提供的检测血凝素蛋白的方法中用到的表面等离子体共振检测技术具体为表面等离子体共振成像技术。本发明提供了一种小分子芯片、其制备方法和应用。该小分子芯片包括芯片和小分子化合物,该芯片包括光交联剂;小分子化合物通过光交联剂与芯片连接;小分子化合物为以下化合物中的一种或多种:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐。本发明提供的小分子芯片其中的小分子化合物可以与疟原虫天冬氨酸蛋白酶ii蛋白或血凝素蛋白相结合,可以用于检测待测样品中的疟原虫天冬氨酸蛋白酶ii和/或血凝素蛋白,检测过程操作简单,检测结果准确,重现性好,所需时间短,省时省力,可用于制备检测疟原虫天冬氨酸蛋白酶ii和/或血凝素蛋白的产品。实验结果证实本发明提供的小分子芯片可以用于检测生物样品中有无疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白,检测结果准确,重现性好,可用于制备检测疟原虫天冬氨酸蛋白酶ii和/或血凝素蛋白的产品。附图说明图1示实施例1中小分子芯片的固定效率检测中1mmol/l的雷帕霉素所对应的spr信号;图2示实施例1中小分子芯片的固定效率检测中5mmol/l的雷帕霉素所对应的spr信号;图3示实施例1中小分子芯片的固定效率检测中10mmol/l的雷帕霉素所对应的spr信号。具体实施方式本发明公开了一种小分子芯片、其制备方法和应用。本领域技术人员可以参考本文内容,获得该小分子芯片,特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。本发明的制备方法及应用已经通过较佳的实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文制备方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明提供的一种小分子芯片、其制备方法和应用中所用到的产品和原料均可由市场购得。为了使本
技术领域:
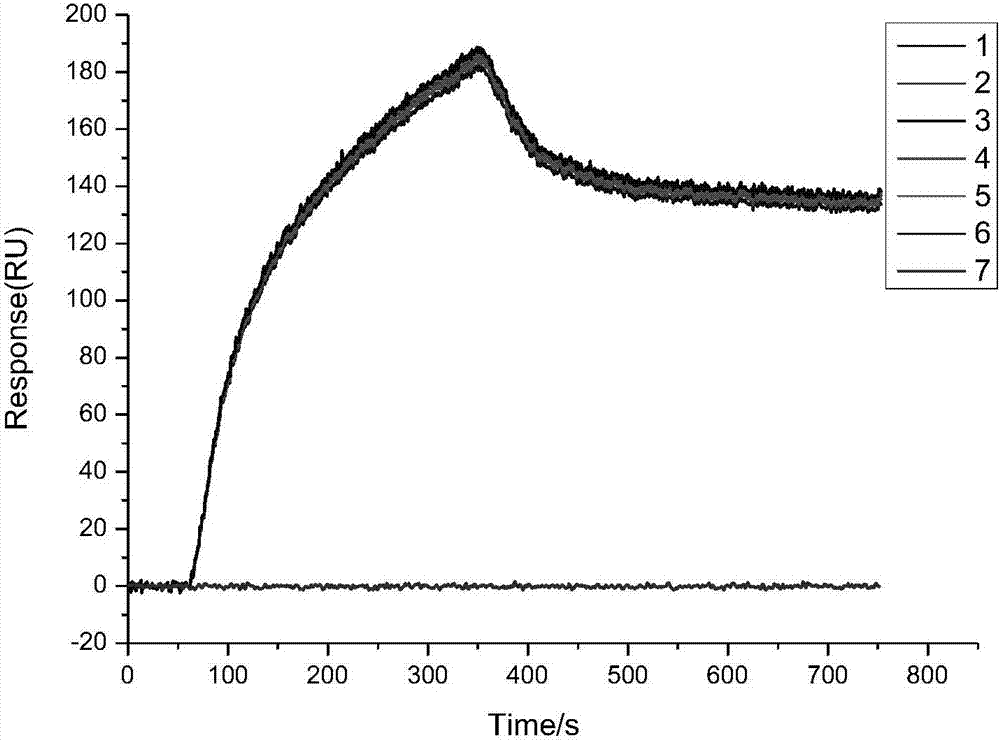
的技术人员能够更好地理解本发明的技术方案,下面结合实施例,进一步阐述本发明:实施例1小分子化合物的筛选本实施例所用芯片为二维光交联芯片,该芯片包括固体支持物、两端修饰的聚乙二醇和光交联剂;两端修饰的聚乙二醇为一端由铆定基团修饰,另一端由结合基团修饰的聚乙二醇,固体支持物与铆定基团连接,光交联剂与结合基团连接;铆定基团为-sh、结合基团为-cooh3,其制备方法为:步骤1:取聚乙二醇分别与铆定基团、结合基团连接,获得两端修饰的聚乙二醇;步骤2:取固体支持物经预处理后与铆定基团连接;步骤3:活化结合基团后,与光交联剂经酸胺缩合反应偶联,即得。(1)小分子芯片的固定效率检测取雷帕霉素作为待测物,溶于dmso中,配置成不同的浓度,相应的浓度为:10mmol/l、5mmol/l、1mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪单独将各个浓度的雷帕霉素均匀点样于二维光交联芯片表面,25℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露3次,每次180s,光交联固定不同浓度的雷帕霉素。将所得芯片依次浸泡于分析纯dmso(二甲基亚砜)、dmf(二甲基甲酰胺)、thf(四氢呋喃)、dcm(二氯甲烷)、mecn(乙腈)、etoh(乙醇)和去离子水中,每种溶剂各清洗四次,每次超声波清洗5min,以除去未固定的雷帕霉素。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得包含不同浓度的雷帕霉素的小分子芯片。按照spri仪器(plexera,v3)的操作手册安装所得芯片,以pbst缓冲溶液(10mmol/l,ph=7.4,0.05%tween)作为流动相,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s)。通入雷帕霉素的靶标蛋白fkbp12(bioscience,100nmol/l)300s,spri仪实时检测雷帕霉素与靶标蛋白的结合作用,收集spr信号,最后使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,盐酸的浓度为10mmol/l,ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同浓度的雷帕霉素与靶标蛋白相互作用所产生的spr信号,检测结果见图1-图3。图1为1mmol/l的雷帕霉素对应的spr信号,其包括了6个不同监测点所得的曲线(即6个重复,曲线1-6)、1个控制点(即dmso空白对照,即曲线7)所得曲线,其中6个不同检测点所得曲线基本吻合、无显著性差异,说明该浓度下本发明的检测方法稳定性好、重现性高;且有明显的spr信号值,与空白对照spr信号相比较,差异显著(p<0.05)。图2为5mmol/l的雷帕霉素对应的spr信号,其包括了6个不同监测点所得的曲线(即6个重复,曲线1-6)、1个控制点(即dmso空白对照,即曲线7)所得曲线,其中6个不同检测点所得曲线基本吻合、无显著性差异,说明该浓度下本发明的检测方法稳定性好、重现性高;且有明显的spr信号值,与空白对照spr信号相比较,差异显著(p<0.05)。图3为10mmol/l的雷帕霉素对应的spr信号,其包括了6个不同监测点所得的曲线(即6个重复,曲线1-6)、1个控制点(即dmso空白对照,即曲线7)所得曲线,其中6个不同检测点所得曲线基本吻合、无显著性差异,说明该浓度下本发明的检测方法稳定性好、重现性高;且有明显的spr信号值,与空白对照spr信号相比较,差异显著(p<0.05)。对比图1-图3,还可知,不同浓度的雷帕霉素的spr信号强度与点样所用雷帕霉素的浓度成正相关,与实际情况相符,说明各个浓度的雷帕霉素均被固定在了芯片表面,表明采用本发明提供的构建小分子芯片的方法制备获得的小分子芯片的固定效率高,可以用于构建小分子芯片。(2)与疟原虫天冬氨酸蛋白酶ii蛋白(plasmepsinii蛋白)相互作用的小分子化合物的筛选筛选一:取800小分子化合物为待测物、雷帕霉素为阳性对照,分别溶于dmso中,浓度均为10mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪将待测物及阳性对照 点样于二维光交联芯片表面,25℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露3次,每次180s,光交联固定待测物和阳性对照物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗三次,每次超声波清洗5min,以除去未固定的待测物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得无标记高通量药物筛选的小分子芯片。按照spri仪器(plexera,v3)的操作手册安装所得芯片,以ch3coona缓冲溶液(20mmol/l,ph=4.7,0.01%tween20)作为流动相,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,首先通入蛋白fkbp12(100nmol/l)300s,用spri仪实时检测雷帕霉素与fkbp12的结合作用,收集spr信号,实时在线观察,发现阳性对照雷帕霉素相比于空白对照有明显的相互作用,与空白对照spr信号相比较,差异显著(p<0.05),说明小分子化合物被很好地固定在芯片表面,可以用于筛选待测物。然后,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液将该小分子芯片重生3次,待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入欲筛选的靶标蛋白plasmepsinii蛋白(sigma-aldrich中国),溶剂为pbs(128nmol/l)300s,spri仪实时检测待测物与靶标蛋白的结合作用,收集spr信号,最后使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的待测物与靶标蛋白plasmepsinii蛋白相互作用所产生的spr信号。检测结果发现以下化合物产生了明显的spr信号,与空白对照spr信号相比较,差异显著(p<0.05):(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮(英文名称为:(8r,9s,13s,14s,17r)-17-ethynyl-17-hydroxy-13-methyl-1,2,4,6,7,8,9,11,12,14,15,16-dodecahydrocyclopenta[a]phenanthren-3-one);(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐(英文名称为:sodium(2s,5r,6r)-6-[[3-(2-chloro-6-fluorophenyl)-5-methyl-1,2-oxazole-4-carbonyl]amino]-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylate);3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐(英文名称为:3-(3-ethylhexahydro-1-methyl-1h-azepin-3-yl)phenolhydrochloride);6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉(英文名称为:2-dihydro-6-ethoxy-2,2,4-trimethylquinoline);通过plexerade软件,获得以上小分子化合物的kd值,分别为:8.0nmol/l、8.2nmol/l、6.4nmol/l和7.9nmol/l。由此可得,这些化合物可以与plasmepsinii蛋白相结合。筛选二:另取620个经提取得到的天然产物小分子化合物为待测物、雷帕霉素为阳性对照,分别溶于dmso中,浓度均为10mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪将待测物及阳性对照点样于二维光交联芯片表面,25℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露3次,每次180s,光交联固定待测物和阳性对照物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗三次,每次超声波清洗5min,以除去未固定的待测物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得无标记高通量药物筛选的小分子芯片。按照spri仪器(plexera,v3)的操作手册安装所得芯片,以ch3coona缓冲溶液(20mmol/l,ph=4.7,0.01%tween20)作为流动相,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,首先通入蛋白fkbp12(100nmol/l)300s,用spri仪实时(plexera,v3)检测雷帕霉素与fkbp12蛋白的结合作用,收集spr信号,实时在线观察,发现阳性对照雷帕霉素相比于空白对照有明显的相互作用,与空白对照spr信号相比较,差异显著(p<0.05),说明小分子化合物被很好地固定在芯片表面,可以用于筛选待测物。然后,使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调节至ph=2.0)水溶液将该小分子芯片重生3次,待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入欲筛选的靶标蛋白plasmepsinii蛋白(128nmol/l)300s,spri仪实时(plexera,v3)检测待测物与靶标蛋白的结合作用,收集spr信号,最后使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的待测物与靶标蛋白plasmepsinii蛋白相互作用所产生的spr信号。检测结果发现以下化合物产生了明显的spr信号,与空白对照spr信号相比较,差异显著(p<0.05):2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮(英文名称为:2-amino-4,4-diphenyl-1-(2-phenylbutyl)-1h-imidazol-5-one)、2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮(英文名称为:2-amino-1-cyclohexyl-4,4-bis(4-methoxyphenyl)-1h-imidazol-5-one);通过plexerade软件,获得以上小分子化合物的kd值,分别为:12nmol/l、4.1nmol/l。由此可得,这两个化合物可以与plasmepsinii蛋白特异性相结合。综合两次筛选的实验结果,得以下化合物可以与plasmepsinii蛋白相结合,包含这些化合物的小分子芯片可以用于检测生物样品中是否含有plasmepsinii蛋白,进而判断生物样品中是否含有疟原虫:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。(3)与血凝素蛋白(ha蛋白)相互作用的小分子化合物的筛选取1300小分子化合物为待测物、雷帕霉素为阳性对照,分别溶于dmso中,浓度为10mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪将待测物及阳性对照点样于二维光交联芯片表面,25℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露3次,每次180s,光交联固定待测物和阳性对照物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗三次,每次超声波清洗5min,以除去未固定的待测物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活 化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得无标记高通量药物筛选的小分子芯片。按照spri仪器(plexera,v3)的操作手册安装所得芯片,以pbst缓冲溶液(10mmol/l,ph=7.4,0.05%tween20)作为流动相,使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,盐酸的浓度为10mmol/l,ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,首先通入蛋白fkbp12(100nmol/l)300s,用spri仪实时(plexera,v3)检测雷帕霉素与fkbp12蛋白的结合作用,收集spr信号,实时在线观察,发现阳性对照雷帕霉素相比于空白对照有明显的相互作用,与空白对照spr信号相比较,差异显著(p<0.05),说明小分子化合物被很好地固定在芯片表面,可以用于筛选待测物。然后,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液将该小分子芯片重生3次,待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入欲筛选的靶标蛋白ha蛋白(sigma-aldrich中国),溶剂为pbs(73nmol/l)300s,spri仪实时(plexera,v3)检测待测物与靶标蛋白的结合作用,收集spr信号,最后使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的待测物与靶标蛋白ha蛋白相互作用所产生的spr信号。与空白对照的spr信号进行对比,检测结果发现以下化合物产生了明显的spr信号,与空白对照spr信号相比较,差异显著(p<0.05):5h-二苯并[b,f]氮杂卓-5-甲酰胺(英文名称为:5h-dibenz[b,f]azepine-5-carboxamide)、2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐(英文名称为:2-oxazolidinone-5-spiro-4-[8-(2-phenylethyl)piperidine]hydrochloride)、5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐(英文名称为:1-(3,5-dihydroxy-phenyl)-2-((1-(4-hydroxybenzyl)ethyl)amino)-ethanolhydrobromide)、1-乙基-3-哌啶基二苯乙酸酯盐酸盐(英文名称为:1-ethyl-3-piperidyldiphenylacetatehydrochloride);通过plexerade软件,获得以上小分子化合物的kd值,分别为:0.2nmol/l、0.6nmol/l、0.3nmol/l和0.2nmol/l。由此可得,以下化合物可以与ha蛋白特异性相结合,包含这些化合物的小分子芯片可以用于检测生物样品中是否含有ha蛋白,进而判断生物样品中是否含有禽流感病毒:5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐。综上所述,含有以下化合物中的一种或多种的小分子芯片可以用于检测疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白,可以用于制备检测疟原虫天冬氨酸蛋白酶ii蛋白和/或血凝素蛋白的产品:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐。实施例2小分子芯片的制备本实施例所用芯片为二维光交联芯片,该芯片包括固体支持物、两端修饰的聚乙二醇和光交联剂;两端修饰的聚乙二醇为一端由铆定基团修饰,另一端由结合基团修饰的聚乙二醇,固体支持物与铆定基团连接,光交联剂与结合基团连接;铆定基团为-s-s-、结合基团为-oh。取以下小分子化合物:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐;分别溶于dmso中,浓度均为:10mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪将上述十个小分子化合物点样于二维光交联芯片表面,25℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露4次,每次180s,光交联固定各个小分子化合物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗五次,每次超声波清洗5min,以除去未固定的小分子化合物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得小分子芯片。实施例3小分子芯片的制备本实施例所用芯片为三维光交联芯片,该芯片包括固体支持物、引发组合物、引发单体和光交联剂;引发单体通过引发组合物与固体支持物连接,光交联剂与引发单体连接;引发组合物包括引发剂和稀释剂;引发剂为双硫醇引发剂。该芯片的制备方法包括以下步骤:步骤1:取引发剂与稀释剂混合获得引发组合物;步骤2:取固体支持物经预处理后,通过引发组合物引发单体聚合,获得高分子聚合物;步骤3:活化高分子聚合物,与光交联剂经酸胺缩合反应偶联,即得。取以下小分子化合物:(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;分别溶于dmso中,浓度均为:10mm。纯dmso作为空白对照,利用高精度自动化点样仪将上述小分子化合物点样于三维光交联芯片表面,20℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露4次,每次180s,光交联固定各个小分子化合物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗四次,每次超声波清洗5min,以除去未固定的小分子化合物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得小分子芯片。实施例4小分子芯片的制备本实施例所用芯片为二维光交联芯片,该芯片包括固体支持物、两端修饰的聚乙二醇和光交联剂;两端修饰的聚乙二醇为一端由铆定基团修饰,另一端由结合基团修饰的聚乙二醇,固体支持物与铆定基团连接,光交联剂与结合基团连接;铆定基团为-sicl3-、结合基团为-nh2。取以下小分子化合物:3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;分别溶于dmso中,浓度为:10mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪将上述小分子化合物点样于二维光交联芯片表面,30℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露4次,每次180s,光交联固定各个小分子化合物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗六次,每次超声波清洗5min,以除去未固定的小分子化合物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得小分子芯片。实施例5小分子芯片的制备本实施例所用芯片为三维光交联芯片,该芯片包括固体支持物、引发组合物、引发单体和光交联剂;引发单体通过引发组合物与固体支持物连接,光交联剂与引发单体连接;引发组合物包括引发剂和稀释剂;引发剂为双硫醇引发剂。取以下小分子化合物:2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;分别溶于dmso中,浓度为:10mm。纯dmso作为空白对照,利用高精度自动化点样仪将上述小分子化合物点样于三维光交联芯片表面,27℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露4次,每次180s,光交联固定各个小分子化合物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗四次,每次超声波清洗5min,以除去未固定的小分子化合物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得小分子芯片。实施例6小分子芯片的制备本实施例所用芯片为三维光交联芯片,该芯片包括固体支持物、引发组合物、引发单体和光交联剂;引发单体通过引发组合物与固体支持物连接,光交联剂与引发单体连接;引发组合物包括引发剂和稀释剂;引发剂为双硫醇引发剂。取小分子化合物,2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮,溶于dmso中,浓度为:10mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪将上述小分子化合物点样于三维光交联芯片表面,30℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露4次,每次180s,光交联固定各个小分子化合物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗四次,每次超声波清洗5min,以除去未固定的小分子化合物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得小分子芯片。实施例7小分子芯片的制备本实施例所用芯片为二维光交联芯片,该芯片包括固体支持物、两端修饰的聚乙二醇和光交联剂;两端修饰的聚乙二醇为一端由铆定基团修饰,另一端由结合基团修饰的聚乙二醇,固体支持物与铆定基团连接,光交联剂与结合基团连接;铆定基团为-s-s-、结合基团为-nh2。取以下小分子化合物:5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;1-乙基-3-哌啶基二苯乙酸酯盐酸盐;分别溶于dmso中,浓度为:10mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪将上述小分子化合物点样于二维光交联芯片表面,20℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露4次,每次180s,光交联固定各个小分子化合物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗四次,每次超声波清洗5min,以除去未固定的小分子化合物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流 通池,获得小分子芯片。实施例8小分子芯片的制备本实施例所用芯片为三维光交联芯片,该芯片包括固体支持物、引发组合物、引发单体和光交联剂;引发单体通过引发组合物与固体支持物连接,光交联剂与引发单体连接;引发组合物包括引发剂和稀释剂;引发剂为双硫醇引发剂。取以下小分子化合物:5h-二苯并[b,f]氮杂卓-5-甲酰胺;2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;分别溶于dmso中,浓度为10mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪将上述小分子化合物点样于三维光交联芯片表面,30℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露4次,每次180s,光交联固定各个小分子化合物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗六次,每次超声波清洗5min,以除去未固定的小分子化合物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得小分子芯片。实施例9小分子芯片的制备本实施例所用芯片为二维光交联芯片,该芯片包括固体支持物、两端修饰的聚乙二醇和光交联剂;两端修饰的聚乙二醇为一端由铆定基团修饰,另一端由结合基团修饰的聚乙二醇,固体支持物与铆定基团连接,光交联剂与结合基团连接;铆定基团为-sh、结合基团为-och3。取小分子化合物:1-乙基-3-哌啶基二苯乙酸酯盐酸盐,溶于dmso中,浓度为:10mmol/l。纯dmso作为空白对照,利用高精度自动化点样仪将上述小分子化合物点样于二维光交联芯片表面,25℃条件下放置进行干燥。待芯片完全干燥后,在紫外光(波长365nm,0~9999uj/cm2)下暴露4次,每次180s,光交联固定各个小分子化合物。将所得芯片依次浸泡于分析纯dmso、dmf、thf、dcm、mecn、etoh和去离子水中,每种溶剂各清洗五次,每次超声波清洗5min,以除去未固定的小分子化合物。充分清洗完毕,氮气吹干后浸泡于乙醇胺(1mol/l,ph=8.5)30min,使未结合的活化位点失活。依次用乙醇、去离子水进行清洗,每种溶剂各清洗3次,氮气吹干,盖上流通池,获得小分子芯片。实施例10小分子芯片与疟原虫天冬氨酸蛋白酶ii蛋白(plasmepsinii蛋白)和血凝素蛋白(ha蛋白)的结合试验plasmepsinii蛋白,来源于sigma-aldrich中国,溶解于pbs;ha蛋白,来源于sigma-aldrich中国,溶解于pbs。设置四个组别,分别为实验组1、实验组2、实验组3和对照组,其中,实验组1以plasmepsinii蛋白为待测样品,浓度为1ug/ml;实验组2以ha蛋白为待测样品,浓度为1ug/ml;实验组3以plasmepsinii蛋白和ha蛋白的混合溶液为待测样品,其中plasmepsinii蛋白的浓度为1ug/ml,ha蛋白的浓度为1ug/ml;对照组为pbst溶液;取实施例2制备获得的小分子芯片,分别对以上三个组别的待测样品和对照组进行检测,检测方法为:按照spri仪器的操作手册安装该芯片,以pbst缓冲溶液(10mmol/l,ph=7.4,0.05%tween20)作为流动相,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测样品300s,spri仪实时检测小分子化合物与蛋白的结合作用,收集spr信号,最后使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调节至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的小分子化合物与蛋白相互作用所产生的spr信号,计算kd值;将待测样品的spr信号与空白对照的spr信号进行对比,如果待测样品具有显著(p<0.05)的spr信号,表明待测样品中含有plasmepsinii蛋白和/或ha蛋白,各个组别所得实验结果见表1,其中:化合物1为小分子芯片中的(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;化合物2为小分子芯片中的(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;化合物3为3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;化合物4为6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;化合物5为2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;化合物6为2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;化合物7为5h-二苯并[b,f]氮杂卓-5-甲酰胺;化合物8为2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;化合物9为5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;化合物10为1-乙基-3-哌啶基二苯乙酸酯盐酸盐。表1各个组别检测结果从表1中可知,对比各个组别相同的化合物对待测样品的结合作用检测结果可知,实施例2制备获得的小分子芯片中的化合物1至化合物6,即(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮、(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐、3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐、6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉、2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮、2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮,对plasmepsinii蛋白产生了结合作用,具有显著(p<0.05)的spr信号,而对ha蛋白、溶剂没有结合作用,说明实施例2制备获得的小分子芯片可以用于检测待测样品中的plasmepsinii蛋白。根据实验结果还可知,实施例2制备获得的小分子芯片中的化合物7至化合物10,即5h-二苯并[b,f]氮杂卓-5-甲酰胺、2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐、5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐、1-乙基-3-哌啶基二苯乙酸酯盐酸盐,对ha蛋白产生了结合作用,具有显著(p<0.05)的spr信号,而对plasmepsinii蛋白、溶剂没有结合作用,说明实施例2制备获得的小分子芯片可以用于检测待测样品中的ha蛋白。从实验组3实验结果中可以看出,本发明实施例2制备获得的小分子芯片所有小分子都产生了显著(p<0.05)的spr信号,即说明待测样品中含有plasmepsinii蛋白和ha 蛋白,可以同时检测出样品中含有的plasmepsinii蛋白和ha蛋白。综合以上实验结果可知,实施例2制备获得的小分子芯片的小分子化合物可以与plasmepsinii蛋白和/或ha蛋白结合,该小分子芯片可以用于检测待测样品中是否含有plasmepsinii蛋白和/或ha蛋白。采用相同的实验方法检测实施例3至实施例9制备获得的小分子芯片对plasmepsinii蛋白和/或ha蛋白的结合作用,获得了相似的实验结果,即实施例3至实施例9制备获得的小分子芯片中的小分子化合物可以与plasmepsinii蛋白或ha蛋白结合,可以用于检测待测样品中是否含有plasmepsinii蛋白或ha蛋白。实施例11小分子芯片检测疟原虫天冬氨酸蛋白酶ii蛋白(plasmepsinii蛋白)和/或血凝素蛋白(ha蛋白)的准确性验证取样品a至样品f作为待测样品,样品a至样品f中的plasmepsinii蛋白和ha蛋白情况见表2:表2已知样品a至样品f中的plasmepsinii蛋白和ha蛋白情况蛋白样品a样品b样品c样品d样品e样品fplasmepsinii蛋白++——+—ha蛋白—++——+“+”表示含有;“—”表示不含设置实验组1至实验组6,实验组1所用待测样品为样品a;实验组2所用待测样品为样品b;实验组3所用待测样品为样品c;实验组4所用待测样品为样品d;实验组5所用待测样品为样品e;实验组6所用待测样品为样品f。取实施例2制备获得的小分子芯片,分别对各个组别进行检测,检测方法为:按照spri仪器的操作手册安装该芯片,以pbst缓冲溶液(10mmol/l,ph=7.4,0.05%tween20)作为流动相,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测样品300s,spri仪实时检测小分子化合物与蛋白的结合作用,收集spr信号,最后使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的小分子化合物与蛋白相互作用所产生的spr信号,计算kd值;将待测样品的spr信号与空白对照的spr信号进行对比,如果待测样品具有显著(p<0.05)的spr信号,表明待测样品中含有plasmepsinii蛋白和/或ha蛋白,各个组别所得实验结果见表3,其中:化合物1为小分子芯片中的(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;化合物2为小分子芯片中的(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;化合物3为3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;化合物4为6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;化合物5为2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;化合物6为2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;化合物7为5h-二苯并[b,f]氮杂卓-5-甲酰胺;化合物8为2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;化合物9为5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸 盐;化合物10为1-乙基-3-哌啶基二苯乙酸酯盐酸盐。表3各个组别检测结果从表3中可知,样品a、样品b、样品e与小分子芯片中的化合物1至化合物6,即(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮、(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐、3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐、6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉、2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮、2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮,发生了结合作用,具有显著(p<0.05)的spr信号,说明样品a、样品b、样品e中含有plasmepsinii蛋白,与实际情况相一致。样品b、样品c、样品f与小分子芯片中的化合物7至化合物10,即5h-二苯并[b,f]氮杂卓-5-甲酰胺、2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐、5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐、1-乙基-3-哌啶基二苯乙酸酯盐酸盐,发生了结合作用,具有显著(p<0.05)的spr信号,说明样品b、样品c、样品f中含有ha蛋白,与实际情况相一致。而样品d没有检测到明显的spr信号,也就是既没有plasmepsinii蛋白也没有ha蛋白,也与实际情况相一致。综合以上实验结果可知,实施例2制备获得的小分子芯片可以用于检测plasmepsinii蛋白和/或ha蛋白,检测准确率为100%。采用相同的实验方法检测实施例3至实施例9制备获得的小分子芯片对样品a至样品f进行检测,获得了类似的实验结果,检测准确率为100%。说明本发明提供的制备方法制备获得小分子芯片可以用于检测plasmepsinii蛋白和/或ha蛋白,检测准确率为100%。实施例12小分子芯片检测疟原虫天冬氨酸蛋白酶ii蛋白(plasmepsinii蛋白)和/或血凝素蛋白(ha蛋白)的重现性验证取plasmepsinii蛋白、ha蛋白进行混合,pbst为溶剂,作为待测样品,其中ha蛋白的浓度为1μg/ml;plasmepsinii蛋白的浓度为1μg/ml;平均分为三个样品,待用。取实施例2制备获得的小分子芯片,分别对所得的三个样品进行检测,分别标记为第一组、第二组和第三组,检测方法相同,操作步骤如下:取实施例2制备获得小分子芯片,按照spri仪器的操作手册安装该芯片,以pbst缓冲溶液(10mmol/l,ph=7.4,0.05%tween20)作为流动相,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测样品300s,spri仪实时检测小分子化合物与蛋白的结合作用,收集spr信号,最后使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的小分子化合物与蛋白相互作用所产生的spr信号,计算kd值;将待测样品的spr信号与空白对照的spr信号进行对比,如果待测样品具有显著(p<0.05)的spr信号,表明待测样品中含有plasmepsinii蛋白和/或ha蛋白,各个组别所得实验结果见表4。其中:化合物1为小分子芯片中的(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;化合物2为小分子芯片中的(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;化合物3为3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;化合物4为6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;化合物5为2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;化合物6为2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;化合物7为5h-二苯并[b,f]氮杂卓-5-甲酰胺;化合物8为2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;化合物9为5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;化合物10为1-乙基-3-哌啶基二苯乙酸酯盐酸盐。表4实施例2制备获得的小分子芯片检测所得实验结果根据表4所示实验结果,可知所有组别的所有小分子化合物均与plasmepsinii蛋白或ha蛋白发生了结合,具有显著(p<0.05)的spr信号。针对芯片上的一个小分子化合物,与空白对照组相比,每个小分子化合物在不同组别与plasmepsinii蛋白或ha蛋白均产生了显著(p<0.05)的spr信号;对比每个小分子化合物在不同组别与plasmepsinii蛋白或ha蛋白相互作用的kd值,发现三个组别的kd值相差不大,无显著性差异(p>0.05)。以上实验结果说明了实施例2提供的制备方法制备获得的小分子芯片可以用于检测plasmepsinii蛋白和ha蛋白,重现性好,可以用于制备检测plasmepsinii蛋白和ha蛋白的产品。实施例13小分子芯片检测疟原虫天冬氨酸蛋白酶ii蛋白(plasmepsinii蛋白)重现性验证取plasmepsinii蛋白作为待测样品,用pbst稀释,配置成浓度为1μg/ml的plasmepsinii蛋白溶液,平均分为三个样品,待用。取实施例3制备获得的小分子芯片,分别对所得的三个样品进行检测,分别标记为第一组、第二组和第三组,检测方法相同,操作步骤如下:按照spri仪器的操作手册安装该芯片,以ch3coona缓冲溶液(20mmol/l,ph=4.7,0.01%tween20)作为流动相,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测样品,即plasmepsinii蛋白300s,spri仪实时检测小分子化合物与plasmepsinii蛋白的结合作用,收集spr信号,最后使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调节至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所 得数据,扣除空白背景后,即为不同的小分子化合物与plasmepsinii蛋白相互作用所产生的spr信号,与空白对照的spr信号进行对比,所得实验结果见表5,其中:化合物1为小分子芯片中的(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;化合物2为小分子芯片中的(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;化合物3为3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;化合物4为6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;化合物5为2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;化合物6为2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。表5实施例3制备获得的小分子芯片检测所得实验结果根据表5所示实验结果,可知,所有组别的所有小分子化合物均与plasmepsinii蛋白发生了作用,产生了显著(p<0.05)的spr信号;与空白对照组相比,每个小分子化合物在不同组别与plasmepsinii蛋白均产生了显著(p<0.05)的spr信号;对比每个小分子化合物在不同组别与plasmepsinii蛋白相互作用的kd值,发现三个组别的kd值相差不大,无显著性差异(p>0.05)。以上实验结果说明了实施例3提供的制备方法制备获得的小分子芯片可以用于检测plasmepsinii蛋白,重现性好,可以用于制备检测plasmepsinii蛋白的产品。采用相同的实验方法,考察实施例2、实施例4至实施例6制备获得的小分子芯片检测plasmepsinii蛋白的重现性,获得了类似的实验结果,说明实施例2、实施例4至实施例6提供的制备方法制备获得的小分子芯片可以用于检测plasmepsinii蛋白,重现性好,可以用于制备检测plasmepsinii蛋白的产品。实施例14小分子芯片检测血凝素蛋白(ha蛋白)的重现性验证取ha蛋白,作为待测样品,用pbst稀释,配置成浓度为1μg/ml的ha蛋白溶液,平均分为三个样品,待用。取实施例7制备获得的小分子芯片,分别对所得的三个样品进行检测,分别标记为第一组、第二组和第三组,检测方法相同,操作步骤如下:取实施例7制备获得小分子芯片,按照spri仪器的操作手册安装该芯片,以pbst缓冲溶液(10mmol/l,ph=7.4,0.05%tween20)作为流动相,使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测样品,即ha蛋白300s,spri仪实时检测小分子化合物与ha蛋白的结合作用,收集spr信号,最后使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的小分子化合物与ha蛋白相互作用所产生的spr信号,与空白对照的spr信号进行对比,所得实验结果见表6,其中:化合物a为5h-二苯并[b,f]氮杂卓-5-甲酰胺;化合物b为2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;化合物c为5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;化合物d为1-乙基-3-哌啶基二苯乙酸酯盐酸盐。表6实施例7制备获得的小分子芯片检测所得实验结果根据表6所示实验结果,可知所有组别的所有小分子化合物均与ha蛋白发生了结合,产生了显著(p<0.05)的spr信号;与空白对照组相比,每个小分子化合物在不同组别与ha蛋白均产生了显著(p<0.05)的spr信号;对比每个小分子化合物在不同组别与ha蛋白相互作用的kd值,发现三个组别的kd值相差不大,无显著性差异(p>0.05)。以上实验结果说明了实施例7提供的制备方法制备获得的小分子芯片可以用于检测ha蛋白,重现性好。采用相同的实验方法,考察实施例2、实施例8、实施例9制备获得的小分子芯片检测ha蛋白的重现性,获得了类似的实验结果,说明实施例2、实施例8、实施例9提供 的制备方法制备获得的小分子芯片可以用于检测ha蛋白,重现性好,可以用于制备检测ha蛋白的产品。实施例15利用小分子芯片检测生物样品待测生物样品的来源及处理方法:从血型、大小相同的成年大鼠的左心房中,抽取血液0.1ml,用pbst稀释10倍至1ml,在其中添加plasmepsinii蛋白和ha蛋白的样品,最终浓度均为1μg/ml,即得待测样品。该生物样品中含有ha蛋白和plasmepsinii蛋白,均来源于sigma-aldrich中国,大鼠来源于广州生物医药与健康研究院。取实施例2制备获得小分子芯片,按照spri仪器的操作手册安装该芯片,以pbst缓冲溶液(10mmol/l,ph=7.4,0.05%tween20)作为流动相,使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调节至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测生物样品300s,spri仪实时(plexera,v3)检测小分子化合物与待测生物样品的结合作用,收集spr信号,最后使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调节至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的小分子化合物与待测生物样品相互作用所产生的spr信号,与空白对照的spr信号进行对比,所得实验结果见表7。其中:化合物1为小分子芯片中的(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;化合物2为小分子芯片中的(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;化合物3为3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;化合物4为6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;化合物5为2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;化合物6为2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;化合物7为5h-二苯并[b,f]氮杂卓-5-甲酰胺;化合物8为2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;化合物9为5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;化合物10为1-乙基-3-哌啶基二苯乙酸酯盐酸盐。表7实施例2制备获得的小分子芯片检测待测生物样品的所得实验结果根据表7可知,所有小分子化合物均产生了显著(p<0.05)的spr信号,其中化合物1至化合物6所产生的spr信号说明待测生物样品中含有plasmepsinii蛋白,化合物7至化合物10所产生的spr信号说明待测生物样品中含有ha蛋白,所以可以推断待测样品中含有plasmepsinii蛋白和ha蛋白,与实际情况相符合,说明实施例2提供的芯片能够用于检测生物样品中的ha蛋白和plasmepsinii蛋白,可以用于制备检测ha蛋白和plasmepsinii蛋白的产品。实施例16利用小分子芯片检测生物样品待测生物样品的来源及处理方法:从血型、大小相同的成年大鼠的左心房中,抽取血液0.1ml,用pbst稀释10倍至1ml,其中添加plasmepsinii蛋白,最终浓度为1μg/ml,即得待测样品。该生物样品中含有plasmepsinii蛋白,来源于sigma-aldrich中国,大鼠来源于广州生物医药与健康研究院。取实施例2制备获得小分子芯片,按照spri仪器的操作手册安装该芯片,以ch3coona缓冲溶液(20mmol/l,ph=4.7,0.01%tween20)作为流动相,使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调节至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测生物样品300s,spri仪实时(plexera,v3)检测小分子化合物与待测生物样品的结合作用,收集spr信号,最后使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,盐酸的浓度为10mmol/l,ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的小分子化合物与待测生物样品相互作用所产生的spr信号,与空白对照的spr信号进行对比,所得实验结果见表8。其中:化合物1为小分子芯片中的(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;化合物2为小分子芯片中的(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;化合物3为3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;化合物4为6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;化合物5为2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;化合物6为2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;化合物7为5h-二苯并[b,f]氮杂卓-5-甲酰胺;化合物8为2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;化合物9为5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;化合物10为1-乙基-3-哌啶基二苯乙酸酯盐酸盐。表8实施例2制备获得的小分子芯片检测待测生物样品的所得实验结果根据表8可知,化合物1至化合物6均产生了显著(p<0.05)的spr信号,而化合物7至化合物10均没有产生spr信号,说明待测生物样品中含有plasmepsinii蛋白而不含ha蛋白,与实际情况相符合,说明实施例2提供的芯片能够用于检测生物样品中的plasmepsinii蛋白,可以用于制备检测plasmepsinii蛋白的产品。实施例17利用小分子芯片检测生物样品待测生物样品的来源及处理方法:从血型、大小相同的成年大鼠的左心房中,抽取血液0.1ml,用pbst稀释10倍至1ml,其中添加ha蛋白;ha蛋白的最终浓度为1μg/ml,即得待测样品。该生物样品中含有ha蛋白,来源于sigma-aldrich中国,大鼠来源于广州生物医药与健康研究院。取实施例2制备获得小分子芯片,按照spri仪器的操作手册安装该芯片,以pbst缓冲溶液(10mmol/l,ph=7.4,0.05%tween20)作为流动相,使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测生物样品300s,spri仪实时检测小分子化合物与待测生物样品的结合作用,收集spr信号,最后使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调节至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的小分子化合物与待测生物样品相互作用所产生的spr信号,与空白对照的spr信号进行对比,所得实验结果见表9。其中:化合物1为小分子芯片中的(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;化合物2为小分子芯片中的(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;化合物3为3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;化合物4为6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;化合物5为2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;化合物6为2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮;化合物7为5h-二苯并[b,f]氮杂卓-5-甲酰胺;化合物8为2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;化合物9为5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;化合物10为1-乙基-3-哌啶基二苯乙酸酯盐酸盐。表9实施例2制备获得的小分子芯片检测待测生物样品的所得实验结果根据表9可知,化合物1至化合物6均没有产生spr信号,而化合物7至化合物10均产生了显著(p<0.05)的spr信号,说明待测生物样品中含有ha蛋白而不含plasmepsinii蛋白,与实际情况相符合,说明实施例2提供的芯片能够用于检测生物样品中的ha蛋白,可以用于制备检测ha蛋白的产品。实施例18利用小分子芯片检测生物样品待测生物样品的来源及处理方法:从感染了疟疾的成年大鼠的左心房中,抽取血液0.1ml,用pbst稀释10倍至1ml(生物样品中含有疟原虫,即含有plasmepsinii蛋白),即得待测样品。该生物样品中含有plasmepsinii蛋白,感染了疟疾的成年大鼠来源于广州生物医药与健康研究院。取实施例3制备获得小分子芯片,按照spri仪器的操作手册安装该芯片,以ch3coona缓冲溶液(20mmol/l,ph=4.7,0.01%tween20)作为流动相,使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测生物样品300s,spri仪实时检测小分子化合物与待测生物样品的结合作用,收集spr信号,最后使用甘氨酸+盐酸(添加盐酸调至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的小分子化合物与待测生物样品相互作用所产生的spr信号,与空白对照的spr信号进行对比,所得实验结果见表10。其中:化合物1为小分子芯片中的(8r,9s,13s,14s,17r)-13-甲基-17-乙基-17-羟基-1,2,4,6,7,8,9,11,12,14,15,16-十二环戊醇[1]苯丙氨酸-3-酮;化合物2为小分子芯片中的(2s,5r,6r)-6-[[3-(2-氯-6-氟苯基)-5-甲基-1,2-恶唑-4-甲酰]氨基]-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐;化合物3为3-(3-乙基六氢-1-甲基-1h-氮杂卓-3-基)苯酚盐酸盐;化合物4为6-乙氧基-2,2,4-三甲基-1,2-二氢喹啉;化合物5为2-氨基-4,4-二苯基-1-(2-苯基丁基)-1h-咪唑-5-酮;化合物6为2-氨基-4,4-双(4-甲氧基苯基)-1-环己基-1h-咪唑-5-酮。表10实施例3制备获得的小分子芯片检测待测生物样品的所得实验结果根据表10可知,所有小分子化合物均产生了显著(p<0.05)的spr信号,说明待测生物样品中含有plasmepsinii蛋白,反映了待测生物样品中含有疟原虫,与实际情况相符合,说明实施例3提供的芯片能够用于检测生物样品中的plasmepsinii蛋白,可以用于制备检测plasmepsinii蛋白的产品。采用相同的实验方法,考察实施例4至实施例6制备获得的小分子芯片在检测生物样品中的应用,获得了类似的实验结果,说明实施例4至实施例6提供的制备方法制备获得的小分子芯片可以用于检测生物样品中的plasmepsinii蛋白,可以用于制备检测plasmepsinii蛋白的产品。实施例19利用小分子芯片检测生物样品待测生物样品的来源及处理方法:从感染了禽流感病毒的成年大鼠的左心房中,抽取血液0.1ml,用pbst稀释10倍至1ml(所得生物样品中含有禽流感病毒,即含有ha蛋白),即得待测样品。取实施例7制备获得小分子芯片,按照spri仪器的操作手册安装该芯片,以pbst缓冲溶液(10mmol/l,ph=7.4,0.05%tween20)作为流动相,使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调至ph=2.0)水溶液重生3次,至基线平稳。待基线稳定后,设定进样方法,进样方法为:样品(2μl/s,300s),重生液(3μl/s300s),缓冲液(2μl/s,300s);通入待测生物样品300s,spri仪实时检测小分子化合物与待测生物样品的结合作用,收集spr信号,最后使用甘氨酸+盐酸(甘氨酸的浓度为10mmol/l,添加盐酸调至ph=2.0)水溶液重生3次,直至基线平稳。操作完毕,保存完整的数据,然后使用数据分析软件(plexerade软件)离线处理所得数据,扣除空白背景后,即为不同的小分子化合物与待测生物样品相互作用所产生的spr信号,与空白对照的spr信号进行对比,所得实验结果见表11。其中:化合物a为5h-二苯并[b,f]氮杂卓-5-甲酰胺;化合物b为2-噁唑烷酮-5-螺-4-[8-(2-苯基乙基)哌啶]盐酸盐;化合物c为5-[1-羟基-2-[[2-(4-羟基苯基)-1-甲基乙基]氨基]乙基]-1,3-苯二酚氢溴酸盐;化合物d为1-乙基-3-哌啶基二苯乙酸酯盐酸盐。表11实施例7制备获得的小分子芯片检测待测生物样品的所得实验结果根据表11可知,所有小分子化合物均产生了显著(p<0.05)的spr信号,说明待测生物样品中含有ha蛋白,反映了待测生物样品中含有禽流感病毒,与实际情况相符合,说明实施例7提供的芯片能够用于检测生物样品中的ha蛋白,可以用于制备检测ha蛋白的产品。采用相同的实验方法,考察实施例8、实施例9制备获得的小分子芯片在检测生物样品中的应用,获得了类似的实验结果,说明实施例8、实施例9提供的制备方法制备获得的小分子芯片可以用于检测生物样品中的ha蛋白,可以用于制备检测ha蛋白的产品。以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本
技术领域:
的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1