辛芍提取物中有效成分在Caco-2细胞模型中吸收转运量的测定方法与流程
本发明属于中药检测技术领域,尤其是涉及辛芍提取物中有效成分在Caco-2细胞模型中吸收转运量的测定方法。
背景技术:
辛芍组方,来源于贵州民间验方,由灯盏细辛和赤芍配伍组成在民间以其汤剂煎服用于治疗偏瘫,有较好的临床基础。本方根据风痰流窜经络,血脉痹阻,经隧不通,气不能行,血不能濡,故肢体废而不用成半身不遂的病因病机,采取活血化淤通络之法。以灯盏细辛为君,化淤通络,赤芍凉血热、通经络,治血热淤滞,助君药以达活血化淤、散淤通络之效。同时,课题组通过现代药理学研究表明,辛芍组方具有抗凝血、抗血栓形成、软化扩张血管、改善脑缺血等作用。但辛芍组方的体内过程、吸收机理、吸收影响因素并不是很明确,有待于进一步研究。
口服用药是中医药治疗的主要手段,现代研究证明,药物口服后透过胃肠道上皮细胞进入血流,随体循环系统分布到各组织器官或靶点,并在达到一定的血药浓度时才能发挥疗效。因此,研究中药的体内吸收特征及机制,对于合理设计药物剂型,阐明中药起效的作用物质基础,对揭开中药体内过程这一“黑箱”至关重要。由于小肠是主要的吸收部位,科学的肠吸收研究方法可使我们了解肠内酶及其细胞的屏障作用对药物吸收的影响,获得药物在肠道的吸收动力学、有效吸收部位、吸收机制、影响吸收的因素等信息。目前研究药物口服吸收的模型主要有体内和体外两部分,其中Caco-2细胞模型法因接近药物在人体内吸收的实际环境,并具有较高的重现性,兼具快速、易于控制、干扰小、可连续检测等优点,而成为近年来国内外公认的体外研究药物肠吸收较为理想的模型。
利用体外模型-“Caco-2细胞”筛选中药的吸收成分(群),再与中药的原有成分比较分析的基础上,明确可被吸收成分,为中药质量评价指标成分的选取提供依据,以得到了广泛的应用。并借助超高压液相色谱-高分辨电喷雾四级杆-飞 行时间质谱仪(UHPLC-ESI-Q-TOF)对辛芍提取物透过细胞膜的可被吸收成分进行分析,通过与对照品进行比对的基础上确定透过细胞膜进入细胞内的可被吸收成分。
因此,采用Caco-2细胞摄取模型,运用超高液相色谱-高分辨电喷雾四级杆(UPLC-MS/MS)对辛芍提取物可被吸收成分进行分析,确定中药成分摄取进入细胞的量。在此基础上考察不同浓度、时间、温度、pH对可被吸收成分吸收的影响,为辛芍提取物的口服剂型研究及配伍合理性研究提供一定的理论依据与基础。本领域技术人员虽然对辛芍组方的化学成分,药理作用、体内药动学特征等进行大量的研究,但其体内吸收过程并不很明确,并且国内外对其吸收机制的研究也少有报道。
技术实现要素:
本发明的目的是提供一种辛芍提取物中有效成分在Caco-2细胞模型中吸收转运量的测定方法,以考察不同浓度、时间、温度、pH对可被吸收成分吸收的影响,为辛芍提取物的口服剂型研究及配伍合理性研究提供一定的理论依据与基础。
本发明通过以下技术方案实现该目的:
本发明的辛芍提取物中有效成分在Caco-2细胞模型中吸收转运量的测定方法包括以下步骤:
步骤1:制备辛芍提取物供试药液;
步骤2:用芍药内酯苷、没食子酸,咖啡酸、灯盏乙素、灯盏甲素制备作为对照品的系列标准溶液;
步骤3:以葛根素配制内标溶液;
步骤4:建立人源结肠腺癌细胞系Caco-2细胞模型;
步骤5:将步骤1得到的供试药液和步骤2得到的系列标准溶液分别加入Caco-2细胞模型,用HBSS并快速清洗三遍细胞单分子层,加入空白细胞裂解液反复冻融裂解细胞,裂解细胞后,分别得到供试品和对照品的含药的细胞悬液;
步骤6:用UPLC-MS测定步骤5中得到的含药的细胞悬液中芍药内酯苷、没食子酸、咖啡酸、灯盏乙素、灯盏甲素5个活性成分的吸收量;
步骤7:取步骤5中得到含药的细胞悬液加入内标溶液,加入乙腈沉淀蛋白,涡混和离心处理,取上清液进样分析,测定芍药内酯苷、没食子酸、咖啡酸、灯盏乙素和灯盏甲素的浓度;另取步骤5中得到含药的细胞裂解液以考马斯亮蓝法测定蛋白含量。
其中,步骤1中辛芍提取物供试药液的制备方法如下:取辛芍提取物,加入适量的PH6的HBSS缓冲溶液,超声10min,5000r·min-1离心5min,取上清液备用,获得10.0g·L-1的供试液。
优选的,步骤2中系列标准溶液的制备方法如下:精密称取芍药内酯苷、没食子酸,咖啡酸、灯盏乙素、灯盏甲素适量,用甲醇定容至10mL;获得芍药内酯苷、没食子酸,咖啡酸,灯盏乙素和灯盏甲素的储备液;分别精密量取5种对照品储备液适量,用甲醇按梯度稀释成所需浓度,得混合系列标准溶液,置冰箱保存备用。
优选的,步骤3中内标溶液的配制方法如下:精密称取葛根素,用甲醇定容至25mL,获得葛根素的储备液;取该储备液适量至10mL容量瓶中,用甲醇定容至刻度,配制成10mg·L-1的内标溶液,置冰箱保存备用。
优选的,步骤4中人源结肠腺癌细胞系Caco-2细胞模型的建立方法如下:将50代以内的Caco-2细胞株接种于培养培养瓶中,置于5%CO2,37℃培养箱中培养;待细胞生长融合约80%贴壁时,采用胰蛋白酶消化,将细胞混悬液种植于6孔培养板中,种植密度为10×104个·cm-2,接种24h后更换培养液,以后隔天换培养液1次,1周后每天换液1次,单层细胞于9~12天左右分化形成。
优选的,步骤5中空白细胞裂解液的制备方法如下:取培养14d的单层膜细胞,加入用PH7.4的HBSS溶液配制而成的0.1%Triton X-100细胞裂解液500μL反复冻融裂解细胞,冷冻保存备用。
优选的,步骤6中UPLC-MS条件如下:
色谱条件:Waters Acquity BEH C18(2.1mm×50mm,1.7μm)色谱柱;流动相0.1%甲酸乙腈(A)-0.1%甲酸水(B),梯度洗脱:0~3min:5~25%A;3~4min:25~95%A;4~5min:95~5%A;流速0.35mL·min-1;柱温:45℃;进样体积1μL;
质谱条件:电喷雾电离源(ESI);毛细管电压3kV;离子源温度120℃;去 溶剂气温度350℃;去溶剂气流量650L·h-1;碰撞气流量0.16mL·min-1;扫描方式为多反应离子监测模式(MRM)。
本发明建立人源结肠腺癌细胞系Caco-2细胞模型,采用UPLC-MS法测定辛芍提取物中芍药内酯苷、没食子酸、咖啡酸、灯盏乙素、灯盏甲素5个活性成分在细胞裂解液中的含量。并用此模型分别研究pH、时间、温度以及药物浓度对辛芍提取物中芍药内酯苷等5种成分的吸收影响,并且考察在P-糖蛋白抑制剂存在与否时5种成分转运情况,预测这5种成分在Caco-2细胞中的吸收机制。
实验结果表明,在37℃环境下,辛芍组方提取物中5种成分的摄取具有一定的时间依赖性;在0.5~12.5g·L-1,摄取呈浓度依赖性,符合被动扩散过程;在pH4.0~7.4,咖啡酸、灯盏乙素、灯盏甲素3个成分的细胞吸收量随pH增加而降低;在温度4~37℃,咖啡酸的细胞吸收量随着温度的增加而降低,而其余4个成分随着温度的增加而增加;加入P-糖蛋白抑制剂维拉帕米和环孢菌素A,咖啡酸与灯盏乙素的细胞摄取量显著增加(P<0.05)。说明辛芍提取物中芍药内酯苷等5种成分的吸收机制可能为被动扩散,且P-糖蛋白参与灯盏乙素和咖啡酸的吸收过程。
附图说明
图1示意芍药内酯苷等5种成分的UPLC-MS图-A部分(空白细胞悬液);
图2示意芍药内酯苷等5种成分的UPLC-MS图-B部分(空白细胞悬液加对照品溶液);
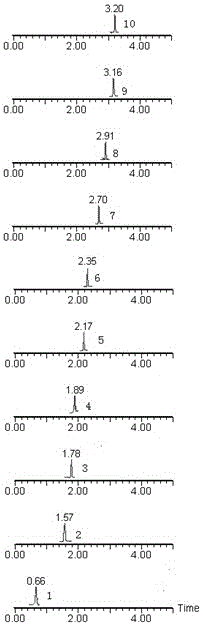
图3示意芍药内酯苷等5种成分的UPLC-MS图-C部分(实测样品);
图1-图3中:1.没食子酸;2.咖啡酸;3.葛根素;4.芍药内酯苷;5.灯盏乙素;6.灯盏甲素;
图4示意辛芍提取物不同浓度对Caco-2细胞吸收的影响;
图5示意辛芍提取物不同时间对Caco-2细胞吸收的影响(注:与pH4.0相比 1)P<0.05;与pH6.0相比2)P<0.05);
图6示意辛芍提取物不同pH对CaCo-2细胞吸收的影响(注:与4℃相比 1)P<0.05;与25℃相比2)P<0.05);
图7示意辛芍提取物不同温度对Caco-2细胞吸收的影响。
具体实施方式
下面结合附图和实施例对本发明作进一步的详细说明。
实施例1:
1仪器与材料
1材料
辛芍提取物(自制,批号20150615);葛根素(批号0752-9605,纯度>98%),没食子酸(批号110831-201204,纯度>98%),咖啡酸(批号110885-200102,纯度>98%),灯盏乙素(批号110842-201207,纯度>98%),灯盏甲素(批号1384-101215,纯度>98%)购于中国食品药品检定研究院,芍药内酯苷(批号S37-100126,纯度>98%)购于中药固体制剂制造技术国家工程研究中心;Caco-2细胞株(ATCC);青霉素-链霉素,0.25%胰蛋白酶-0.02%EDTA消化液,Hank′s缓冲溶液,DMEM培养基,非必需氨基酸(Gibco公司);考马斯亮蓝(南京建成生物工程研究所);胎牛血清(杭州四季青生物工程材料有限公司);MTT,Triton X-100,DMSO(北京荣宝莱科技有限公司);盐酸维拉帕米(批号29940,阿拉丁试剂上海有限公司),头孢菌素A(批号201212,北京博奥拓达科技有限公司);甲醇,乙腈,甲酸(色谱纯,Merck公司),去离子水(自制)。
超高效液相色谱-三重四极杆串联质谱联用仪,Masslynx 4.1质谱工作站(waters公司);Allegra 64R低温高速离心机(Beckman Coulter公司);CO2培养箱(Thermo scientific公司);Milli cell-ERS电位仪(Millipore公司);相差显微观察系统(Nikon公司);680型酶标仪(伯乐生命医学产品有限公司);UV-2401PC紫外分光光度计(岛津公司)。
2方法
2.1溶液的配制
2.1.1辛芍提取物供试药液的制备:取辛芍提取物,加入适量的PH6的HBSS缓冲溶液,超声10min,5000r·min-1离心5min,取上清液备用,获得10.0g·L-1的供试液。没食子酸、芍药内酯苷、咖啡酸、灯盏乙素、灯盏甲素在提取物中的含量分别为4.26%、7.45%、0.16%、50.02%、12.3%。
2.1.2系列标准溶液的配制:精密称取芍药内酯苷、没食子酸,咖啡酸、灯盏乙素、灯盏甲素适量,用甲醇定容至10mL。获得芍药内酯苷(0.968g·L-1)和没食子酸(0.68g·L-1),咖啡酸(0.497g·L-1),灯盏乙素(0.994g·L-1),灯盏甲素(1.06 g·L-1),的储备液。分别精密量取芍药内酯苷等5种对照品储备液适量,用甲醇按梯度稀释成所需浓度,得混合系列标准溶液,置冰箱(-20℃)保存,备用。各成分系列浓度见表1。
表1芍药内酯苷等5种成分系列标准溶液 mg·L-1
2.1.3内标溶液的配制:精密称取葛根素(10.33mg),用甲醇定容至25mL。获得葛根素(0.4132g·L-1)的储备液。取内标储备液适量至10mL容量瓶中,用甲醇定容至刻度,配制成10mg·L-1的内标溶液,置冰箱(-20℃)保存,备用。
2.1.4空白细胞裂解液的配制:取培养14d的单层膜细胞,加入0.1%Triton X-100(PH7.4的HBSS溶液配制)细胞裂解液500μL反复冻融裂解细胞,置冰箱(-80℃)保存,备用。
2.2UPLC-MS条件
2.2.1色谱条件:Waters Acquity BEH C18(2.1mm×50mm,1.7μm)色谱柱;流动相0.1%甲酸乙腈(A)-0.1%甲酸水(B),梯度洗脱:0~3min:5~25%A;3~4min:25~95%A;4~5min:95~5%A;流速0.35mL·min-1;柱温:45℃;进样体积1μL。
2.2.2质谱条件:电喷雾电离源(ESI);毛细管电压3kV;离子源温度120℃;去溶剂气温度350℃;去溶剂气流量650L·h-1;碰撞气流量0.16mL·min-1;扫描方式为多反应离子监测模式(MRM),各成分定量离子对分别为:芍药内酯苷m/z(+)481.3/105.0,没食子酸m/z(-)168.9/125.0,咖啡酸m/z(-)179.1/135.0,灯盏乙素m/z(+)463.1/287.1,灯盏甲素m/z(+)447.0/271.1,葛根素m/z(+)417.0/267.0。
2.3Caco-2细胞模型的建立:将50代以内的Caco-2细胞株接种于培养培养瓶中,置于5%CO2,37℃培养箱中培养。待细胞生长融合约80%贴壁时,采用胰蛋白酶消化,将细胞混悬液种植于6孔培养板中,种植密度为10×104个·cm-2,接种24h后更换培养液,以后隔天换培养液1次,1周后每天换液1次,单层细胞于 9~12天左右分化形成,符合要求可用于实验。
2.4药物摄取实验:将培养14d的单层膜细胞用pH6,37℃的HBSS缓冲溶液在培养箱中培养20min后,吸去缓冲溶液。用HBSS缓冲溶液轻轻洗去细胞单分子层表面的杂质,连续冲洗2遍。将待测药物加入细胞表面,置37℃恒温箱培养1h,取出后,加入4℃的HBSS并快速清洗三遍细胞单分子层。加入0.1%Triton X-100细胞裂解液500μL,反复冻融裂解细胞,取出细胞超声10min,得细胞悬液,UPLC-MS测定细胞裂解液中5种成分的吸收量。该部分实验分别考察培养时间、培养液pH、药物浓度和P-gp抑制剂维拉帕米、环孢菌素对辛芍提取物中5种成分细胞吸收的影响。
2.5样品处理:取250μL细胞悬液加入20mg·L-1内标溶液10μL,加入400μL乙腈沉淀蛋白,涡混2min,15000rpm离心10min,取上清液进样分析,测定芍药内酯苷、没食子酸、咖啡酸、灯盏乙素和灯盏甲素的浓度;另取10μL细胞悬液以考马斯亮蓝法测定蛋白含量。吸收量以mg(药物)/g(蛋白)表示。
2.6统计学分析:采用SPSS18.0软件,组间差异比较为t检验,多组比较为单因素方差分析,P<0.05视为差异有统计学意义。
3结果
3.1辛芍提取物含量测定UPLC-MS分析方法的建立
3.1.1专属性:实验条件下比较5种成分(没食子酸等5种成分的浓度分别为:0.92、1.59、0.82、1.64、2.62mg·L-1)的色谱行为,结果表明空白细胞悬液中无杂质峰干扰,各成分及内标色谱分离良好,保留时间(RT)分别为0.65、1.76、1.86、2.16、2.68、3.19min。见图1-图3。
3.1.2线性关系考察:取混合标准系列溶液各100μL,按2.5项下操作,建立标准曲线。以混合溶液中的药物浓度(c)为横坐标X,样品与内标的峰面积比(A/Ai)为纵坐标Y进行直线回归,得到辛芍提取物的标准曲线。见表2。
表2典型回归曲线方程
3.1.3精密度试验:选取表1中2、4、6这3个浓度的标液,加入空白细胞混悬液,制成质量控制样品(QC),各5份,测定峰面积,并计算日内精密度,连续测定三天,并计算日间精密度。求得芍药内酯苷等5个成分的日内精密度RSD(n=5)为0.16%~8.44%;日间精密度RSD(n=5)为0.21%~9.51%。
3.1.4回收率试验:选取表1中2、4、6这3个浓度的标液,每个浓度重复5次,经UPLC-MS测定值与相应浓度直接用流动相配制的样品溶液测定值的比值计算回收率。结果9种成分的回收率为(87.27±0.01)%~(99.95±0.02)%,RSD均小于15%。
3.1.5稳定性试验:用空白细胞混悬液配置上述高浓度的混标溶液,室温放置,分别在1、2、3d,分别进样分析,根据芍药内酯苷等5种成分的色谱峰面积计算其RSD(n=5),RSD分别为0.22%、0.55%、1.12%、1.42%、0.62%。
3.1.6基质效应:选取表1中2、4、6这3个浓度的标液,加入空白细胞裂解液,另取相应流动性配制相应浓度标液的标准稀释液,测定其基质效应。结果表明基本无基质效应影响。
3.2辛芍提取物细胞毒性研究:实验分为药物组,对照组。药物组将药物稀释至不同体积比浓度(辛芍提取物浓度为0.1、1、5、15、25、30g·L-1)每孔加入100μL;对照组每孔加入100μL DMEM培养液。分别与细胞作用4h后,MTT法检测。每个浓度平行5孔,重复3次。结果表明在所设置的浓度范围,辛芍提取物对Caco-2细胞有无明显的细胞毒性作用,计算出细胞存活率为98%所对应的辛芍提取物的浓度,选择此范围作为实验中给药剂量的参考范围。
3.3浓度依赖性实验:Caco-2细胞分别与不同浓度(0.5、2.5、5.0、7.5、12.5g·L-1)的辛芍提取物供试液培养60min后,分别考察药物浓度对细胞吸收的影响。结果,在0.5~12.5g·L-1范围内,辛芍提取物中的芍药内酯苷等4个成分的摄取随浓度的增加而增加,咖啡酸随着浓度的增加,摄取量先增加,后降低,见图4。
3.4时间对Caco-2细胞吸收的影响:将辛芍提取物(9g·L-1)加入到培养好的细胞中,分别考察不同摄取时间(15、30、60、90、120、180min)对Caco-2细胞吸收的影响。结果,辛芍提取物中的芍药内酯苷、没食子酸和灯盏甲素3个成分的细胞摄取量都随着时间的增加而摄取增加,而咖啡酸、灯盏乙素随着摄取时间的增加细胞摄取量增加减少,综合结果,本实验将60min设定为细胞最佳吸收时间。 见图5。
3.5pH值对Caco-2细胞吸收的影响:取辛芍提取物(9g·L-1)供试液分别在pH4.0,6.0,7.4的条件下,测定加药60min后细胞的吸收量。结果表明,辛芍提取物中芍药内酯苷、没食子酸、灯盏乙素和灯盏甲素的细胞摄取量随pH增加而逐渐降低,咖啡酸却随着PH的增加摄取量逐渐增加。见图6。
3.6不同温度对Caco-2细胞吸收的影响:将辛芍组方提取物(9g·L-1)加到培养好的细胞中,分别在pH为6、加药60min后测定不同温度(4、25、37℃)对Caco-2细胞吸收的影响。结果见图7。结果表明,在不同温度下,辛芍组方提取物中的芍药内酯苷等4个成分的细胞摄取量都随着温度的增加而增加,而咖啡酸且随着温度的增加显著降低,在37℃环境下,细胞吸收更有利。
3.2.6抑制剂对Caco-2细胞吸收的影响:按上述实验确定的pH、温度条件,分别加入相同浓度的辛芍组方提取物(18g·L-1)溶液、含维拉帕米(50mg·L-1)和环孢菌素(10mg·L-1)的辛芍组方提取物溶液,分别与给药60min后测定有无抑制剂存在时Caco-2细胞对辛芍组方提取物吸收的变化。结果见表3。
表3抑制剂对Caco-2细胞吸收5种成分的影响(n=5)
注:与对照组比较1)P<0.05;2)P<0.01。
4讨论
本发明采用的Caco-2细胞来源于人结肠癌细胞,体外培养可以分化成小肠微绒毛的结构,能提供药物透过小肠黏膜吸收、转运等过程的信息,目前被广泛 应用于研究药物吸收的工具。
本实验发现辛芍组方提取物在0.5-12.5g·L-1浓度范围内,Caco-2细胞的摄取量与药物浓度呈良好的线性关系,而咖啡酸随着浓度的增加,摄取量先增加,后降低,可能因为刚开始为被动转运,浓度高时,由于达到临界浓度而使其对细胞产生毒性,进而破坏的单层膜的完整性,从而使摄取量变低。故本实验在研究不同时间、温度、PH、P-gp抑制剂对吸收的影响时辛芍提取物的浓度均为9g·L-1;由于在各自相应浓度范围内,细胞吸收表现出一级速率过程的特征,表明辛芍提取物中5种成分的吸收机制可能为被动扩散。
胃肠道内不同部位的pH环境可以影响药物的某些离子化存在状态,从而影响药物在体内的溶解性能及其胃肠道吸收情况。辛芍组方提取物属于黄酮类和酚酸类物质,分子结构中含有酚羟基结构,弱碱性环境相对不利于该类成分的吸收,这在Caco-2细胞的吸收实验中得到了进一步的证实。考虑到小肠黏膜表面的微酸性环境,故在Caco-2细胞的吸收实验中,pH选为6。表明碱性环境相对不利芍药内酯苷等4中成分的吸收,而咖啡酸在碱性条件下有利于其吸收,其吸收机制有待于进一步研究。
P-gp抑制剂对辛芍提取物的吸收影响实验表明,环孢菌素A和维拉帕米[13]对灯盏乙素和咖啡酸的摄取量与对照组相比有显著增加作用(P<0.05),说明灯盏乙素和咖啡酸的吸收过程中有P-gp的参与,即灯盏乙素和咖啡酸是P-gp底物;而芍药内酯苷等3个成分的摄取量与对照组相比没有显著增加作用(P>0.05),则说明这3种成分的吸收过程中没有P-gp的参与,即芍药内酯苷这3个成分不是P-gp底物。
本发明的实验采用Caco-2细胞模型结合液质联用技术研究辛芍提取物中5种活性成分的吸收机制,考察这几种成分的摄取、跨膜转运等特点,从细胞水平,提供药物分子的吸收的综合信息。为辛芍提取物相关制剂研究提供一定的科学依据,并为中药配伍制剂研究方法提供一种有益的尝试。
当然,以上只是本发明的具体应用范例,本发明还有其他的实施方式,凡采用等同替换或等效变换形成的技术方案,均落在本发明所要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!