一种5-羟甲基糠醛二聚体在药品安全性控制中的应用的制作方法
本发明涉及医药
技术领域:
,具体涉及一种5-羟甲基糠醛二聚体在药品安全性控制中的应用。
背景技术:
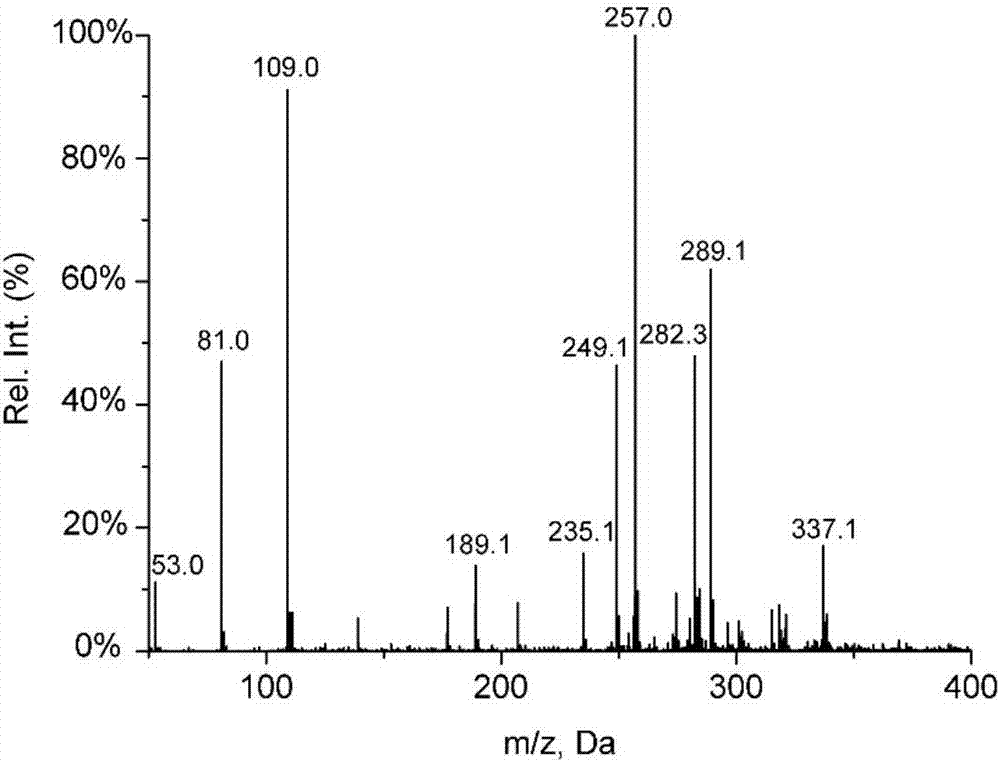
:近年来,随着临床中中药注射液和含葡萄糖的注射液引起的不良反应的发生,特别是2006年的“鱼腥草注射液紧急停用事件”以后,中药注射液和含葡萄糖的注射液的安全性越来越得到人们的重视。加强中药注射液和含葡萄糖的注射液的质量控制,完善质量标准是提高中药注射液和含葡萄糖的注射液临床用药安全的关键环节。本领域中现有技术已知,5-羟甲基糠醛(c6h6o3,式1),是葡萄糖和果糖的主要降解产物[1],普遍存在于葡萄糖注射液和中药注射液中,目前通常认为过量的5-hmf可能引起血栓性静脉炎[2],产生副作用,2015年版中国药典中也明确规定了葡萄糖注射液中5-hmf的检查要求[3]。本申请人在前期研究中通过建立5-hmf定量检测的lc-ms/ms分析方法,对56批市售的23种常用中药注射液和葡萄糖注射液中的5-hmf进行了定量分析,结果在52批中检出5-hmf,并且发现不同种类、不同厂家、同一厂家不同批次生产的中药注射液中5-hmf的含量差异很大[4]。由于5-hmf化学性质不稳定,在一定条件下可以发生加氢,酯化和聚合等化学反应,另据文献报道5-hmf可聚合成有色物质,从而使注射液颜色变黄[5,6],影响注射液的质量。然而,目前仍主要认为5-hmf是引起注射液不良反应的主要物质基础,特别是认为5-hmf是明确的免疫抗原,而仅将聚合物作为导致制剂颜色改变的一种因素。正是基于这种原因,多年以来,本领域一直仅使用5-hmf作为相应药品安全性控制中的指标,而从未也没有动机去使用5-hmf的聚合物作为药品的免疫抗原的指标。本发明人出人意料的发现,在相关中药注射液和含葡萄糖的注射液中,5-hmf并非相关制剂中的主要免疫抗原,其免疫毒性相对较弱,而5-hmf二聚体才是相 关制剂中最主要的免疫抗原。虽然在某些情况下,制剂中5-hmf二聚体的含量明显低于5-hmf或其他5-hmf聚合物或其他5-hmf衍生物,但其产生的免疫不良反应却明显强于5-hmf或其他5-hmf聚合物或其他5-hmf衍生物。也就是说,本发明人克服了现有技术中对5-hmf作用的偏见,发现5-hmf二聚体才是最应当给予关注的制剂内的免疫抗原,通过对葡萄糖注射液和中药注射液中有关5-hmf聚合产物及其有害性进行研究,为葡萄糖注射液和中药注射液的质量控制及安全性评价提供参考依据。式1.5-hmf的结构式(c6h6o3,126.0317da)技术实现要素:本发明解决的技术问题是提供一种5-hmf二聚体在药品安全性控制中的应用,以及其定量检测方法。为解决本发明的技术问题,本发明提供如下技术方案:本发明技术方案的第一方面是提供了一种式2所示的5-hmf二聚体在药品安全性控制中的应用;其特征在于,所述安全性是指会引起免疫毒性的不良反应,所述药品包括直接或间接输注入体内的剂型。进一步的,所述的体内包括肌肉、血管或皮下,所述的剂型为含糖剂型。进一步的,所述的含糖剂型包括含葡萄糖、果糖或多糖的剂型。进一步的,所述剂型为含葡萄糖的注射剂或中药注射剂,其中中药注射液优选中药含糖注射液,最优选中药含葡萄糖注射液。进一步的,所述免疫毒性是指5-hmf二聚体能够作为一种小分子半抗原诱发th1/th2混合型免疫应答。更进一步的,所述免疫毒性主要表现如下:1)采用小鼠直接腘窝淋巴结模型:实验结果提示5-hmf二聚体能引起小鼠腘窝淋巴结的重量和细胞数增多,提示其具有潜在的免疫毒性,造成炎性反应或有致敏潜能,其作用明显强于5-hmf单体。2)采用小鼠报告抗原腘窝淋巴结模型实验进一步证明5-hmf二聚体在加入报告抗原tnp-ficoll和tnp-ova时,都能够引起小鼠腘窝淋巴结重量和细胞数的升高;流式细胞术(fcm)结果证明5-hmf二聚体能引起cd4+t细胞和cd8+t细胞减少,b细胞显著升高,t/b升高,抗原呈递细胞表面标志cd11c,mhcii升高。酶联免疫斑点试验(elispot)证明5-hmf二聚体不仅能明显升高抗原特异性igm,还能产生igm向igg1、igg2a、igg2b的抗体类别转换,并引起细胞因子ifn-γ和il-4分泌量显著增多;且腘窝淋巴结部位病理h&e染色可观察到生发中心明显,或数量增多,提示b细胞的激活和增殖,验证了b细胞数量的增多及多种抗体的产生。以上结果证明5-hmf能够作为半抗原诱导th1和th2混合型的免疫应答。上述作用及机制在5-hmf单体的毒性评价中未见到。本发明技术方案的第二方面是提供了一种5-hmf二聚体的定量检测方法,其特征在于,包括如下步骤:1)配制5-hmf二聚体对照品溶液精密称取5-hmf二聚体对照品(纯度≥98%)3.35mg置于10ml容量瓶中,加入1ml甲醇超声溶解,用初始流动相稀释至刻度,摇匀,配制成0.335mg/ml对照品储备液。将对照品储备液逐步稀释得30,15,5,2.4,1.2,0.6,0.3ng/ml的对照品溶液。2)配制供试品溶液用0.22μm微孔滤膜对供试品溶液过滤,取续滤液得供试品溶液。若样品浓度过大,再用初始流动相稀释适当的倍数使样品中5-hmf二聚体浓度处于所建立方 法的检测线性范围内。3)定量检测采用液相色谱-串联质谱联用(lc-ms/ms)方法分别测定步骤1)中的对照品溶液和步骤2)中的供试品溶液,采用外标法对供试品溶液中的5-hmf二聚体进行定量分析。所述液相色谱的色谱条件为:高效液相色谱仪(hplc)或超高效液相色谱仪(uplc);色谱柱,c18色谱柱;柱温:20~40℃;流速:0.2~0.5ml/min;进样量:5~20μl;流动相:甲醇-水溶液(含0.1%甲酸);分析时间:30min;梯度洗脱。进一步的,所述流动相中,a相为甲醇,b相为水溶液(含0.1%甲酸)。进一步的,所述0.1%甲酸为体积百分比为0.1%甲酸水溶液。进一步的,所述梯度洗脱程序的具体为:平衡色谱柱10min,a相:b相体积比为5:95;0~5min,a相:b相体积比为5:95~5:95;5~18min,a相:b相体积比为5:95~100:0;18~30min,a相:b相体积比为100:0~100:0。所述质谱的检测条件为:三重四级杆串联质谱仪;电喷雾离子源(esi源);检测模式:电喷雾正离子电离模式(esi+);扫描方式:多反应监测(mrm)方式;离子源温度:300~600℃;喷雾电压(is):3~5.5kv;雾化气(gs1)压力:20~80;辅助气(gs2)压力:20~80;碰撞能量(ce):10~80ev;解簇电压(dp):20~200v;入口电压(ep):2~15v;q1和q3的分辨率均设为unit。进一步的,所述mrm的扫描方式,其监测离子对的选择过程为:在正离子检测模式下,获得5-hmf二聚体的一级质谱图,如图1所示。从5-hmf二聚体的一级质谱图中可观察到m/z257.0([m+na]+)和m/z235.1([m+h]+)的分子离子峰。选择m/z235.1作为母离子进行碰撞诱导解离,采用子离子扫描,获得5-hmf二聚体的二级质谱图,如图2所示。从5-hmf二聚体的二级质谱图中可以看到分子离子m/z235.1及其产生的子离子m/z207.1、m/z177.1、m/z109.0和m/z81.0。由分子离子m/z235.1及其任意一个子离子均可以组成用于检测5-hmf二聚体的mrm监测离子对,分子离子m/z235.1和相对强度最高的子离子m/z109.0是最优选的定量离子对。按照优化的条件,将逐步稀释获得的不同浓度的5-hmf二聚体的对照品溶液和供试品溶液进行hplc-ms/ms分析,得到5-hmf二聚体的色谱图(图3-5),计算色谱图中的色谱峰面积,根据对照样品的浓度和相应的峰面积的对应关系,建立标准曲线。根据供试品中5-hmf二聚体的峰面积和建立的标准曲线计算得到注射液样品中5-hmf二聚体的含量。4)对上述方法进行方法学验证,该方法对5-hmf二聚体的检出限为0.1ng/ml(s/n=3),最低定量限为0.3ng/ml(s/n=10);在0.3~30ng/ml范围内线性良好;平均加样回收率为99.8%,日内及日间精密度的相对标准偏差(rsd)均小于10%。本发明的创新性以及与现有技术相比具有的优点:1.本发明克服现有技术中的偏见,首次公开了5-hmf二聚体化合物具有显著的免疫毒性,是相关制剂中引起不良反应的主要抗原。其能够以半抗原的形式诱发未免疫balb/c小鼠产生th1/th2混合型免疫应答,引起多种抗体及细胞因子分泌量增加和病理变化。机体免疫应答th1、th2类型的偏移打破了th1/th2的平衡,与多种疾病的诱发相关(如,器官特异性或全身性自身免疫病、速发/迟发型超敏反应、感染、炎症慢性迁移)。5-hmf二聚体免疫毒性及其机制研究,对葡萄糖和含单糖中药注射液使用的安全性检测及风险控制提供重要参考依据。2.本发明针对在相关制剂中5-hmf二聚体含量较低,且相关制剂特别是中药制剂中化学成分较为复杂的特点,首次提供了一种采用lc-ms/ms技术定量检测葡萄糖注射液和中药注射液中5-hmf二聚体的方法,对葡萄糖注射液和中药注射液的质量控制和产品安全监测提供必要的技术支持。3.本发明公开的方法对5-hmf二聚体的检出限低至0.1ng/ml,加标回收率为99.8%,检测结果准确,样品前处理简单,分析时间短,灵敏度高,能够满足大批量市售葡萄糖注射液和中药注射液中5-hmf二聚体定量筛查的要求。附图说明图1.5-hmf二聚体的一级质谱图。图2.5-hmf二聚体的二级质谱图。图3.空白溶剂样品的mrm谱。图4.5-hmf二聚体对照品的mrm谱。图5.脉络宁注射液样品的mrm谱。图6.流式细胞术对d-plna模型中小鼠plnt细胞及其分型比例分析。cd3+t细胞(a)、cd4+t细胞(b)、cd8+t细胞(c)、cd4/cd8比例(d)以细胞的百分数平均值±sd表示,每组动物数n=6,*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。图7.流式细胞术对d-plna模型中小鼠plnb细胞比例分析。cd19+b细胞(a)、cd3/cd19比(b)以细胞的百分数或比值的平均值±sd表示,每组动物数n=6,*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。图8.给予受试物后小鼠给药部位(足趾部)笼旁观察。阳性药dph给药后第一天足趾肿胀(a)、dph给药后第七天足趾部结痂(b)、5-hmf二聚体给药后第一天足趾无明显异常(c)、二聚体给药后第七天足趾无明显异常(d)。图9.给药组和对照组相比,淋巴结增大。图10.流式细胞术对ra-plna(testcompound+tnp-ficoll)模型中小鼠plnt细胞及其分型比例分析。cd3+t细胞(a)、cd4+t细胞(b)、cd8+t细胞(c)、cd4/cd8比例(d)以细胞的百分数平均值±sd表示,每组动物数n=6,*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。图11.流式细胞术对ra-plna(testcompound+tnp-ova)模型中小鼠plnt细胞及其分型比例分析。cd3+t细胞(a)、cd4+t细胞(b)、cd8+t细胞(c)、cd4/cd8比例(d)以细胞的百分数平均值±sd表示,每组动物数n=6,*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。图12.流式细胞术对ra-plna模型中小鼠plnb细胞比例分析。加入tnp-ficoll,cd19+b细胞(a)、cd3/cd19比(b);加入tnp-ova,cd19+b细胞(c)、cd3/cd19比(d)以细胞的百分数或比值的平均值±sd表示,每组动物数n=6,*p<0.05 与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。图13.流式细胞术对ra-plna(tnp-ficoll和tnp-ova)模型中小鼠pln抗原递呈细胞比例分析。加入tnp-ficoll,表达于b细胞、单核细胞及巨噬细胞表面标记cd11c(a)、mhc-ⅱ表面标记i-a/i-e(c)、巨噬细胞表面标记f4/80(e);加入tnp-ova,表达于b细胞、单核细胞及巨噬细胞表面标记cd11c(b)、mhc-ⅱ表面标记i-a/i-e(d)、巨噬细胞表面标记f4/80(f)均以细胞的百分数的平均值±sd表示,每组动物数n=6,*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。图14.ra-plna(tnp-ficoll)模型中tnp特异性afc数量/106pln细胞。tnp特异性igm(a)、tnp特异性igg1(b)、tnp特异性igg2a(c)、tnp特异性igg2b(d)均以afc数量平均值±sd表示,每组动物数n=6,*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。图15.ra-plna(tnp-ova)模型中tnp特异性afc数量/106pln细胞。tnp特异性igm(a)、tnp特异性igg1(b)、tnp特异性igg2a(c)、tnp特异性igg2b(d)均以afc数量平均值±sd表示,每组动物数n=6,*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。图16.ra-plna(tnp-ficoll和tnp-ova)模型中细胞因子斑点形成细胞(sfc)数量/106pln细胞。一同给予tnp-ficoll时,ifn-γ分泌细胞数(a)、il-4分泌细胞数(b);一同给予tnp-ova时,ifn-γ分泌细胞数(c)、il-4分泌细胞数(d)均以sfc数量平均值±sd表示,每组动物数n=6,*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。图17.阳性药组足趾部位h&e染色病理图(a)和二聚体组足趾部位h&e染色病理图片(b)。图18.小鼠plnh&e染色病理图片:空白对照组(a)、阳性药dph+tnp-ova 组(b)、单体组+tnp-ova(c)和二聚体组+tnp-ova(d)。具体实施方式为更好的说明本发明的技术方案,给出以下说明性实施例,但本发明并不仅限于此。实施例1.小鼠直接腘窝淋巴结试验(d-plna模型)对5-hmf单体及二聚体免疫毒性检测1目的:将本发明中的5-hmf单体及二聚体配制成均匀的溶液,观察小鼠足趾部皮下注射受试物后产生的免疫反应并进行比较,快速检测受试物免疫毒性,为含有5-hmf单体及二聚体的葡萄糖注射液和中药注射液使用的安全性提供参考依据。而直接腘窝淋巴结试验是目前公认的检测小分子过敏原的灵敏方法,但是对小分子的半抗原不敏感。2供试品和试剂苯妥英钠(diphenylhydantoin,dph);5-hmf单体(纯度:99%);5-hmf二聚体(纯度>98%);0.9%生理盐水(normalsaline,ns);dmso;pbs缓冲液。3实验动物spf级balb/c小鼠,雄性,18-22只,动物饲养在温度23±2℃,相对湿度50±5%,明暗各12小时光照循环条件下,动物可自由饮水、摄食。4方法阳性药苯妥英钠溶于0.9%ns,5-hmf二聚体溶于20%dmso中分别配制成均匀的溶液,溶解后超声粉碎,临用前配置,配制后尽快使用。按dph2mg/只,5-hmf单体及二聚体分别40μg/只、80μg/只和160μg/只的剂量于小鼠足趾部皮下注射受试物,另设空白不给药组、ns和20%dmso溶剂对照组(n=6)。给药后连续观察7天,于给药后第7天,处死小鼠,解剖并分离腘窝淋巴结(popliteallymphnode,pln),对淋巴结进行称重,并制成淋巴细胞悬液,进行细胞计数。5结果5.15-hmf单体及二聚体对d-plna模型pln重量和细胞计数的影响阳性药dph组pln重量和细胞数显著增多,5-hmf二聚体中、高剂量组pln重量和细胞数有升高的趋势,而单体的相关指标没有明显变化(表1)。表1.d-plna模型中pln重量和细胞计数testcompoundplnweight(mg)plncellularity(106)/1.89±0.371.02±0.395-hmfmonomer0μg1.96±0.300.99±0.4640μg2.27±0.261.04±0.5180μg2.28±0.201.10±0.50160μg2.26±0.431.11±0.55dph2mg3.1±0.69**2.37±0.48**5-hmfdimer0μg2.04±0.190.96±0.4040μg2.46±0.281.06±0.3580μg2.51±0.311.18±0.42160μg2.56±0.321.18±0.44注:结果以平均值±sd表示,每组动物数n=6;*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。5.25-hmf单体及二聚体对d-plna模型pln细胞表型比例的影响5.2.1对t细胞及其亚型比例的影响阳性药dph组cd3+t细胞、cd4+和cd8+t细胞均明显降低,二聚体高剂量组提高了cd8+t细胞的比例,cd4/cd8比例明显降低;而单体的t细胞及其亚型比例没有明显变化(图6)。5.2.2对b细胞比例的影响阳性药dph和二聚体高剂量组cd19+b细胞比例升高,t/b比降低,单体组b细胞比例没有明显变化(图7)。6结论阳性dph给药部位明显肿胀,7天后给药部位结痂;5-hmf单体和二聚体给药后局部没明显变化,提示单体和二聚体在给药剂量下没有明显局部刺激性(图8)。dph组淋巴结重量和细胞数显著增多(图9),二聚体中、高剂量组淋巴结重量和细胞数随着剂量升高有增多的趋势,而单体变化不明显;dph组对t细胞及其亚型、b细胞比例有显著影响,二聚体高剂量能增高cd8+t细胞和b细胞比例,单体的细胞分型比例没有明显变化;以上结果提示d-plna模型(即单独给予受试物)中,二聚体在中、高剂量组有潜在的免疫毒性,而且作用强于阳性药物dph,而单体未见明显给药相关毒性。实施例2.小鼠报告抗原腘窝淋巴结试验对5-hmf二聚体免疫毒性及其机制研究1目的:将本发明中的5-hmf二聚体与两种报告抗原(tnp-ficoll和tnp-ova)一起向小鼠足趾部皮下注射,观察小鼠腘窝淋巴结产生的免疫反应,检测5-hmf二聚体的免疫毒性及其机制,为5-hmf二聚体的葡萄糖注射液和中药注射液使用的安全性和质量控制提供参考依据。小鼠报告抗原腘窝淋巴结试验是目前公认的检测小分子半抗原的敏感方法。2.供试品和试剂苯妥英钠(diphenylhydantoin,dph);5-hmf单体(纯度:99%);5-hmf二聚体(纯度>98%);tnp-ficoll;tnp-ova;tnp-bsa;0.9%生理盐水;dmso;pbs缓冲液。流式细胞术抗体:percp-cy5.5anti-mousecd3e,fitcanti-mousecd4,peanti-mousecd8a,apcanti-mousecd19,apcanti-mousecd11c,peanti-mousei-ad/i-ed,fitcanti-mousef4/80.酶联免疫斑点试验:小鼠igm、igg1、igg2a、igg2belispot检测试剂盒;elispot专用pvdf膜96孔板;小鼠ifn-γ、il-4elispot检测试剂盒。3实验动物spf级balb/c小鼠,雄性,18-22只,动物饲养在温度23±2℃,相对湿度50±5%,明暗各12小时光照循环条件下,动物可自由饮水、摄食。4方法阳性药dph溶于0.9%生理盐水,5-hmf二聚体溶于20%dmso中分别配制成均匀的溶液,每种受试物分别加入报告抗原tnp-ficoll和tnp-ova(10μg/只),溶解后超声粉碎,临用前配置,配制后尽快使用。按dph2mg/只,二聚体和单体分别40μg/只、80μg/只和160μg/只的剂量于小鼠足趾部皮下注射受试物,再设置空白不给药组,以及分别用两种溶剂0.9%生理盐水、20%dmso加入两种报告抗原tnp-ficoll和tnp-ova的对照组(n=6)。给药后连续观察7天,于给药后第7天,处死小鼠,无菌条件下解剖并分离腘窝淋巴结,对部分淋巴结进行称重,然后放入多聚甲醛中固定,进行病理切片的制作和h&e染色;另一部分制成淋巴细胞悬液,进行细胞计数,调整细胞浓度,分别利用流式细胞术检测淋巴细胞亚型比例的变化,以及离体细胞特异性抗体、细胞因子分泌的检测。5结果5.15-hmf单体及二聚体对ra-plna模型pln重量和细胞计数的影响给予tnp-ficoll和受试物后,dph组和二聚体三个剂量组的pln重量和细胞数量显著增高,而单体的相应指标没有明显变化;给予tnp-ova和受试物后,dph组和二聚体三个剂量组的pln重量和细胞数显著增高,单体中剂量组pln重量和中、高剂量组pln细胞数也明显升高。说明5-hmf二聚体加入ficoll和ova两个佐剂后的免疫反应明显强于5-hmf单体(表2)。表2ra-plna模型中pln重量和细胞计数testcompoundplnplnplus10μgtnp-ficollweight(mg)cellularity(106)/1.81±0.330.99±0.465-hmfmonomer0μg1.92±0.251.14±0.2440μg2.26±0.231.14±1.4080μg2.38±0.281.16±1.24160μg2.50±0.321.19±0.38dph2mg3.25±0.55**3.14±0.47**5-hmfdimer0μg2.02±0.191.08±0.0840μg2.62±0.34#1.66±0.52#80μg2.66±0.25#1.61±1.16#160μg2.69±0.29#2.12±0.33##testcompoundplnplnplus10μgtnp-ovaweight(mg)cellularity(106)/1.91±0.361.00±0.445-hmfmonomer0μg2.0±0.261.16±0.3540μg2.54±0.351.56±0.2980μg2.60±0.32*2.00±0.32**160μg2.56±0.301.84±0.28*dph2mg3.04±0.59**4.21±0.55**5-hmfdimer0μg2.25±0.211.21±0.2840μg2.75±0.38#1.99±0.37##80μg2.8±0.29##3.01±0.31##160μg2.7±0.50#2.89±0.40##注:结果以平均值±sd表示,每组动物数n=6;*p<0.05与ns对照组相比有显著差异,**p<0.01与ns对照组相比有显著差异;#p<0.05与20%dmso对照组相比有显著差异,##p<0.01与20%dmso对照组相比有显著差异。5.25-hmf单体及二聚体对ra-plna模型pln细胞表型比例的影响5.2.1对t细胞及其亚型比例的影响5.2.1.1dph和tnp-ficoll一同注射后,t细胞及其亚型比例显著降低;二聚体三 个剂量组+tnp-ficoll使cd4+t显著降低,中剂量组cd8+t升高且cd4/cd8明显降低;单体高剂量组cd4+t细胞降低,中、高剂量cd8+t升高明显,三个剂量cd4/cd8均降低。结果说明5-hmf二聚体和单体对t细胞亚群的影响不同(图10)。5.2.1.2dph和tnp-ova一同注射后,t细胞及cd8+t细胞比例显著降低;二聚体三个剂量组+tnp-ova使cd4+t显著降低,且cd4/cd8明显降低;单体三个剂量组cd8+t细胞均显著升高,且cd4/cd8均降低。结果说明5-hmf二聚体和单体对t细胞亚群的影响不同(图11)。5.2.2对b细胞比例的影响在加入tnp-ficoll或tnp-ova后,dph均能显著提高b细胞比例,从而降低t/b。给予二聚体+tnp-ficoll后,中、高剂量组b细胞增多,t/b降低;给予二聚体+tnp-ova后,低、中剂量组b细胞增多,三个剂量组t/b相对降低。只有加入tnp-ova后,单体低剂量b细胞增多,低、中剂量t/b相对降低。结果说明5-hmf二聚体和单体对b细胞数量的影响明显不同(图12)。5.2.3对抗原递呈细胞(apc)表面标记的影响同时给予受试物与tnp-ficoll或tnp-ova时,仅见dph组mhc-ⅱ表面标记i-ad/i-ed显著增高,cd11c有升高的趋势但未达到统计学显著性,f4/80标记细胞有所降低;单体仅在同时给予tnp-ova时,f4/80标记细胞有不同程度的增多,其中低、高剂量达到统计学显著性,而cd11c和i-ad/i-ed有轻度的升高趋势;而二聚体中、高剂量组的apc表面标志物mhc-ⅱ、cd11c和f4/80明显增多(图13)。5.35-hmf单体及二聚体对抗原特异性(tnp-specific)抗体形成细胞(afc)的影响5.3.1当一同给予受试物与报告抗原tnp-ficoll时,阳性组tnp特异性igm显著升高,并发生igm向igg1的抗体同型转换,igg1同时升高;二聚体给药组igm明显升高,其中中、高剂量组产生igg1、igg2b抗体,低、中剂量组产生igg2a;单体仅低剂量产生igg1,但无明显剂量效应关系(图14)。5.3.2当一同给予受试物与报告抗原tnp-ova时,阳性组tnp特异性igm显著升高,并发生igm向igg1的抗体同型转换,igg1同时升高;二聚体给药组igm明显升高,并产生igg1、igg2a抗体,且中剂量组产生igg2b;单体的低、高剂量组 igm明显升高,其中中剂量组有igg2a和igg2b抗体的产生,高剂量仅igg2a有所升高(图15)。5.45-hmf单体及二聚体对细胞因子斑点形成细胞(sfc)的影响当给予受试物和tnp-ficoll后,阳性药dph组il-4分泌显著升高;二聚体中、高剂量组ifn-γ和il-4同时升高;单体高剂量组ifn-γ和il-4均有所升高,其中ifn-γ升高更为明显。当给予受试物和tnp-ova后,阳性药dph组ifn-γ和il-4分泌均显著升高;二聚体所有给药组ifn-γ均显著升高,且低剂量组il-4分泌量也明显增加;单体仅低、中剂量组ifn-γ分泌量明显升高(图16)。5.55-hmf单体及聚合物对小鼠足趾给药部位及pln作用的病理检查5.5.1足趾部给药部位dph组小鼠足趾部发生轻度肌纤维坏死、肌间纤维化;二聚体、单体组足趾部未见明显毒性相关病理学变化(图17)。5.5.2pln小鼠给药部位引流淋巴结pln的病理切片h&e染色结果显示:在给予受试物和tnp-ova后,阳性药dph和二聚体的初级滤泡增多,并增殖形成生发中心(germinalcenter,gc);单体组pln皮髓分界不清晰,未形成生发中心(图18)。6结论阳性药dph+tnp-ficoll、dph+tnp-ova组给药部位明显肿胀,7天后给药部位破溃、结痂;5-hmf单体、二聚体+tnp-ficoll、5-hmf单体、二聚体+tnp-ova不同剂量组给药后局部没明显变化,提示单体和二聚体在给药剂量下没有明显局部刺激性。共同给予报告抗原tnp-ficoll时,dph和二聚体组淋巴结重量和细胞数增高,单体无显著变化;fcm结果显示dph组t细胞及其亚型减少、b细胞增多、mhc-ⅱ标记的细胞增多,二聚体cd4+t细胞减少、高剂量组b细胞增多,单体高剂量cd4+和cd8+t细胞增多而b细胞没有变化;elispot结果显示dph组igm和igg1明显增高,二聚体igm明显增高,中、高剂量组发生igg1、igg2b的抗体类型转换,低、中剂量发生igg2a的抗体类型转换,单体仅低剂量有igg1产生,但未见量效关系;dph组il-4显著升高,二聚体中、高剂量组ifn-γ、il-4均显著升高,单体高剂量组ifn-γ、il-4也有一定程度的增高,但幅度低于二聚体。共同给予报告抗原tnp-ova时,dph、5-hmf二聚体淋巴结重量和细胞数 明显升高,单体中剂量淋巴结重量、中高剂量淋巴细胞数明显升高。fcm结果显示dph组cd3+t细胞和cd8+t亚型细胞减少,b细胞明显增多,t/b降低,apc表面标记mhc-ⅱ升高,f4/80降低;二聚体t细胞减少,cd4/cd8降低,b细胞明显增多,t/b降低,高剂量组apc标志物的cd11c和mhc-ⅱ表面标记增多;单体cd4+t细胞降低,cd8+t细胞增多,cd4/cd8降低,t/b随剂量升高而升高,f4/80有轻微升高。elispot结果显示dph组igm、igg1、ifn-γ和il-4均升高;二聚体所有剂量igm、igg1和igg2a均显著升高,其中中剂量组亦产生igg2b,二聚体低、高剂量组ifn-γ和il-4均升高;单体低、高剂量组igm升高,中剂量发生igg2a、igg2b抗体类别转换,高剂量组igg2a升高,低、中剂量组ifn-γ升高,与二聚体比较差别显著。淋巴结部位病理切片h&e染色可以观察到加入报告抗原dph、5-hmf二聚体组淋巴结初级滤泡增殖,形成生发中心明显,提示b细胞的激活及增殖,而单体组淋巴结皮髓分界不明显。以上结果表明:阳性药dph在加入报告抗原tnp-ficoll和tnp-ova时,都能引起th2类型细胞因子和抗体的升高,提示半抗原dph可诱导th2方向的偏移,即体液免疫为主的免疫应答,与文献一致。5-hmf二聚体与tnp-ficoll和tnp-ova都可以诱导b细胞升高,th1和th2类型细胞因子和抗体分泌量升高,提示5-hmf二聚体可作为潜在的半抗原诱导th1/th2混合型的免疫调节作用,可以同时诱导细胞免疫和体液免疫的增强,是一种具有显著免疫毒性的小分子半抗原。而单体虽然在加入tnp-ficoll时高剂量cd4+t细胞及ifn-γ、il-4的分泌有一定程度增多,但未见抗原特异性igm的升高及抗体同型转换的发生,即igg的产生,故认为tnp-ficoll与5-hmf单体不能诱导明显的免疫应答。5-hmf仅在加入tnp-ova时可以诱导以th1方向为主的免疫应答,引起th1相关细胞免疫表型、抗体及细胞因子分泌等相关指标的变化,提示5-hmf单体在相同剂量下仅作为一种辅助刺激物质诱发细胞免疫为主的免疫应答,而不具有半抗原的特性。实施例3.市售葡萄糖注射液和中药注射液中5-hmf二聚体的定量检测1仪器与试剂agilent1200series高效液相色谱仪(美国安捷伦公司);zorbaxsb-c18(150 mm×2.1mm,5μm)色谱柱;api4000质谱仪(美国absciex公司),配备esi离子源;电子分析天平(xp205,梅特勒-托利多仪器有限公司);eppendorf微量移液器和移液管。5-hmf二聚体(纯度>98%);中药注射液及葡萄糖注射液为市售药品;甲醇和甲酸(色谱纯)购自merck公司;实验用水为哇哈哈纯净水。2样品制备2.1对照品溶液的配制精密称取5-hmf二聚体对照品3.35mg置于10ml容量瓶中,加入1ml甲醇超声溶解,用初始流动相稀释至刻度,摇匀,制成0.335mg/ml对照品储备液。将对照品储备液逐步稀释得30,15,5,2.4,1.2,0.6,0.3ng/ml的对照品溶液。2.2供试品溶液的配制取葡萄糖注射液和中药注射液适量,用0.22μm微孔滤膜过滤,取续滤液置于进样瓶中用于lc-ms/ms分析。3检测条件3.1色谱条件采用agilent1200series高效液相色谱仪,zorbaxsb-c18(150mm×2.1mm,5μm)色谱柱,柱温为35℃。以甲醇-0.1%甲酸水为流动相,流速为0.3ml/min,进样量为10μl,分析时间30min。采用梯度洗脱程序进行洗脱:平衡色谱柱10min,a相:b相体积比为5:95;0~5min,a相:b相体积比为5:95~5:95;5~18min,a相:b相体积比为5:95~100:0;18~30min,a相:b相体积比为100:0~100:0。3.2质谱条件采用配备esi离子源的api4000质谱仪,在正离子模式下进行检测,离子源温度:450℃,喷雾电压(is):5kv;雾化气(gs1)压力:60;辅助气(gs2)压力:55;碰撞能量(ce):18ev;解簇电压(dp):55v;入口电压(ep):10v;q1和q3的分辨率均设为unit。以5-hmf二聚体的分子离子m/z235.1和子离子m/z109.0作为监测离子对,采用多反应监测(mrm)方式对市售葡萄糖注射液和中药注射液中5-hmf二聚体的含量进行检测。3.3方法学验证3.3.1线性关系将对照品储备液逐步稀释得30,15,5,2.4,1.2,0.6,0.3ng/ml的对照品溶液,从低浓度到高浓度分别平行进样3次,取峰面积的平均值对浓度作标准曲线,进行线性考察。以5-hmf二聚体的峰面积为纵坐标,以5-hmf二聚体浓度为横坐标,进行回归运算,求得线性回归方程为:y=62169x+814.94(r=0.9998),结果表明在0.3~30ng/ml内线性良好。3.3.2最低检测限及最低定量限将对照品溶液逐步稀释进样,测得该方法下5-hmf二聚体的最低检测限为0.1ng/ml(s/n=3),最低定量限为0.3ng/ml(s/n=10)。3.3.3精密度取对照品储备液,用初始流动相稀释成0.6,12,24ng/ml的低、中、高三种浓度的5-hmf二聚体对照品溶液,在上述实验条件下分别连续进样5次,每次进样10μl,检测样品的浓度,连续测定三天,进行仪器的精密度考察。低、中、高浓度三份样品的日内rsd(n=5)分别为1.4%、1.8%、1.5%,低、中、高浓度三份样品的日间rsd(n=15)分别为9.5%、1.7%、1.7%,表明仪器精密度良好。3.3.4稳定性分别精密吸取浓度为0.6,12,24ng/ml的5-hmf二聚体对照品溶液和供试品溶液(脉络宁注射液,批号:20140928)各10μl,在上述条件下分别在0、2、4、8、12、24h进行测定,考察样品的短期稳定性,并将上述样品分别在2、3、7、15d进行测定,考察样品的长期稳定性。短期稳定性的rsd(n=6)分别为5.9%、2.8%、3.4%、3.1%。长期稳定性的rsd(n=6)分别为12.3%、1.92%、0.95%、2.73%。3.3.5加样回收率将已测得含量的同一批样品(脉络宁注射液,批号:20140544)用初始流动相稀释10倍,精密吸取稀释后该样品溶液9份,每份1ml,平均分为三组,每组分别精密加入15ng/ml的5-hmf二聚体对照品溶液0.4ml、0.5ml、0.6ml,再用流动相定容至2ml,配制成低、中、高不同浓度样品溶液,在上述实验条件下分别进样10μl,测定5-hmf二聚体的含量,进行加样回收率实验。测得平均加样回收率为99.8%,rsd(n=9)为5.8%,加样回收率结果良好。3.3.6重复性取同一批样品(脉络宁注射液,批号:20140928)6份,分别用0.22μm微孔滤 膜对供试品溶液过滤,取续滤液200μl,置于2ml容量瓶中,用流动相定容到2ml,制备6份供试液,在上述实验条件下进样,测定每份样品中5-hmf二聚体的含量,进行重复性实验。脉络宁注射液(批号:20140928)中5-hmf二聚体的平均含量为126.7ng/ml,rsd(n=6)为1.6%,重复性良好。4葡萄糖注射液和中药注射液中5-hmf二聚体的定量检测采用上述方法对10批市售的9种中药注射液和葡萄糖注射液中5-hmf二聚体进行定量分析,结果见表3,在其中的6批中检出5-hmf二聚体,最低含量为0.37ng/ml,最高含量为127ng/ml。5与现有的其他技术相比,lc-ms/ms技术结合了液相色谱高分离能力和质谱高灵敏度、高专属性的检测优势,质谱多反应监测(mrm)模式可以对特异性母离子进行碰撞诱导断裂,选择特异性的子离子组成定量离子对,通过两级离子的选择,可以排除大量干扰离子,使质谱的化学背景降低,目标待测物的信噪比显著提高,非常适合于从复杂体系中选择特定质量数的待测物,经常用于复杂样品中微量成分的定量分析。本发明采用lc-ms/ms技术建立了5-hmf二聚体的定量检测方法,该方法具有快速、灵敏度高、稳定、可靠的优势,适用于葡萄糖注射液和中药注射液中5-hmf二聚体的定量检测。表3.葡萄糖注射液和中药注射液中5-hmf二聚体的含量测定结果注:#表示同一厂家不同批次的注射液;n/d表示未检出5-hmf二聚体。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进也应视为本发明的保护范围。参考文献[1]李艳,魏作君,陈传杰,刘迎新.碳水化合物降解为5-羟甲基糠醛的研究[j].化学进展,2010,22(8):1603-1609.[2]cookap,macleodtm.appletonjd,etal.reversed-phasehigh-performanceliquidchromatographicmethodforthequantificationof5-hydroxymethylfurfuralasthemajordegradationproductofglucoseininfusionfluids[j].journalofchromatographya,1989,467:395-401.[3]chinapharmacopoeiacommittee.pharmacopoeiaofthepeople’srepublicofchina(中华人民共和国药典)[s].2010ed.partⅱ.beijing:chinamedicalsciencepress,2010:928-929.[4]臧清策,何菁菁,白进发,郑亚杰,张瑞萍,李铁钢,王中华,贺玖明,再帕尔·阿不力孜.快速筛查中药注射液中有害物质5-羟甲基糠醛的lc-ms/ms方法及其质量评价研究[j].药学学报,2013,48(11):1705-1709.[5]杨立恒.对葡萄糖注射液中相关杂质5-羟甲基糠醛的考察分析[j].黑龙江医药科学,2005,28(3):57.[6]何伍,凌霄.含葡萄糖注射液中5-羟甲基糠醛限度的检测方法[j].中国医药工业杂志,2008,39(1):47-49.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1