一种同时分离测定三种氨基糖苷类抗生素的含量的方法与流程
本申请属于药物分析技术领域,具体地说,涉及同时分离测定三种AGs(妥布霉素、依替米星、奈替米星)的含量的方法。
背景技术:
氨基糖苷类抗生素(Aminoglycoside antibiotics,AGs)是由氨基糖与氨基环醇通过氧桥连接而成的苷类抗生素,包括链霉素、庆大霉素、新霉素、妥布霉素,以及一些新合成氨基糖苷类药物如依替米星和奈替米星等。由于其廉价、毒性低及抗菌谱广的特点,AGs成为临床上使用最为广泛的抗生素。同时,AGs具有一定的耳毒性及肾毒性,为保证用药安全,剂量使用范围较窄,临床监管十分严格。
由于AGs缺乏特征紫外吸收基团,目前其主要的分析方法包括微生物法,紫外可见光谱法,HPLC-柱前衍生法,HPLC-蒸发光散射检测法,HPLC-脉冲电化学检测方法,质谱法,HPLC-电喷雾串联质谱分析,毛细管电泳法和荧光偏振免疫法。目前,HPLC-衍生法和分光光度法是测定AGs的主要方法。然而,HPLC-衍生法仍有许多缺点无法避免,例如衍生化反应不完全、衍生试剂的额外费用等。此外,分光光度法的灵敏度不够高,不能满足痕量分析的临床要求。因此,建立一种简便,快速,灵敏度高的测定AGs的方法无论在制剂分析还是临床检测中都是十分必要的。
目前,HPLC-RRS联用测定AGs的文献还未见报道。本文以RRS技术作为HPLC一种新型的检测模式,同时分离测定三种AGs的含量(妥布霉素、依替米星、奈替米星),该方法已成功分离了三种抗生素的混合物,同时应用于妥布霉素滴眼液、硫酸依替米星注射液和硫酸奈替米星注射液中AGs含量的测定中。
共振瑞利散射(resonance Rayleigh scattering,RRS)是指当瑞利散射位于或接近分子吸收带时,电子吸收电磁波的频率与散射光频率相同,电子因共振而强烈吸收辐射能量并再次发生散射的过程。RRS因其灵敏度高、线性范围较宽、方法简便等优点,已发展成为光谱分析中活跃的研究领域。国内西南大学和北京大学先后在共振光的研究方面进行了开创性的工作。西南大学的刘绍璞等研究发现,静电作用、疏水作用以及电荷转移作用对于光谱特征以及RRS强度的增加有重要影响。通过离子缔合反应,RRS技术不仅可用于测定生物大分子 如蛋白质、核酸等还可应用于痕量离子及药物小分子的测定中,极大的拓展了RRS的应用领域。
近年来,RRS与流动注射分析及毛细管电泳联用方法的成功建立,表明被测物可在动态反应中与探针结合成离子缔合物,并被定量检测。尽管这些联用方法仍存在着一定的不足,却充分发挥了RRS高灵敏度及高选择性的优点同时避免了其重现性、稳定性较差的不足。
高效液相色谱法(high performance liquid chromatography,HPLC)自20世纪70年代建立以来,以高速、高效、灵敏度高及检测范围广等特点成为目前应用最多的色谱分析方法,在有机化学、生物化学、医学、药物开发与检测、食品科学、环境监测、商检和法检等方面都有广泛的应用。经过几十年的发展,HPLC已与众多检测技术相结合,从传统的紫外、荧光检测器到先进的质谱及核磁共振检测技术,HPLC已可同时满足对被测物定量及定性的分析需求。HPLC与更为精密的检测仪器联用的同时也大大提高了设备成本及检测成本,因此发展高效通用的检测器仍是HPLC的主要发展趋势之一。
虽然高效液相色谱法(HPLC)是目前药物分析中最常用的检测方法,但HPLC与RRS联用(HPLC-RRS)的方法鲜见报道。RRS技术与其他分析仪器联用方法的成功建立表明其可以作为一种新型的检测方法与HPLC联用(HPLC-RRS)。RRS技术作为一种新型的HPLC检测方法,其突出优点是RRS信号的产生不依赖于被测物本身的化学特性,尤其适用于无紫外特征吸收及非荧光物质的检测。
技术实现要素:
有鉴于此,本申请要解决HPLC-衍生法衍生化反应不完全、衍生试剂的额外费用高,分光光度法的灵敏度不够高,不能满足痕量分析的临床要求的问题。提供一种简便,快速,灵敏度高的测定AGs的方法,无论在制剂分析还是临床检测中都是十分必要的。
为了解决上述技术问题,本申请公开了一种同时分离测定三种AGs的含量的方法,采用高效液相色谱与共振瑞利散射联用技术,先用高效液相色谱法将供试品中的AGs洗脱分离,再将洗脱分离后的妥布霉素、依替米星、奈替米星和探针溶液混合反应,最后将混合反应后的反应液注入检测器进行检测;
进一步的,所述高效液相色谱的色谱条件为:甲醇∶水(含0.2%TFA)=5∶95(v/v)为流动相,流速=0.50mL·min-1,所述探针溶液为PSB溶液,所述检测器为荧光检测器。
进一步的,所述检测波长λex=λem=362nm。
进一步的,所述PSB溶液浓度为2.0×10-4mol·L-1。
进一步的,所述BR缓冲液溶液pH=9.5。
进一步的,所述BR缓冲液的流速为0.2mL·min-1。
进一步的,所述反应管管长250cm,内径0.5mm。
进一步的,所述三种AGs的最低检测限为1.0μg·mL-1。
进一步的,所述三种AGs的线性范围为2.0μg·mL-1~20.0μg·mL-1。
进一步的,所述色谱条件的色谱柱为C18,5μm,250mm×4.6mm。
与现有技术相比,本申请可以获得包括以下技术效果:
1)本申请的技术方案,建立了HPLC-RRS联用同时分离测定三种AGs的含量。
2)本申请的检测方法,方法简便、快速、灵敏度高、选择性好并成功用于分离了三种抗生素的混合物,同时应用于妥布霉素滴眼液、硫酸依替米星注射液和硫酸奈替米星注射液中AGs含量的测定中。
3)本申请的HPLC-RRS联用方法,进一步拓宽了RRS技术的应用范围,并为HPLC提供了一种全新的检测模式。
当然,实施本申请的任一产品不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
图1为本申请实施例中三种氨基糖苷类抗生素及PSB的RRS光谱图;
图2为本申请实施例中PSB-TOB体系RRS光谱图;
图3为本申请实施例中酸度对RRS反应的影响图;
图4为本申请实施例中SB-TOB离子缔合物UV/VIS吸收图与RRS光谱图对比图;
图5为本申请实施例中TOB与PSB反应式图;
图6为本申请实施例中PSB-AGs体系HPLC-RRS色谱图;
图7为本申请实施例中PSB浓度对RRS反应的影响图;
图8为本申请实施例中探针流速对RRS反应的影响图;
图9为本申请实施例中反应管长度对RRS反应的影响图。
具体实施方式
以下将配合附图及实施例来详细说明本申请的实施方式,藉此对本申请如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
实施例
1、试剂
妥布霉素(Tobramycin,TOB)、依替米星(etimicin,ETI)及奈替米星(netilmicin,NET)标准品均购自中国药品生物制品检定所,滂胺天蓝(PSB)购自Chroma公司(德国)。甲醇和乙腈均为色谱纯(江苏省汉邦公司)。BR缓冲溶液由0.04mol·mL-1H3PO4、H3BO3、CH3COOH与0.02mol·mL-1NaOH溶液按一定比例混合,配成不同pH值的缓冲溶液,用酸度计校正其pH值。三氟乙酸(TFA)为分析纯。实验中使用超纯水。妥布霉素滴眼液、硫酸依替米星针剂及硫酸奈替米星针剂均购自当地药房。
2、仪器
安捷伦1100系统(美国)(G1322A在线脱气,G1311A四元泵,G1316A柱温箱,G1313A自动进样器,G1321A荧光检测器、G2070-60069色谱工作站)。P100高压力恒定流泵(伍丰科学仪器有限公司,上海,中国)。Eclipse荧光分光仪(瓦里安,美国)用于测量RRS强度。U-3019/3310紫外可见分光光度计(日立,日本)用于记录吸收光谱。PHS-3C型酸度计(上海大普分析仪器厂)。Sartorius BS210S电子天平(Sartorius公司,德国)。SK-1快速混匀器(江苏国华仪器厂)。TGL-16高速台式离心机(上海医用分析仪器厂)。BF2000型氮气吹干仪(北京八方世纪有限公司)。
3、溶液的配制
3.1标准溶液的配置
精密称取TOB、ETI及NET标准品10.0mg,经双蒸水溶解后定溶于10mL容量瓶中,得到浓度为1.0mg·mL-1的储备液,并存储于4~8℃的冰箱中。精密量取不同体积的TOB、ETI及NET储备液于5mL容量瓶中,用BR缓冲溶液稀释得到不同浓度的工作液。RRS实验中所用TOB、ETI及NET标准溶液为储备液由双蒸水稀释所得。
3.2探针溶液的配制
精密称取PSB固体粉末,经双蒸水溶解后定溶于容量瓶中,得到浓度为1.0×10-3mol·L-1的储备液,并存储于4~8℃的冰箱中。HPLC-RRS所用PSB探针溶液由BR缓冲溶液溶解,浓度为2.0×10-5mol·L-1;RRS实验中所用PSB溶液为双蒸水稀释所得,浓度为1.0×10-4mol·L-1。
3.3样品的配制
取妥布霉素滴眼液、硫酸依替米星针剂及硫酸奈替米星针剂适量,用双蒸水稀释至适量浓度,所用样品均置于4℃冰箱中保存,进样前均经0.45μm滤膜过滤。
4、RRS实验
4.1RRS光谱
于10mL比色管中,依次加入1.0mL pH=5.00的BR缓冲溶液、一定量的AGs标准溶液 和1.0mL 1.0×10-4mol·L-1的PSB溶液,用水稀释至刻度,摇匀,于荧光分光光度计上以λex=λem方式进行同步扫描,记录共振瑞利散射光谱,并分别于最大RRS波长处测量离子缔合物的RRS强度IRRS及试剂空白的RRS强度I0,ΔIRRS=IRRS-I0。
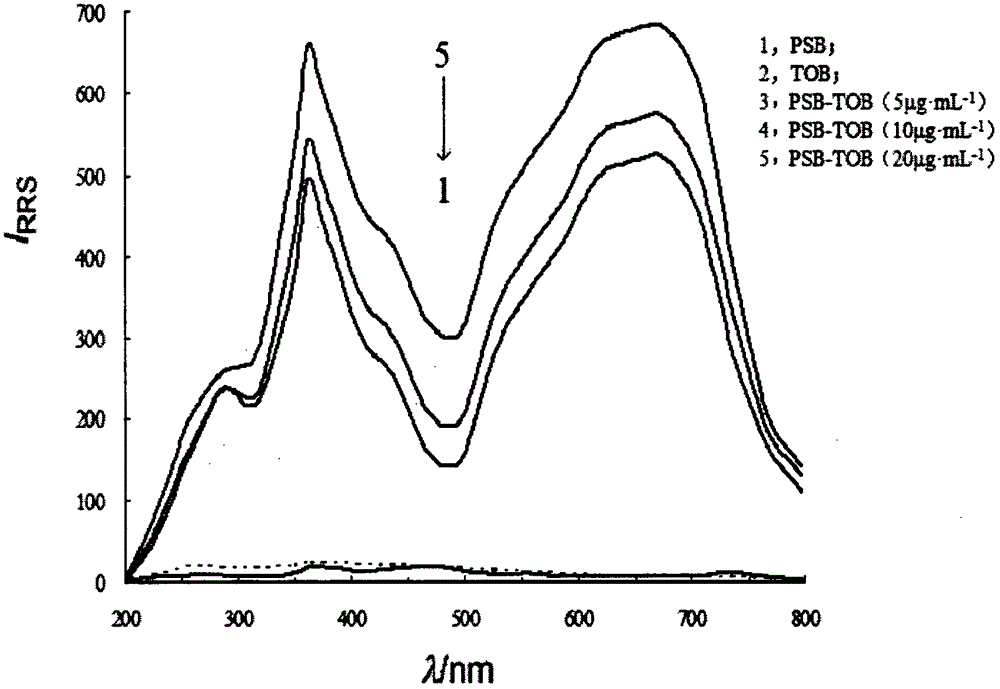
三种氨基糖苷类抗生素及PSB的RRS光谱图如图1所示。从图1中可以看出,TOB、ETI、NET及PSB自身的RRS均十分微弱,但当三种氨基糖苷类抗生素与PSB反应形成离子缔合物后,RRS强度明显增强;它们具有相似的光谱特征,最大散射波长位于362nm处,另外两个散射峰分别位于275nm与677nm处。PSB-AGs体系RRS强度顺序为TOB>ETI>NET。以TOB为例,RRS强度与TOB浓度呈良好线性关系,如图2。
4.2酸度对RRS反应的影响
通过调节BR缓冲溶液的pH值来考察酸度对RRS的反应,实验通过调节BR缓冲溶液的pH值来考察酸度对RRS的反应,如图3所示。结果表明,反应的最佳酸度范围为pH 4.0~6.0,超出此范围,PSB-AGs体系的RRS强度均会明显降低。这与AGs及PSB的结构有关,在较低的pH值下,PSB自身形成二聚物的趋势增加,与PSB-AGs分子间的缔合作用相竞争,导致离子缔合物的RRS强度减小;另一方面,在较高pH值条件下,不利于形成AGs阳离子,亦使RRS反应强度减低。
4.3PSB-AGs体系的紫外可见光吸收图谱
图4所示为本文以PSB-TOB为例分析的紫外-可见光(UV/VIS)吸收图谱。其中362nm及677nm的散射峰与347nm及635nm的吸收峰相对应,这是RRS强度增强的主要原因。
4.4离子缔合物的形成
在弱酸环境中(pH 5.00),PSB结构中的四个磺酸基团解离形成一个大的阴离子,同时AGs质子化为阳离子。实验中使用摩尔比法和等摩尔连续变化法测定了PSB与AGs结合成离子缔合物的组成比约为1∶2。以PSB-TOB为例,其反应过程及离子缔合物的组成情况如图5所示。在pH=5.0的BR缓冲溶液中,带4个单位负电荷的PSB4-与带2个单位正电荷的TOB2+之间存在较强的静电引力作用。此外,PSB结构中的2个萘基及1个联苯基与AGs结构中的多个环醇基均为较大的疏水基团。因此,当AGs阳离子与PSB阴离子形成电中性的离子缔合物后,由于静电引力及疏水作用,散射强度大大增加。
4.5结论
当反应条件确定之后,RRS反应强度主要有以下两方面因素决定:一是形成的离子缔合物的体积(体积越大,散射强度越强);二是散射分子的摩尔吸光系数ε(ε值越大,分子的吸光度越强,对散射强度的贡献越大)。当TOB2+与染料阴离子PSB4-相反应形成离子缔合物 后,分子的体积及ε值均较TOB自身大幅度的增加。此外,由于范德华力及疏水作用力均导致大的散射分子形成,这都大大的有利于散射强度的增加。
5、HPLC-RRS实验
实验中所用色谱柱为Agilent Zorbox SB-C18column(250mm×4.6mm i.d.,5μm)及保护柱(Security Guard C18,4×2mm,Phenomenex)。流动相为甲醇∶水(含0.2%TFA)=5∶95(v/v),HPLC流速为0.50mL·min-1,λex=λem=362nm,柱温为30℃,进样量为20μL,探针为2.0×10-5mol·L-1的PSB溶液,pH为9.5,单泵的流速为0.2mL·min-1,反应管长250cm,内径0.5mm。实验所用的溶液均经过0.45μm滤膜过滤。
5.1色谱条件的优化
5.1.1测定波长的选择
根据4.3项,两个主要的散射峰分别为362nm和677nm,实验中分别尝试λex=λem=362nm及677nm的情况。发现当λex=λem=362nm时,散射峰明显,峰形较好;相反,当λex=λem=677nm时,液相图谱中完全没有散射峰出现,这与荧光检测器的光源的能量有关。因此,实验中选择362nm为测定波长。
5.1.2有机溶剂对RRS反应的影响及流动相的选择
实验中选择在水相中添加TFA来调节pH值,TFA有以下两方面作用:一是使流动相呈酸性,使目标成分在流动相中完全离子化;二是起到离子对试剂的作用,调节保留时间。
实验中分别考察了乙腈及甲醇作为有机相的情况,发现当流动相中含有乙腈时,基线波动较大,目标峰面积显著减小,当流动相中含有甲醇时,则色谱峰形较好,基线稳定。测定添加TFA的流动相的pH值约为2.0,在此情况下,若使用乙腈作为有机相,则乙腈分子结构中的N原子所含的孤对电子(CH3CN:)极易吸引溶液中的氢质子(H+)而带正电荷。当携带正电荷的流动相与带负电荷的PSB探针溶液在反应盘管中汇合,必然导致PSB4-与CH3CN:H+及PSB4-与AGs2+之间形成竞争,表现为基线波动及目标峰面积下降。因此,实验中选择甲醇-水(含TFA)作为流动相。实验中发现当甲醇比例超过10%后,ETI与NET不能分开,若甲醇比例低于3%则洗脱时间大大增加,色谱峰展宽。最终实验确定流动相为甲醇∶水(含0.2%TFA)=5∶95(v/v),HPLC-RRS色谱图如图6所示,其中TOB、NET及ETI的保留时间分别为9.5min、16.2min及18.8min,分离度均大于1.5。
5.1.3HPLC流速对RRS反应的影响
HPLC-RRS联用中HPLC流速的选择与一般液相方法不同。实验中考察了HPLC流速(0.20ml·min-1~0.80ml·min-1)对RRS反应的影响。实验表明,反应管中的pH值由流动相 及探针溶液共同决定,混合后溶液中两者的比例由HPLC及单泵的流量决定,因此HPLC流速变化对反应管中pH值有显著的影响。实验发现,当HPLC流速加大时,色谱峰面积明显减少,这不仅与流速加大导致反应时间缩短有关,还与反应管中pH值明显降低有关。若HPLC流速过缓,则目标成分保留时间延长、色谱峰展宽严重。综合评价了对称因子、保留时间及RRS反应的基础上,实验最终选定了0.50ml·min-1为HPLC流速。
5.2柱后条件的优化
柱后条件的优化采用流动注射分析的方法进行考察,也就是用不锈钢两通代替色谱柱,去除色谱柱的影响仅分析柱后反应的情况,包括BR缓冲溶液酸度、探针浓度、探针流速及反应管长度的考察。
5.2.1PSB浓度对RRS反应的影响
以TOB为例,PSB浓度对RRS反应强度的影响如图7所示。起初依照反应比,PSB浓度没有达到饱和,RRS反应强度随钼酸铵浓度的增大而增大,当浓度达到一定值后,PSB趋于饱和,当浓度再度增大时,PSB自身形成二聚物的趋势加大,与PSB-AGs分子间的缔合作用相竞争,导致离子缔合物的RRS强度随PSB浓度的增大而减小。因此,实验中选择浓度为2.0×10-5mol·L-1的PSB溶液为探针。
5.2.2pH值对RRS反应的影响
静态条件下pH对RRS反应的影响已考察,结果表明BR缓冲溶液最佳酸度范围是pH4.0~6.0。经测定含0.2%TFA的流动相的pH值约为2.0,为了平衡过酸的流动相对反应的影响,必须调节BR缓冲溶液的酸度,使混合后溶液的pH在4.00~6.00的范围内。经测定当BR缓冲溶液的pH值在8.5~10.0时,可满足反应的pH要求,但当pH值过高时,基线波动大、灵敏度降低,因此实验中选择BR缓冲溶液的pH值为9.5。
5.2.3探针流速对RRS反应的影响
实验考察了探针流速(0.10mL·min-1~0.45mL·min-1)对RRS反应的影响。以PSB-TOB为例结果如图8所示,当单泵流速低于0.10mL·min-1时,由于探针流速过慢导致RRS反应不完全,色谱峰面积下降、灵敏度减低;同时流速过快,导致反应时间减少,RRS强度下降。因此,实验中选择0.20mL·min-1的PSB为探针。
5.2.4反应管长度对RRS反应的影响
实验中考察了反应管长度(150~450cm)对RRS反应的影响。以PSB-TOB为例结果如图9所示,反应管最佳长度范围为200~300cm。最初RRS反应强度随反应管的增加而增强,但当反应管长度超过300cm后,出峰时间延长、色谱峰展宽严重,对称度下降,灵敏度降低; 若反应管过短,反应时间缩短,目标峰面积明显减小。综合以上各因素考虑,实验选择反应管长度为250cm。
6.方法可行性考察
6.1标准曲线及线性范围
精密配置不同浓度三种AGs标准溶液,按上述色谱条件进行测定,记录峰面积,三种AGs回归方程及相关系数为见表1,其中y色谱峰面积,x为AGs浓度(μg·mL-1)。线性范围为2.0μg·mL-1~20.0μg·mL-1,最低检测限为1.0μg·mL-1(S/N=3)。
表1 TOB、NET及ETI回归方程及相关系数
6.2精密度实验
分别制备高、中、低浓度的AGs标样各5份,均按上述样品处理方法处理后,于同日内进样5次测定;另取上述样品,每天测定一次,连续测定5天,测定样品峰面积,按回归方程求出对应浓度,计算其日内和日间的精密度。日内精密度在1.47%~2.68%之间;日间精密度在3.45%~5.26%之间。
7、应用
上述HPLC-RRS方法已成功用于妥布霉素滴眼液、硫酸依替米星针剂及硫酸奈替米星针剂的含量测定中。按3.3项制备样品后进样。回收率见表2。
表2 不同制剂中AGs含量的测定
HPLC-RRS联用技术中,HPLC系统实现了样品的自动分离分析,同时RRS检测技术实现了对无紫外吸收物质的检测,这是HPLC-RRS联用技术无可比拟的优点。
本文以RRS为检测方法建立了一种全新的HPLC检测模式,并成功用于不同制剂中AGs含量的测定中。虽然HPLC-RRS的扩大应用还有许多困难,但是HPLC-RRS联用技术可以满足对某些物质简便、快速及高灵敏度的检测,可以肯定的是,HPLC-RRS联用技术必将在更为广泛的测定领域得到应用。
如在说明书及权利要求当中使用了某些词汇来指称特定成分或方法。本领域技术人员应可理解,不同地区可能会用不同名词来称呼同一个成分。本说明书及权利要求并不以名称的差异来作为区分成分的方式。如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定于”。“大致”是指在可接收的误差范围内,本领域技术人员能够在一定误差范围内解决所述技术问题,基本达到所述技术效果。说明书后续描述为实施本申请的较佳实施方式,然所述描述乃以说明本申请的一般原则为目的,并非用以限定本申请的范围。本申请的保护范围当视所附权利要求所界定者为准。
还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的商品或者系统不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种商品或者系统所固有的要素。在没有更多限制的情况下,由语句“包括一个......”限定的要素,并不排除在包括所述要素的商品或者系统中还存在另外的相同要素。
上述说明示出并描述了本发明的若干优选实施例,但如前所述,应当理解本实用新 型并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!