基于飞行时间质谱原理的微生物肽质量指纹图谱库的构建方法与流程
本发明涉及微生物鉴定数据库,尤其是涉及一种基于飞行时间质谱原理的微生物肽质量指纹图谱库的构建方法。
背景技术:
细菌、真菌、放线菌、立克次体、支原体、衣原体、螺旋体等微生物中都含有大量保守的蛋白,通常为核糖体蛋白,相对于微生物代谢产物及其他易受培养条件影响的细胞成分,利用保守蛋白进行微生物鉴定可以保证鉴定结果的稳定性及重现性。所以快速准确的对细菌、真菌、放线菌、支原体、衣原体、立克次氏体等进行鉴定是临床诊断、食品和疾控检测等微生物学领域的基本要求。
传统的鉴定主要依赖于生化鉴定方法,该方法除了耗时、费力外,对某些细菌或细菌群难以做到有效区分,例如部分革兰阴性细菌、非发酵杆菌等具有不活跃生化反应特性的菌类。16srRNA虽然是微生物鉴定的金标准,但该技术要求检测人员素质高,且具有检测成本高、耗时久等缺陷,不能广泛应用于微生物检验。基质辅助激光解析电离飞行时间质谱(简称MALDI-TOF MS)的出现改善了现有鉴定方法耗时、费力、成本高的缺点,并可以有效区分过去通过生化鉴定难以区分的部分微生物种群。
MALDI-TOF MS是一种软电离技术,基于基质辅助激光解析飞行时间质谱的肽质量指纹谱微生物识别技术也随之问世。该技术是在完整的微生物中添加酸性基质辅助细胞裂解,激光激发细胞裂解物(蛋白或多肽)形成肽质量指纹图谱,并与已构建完成的属、种水平的共性参考谱进行比对分析,从而实现对未知微生物的鉴定。
目前,市场上有两款微生物标准肽指纹质量图谱数据库(主要是指布鲁克公司的Biotyper数据库和梅里埃公司的SARAMIS数据库),由于这些数据库中用于构建标准图谱的菌株多采用国外的微生物,而微生物是存在地域性差异的,所以这两款数据库中的部分菌株并不符合中国临床、食品、疾病监控等的实际需求,造成中国部分微生物由于缺乏标准图谱而不能鉴定或只能鉴定到属水平,给临床诊断和治疗带来困难。例如布鲁氏菌在这两个数据库内都不存在,而布鲁氏菌是一种在国内高发的人畜共患致病菌,特别是牛羊等养殖场中,该病菌的出现频率很高;一些临床上高频率出现的菌株,如鲍曼不动杆菌、沙门菌、单增李斯特、念珠菌等菌种下面的部分株系在种水平的鉴定也存在困难。基于我国在病原微生物研究方面的需要以及临床、食品诊断等方面的实际需求,采用操作性强、鉴定菌株准确的方法来构建一款微生物种类齐全、标准图谱库数据量大且能满足我国临床、食品诊断、疾病监控等实际需求的基质辅助激光解析离子质谱仪微生物鉴定数据库就显得很有必要。
技术实现要素:
本发明的目的在于针对现有技术存在的缺陷而提供一种基于飞行时间质谱原理的微生物肽质量指纹图谱库的构建方法。
为实现上述目的,本发明可采取下述技术方案:
本发明所述的基于飞行时间质谱原理的微生物肽质量指纹图谱库的构建方法包括下述步骤:
第一步,菌株的标准化
首先将获得的菌株分别依据各自的生理习性在特定的培养基和培养条件下进行纯培养,依次获得对数期的菌株;并将培养得到的菌株采用保护剂进行保藏,使其长期稳定的存活;
通过形态学对保藏存活的菌株进行验证,保证菌株的纯度为100%;通过分类学对保藏存活的菌株进行验证,保证菌株的名称正确无误;通过不同方法对同一菌株进行分子学鉴定,保证其鉴定结果的一致性;
第二步,建库菌株肽指纹图谱的提取
将第一步确认符合建库条件的细菌、真菌、放线菌、支原体、衣原体、立克次氏体菌株进行预处理,对菌体进行灭活及脂质溶解,干燥后采用乙醇/甲酸法提取肽指纹图谱;将带有芽孢的菌株、依靠呼吸道传播的菌株以及生物安全性在二类以上的菌株采用80%TFA提取法提取肽指纹图谱;
第三步,建库菌株肽指纹图谱的采集
1)采集设备的确定 采用MALDI-TOF MS质谱平台进行图谱的采集,仪器调整参数如下:
(a)离子化激光源若采用氮气激发,波长为337nm;若采用固态激光,波长为355nm;
(b)微生物标准谱图的肽质量指纹图谱的采集范围是2000-20000Da之间;
(c)激光激发的电荷为带一个正电荷的多肽或蛋白,采用线性正离子操作模式,离子源1电压 20 KV,离子源2电压 17-20KV,电子透镜电压 5-10KV,延时提取时间为30-400ns之间;
(d)激光频率为40-100HZ;
(e)检测器电压在-2kv到-5kv之间,调试时以基质HCCA为背景峰,测定出检测器对其达到响应时的最低电压值;
(f)仪器校准:采集谱图的激光击打次数设定为40-200次;每次数据采集前采用大肠杆菌DH5a与肌红蛋白、核糖核酸RNA酶的混合的蛋白进行仪器校准,选取八个均匀分布于2000-20000Da的特征蛋白对仪器进行校准,其中校准的最大误差小于150ppm,校准方程为:
y=ax2+bx+c,其中y代表m/z, x代表时间;
2)采集方法 每个菌株的每个靶点采集3~5张图谱,每张图谱由4次以上累加获得,每次参与累加的图谱要符合以下条件:信噪比高于3.0、基线低且平、主体峰强度在2000-20000之间,每个菌株符合要求的谱图在20~40张;
3)图谱处理 将采集到的多张图谱在分析软件内进行分析,首先对每张图谱的特征峰进行比对,删除统计学意义上的明显区别于其他图谱的图谱,并删除不合格的图谱,合格图谱留存,图谱张数大于20,不满足需重新提取采集,以达到数据库建库的要求;
第四步,建库
1)对第三步采集的菌株图谱进行参数确定
标准图谱参数设置如下:a)单个图谱特征峰的最大误差1500-2400ppm;(b)创建标准肽质量指纹参考谱的误差在200-300ppm;(c)最小谱图频率:25%; (d)谱图最大峰数目:70-80;
2)将确定的标准谱图与菌株名称进行统一,并标注该菌株的建库方法,完成该菌株的建库;其他菌株建库方法依次类推,完成微生物肽质量指纹图谱库的构建。
为保证菌体的破壁效果,提高鉴定的准确率,第二步对建库菌株肽指纹图谱提取时,对细菌、真菌、放线菌、支原体、衣原体、立克次氏体等菌株需要进行预处理,其方法为:
第一步,从培养基中挑取适量的菌体,使用超纯水悬浮、混匀;
第二步,加入无水乙醇,充分混匀,使混合液中无水乙醇的体积分数达到70~80%,静置1~5分钟;
第三步,将第二步静置后的混合溶液10000~15000rpm/min转速离心3~5分钟,倒去上清;
第四步,将沉淀的菌体在40℃±1℃条件下恒温温育5~25分钟。
本发明的目的在于提供了从菌株的调查到数据库构建的一套完整方法,并以此作为指导,构建包括食品、疾控、临床、工业、农业、海洋、环境等不同来源微生物菌种的数据库,该数据库微生物种类齐全,不仅包含每种微生物的模式菌株,还包含该种下的其他菌株,以弥补自然状态下菌株的变异,该数据库将满足于微生物相关行业的鉴定需求。采用本发明方法,联合多家医院、科研院所以及各菌种中心,收集微生物菌种,并利用质谱平台,可构建中国人自已的微生物蛋白指纹图谱库,该图谱库可为我国病原微生物的毒力分析、细菌分型、克隆菌株的分子流行病学、细菌耐药检测和耐药机制等方面的研究提供有力的帮助,同时作为国家战略性资源为我国生防建立了微生物鉴定基础。采用本发明方法,可以构建包含细菌、病毒、真菌、放线菌、立克次体、支原体、衣原体、螺旋体等至少四千种、无万株以上菌株的的标准图谱。
附图说明
图1是本发明建库图谱的分析。
图2是本发明建库图谱的MSP的特征蛋白峰信息列表。
图3是采集对比分析后参与建库的30张大肠杆菌图谱。
图4是建库的30张大肠杆菌图谱堆积图。
图5是采集的30张大肠杆菌图谱茎建库参数合成一张标准图谱。
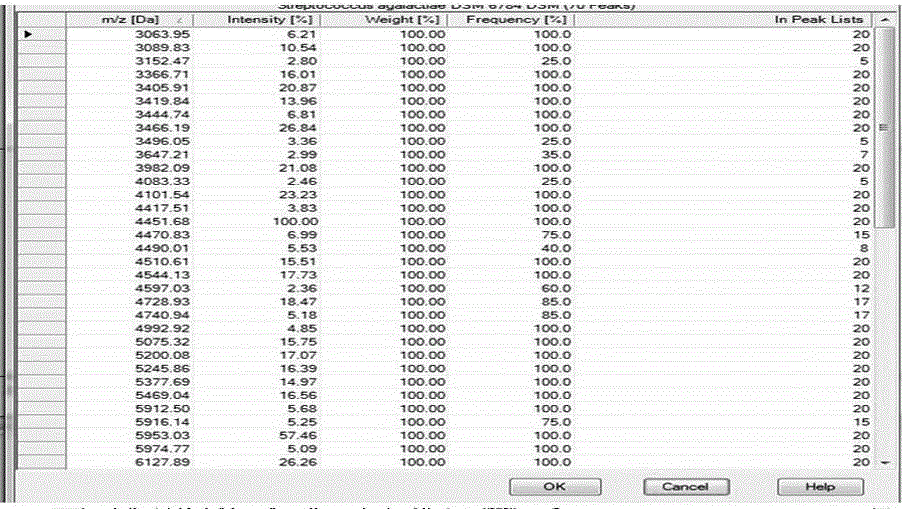
图6是大肠杆菌建库完成后的特征峰信息列表。
具体实施方式
本发明所述的基于飞行时间质谱原理的微生物肽质量指纹图谱库的构建方法包括下述详细的步骤:
第一步,菌株的标准化
1、菌株的培养
首先将从科研院所、保藏中心等渠道获得的菌株,依据其生理特性,分别在不同培养基上进行培养:例如真菌在沙保罗琼脂平板、细菌在哥伦比亚血平板或普通血平板上37度分别培养48h和24h,奈瑟氏菌属、链球菌属等需要接种巧克力琼脂平板,在5%的二氧化碳环境中培养24h,以此来获得对数期的菌株,其原则为严格遵守各种微生物既定的培养条件,提高微生物的鉴定准确率;
2、菌株的保藏
由于数据库构建时间较长,为了确保菌株能长期稳定的存活,需要对培养得到的菌株进行保藏,使其长期稳定的存活;常用的保护剂为:(1)酸性化合物:谷氨酸、天门冬氨酸、苹果酸等;(2) 中性化合物:葡萄糖、乳糖、蔗糖、棉子糖、山梨醇、肌醇;(3) 高分子物质及其分解物:白蛋白、明胶、蛋白胨、藻类;(4)天然混合物:脱脂乳、血清等;(5)其它:抗坏血酸、羟胺、甘油等。
选择保护剂的准则是:菌株存活时间久、变异几率低、易复壮。本次构建数据库的菌株,保护剂大多采用天然混合物中的脱脂乳,其浓度为2.5~10%,部分弧菌、支原体等菌株的保藏,在脱脂乳的基础上添加了中性化合物及氯化钠等作为保护剂;其他的特殊菌株的保护剂依据菌株生理生化特性,在以上的保护剂内筛选。
3、菌株的分类及验证
1)菌株的形态学验证:首先以菌落的大小、光滑程度、边缘是否整齐、颜色等形态特征为依据,判定保藏的菌株是否为纯培养物,其次通过显微镜检,查看革兰染色的阴阳性、大小、形态(为杆菌、球菌、双球菌、弧菌、孢子、芽孢)等菌株的镜检特性,进一步确保保藏的菌株为单一菌株,即保证保藏菌株的纯度为100%。
2)菌株的分类学验证:
确保库内无错菌是构建数据库的必要条件,所以在构建数据库前,需对保藏的菌株进行多种分类学方法鉴定,各种方法互相比较,确保建库菌株名称的正确无误;申请人对建库菌株的验证方法采用:(1)形态和生化鉴定:形态结构和生化特征实验、生理生化实验;(2)质谱鉴定:采用德国布鲁克的MALDI Biotyper、梅里埃的VITEK MS系列。
3)分子学鉴定:分别采用DNA-DNA分子杂交技术、recA基因序列分析、GC%含量测定法、基于16S或23S rRNA序列的DNA标记技术、梯度变性凝胶电泳分析;采用编码和自动化鉴定系统(比较常用的全自动生化鉴定仪VITEK 2 COMPACT、BD Phoenix-100等)及荧光光谱法对同一菌株进行鉴定;当对同一菌株按照不同分类学鉴定后结果完全一致时,再进行该菌株肽质量指纹图谱的采集建库,否则不进行该菌株的建库。
第二步,建库菌株肽指纹图谱的提取
由于直接将菌落涂布于靶板上,加基质HCCA(α-氰基,4-羟基肉桂酸作为基质,以47.5%的水、2.5%的三氟乙酸,50%的乙腈的混合液为溶剂配置的HCCA饱和溶液),干燥后所产生的结晶斑点不均,采集到的肽指纹蛋白图谱相对强度、m/z比的位置偏移,图谱重复性差,所以采用标准提取法进行建库肽指纹图谱的提取,且要求提取时使用的器材均无金属离子、大分子聚合物等易于蛋白结合的离心管、枪头等实验器材和试剂,以保证检测到的肽指纹图谱真实可靠。
正常情况下,可采用下述方法对不同菌株进行肽指纹图谱的提取:
1、乙醇/甲酸法 适合绝大部分的细菌、真菌、放线菌、支原体、衣原体、立克次氏体等菌株。为缩短提取时间,提高菌体的破壁效果,保证鉴定结果的准确性,还需要对菌体进行预处理,其具体步骤如下:
(a)往离心管内加入一定体积的超纯水(电阻率接近18.3MΩ/cm,通常对于建库而言加入300ul超纯水),加入培养完毕的建库菌株的菌体(对于固体培养基培养,挑取一定量的单菌落即可,如果为液体培养,首先进行离心去除液体培养基,以超纯水反复洗涤菌体至完全除去培养基,加入300ul的超纯水重悬菌体),其浊度范围控制在1~10麦氏之间(或者简单挑取5~10mg菌体到300ul超纯水中),反复用移液枪吹打并涡旋,形成菌悬液;
(b)加入色谱级的无水乙醇,本发明建库时加入900ul色谱级乙醇,配置成75%的乙醇溶液,混匀后静置2min,实验证明最终乙醇浓度在60%~85%之间,涡旋振荡后静置一分钟以上(最好为1~5分钟),即可能洗去菌体上的脂溶性杂质;
(c)本发明建库时,以13000r/min离心2min,去除上清,重新离心后再次去除上清,室温下干燥半小时以上或采用干锅进行35~40℃加热,实验证明8000-15000r/min离心2min以上(至少两遍),去上清,静置直至完全干燥为止,也可以达到要求,其目的主要为去除乙醇,避免因乙醇和蛋白结合或蛋白之间聚合而导致肽指纹图谱偏移,造成采集的图谱失真。
(d)加入一定量40%~90%的甲酸(超纯水为溶剂,本发明构建图谱时采用70%的甲酸),完全覆盖干燥后的菌体,浊度不低于1麦氏,菌体重悬混匀后,静止2min以上,保证菌体破壁充分(本发明建库时,加入20ul 70%甲酸水溶液,用移液枪液面下反复吹打后静置2min)。
(e)加入0.8~1.5倍于甲酸体积的乙腈(本发明采用加入等体积乙腈,建库时操作为加入20ul乙腈,移液枪液面下反复吹打混匀),混匀后,静止2min以上,使蛋白充分溶解到上清液中。
(f)10000-15000r/min离心2min以上,取上清后点靶,每株菌点8-20个靶位,每个靶位点0.5-2ul,干燥后点0.5-2ul基质,待完全干燥后上机打靶(本发明建库时,采用13000r/min离心2分钟,取1ul上清液点在96孔靶板上,每株菌点10个样品点,干燥后,每个样品点加1ul基质,完全干燥后上机)。
2、80%TFA提取法
虽然三氟乙酸(TFA)的灭菌效果较好,但其采集的图谱质量略低于乙醇/甲酸法,考虑到今后建库和后期的鉴定使用的生物安全性,带有芽孢的菌株、依靠呼吸道传播的菌株以及生物安全性在二类以上的菌株采用80%TFA提取法提取肽指纹图谱,其具体方法为:
取适量样品(5~10mg),加入50ul 80%TFA,反复吹打至样品完全变性,静止10~30min,加入100ul水和150ul乙腈,混匀后13000r/min离心2min,吸取上清点靶,放干后加1ul基质,完全干燥后上机打靶。
第三步,建库菌株肽指纹图谱的采集
1)采集设备的确定 采用申请人单位自主研发的MALDI-TOF MS质谱平台(当然也可以采用包括布鲁克的flex系列的时间飞行质谱、梅里埃的VITEK MS系列的时间飞行质谱)进行图谱的采集,仪器调整参数如下:
(a)离子化激光源若采用氮气激发,波长为337nm;若采用固态激光,波长为355nm;
(b)微生物标准谱图的肽质量指纹图谱的采集范围是2000-20000Da之间;
(c)激光激发的电荷为带一个正电荷的多肽或蛋白,采用线性正离子操作模式,离子源1电压 20 KV,离子源2电压 17-20KV,电子透镜电压 5-10KV,延时提取时间30~400ns之间(离子源电压、电子透镜电压、延时提取时间的参数确定,以肽指纹图谱的分辨率为依据进行调整,参数确定后,主体峰的肽指纹图谱的分辨率FWHM在1000以上);
(d)激光频率为40~100Hz(通常为60Hz);
(e)检测器电压在-2kv到-5kv之间,调试时以基质HCCA为背景峰,可以测定出检测器对其达到响应时的最低电压值;该电压值会因检测器长期使用后衰减而逐渐增高,因此每隔一周要进行一次校准。
(f)仪器校准:采集谱图的激光击打次数设定为40-200次(最佳次数为100次);每次数据采集前采用大肠杆菌DH5a与肌红蛋白、核糖核酸RNA酶的混合的蛋白进行仪器校准,选取八个均匀分布于2000-20000Da的特征蛋白对仪器进行校准,其中校准的最大误差小于150ppm,校准方程为:
y=ax2+bx+c, 其中y代表m/z,x代表时间;
2)采集方法 每个菌株的每个靶点采集3~5张图谱,每张图谱由4次以上累加获得,每次参与累加的图谱要符合以下条件:信噪比高于3.0、基线低且平、主体峰强度在2000-20000之间,检测器换算时,100mv的电压值相当于256的峰强度(本数据库构建时,每个靶点通常采3张谱图,每张谱图累加6次,主体峰强度为6000-12000,每株菌采集30张谱图,相当于这30张谱图由180张谱图累加获得)。
3)图谱处理 将采集到的多张图谱使用分析软件(可采用布鲁克的FlexAnalysis分析软件)进行分析,首先对每张图谱的特征峰进行比对,删除统计学意义上的明显区别于其他图谱的图谱,并删除不合格的图谱,合格图谱留存,图谱张数大于20,不满足需重新提取采集,以达到数据库建库的要求。如图1所示,需要删除箭头指示的图谱,在采集到的图谱中,只有这两张明显区别于其他图谱,应该是采样误差造成的;
第四步,建库
1)对第三步采集的菌株图谱进行参数确定
标准图谱参数设置如下:
a)单个图谱特征峰的最大误差为1500~2400ppm(通常设置为200 ppm);由于质谱仪器在称量肽指纹图谱时,本身存在偏差,例如真实肽质量为3000Da,经质谱测量其分子质量应该在2998Da到3002Da之间,因此通过此参数来判定待测定的肽质量是否指示同一种蛋白,例如(2998-3000)/3000=667,小于2000ppm,因此2998Da的特征峰是由于仪器的误差造成了测量值与真实值之间的差别。
b)创建标准肽质量指纹参考谱的误差在200-300ppm;标准肽质量指纹图谱的构建,是将经FlexAnalysis分析后,至少20张以上合格的图谱合成一张标准图谱(简称MSP)。以图1中5954Da特征峰为例,经第一步(a)判断在一定范围内波动的特征峰是指示同一种蛋白,假如经(a)判定28张图谱的该特征峰实测值指示同一种特征蛋白,将这28张图谱的5954Da的特征峰的实际测定质量求平均值,然后每张图谱的(实测值-平均值)/平均值<(200-300ppm),则认为该图谱符合建库要求,参与到构建MSP中,反之则不参与MSP的构建,此时需要重新计算此5954Da特征峰的平均值,重复上一步计算,直到结束,最后符合此特征参数的图谱的实测蛋白的平均值,即为该多肽或蛋白在构建的MSP中的m/z值。
c)最小图谱频率:25%;仍以图1中5954Da特征峰为例,经(a)、(b)两步判定后,假如30张合格的图谱只有20张参与MSP的构建,那么该特征峰的谱图出现频率为:20/30=66.7%,大于25%,符合参数要求,否则不符合要求,舍弃该特征峰。
(d)谱图最大峰数目:70-80;每张入库的标准谱最少由20张以上图谱经归一化、平滑、基线修正,再经过(a)、(b)、(c)三个限制参数筛选后,按特征峰强度、误差大小、信噪比等参数的综合评分,由高到低进行排序,挑选出70-80个特征峰组成该菌株的MSP。其中数目的选择可以结合FlexAnalysis内显示的采集图谱,特征峰数目是否完全包含FlexAnalysis显示图谱的特征峰,依据实际特征峰数目进行选择。
2) 经(a)、(b)、(c)、(d)四个步骤筛选确定后形成一张表格,其内含有平均质荷比、特征峰强度、特征峰权重、特征峰出现频率、参与建库的图谱数量等一系列共性特征峰,如图2表中所示。
将确定的标准图谱与菌株名称进行统一,并详细标注出该菌株的建库方法,完成该菌株的建库;其他菌株建库方法依次类推,直至完成微生物肽质量指纹图谱库的构建。
下面以大肠杆菌为例,详细说明该菌株的建库方法:
1、建库菌株的培养:将大肠杆菌接种于血平板上培养,37度培养24h;
2、建库菌株的提取:(1)、往离心管内加入300ul的超纯水;(2)挑取3~5个大肠杆菌单菌落,其浊度范围控制在5麦氏,充分涡旋形成菌悬液;(3)加入900ul色谱级的无水乙醇,涡旋振荡后静置2分钟;(4)13000r/min离心2min,去上清,重复一次离心,常温下静置20min以上到完全干燥。(5)加入20ul的70%的甲酸菌体重悬混匀后,静置2min。(6)加入20ul乙腈,混匀后,静置2min。(7)13000r/min离心2min,取上清后点靶,点10个靶位,每个靶位点1ul,干燥后点1ul基质,完全干燥后上机打靶;
3、仪器参数的确认:采用氮气激发光源,波长为377nm,微生物鉴定的质量采集范围是2000-20000Da之间,线性正离子操作模式,离子源1电压20 KV,离子源2电压18.1KV,电子透镜电压6KV,延时提取时间为150ns;激光频率为60HZ,检测器电压在负2673V,采集谱图的激光击打次数设为100。数据采集前采用大肠杆菌DH5a与肌红蛋白、核糖核酸RNA酶的混合蛋白对仪器进行校准;
4、建库图谱的采集与建库:每个靶点采集3张图谱,每张图谱由6次累加获得,每次参与累加的图谱符合:信噪比高于3.0、基线低且平、主体峰强度在6000-12000之间。采集到的30张图谱,到分析软件FlexAnalysis中删除统计学意义上的明显区别于其他图谱的谱图,合格谱图进行建库,如图3、4所示。
构建标准肽质量参考图谱参数设置如下:单个图谱特征峰的最大误差 2000ppm;创建标准肽质量参考图谱的误差在200ppm;最小图谱频率25%;图谱最大峰数目70;入库参考谱由30张谱图经归一化、平滑、基线修正、特征峰挑选后形成含有平均质荷比、特征峰强度、特征峰权重、特征峰出现频率、参与建库的谱图数量等一系列共性特征峰的列表,如图5和图6表中所示。
- 还没有人留言评论。精彩留言会获得点赞!