本发明属于精准医学领域,具体为涉及对拟行或已行肝移植术的符合米兰标准的肝细胞癌患者进行预后情况分析的方法、系统与相关产品,通过该方法、系统与相关产品的实施得到的结果可对肝细胞癌患者采取肝移植术后的原发肿瘤的转移、复发风险评估与预测提供中间信息或辅助信息。
背景技术:
原发性肝癌是世界范围内发病率最高的恶性肿瘤之一,每年约有100万以上的人新患此病。我国肝癌发病人数始终居于世界首位,每年约23万人死于肝癌,占全球肝癌病人死亡数的53%,位列我国恶性肿瘤病死率首位。
1963年,Starzl进行了世界第一例肝癌的肝移植手术并获得成功,至今肝移植仍为公认的治疗肝癌的有效手段。就肝癌伴肝硬化患者而言,肝移植似乎是唯一可选择的治疗手段。目前移植术前对受体选择的方法有米兰标准、UCSF标准、杭州标准、上海复旦标准等,其中米兰标准被认为是当前最严格的肝移植受体的筛选方法,但遗憾的是,符合米兰标准的肝移植患者3年内的肿瘤复发率仍然达到了10-20%。肿瘤的生物学行为决定了肿瘤的侵袭能力。而米兰标准只依赖于肿瘤的直径和个数,不能很好反映出肿瘤的生物学行为,这是符合米兰标准的肝细胞癌患者移植后发生肿瘤复发和转移的最重要原因。
借助于可反映肿瘤细胞恶性生物学行为的标志物,在移植术前对拟行肝细胞癌的肝移植患者的复发风险进行评估,对于筛选适宜受体,提高移植效果,有效利用宝贵肝源,节约社会资源等方面具有重要意义;同时,对肝癌肝移植患者术后肿瘤复发、转移风险的评估,可以使临床医生能够根据复发风险的高低实施监测及采取相应的预防措施。虽然肝细胞癌中细胞角蛋白19(CK19)或磷脂酰肌醇蛋白聚糖-3(GPC3)的表达与患者术后肿瘤转移、复发的关系可见报道,但联合检测CK19或GPC3对肝细胞癌进行亚分类以及对患者预后进行分层尚未见公开报道。
技术实现要素:
针对上述问题,本发明的目的是提供对符合米兰标准的拟进行或已进行肝移植术的肝细胞癌患者进行预后情况分组的方法和系统。
本发明的另一个目的是提供与该方法或系统组合使用的试剂盒。
本发明的技术方案如下。
本发明所述预后包括肝移植术后的肿瘤肝内复发或肝外转移以及患者无复发生存。
一方面,本发明提供一种对符合米兰标准的拟进行或已进行肝移植术的肝细胞癌患者进行预后情况分组的方法,所述方法包括:
(1)检测所述患者的肝细胞癌组织样品中细胞的CK19(细胞角蛋白19)和GPC3(磷脂酰肌醇蛋白聚糖-3)表达情况,并基于表达情况给患者赋值:如为共表达CK19和GPC3的CK19+/GPC3+,赋值2分;如为表达GPC3但不表达CK19的CK19-/GPC3+,赋值1分;如为CK19和GPC3均不表达的CK19-/GPC3-,赋值0分;
(2)检测所述患者的血清AFP(甲胎蛋白)浓度,并基于与AFP浓度阈值的比较结果给患者赋值:如患者的血清AFP浓度≤阈值,赋值0分;如患者的血清AFP浓度>阈值,赋值1分;和
(3)将步骤(1)和步骤(2)中得到的赋值进行加和,得到所述患者的总赋值,由此将总赋值为0或1分的患者确定为肝移植术后良好预后组,将总赋值为2或3分的患者确定为肝移植术后差预后组。
在本发明中,步骤(1)中的所述肝细胞癌组织样品获取自所述患者的移植前肝穿活检或肝移植术;
优选地,步骤(1)中通过对所述肝细胞癌组织样品进行免疫组织化学染色来检测CK19和GPC3表达情况;
更优选地,所述免疫组织化学染色利用分别针对CK19和GPC3的单克隆抗体进行;更优选地,所述免疫组织化学染色利用不同颜色荧光素标记的分别针对CK19和GPC3的单克隆抗体进行。CK19和GPC3的表达为阴性还是阳性根据本领域的一般标准进行判断。
根据本申请的具体实施方式,所述免疫组织化学染色利用兔抗人CK19单克隆抗体(ab52625,Abcam公司)和小鼠抗人GPC3单克隆抗体(ab129381,Abcam公司)进行;或者所述免疫组织化学染色利用针对CK19的单克隆抗体(FITC标记,ab87014,Abcam公司)和针对GPC3的单克隆抗体(Alexa647标记,ab199813,Abcam公司)进行。
优选地,步骤(2)中的血清获自所述患者的肝移植术前;
优选地,步骤(2)中AFP浓度阈值为200ng/mL至410ng/mL之间的任何值,优选为200ng/mL至330ng/mL之间的任何值,更优选为300ng/mL至330ng/mL之间的任何值,例如320ng/mL至330ng/mL之间的任何值;
根据本发明的具体实施方式,AFP浓度阈值为321ng/mL。
优选地,步骤(2)中通过电化学发光法来检测AFP浓度。根据本发明的具体实施方式,所述电化学发光法采用罗氏诊断产品上海有限公司的人血清AFP浓度检测试剂盒(注册证号:国食药监械(进)字2014第3404874号)。
优选地,所述AFP浓度是所述患者的肝移植术前的多次检测的最高值,并且检测前一个月内所述患者不伴有急性活动性肝炎和肝坏死,并且未进行介入消融或栓塞治疗;
更优选地,当检测到CK19+/GPC3+患者、CK19-/GPC3+患者的血清中的AFP浓度≤阈值时,检查所述患者是否具有肿瘤内部典型坏死,并将具有肿瘤内部典型坏死的患者排除;
其中优选地,通过肝移植术前的影像学结果,或回顾大体标本及病理切片检查结果来判断肿瘤内部典型坏死;
更优选地,所述影像学结果获取自增强CT或增强核磁扫描成像。
另一方面,本发明提供一种对符合米兰标准的拟进行或已进行肝移植术的肝细胞癌患者进行预后情况分组的系统,所述系统包括:
(1)生物分析模块:
(1-A)CK19和GPC3表达分析模块,所述模块设置为基于所述患者的肝细胞癌组织样品中细胞的CK19和GPC3表达情况给患者赋值:如为共表达CK19和GPC3的CK19+/GPC3+,赋值2分;如为表达GPC3但不表达CK19的CK19-/GPC3+,赋值1分;如为CK19和GPC3均不表达的CK19-/GPC3-,赋值0分;和
(1-B)血清AFP浓度分析模块,所述模块设置为基于所述患者血清中AFP浓度与AFP浓度阈值的比较结果给患者赋值:如患者的血清AFP浓度≤阈值,赋值0分;如患者的血清AFP浓度>阈值,赋值1分;
以及
(2)数据处理模块:
所述模块设置为对来自(1-A)中模块和(1-B)中模块的赋值进行加和,得到所述患者的总赋值,并将总赋值为0或1分的患者确定为肝移植术后良好预后组,或将总赋值为2或3分的患者确定为肝移植术后差预后组。
在本发明中,所述(1-A)中的肝细胞癌组织样品获取自所述患者的移植前肝穿活检或肝移植术。
在本发明提供的系统中,优选地,(1-A)中的模块还设置为检测CK19和GPC3表达情况;
优选地,通过对所述肝细胞癌组织样品进行免疫组织化学染色来检测CK19和GPC3表达情况;
更优选地,所述免疫组织化学染色利用分别针对CK19和GPC3的单克隆抗体进行;更优选地,所述免疫组织化学染色利用不同颜色荧光素标记的分别针对CK19和GPC3的单克隆抗体进行。
根据本申请的具体实施方式,所述免疫组织化学染色利用兔抗人CK19单克隆抗体(ab52625,Abcam公司)和小鼠抗人GPC3单克隆抗体(ab129381,Abcam公司)进行;或者所述免疫组织化学染色利用针对CK19的单克隆抗体(FITC标记,ab87014,Abcam公司)和针对GPC3的单克隆抗体(Alexa647标记,ab199813,Abcam公司)进行。
在本发明提供的系统中,优选地,所述(1-B)中的血清获自所述患者的肝移植术前;
优选地,所述(1-B)中AFP浓度阈值为200ng/mL至410ng/mL之间的任何值,优选为200ng/mL至330ng/mL之间的任何值,更优选为300ng/mL至330ng/mL之间的任何值,例如320ng/mL至330ng/mL之间的任何值;根据本发明的具体实施方式,AFP浓度阈值为321ng/mL。
优选地,(1-B)中模块还设置为检测所述血清中的AFP浓度;
优选地,通过电化学发光法来检测AFP浓度。根据本发明的具体实施方式,所述电化学发光法采用罗氏诊断产品上海有限公司的人血清AFP浓度检测试剂盒(注册证号:国食药监械(进)字2014第3404874号)。
更优选地,所述AFP浓度是所述患者的肝移植术前的多次检测的最高值,并且检测前一个月内所述患者不伴有急性活动性肝炎和肝坏死,并且未进行介入消融或栓塞治疗。
在本发明提供的系统中,优选地,所述(1-B)中的模块还设置为,当检测到CK19+/GPC3+患者、CK19-/GPC3+患者的血清中的AFP浓度≤阈值时,检查所述患者是否具有肿瘤内部典型坏死,并将具有肿瘤内部典型坏死的患者排除;
其中优选地,通过肝移植术前的影像学结果,或回顾大体标本及病理切片检查结果来判断肿瘤内部典型坏死;
更优选地,所述影像学结果获取自增强CT或增强核磁扫描成像。
又一方面,本发明还提供一种本发明的方法或系统组合使用的试剂盒,所述试剂盒包括:
(A)用于检测肝细胞癌组织样品中细胞的CK19和GPC3表达情况的试剂;和
(B)用于检测血清中的AFP浓度的试剂。
在本发明提供的试剂盒中,优选地,(A)中的试剂包括用于对所述肝细胞癌组织样品进行免疫组织化学染色的试剂;
优选地,所述试剂包括CK19和GPC3的单克隆抗体;更优选地,所述试剂包括不同颜色荧光素标记的分别针对CK19和GPC3的单克隆抗体。
在本发明提供的试剂盒中,优选地,(B)中的试剂为通过电化学发光法测定来血清AFP浓度的试剂。例如罗氏诊断产品上海有限公司的注册证号为国食药监械(进)字2014第3404874号的试剂盒。
具体而言,首先,本发明的方法、系统与试剂盒涉及检测患者的肝细胞癌组织样品中细胞的CK19和GPC3表达情况,并基于该表达情况对患者进行共表达CK19和GPC3的CK19+/GPC3+、表达GPC3但不表达CK19的CK19-/GPC3+、和CK19和GPC3均不表达的CK19-/GPC3-的分组。
CK19和GPC3的表达为阴性还是阳性根据本领域的一般标准进行判断。在本发明的优选实施方式中,可利用CK19和GPC3的单克隆抗体进行检测,当样品中表达CK19或GPC3的细胞≥所有细胞的5%,判断为阳性;而当表达CK19或GPC3的细胞<所有细胞的5%,判断为阴性。而利用不同颜色荧光素标记的单克隆抗体进行检测时,当观察到样品中细胞显示相应颜色,判断为阳性;当观察到样品中细胞未显示相应颜色,判断为阴性。
第二,本发明的方法、系统与试剂盒涉及检测患者的血清中AFP浓度情况。通过将血清中AFP浓度与阈值相比较,可以将患者分成≤阈值或>阈值的两种情况。如本文所定义,所述AFP浓度应为患者术前血清学检查的最高值,且该次检查前一个月内患者不伴有急性活动性肝炎和肝坏死,未进行介入消融或栓塞治疗。并且,在CK19+/GPC3+或CK19-/GPC3+患者中,如果AFP≤阈值,必须利用增强核磁和CT检查排除肿瘤内部坏死的可能,如果影像学无典型坏死的表现方可进入随后分析。
示例性地,本发明提供采用所述系统与试剂盒可进行以下实施过程:
可在肝移植术前实施技术方案1:
1.根据影像学资料选择符合米兰标准的肝细胞癌患者进入以下分析。
2.利用肝穿活检获取的肝细胞癌组织进行CK19和GPC3的免疫组化染色,将肝细胞癌患者分为CK19+/GPC3+、CK19-/GPC3+和CK19-/GPC3-三种分子亚型,其中具有CK19+/GPC3+患者赋值2分,CK19-/GPC3+患者赋值1分、CK19-/GPC3-患者赋值0分。
优选地,该免疫组织化学技术为利用CK19和GPC3单克隆抗体对肿瘤组织的连续切片进行免疫组织化学染色,以观察到表达CK19或GPC3的细胞是否≥所有细胞的5%为标准来判断阳性或阴性,如肿瘤细胞的二者表达均为阳性,即记录为CK19+/GPC3+;如肿瘤细胞只显示GPC3阳性,则记录为CK19-/GPC3+;如肿瘤细胞CK19和GPC3染色均无阳性表达,则记录为CK19-/GPC3-。
优选地,利用不同颜色荧光素标记的CK19和GPC3单克隆抗体进行共同染色,只要观察到肿瘤细胞同时表达CK19和GPC3,即记录为CK19+/GPC3+;如肿瘤细胞只显示GPC3阳性,则记录为CK19-/GPC3+;如肿瘤细胞CK19和GPC3染色均无阳性表达,则记录为CK19-/GPC3-。
3.设置术前血清AFP阈值为200ng/mL至410ng/mL之间的任何值,优选为200ng/mL至330ng/mL之间的任何值,更优选为300ng/mL至330ng/mL之间的任何值,例如320ng/mL至330ng/mL之间的任何值:例如210ng/mL、220ng/mL、230ng/mL、240ng/mL、250ng/mL、260ng/mL、270ng/mL、或280ng/mL,优选设置术前血清AFP阈值为290ng/mL、300ng/mL、310ng/mL、320ng/mL、或330ng/mL,特别优选设置为321ng/mL,将患者术前血清中AFP浓度与阈值相比较,将患者分为AFP≤阈值或AFP>阈值两个情况,AFP≤阈值赋值0分,AFP>阈值赋值1分。
所述AFP浓度应为患者术前血清学检查的最高值,且该次检查前一个月内患者不伴有急性活动性肝炎和肝坏死,未进行介入消融或栓塞治疗。并且,在CK19+/GPC3+或CK19-/GPC3+患者中,如果AFP≤阈值,必须利用增强核磁或增强CT检查排除肿瘤内部坏死的可能,如果上述检查无典型坏死的表现方可进入随后分析。
4.将患者肿瘤免疫表型和血清AFP浓度两项分类指标的赋值得分相加,可以得到0、或1、或2、或3分。
5.将得分为0分或1分的患者确定为肝移植术后低级别复发风险组(良好预后组),将得分为2分或3分的患者确定为肝移植术后高级别复发风险组(差预后组)。
实验证明,上述技术方案可以对选择肝移植术合适受体患者提供中间结果或辅助信息。特别是实验证明,差预后组的患者在进行肝移植术后肿瘤无复发生存率高于米兰标准,且与目前报道的米兰标准外的肝移植受体的无复发生存率相当,如果选择进行肝移植术,术后必须进行密切监控和相应治疗。
或者,可在肝移植术后实施技术方案2:
1.根据增强核磁成像或增强CT影像学检查结果或肿瘤大体标本信息选自符合米兰标准的肝细胞癌患者进行以下分析。
2.利用肝移植术后获取的肝细胞癌组织进行CK19和GPC3的免疫组化染色,将肝细胞癌患者分为CK19+/GPC3+、CK19-/GPC3+和CK19-/GPC3-三种分子亚型,其中具有CK19+/GPC3+患者赋值2分,CK19-/GPC3+患者赋值1分、CK19-/GPC3-患者赋值0分。
CK19和GPC3的表达为阴性还是阳性的判断同技术方案1。
3.设置术前血清AFP阈值为200ng/mL至410ng/mL之间的任何值,优选为200ng/mL至330ng/mL之间的任何值,更优选为300ng/mL至330ng/mL之间的任何值,例如320ng/mL至330ng/mL之间的任何值:例如210ng/mL、220ng/mL、230ng/mL、240ng/mL、250ng/mL、260ng/mL、270ng/mL、或280ng/mL,优选设置术前血清AFP阈值为290ng/mL、300ng/mL、310ng/mL、320ng/mL、或330ng/mL,特别优选设置为321ng/mL,将患者术前血清中AFP浓度与阈值相比较,将患者分为AFP≤阈值或AFP>阈值两个情况,AFP≤阈值赋值0分,AFP>阈值赋值1分。
所述AFP浓度应为患者术前血清学检查的最高值,且该次检查前一个月内患者不伴有急性活动性肝炎和肝坏死,未进行介入消融或栓塞治疗。并且,在CK19+/GPC3+或CK19-/GPC3+患者中,如果AFP≤阈值,必须利用增强核磁或增强CT检查或回顾大体标本或病理切片以排除肿瘤内部坏死的可能,如果上述检查无典型坏死的表现方可进入随后分析。
4.将患者肿瘤免疫表型和血清AFP浓度两项分类指标的赋值得分相加,可以得到0、或1、或2、或3分。
5.将得分为0分或1分的患者确定为肝移植术后低级别复发风险组(良好预后组),将得分为2分或3分的患者确定为肝移植术后高级别复发风险组(差预后组)。
实验证明,上述技术方案可以对患者术后肿瘤复发与转移进行有效分层和预测提供中间结果或辅助信息。特别是实验证明,差预后组的患者在进行肝移植术后肿瘤无复发生存率高于米兰标准,且与目前报道的米兰标准外的肝移植受体的无复发生存率相当,因此在肝移植术后必须进行密切监控和相应治疗。
本发明证明,结合CK19或GPC3联合检测以及术前血清中的AFP浓度可以对肝细胞癌患者的肝移植预后进行有效分组,该分组可以对患者是否适合进行肝移植或术后肿瘤复发与转移进行有效分层和预测提供中间结果或辅助信息,因此,本发明对于筛选适宜肝移植术的患者人群,提高治疗效果,节约社会资源等方面具有重要意义;同时,对肝移植术术后肿瘤复发、转移风险的评估,可以使临床医生能够根据复发风险的高低实施监测及采取相应的预防措施。
对于大量肝细胞癌患者进行上述预后情况分组后,发现,良好预后组中的肝细胞癌患者,肝移植后三年内的无转移或复发生存率约为93.4%,远低于米兰标准,表明该患者群体是肝移植患者的最适合人群,预后良好;而差预后组中的肝细胞癌患者,肝移植术后的肿瘤无复发生存率为45.1%,高于米兰标准、且与目前报道的米兰标准外的肝移植受体的无复发生存率相当。因此,对这一肝移植术后患者群体应该进行更密切的影像学及血清学监测以便及早发现肿瘤复发,及时采取进一步的治疗措施以提高总生存率。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
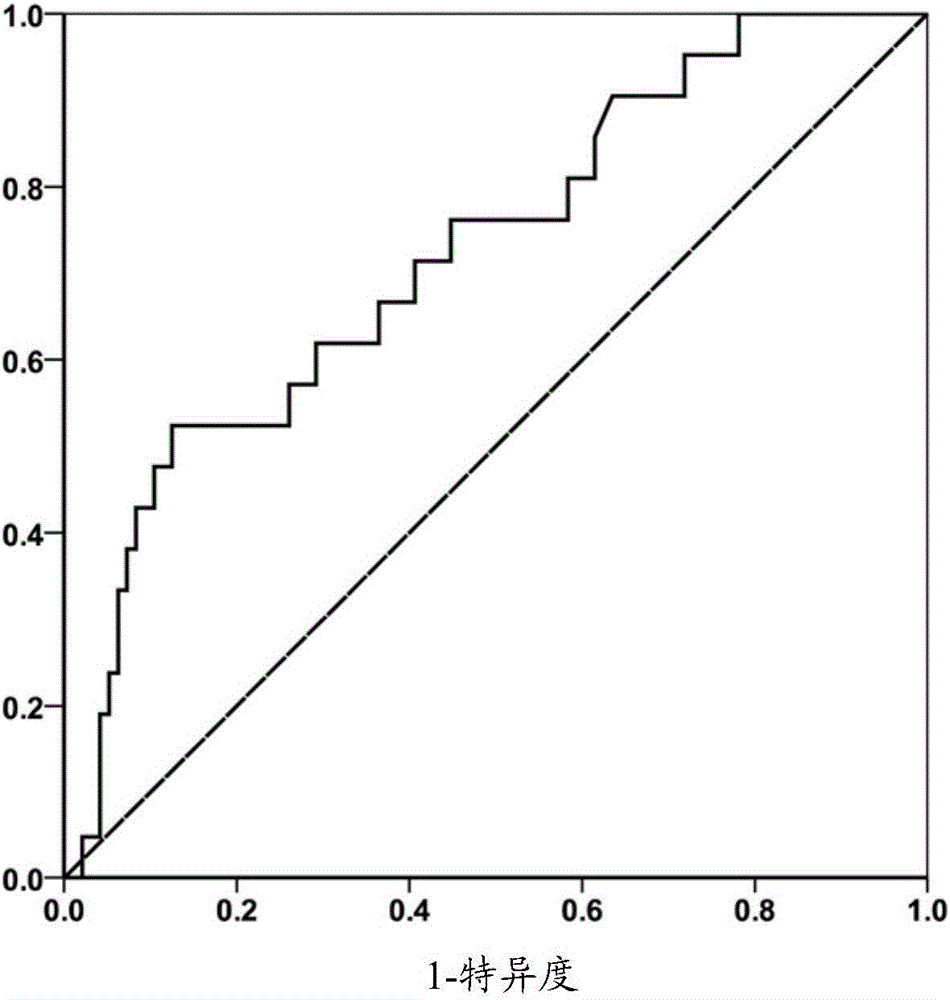
图1:根据本发明实施例1显示血清甲胎蛋白阈值的敏感度和特异性的受试者工作曲线;
图2:根据本发明实施例1所有入组病例的生存曲线,其中图2A显示为六组的生存曲线,图2B显示合并为两组的生存曲线;
图3:根据本发明实施例1提供受试者工作曲线检验显示的总预测性能:曲线下面积(AUC)=0.784(95%置信区间为0.663-0.905),其中虚线为根据米兰标准得到的参考线。与所有其它风险因素相比,新风险评分模型的AUC最大。
图4:根据本发明实施例2(技术方案1),基于肝穿的肿瘤组织CK19和GPC3免疫分型和血清中AFP浓度的肝细胞癌患者肝移植术预后分组流程图;
图5:根据本发明实施例2(技术方案1),显示不同组中患者群的生存曲线;
图6:根据本发明实施例2(技术方案1),显示本发明分类方法的ROC曲线,曲线下面积为0.771(95%置信区间为0.560-0.981),其中虚线为根据米兰标准得到的参考线;
图7:根据本发明实施例3(技术方案2),基于手术大体标本的肿瘤组织CK19和GPC3免疫分型和血清中AFP浓度的肝细胞癌患者肝移植术预后分组流程图;
图8:根据本发明实施例3(技术方案2),显示不同组中患者群的生存曲线;
图9:根据本发明实施例3(技术方案2),显示本发明分类方法的ROC曲线,曲线下面积为0.803(95%置信区间为0.635-0.970),其中虚线为根据米兰标准得到的参考线。
具体实施方式
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。
实施例1通过鉴定预测HCC患者中的无复发生存的风险因子而建立本发明的分组方法
1.患者和方法
患者和组织样本
收集2007年1月至2010年11月期间首都医科大学附属北京佑安医院的肝细胞癌移植的符合米兰标准的病例117例。此研究符合赫尔辛基宣言并经当地伦理委员会批准,受检者均签署知情同意书。所有病例术前未经化疗、放射治疗或介入治疗。上述米兰标准的定义为:单个肿瘤直径不超过5CM;多发的肿瘤少于3个并且最大直径不超过3CM;没有大血管侵犯,也没有淋巴结或肝外转移。
包括在预后分析中的HCC的临床、组织学数据(n=117)总结在表1中:分类变量和连续变量间的比较分别用卡方检验或Student t检验。无复发生存时间指从手术当日起到第一次远处转移或局部复发或最后一次随访时间。患者在肿瘤复发之前发生死亡事件被认为数据删失。Kaplan-Meier方法用于绘制生存曲线,曲线之间的差异用log-rank检验。
所有组织样本首先经过10%的甲醛固定,然后切取肿瘤组织按脱水、透明、浸蜡、包埋程序处理,4μm连续切片,并进行苏木素-伊红(HE)染色。所有的HCC的诊断和组织学分级是基于既定的组织学标准(International working party Hepatology 1995,international consensus group Hepatology 2009),由2位副主任医师级别以上的病理学医生利用双盲法进行评估。
表1.研究中包括的所有患者的基线临床特征
2.与无复发生存时间相关的患者血清甲胎蛋白浓度的阈值(cut-off value)的确定:
根据受试者工作曲线(ROC),当AFP阳性诊断阈值207ng/mL时诊断敏感度为52.4%、特异度为81.2%;当AFP阳性诊断阈值229ng/mL时诊断敏感度为52.4%、特异度为82.3%;当AFP阳性诊断阈值245ng/mL时诊断敏感度为52.4%、特异度为83.3%;当AFP阳性诊断阈值280ng/mL时诊断敏感度为52.4%、特异度为84.4%;当AFP阳性诊断阈值306ng/mL时诊断敏感度为52.4%、特异度为85.4%;当AFP阳性诊断阈值313ng/mL时诊断敏感度为52.4%、特异度为86.5%;当AFP阳性诊断阈值321ng/mL时诊断敏感度为52.4%、特异度为87.5%;当AFP阳性诊断阈值364ng/mL时诊断敏感度为47.6%、特异度为87.5%;当AFP阳性诊断阈值406ng/mL时诊断敏感度为47.6%、特异度为88.5%;其中,当AFP阳性诊断阈值321ng/mL时约登指数最大,为0.399;AUC值为0.724,坐标点对应于曲线左上角位置,因此本实施例中选定AFP阳性诊断阈值“321ng/mL”作为范例。结果见图1。
3.单因素分析:
根据患者的临床和病理学检查,将包括患者性别、年龄、是否有肝硬化、肉眼瘤栓、镜下瘤栓、组织学分级、CK19/GPC3表达模式、AFP阈值(321ng/mL)、肿瘤结节数目的9个因子用于单因素分析,Kaplan-Meier方法检测。结果发现:上述9个因子中有3个,即组织学低分化(P<0.01)、CK19/GPC3免疫表型(P<0.01)和AFP阈值(>321ng/mL)(P<0.01)与患者的肿瘤无复发生存时间密切相关。结果见下表2。
表2.针对肿瘤复发的单因素分析
AFP-CV,AFP阈值分类;CK19,细胞角蛋白19;GPC3,磷脂酰肌醇蛋白聚糖-3
4.多因素COX回归分析:
将上述3个因子纳入多因素分析。结果显示,CK19/GPC3免疫表型[CK19-/GPC3+:风险比(HR)=5.617,95%置信区间(CI)=1.257-25.106,P=0.024;CK19+/GPC3+:风险比(HR)=15.020,95%置信区间(CI)=3.116-72.409,P=0.001]和AFP阈值(>321ng/mL)(HR=4.898,95%CI=2.079-11.540,P=0.000)是患者肿瘤无复发生存时间的独立预测因素。结果见下表3。
5.用于预测HCC患者的无复发生存的多因素风险积分模型:
根据COX回归中预后相关因子的β系数,设定因子的风险得分。以每项中最低值为标准,并赋值为1分。所有得分四舍五入取整数。把每一病例中各个风险因子的权重得分相加得到每一病例总的风险得分。根据上述原则,本案例中,AFP<321ng/mL的病例得分为0,AFP≥321ng/mL得分为1;CK19-/GPC3-HCC得分为0,CK19-/GPC3+HCC得分为1,CK19+/GPC3+HCC得分为2。根据上述积分系统,所有入组病例被分为4组(得分:0、1、2、3分)。结果见下表3。
表3.多变量Cox回归分析和基于β系数和HR的得分
RFS:无复发生存;HCC,肝细胞癌;HR,风险比;CI,置信区间;CK19,细胞角蛋白19;GPC3,磷脂酰肌醇蛋白聚糖-3;AFP-CV,AFP阈值分类
绘制四组的生存曲线,结果见图2,其中图2A显示得分为0和1组的生存曲线明显重叠(P>0.05),得分为2和3组的生存曲线明显重叠(P>0.05)。因此,对统计学检验无显著差异的组进行合并。最终,所有入组病例被分为两组:即良好预后组(0、1分)和差预后组(2、3分),见图2B。生存分析显示,良好预后组和差预后组的平均无复发生存期分别为38.5个月和20.0个月,三年内的复发率分别为6.6%(6/88)和54.9%(15/29)。Log-rank发现两组之间无复发生存期的差异具有统计学意义(P<0.01)。结果见下表4。
表4.预测符合米兰标准的HCC患者在LT后复发的风险得分
HCC:肝细胞癌;LT:肝移植;RFS:无复发生存;
6.对模型预测能力的评估
模型的预测能力由ROC曲线下的面积(AUC)来进行评估。当AUC>0.7提示模型的预测能力较好。本模型的AUC值为0.784(95%CI:0.663-0.905),P=0.000。相对于其他风险因子,该模型的AUC值最大,提示与其他单因素预测因子相比,该模型对平均无复发生存期具有最佳的预测能力。结果见图3和下表5。
表5.多因素评分和其他要素的AUC
AUC:曲线下面积;CI:置信区间;CK19:细胞角蛋白19;GPC3,磷脂酰肌醇蛋白聚糖-3;AFP-CV:AFP阈值分类
实施例2在肝移植术前基于肝脏穿刺活检对符合米兰标准的肝细胞癌患者进行预后情况分组(技术方案1)
从北京海淀区某三级甲等医院收集符合米兰标准的肝细胞癌患者的肝移植病例23例,所有患者均在肝移植术前曾进行肝脏穿刺活检,并且从检验科和病理科数据库获得患者血清中AFP浓度和CK19、GPC3免疫组化染色结果,从医学影像科获得患者影像学信息。
采用本发明提供的方法、系统与试剂盒对符合米兰标准的肝细胞癌患者进行预后情况分组,其中血清中AFP浓度阈值设定为321ng/mL,结果见下表6。
具体实施过程见图4。
由该院医生电话随访获得各组中患者术后生存信息。基于表6中每一入组病例的免疫表型和血清中AFP浓度的分类及得分,采用实施例1中方法计算每一患者肝移植术后转移和复发风险累计得分,并根据结果绘制各组中患者的生存曲线和ROC曲线,结果分别见图5和图6(将根据米兰标准得到的对角线作为参考线)。
结果显示,两组中患者群的总的肝移植术后复发率为26.1%(6/23),而被分到肝移植术后良好预后组中患者群的术后实际复发率为0.00%(0/16),被分到肝移植术后差预后组中患者群的术后实际复发率为85.7%(6/7)。因此证明本发明的系统与试剂盒可以通过对肝细胞癌患者进行预后情况分组,对移植前筛选出高转移或复发风险的肝移植受体提供中间结果或辅助信息,有助于更有效地在肝移植术前对患者术后的转移和复发风险进行分层。
实施例3在肝移植术后基于肝移植后大体标本对符合米兰标准的肝细胞癌患者进行预后情况分组(技术方案2)
从北京海淀区某三级甲等医院收集符合米兰标准的肝细胞癌患者的肝移植病例36例,其中包括了实施例1中的23例移植术前的肝穿活检患者,并且从检验科和病理科数据库获得患者血清中AFP浓度和CK19、GPC3免疫组化染色结果,从医学影像科获得患者影像学信息。
采用本发明提供的方法、系统与试剂盒对符合米兰标准的肝细胞癌患者进行预后情况分组,其中血清中AFP浓度阈值设定为321ng/mL。结果见下表7。
具体实施过程见图7。
由该院医生电话随访获得各组中患者术后生存信息。基于表7中每一入组病例的免疫表型和血清中AFP浓度的分类及得分,采用实施例1中方法计算每一患者手术肝移植术后转移和复发风险累计得分,并根据结果绘制该队列中患者的生存曲线和ROC曲线,结果分别见图8和图9(将根据米兰标准得到的对角线作为参考线)。
结果显示,两组中患者群的总的肝移植术后复发率为27.78%(10/36),而被分到肝移植术后良好预后组中患者群的术后实际复发率为0.00%(0/36),被分到肝移植术后差预后组中患者群的术后实际复发率为90.91%(10/11)。因此证明本发明的方法、系统与试剂盒可以通过对肝细胞癌患者进行预后情况分组,对患者术后肿瘤复发与转移提供中间结果或辅助信息,有助于更有效地在肝移植术后对患者术后的转移和复发风险进行分层。
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:冯骥良;
- 技术所有人:冯骥良;
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、邢老师:1.机械设计及理论 2.生物医学材料及器械 3.声发射检测技术。
- 2、王老师:1.数字信号处理 2.传感器技术及应用 3.机电一体化产品开发 4.机械工程测试技术 5.逆向工程技术研究
- 3、王老师:1.机器人 2.嵌入式控制系统开发
- 4、张老师:1.机械设计的应力分析、强度校核的计算机仿真 2.生物反应器研制 3.生物力学
- 5、赵老师:检测与控制技术、机器人技术、机电一体化技术
- 如您是高校老师,可以点此联系我们加入专家库。
- 还没有人留言评论。精彩留言会获得点赞!