土壤厌氧氨氧化微生物群落结构检测方法与流程
本发明属于土壤微生物群落结构检测技术领域,具体涉及一种土壤厌氧氨氧化微生物群落结构的检测方法,特别是一种利用13C-PLFA测定土壤厌氧氨氧化微生物群落结构的方法。
背景技术:
厌氧氨氧化作用(ANAMMOX-Anaerobic ammonium oxidation)是指在厌氧条件下,微生物以NO2-为电子受体,NH4+为电子供体,将NH4+、NO2-转变为氮气的生化过程。1977年Broda从化学热力学出发,计算其与生物的进化关系时,大胆预言了Anammox过程的存在。第一个被命名的厌氧氨氧化的菌株是从一个生物反应器的实验室富集培养菌株中利用物理方法珀可梯度离心法分离得到的。随后Vande Graaf等人证实了厌氧氨氧化过程的存在。在这一过程中起作用的厌氧氨氧化细菌对氧极度敏感、生长非常缓慢,并且在较高细菌浓度条件下才表现出厌氧氨氧化活性,因此用传统的微生物分离、纯化培养方法研究厌氧氨氧化菌非常困难。但随着现代技术的发展,有许多新方法被引入到土壤微生物分析中。在分析环境样品中厌氧氨氧化菌群落组成时,常常采用克隆、测序构建16S rDNA克隆文库的方法。该方法避免了对厌氧氨氧化菌纯培养的要求,但是构建克隆文库工作量大,费用高,不能实现厌氧氨氧化菌群落结构的快速分析。
克隆和DGGE是研究微生物群落结构常用的方法,但这两种方法均仅能体现群落结构之间的相似性与差异性,若想确切分析各微生物含量,则需结合其他技术。磷脂脂肪酸(PLFA)是微生物细胞膜的主要成分,因微生物不同其PLFA组成与结构各异,不同的磷脂脂肪酸指示不同的微生物,因此将PLFA与稳定同位素标记相结合并通过特定的厌氧氨氧化培养过程中,则可以更好地分析厌氧氨氧化过程中参与代谢的各土壤微生物含量,经分析后可知厌氧氨氧化微生物的群落结构。
技术实现要素:
本发明要解决的技术问题是提供一种土壤厌氧氨氧化微生物群落结构检测方法;本发明将13C标记的尿素与PLFA结合并进行厌氧培养来分析土壤厌氧氨氧化菌群落结构的方法,该方法不仅对试验条件要求低、稳定性好,并且灵敏性高、定量准确性强,能精确地检测出在厌氧氨氧化过程中具有活性、参与反应的微生物的群落结构。
为了解决上述技术问题,本发明提供一种土壤厌氧氨氧化微生物群落结构检测方法,包括以下步骤:
设置6个容器,每个容器分别依次进行如下的步骤1)~步骤4):
1)、在容器中装入待测土壤和13C-尿素溶液,均匀搅拌,从而使土壤中13C-尿素-N的浓度达到200mg/kg;
备注说明:13C-尿素进入土壤后在土壤脲酶的作用下水解为铵和13CO2,为厌氧氨氧化提供了无机能源,厌氧氨氧化菌为化能自养型直接利用了13CO2,通过13C-PLFAs检测土壤厌氧氨氧化的群落结构;
2)、向步骤1)所得的土壤中加入KNO3溶液,均匀搅拌,从而使土壤中NO3--N浓度达200mg/kg;
3)、向步骤2)所得的土壤中加水(迅速加水)调至泥浆态,并封闭容器;
4)、用惰性气体替换掉容器中的空气,然后放入厌氧培养箱进行厌氧30±1℃培养;
5)、将步骤4)所得的6个容器分别培养1~2h,1d,3d,7d,10d,直至NO3--N、NH4+-N值稳定的那天;
对6个培养阶段对应的容器分别进行内容:
取土(例如5g),使用SKALAR连续流动分析仪测定土壤NO3--N和NH4+-N含量;
例如,具体可为:将SKALAR连续流动分析仪中氮气瓶开氮气至0.2MPa,松开流量计值45单位,开加热器,并打开主机99℃的加热器,使用SKALAR连续流动分析仪测定土壤NO3--N和NH4+-N含量;
备注说明:容器中剩余的土壤可直接进行下述步骤,如果不是及时进行下述步骤,也可暂时放入-18℃保存;
6)、根据NO3--N,NH4+-N的含量变化速率,选取变化速率最高的培养阶段所对应的容器中的土壤,提取其中的PLFA(磷脂脂肪酸);
变化速率最高的培养阶段的判断规则为:6个培养阶段的土壤在相同培养时间(单位培养时间)内NO3--N,NH4+-N的浓度下降值最高的培养阶段为变化速率最高的培养阶段,若NO3--N,NH4+-N的变化速率不一致,则取二者变化速率的均值最大的为变化速率最高的培养阶段;
备注说明:上述单位培养时间内NO3--N,NH4+-N的浓度下降值可依据常规的利用Origin拟合曲线后,据Origin中Analysis-Mathematics-Differentiate的方法,即能轻易检测获得;
7)、通过气相色谱-燃烧-同位素比率质谱联用法(GC-c-IRMS)测定提取出的PLFA中13C的丰度D13C,13C的丰度即13C标记的磷脂脂肪酸的丰度。
备注说明:13C标记的磷脂脂肪酸可以指示参与厌氧氨氧化过程的微生物,即可知厌氧氨氧化微生物的丰度,进而分析得出群落结构,所以可以根据13C的丰度得出土壤厌氧氨氧化微生物的群落结构。
作为本发明的土壤厌氧氨氧化微生物群落结构检测方法的改进:
所述步骤1)中,每个容器中加入30g新鲜的待测土壤和1.2mL浓度为5g/L的13C-尿素溶液;
所述步骤2)中,每个容器中加入1.2mL浓度为5g/L的KNO3溶液。
作为本发明的土壤厌氧氨氧化微生物群落结构检测方法的进一步改进:
所述步骤6)中提取PLFA的方法(采用修进后的布莱和戴尔方法,布莱和戴尔方法仅应用于于食品,且只能确定总脂类含量,修进后的方法提取和分离出了磷脂脂肪酸来确定土壤微生物结构)包括以下步骤:
在土壤(或冻干土壤)加入氯仿:甲醇:柠檬酸柠檬酸钠缓冲液(0.15M,ph4.0)(1:2:0.8v/v/v)进行提取;
将提取物(即,提取液)转移至硅胶固相萃取柱后分别用氯仿和丙酮洗去中心脂和糖脂后,用甲醇将磷脂洗脱;洗脱后的磷脂添加内标十九烷酸甲酯(C19:0)后,通过温和碱性甲基化方法将脂肪酸甲基化为相应的脂肪酸甲酯(FAMES)。温和碱性甲基化方法,即,在含有磷脂的试管中加入1mL的甲醇甲苯混合液(甲醇:甲苯=1:1)和1mL 0.2M的KOH甲醇溶液,放入37℃的水浴锅中加热进行甲酯化后,加入2mL水、0.3mL冰醋酸,再用正己烷氯仿混合液(两次,每次2mL,正己烷:氯仿=4:1)萃取磷脂脂肪酸甲酯,并用氮气吹干得到脂肪酸甲酯。
备注说明:脂肪酸甲酯(FAMES)与PLFA(磷脂脂肪酸)的关系为甲醇分解磷脂脂肪酸得脂肪酸甲酯,因此,在获知脂肪酸甲酯的量的前提下能轻易获得PLFA(磷脂脂肪酸)的量。
作为本发明的土壤厌氧氨氧化微生物群落结构检测方法的进一步改进:
所述步骤7)为:
利用步骤6)所得脂肪酸甲酯经气相色谱(GC)分离,具体为:首先打开氮气气瓶的总阀,调节压力至0.5MPa,打开空气发生器、氢气发生器电源,向气瓶供气;打开流量控制器机壳,调节压力与流量,调节氢气与空气的压力为50KPa,载气压力为70KPA,总气压为300KPa,调节尾吹至30ml/min后进样;分离之后由相连接的火陷离子检测器(FID)检测(仪器为美国Agilent公司,系统中存有美国MIDI公式的磷脂脂肪酸数据库),以此进行脂肪酸的定量;单个PLFA的13C/12C由气相色谱-燃烧法-稳定同位素比质谱仪(GC-C-IRMS)进行测定,其中Delta V同位素比质仪连有TraceGCUltra气相色谱、GC Combustion III(所有设备为德国Thermo Finnigan公司);
PLFA单体的量按照公式(1)进行计算:
Mi=dilution×(PFAME×ng Std)/(PISTD×W) (1)
(1)式中,Mi为单个磷脂脂肪酸(PLFA)的量(以干土计),单位为μg/g;PFAME为样品峰面积;PISTD为内标(methyl ester C19:0,6.2ng/μL)峰面积;PFAME及PISTD由由气相色谱仪获得;ng Std为内标的浓度(6.2ng/μL);dilution为稀释倍数;W为烘干土干重(以干土计),3g。
各个脂肪酸中C来源于尿素-C的量(Pi,μg/g)用公式(2)进行计算:
Pi=Mi*(δ13Cc-δ13Ccontrol)/(δ13CM-δ13Ccontrol) (2)
其中,Mi是单个PLFA的浓度,由公式(1)算得,δ13Cc和δ13Ccontrol是标记前和标记后单个脂肪酸的δ13C,δ13CM是添加尿素的δ13C,由同位素比质仪得。
各土壤中PLFA总的13C富集比例(pt)即13C的丰度D13C用下式(3)进行计算:
pt=∑Pi/∑Mi (3)
其中Mi是单个脂肪酸中C的含量(μg/kg)。
作为本发明的土壤厌氧氨氧化微生物群落结构检测方法的进一步改进:所述步骤1)中,容器为100mL的玻璃螺口培养瓶,用软橡胶塞加塞实现密封。该玻璃螺口培养瓶例如为:底部直径约4.5cm,口径约1.3cm,甁身高约9.5cm。
作为本发明的土壤厌氧氨氧化微生物群落结构检测方法的进一步改进:所述步骤3)中,每30g土壤加水5~7ml(较佳为6mL)。
本发明明确了土壤厌氧氨氧化微生物群落结构的检测方法,同时也可以作为底泥、污泥反应器、湿地等环境中厌氧氨氧化微生物群落结构检测的参考。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
图1是菜园土NO3--N,NH4+-N趋势图;
图2是菜园土13C–PLFA图谱;
图3是无机肥处理水稻土NO3--N,NH4+-N趋势图;
图4是无机肥处理水稻土13C–PLFA图谱;
图5是有机无机配施处理水稻土NO3--N,NH4+-N趋势图;
图6是有机无机配施处理水稻土13C-PLFA图谱;
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
下面实例将进一步说明本发明方法的可行性和应用效果。
实施例1、菜园土中土壤厌氧氨氧化微生物群落结构的检测方法,依次进行以下步骤:
准备6个100mL培养瓶,每个培养瓶分别进行如下的步骤1)~步骤4):
1)、在每个培养瓶加入30g新鲜的待测土壤,吸取鲜配的1.2mL浓度为5g/L的13C-尿素溶液均匀洒于每个培养瓶的土壤中并迅速搅拌混匀,使土壤中13C-尿素-N的浓度达到约200mg/kg;
2)、吸取1.2mL浓度为5g/L的KNO3溶液均匀洒于步骤1)所得的培养瓶土壤中,并搅拌混匀使NO3--N浓度约达200mg/kg;
3)、迅速加水6ml调至泥浆态并加橡皮塞封闭100mL培养瓶;
4)、用注射器向培养瓶内充惰性气体He赶走空气,放入厌氧培养箱进行厌氧30℃培养。
5)、将步骤4)所得的6个容器分别培养1~2h,1d,3d,7d,10d,直至NO3--N,NH4+-N值稳定的那天(约14天);
对6个培养阶段对应的容器分别进行内容:
破坏性取土,每个培养瓶各取5g土,于150ml震荡瓶中,加50ml 1mol/L KCl浸提液在20℃,180r/s震荡1小时,过滤上机测定,将SKALAR连续流动分析仪中氮气瓶开氮气至0.2Mpa,松开流量计值45单位,开加热器,并打开主机99℃的加热器,使用SKALAR连续流动分析仪测定NO3--N,NH4+-N,每个培养瓶中剩余的土壤(25g)可放入-18℃冰箱保存(也可即可直接进行后续步骤)。
测得NO3--N,NH4+-N浓度结果如图1所示,将该结果依据常规的在利用Origin拟合曲线后,据Origin中Analysis-Mathematics-Differentiate的方法进行运算,NO3--N,NH4+-N浓度下降速率均最快的前两天为培养后第7天及第14天。
6)、取-18℃冰箱保存的培养后7天及14天的土壤用修进的布莱和戴尔方法提取PLFA。向3.0g(冻干土壤样本)中加入15.2ml的氯仿:甲醇:柠檬酸柠檬酸钠缓冲液(0.15M,ph4.0)(1:2:0.8v/v/v)进行提取(250rpm、室温、提取2h),在提取所得的残渣中加入7.6ml的氯仿:甲醇:柠檬酸柠檬酸钠缓冲液(0.15M,ph4.0)(1:2:0.8v/v/v)进行再次的提取(提取工艺参数同上);将2次提取所得的提取液进行合并,作为提取物。
将提取物转氮气吹干后,用甲醇溶解(体积用量为1ml*2次)继而氮气吹干后,用氯仿(体积用量为0.5ml*3次)溶解移至硅胶固相萃取柱后(内装C18型号/规格的硅胶500mg)分别用氯仿(10ml,流速为0.3m/min)和丙酮(10ml,流速为0.3m/min)洗去中心脂和糖脂后,用甲醇(8ml,流速为0.3m/min)将磷脂洗脱;收集磷脂洗脱液。
洗脱后的磷脂(即,磷脂洗脱液)氮气吹干后添加200μl的内标十九烷酸甲酯(19:0,6.2ng/μL)后氮气吹干,从而形成含有磷脂的试管。通过温和碱性甲基化方法将脂肪酸甲基化为相应的脂肪酸甲酯(FAMES)。温和碱性甲基化方法即,在上述含有磷脂的试管中加入1mL的甲醇甲苯混合液(甲醇:甲苯=1:1)和1mL 0.2M的KOH甲醇溶液,放入37℃的水浴锅中加热进行甲酯化后,加入2mL水、0.3mL冰醋酸,再用正己烷氯仿混合液(两次,每次2mL,正己烷:氯仿=4:1)萃取磷脂脂肪酸甲酯,并用氮气吹干得到脂肪酸甲醋。
7)、利用步骤6)所得脂肪酸甲酯经气相色谱(GC)分离,首先打开氮气气瓶的总阀,调节压力至0.5MPa,打开空气发生器、氢气发生器电源,向气瓶供气;打开流量控制器机壳,调节压力与流量,调节氢气与空气的压力为50KPa,载气压力为70KPA,总气压为300KPa,调节尾吹至30ml/min后进样,分离之后由相连接的火陷离子检测器(FID)检测(仪器为美国Agilent公司,系统中存有美国MIDI公式的磷脂脂肪酸数据库),以此进行脂肪酸的定量。单个PLFA的13C/12C由气相色谱-燃烧法-稳定同位素比质谱仪(GC-C-IRMS)进行测定,其中Delta V同位素比质仪连有TraceGCUltra气相色谱、GC Combustion III(所有设备为德国Thermo Finnigan公司);
PLFA单体的量按照公式(1)进行计算:
Mi=dilution*(PFAME*ng Std)/(PISTD*W) (1)
(1)式中,Mi为单个磷脂脂肪酸(PLFA)的量(以干土计),单位为μg/g;PFAME为样品峰面积;PISTD为内标(methyl ester C19:0,6.2ng/μL)峰面积;PFAME及PISTD由由气相色谱仪获得;ng Std为内标的浓度(6.2ng/μL);dilution为稀释倍数;W为烘干土干重(以干土计),3g。
各个脂肪酸中C来源于尿素-C的量(Pi,μg/g)用公式(2)进行计算:
Pi=Mi*(δ13Cc-δ13Ccontrol)*100/(δ13CM-δ13Ccontrol) (2)
其中,Mi是单个PLFA的浓度,由公式(1)算得,δ13Cc和δ13Ccontrol是标记前和标记后单个脂肪酸的δ13C,δ13CM是添加尿素的δ13C,由同位素比质仪得。
各土壤中PLFA总的13C富集比例(pt)即13C的丰度(D13C)用下式(3)进行计算:
pt=∑Pi/∑Mi*100 (3)
具体实验如下:
实验:供试土壤采自浙江省余杭麻车头村;
所得数据以14d的15:0iso为例:
PFAME=6.651,PISTD=18.105,ng Std=6.2,W=3,所以Mi=0.759205;
δ13Cc=1.279,δ13Ccontrol=1.074,δ13CM=99,所以Pi=0.208;
∑Pi=1.170,∑Mi=66.242,pt=1.766。
因数据量较大,不一一赘述。
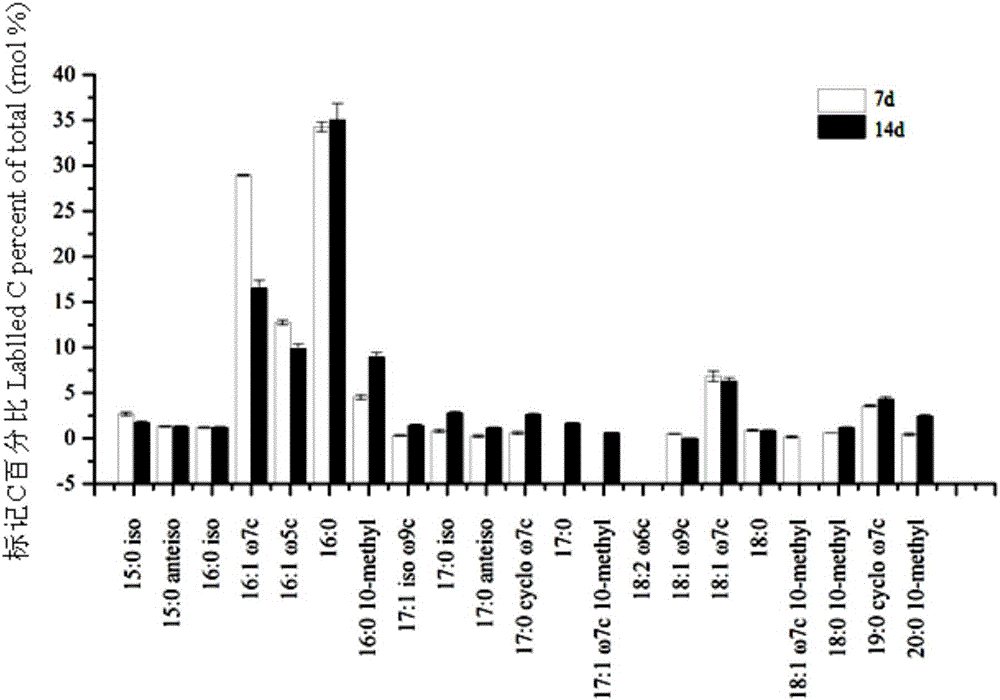
共测得20种磷脂脂肪酸,经计算得出各磷脂脂肪酸的13C富集比例(pt)如图2所示,横坐标即测得的各种磷脂脂肪酸,纵坐标即各种磷脂脂肪酸占总磷脂脂肪酸的百分比。从图2可看出,培养后14d菜园土土壤厌氧氨氧化微生物群落结构多样性。
根据磷脂脂肪酸所指示的不同微生物,14d的结果显示表征细菌的磷脂脂肪酸含量占约93.9±0.7%,而真菌的占约0.49±0.02%,放线菌的占约5.5±0.2%。
说明:培养7d后土壤所得结论基本同上。
实验2、无机肥处理水稻土土壤厌氧氨氧化微生物群落结构的检测
供试土壤采自江苏省金坛市指前镇建春村,纯NPK处理(100%当地用量,N 300kg·hm-2,P2O5 120kg·hm-2,K2O 100kg·hm-2)。采取同实施例1中的工艺参数以及工艺步骤。
测得NO3--N,NH4+-N浓度结果如图3所示,经运算,NO3--N,NH4+-N浓度均在培养后7天及14天的浓度下降速率最快。
所得数据以14d的15:0iso为例:
PFAME=31.656,PISTD=28.249,ng Std=6.2,W=3,所以Mi=2.3159;
δ13Cc=1.245,δ13Ccontrol=1.074,δ13CM=99,所以Pi=0.174;
∑Pi=2.985,∑Mi=102.258,pt=2.920。
因数据量较大,不一一赘述。
共测得20种磷脂脂肪酸,经计算得出各磷脂脂肪酸的13C富集比例(pt)如图4所示,横坐标即测得的各种磷脂脂肪酸,纵坐标即各种磷脂脂肪酸占总磷脂脂肪酸的百分比。从图4可看出,培养14d无机处理水稻土的土壤厌氧氨氧化微生物群落结构多样性。
根据磷脂脂肪酸所指示的不同微生物,表征细菌的磷脂脂肪酸含量占约94.0%,而真菌的占约0.60%,放线菌的占约5.4%。
说明:培养7d后土壤所得结论基本同上。
实施例3、有机肥无机肥配施处理水稻土土壤厌氧氨氧化微生物群落结构多样性。
供试土壤采自江苏省金坛市指前镇建春村,猪粪堆肥6000kg·hm-2+50%NPK处理;其中,纯NPK(尿素、过磷酸钙、硫酸钾)处理肥料用量为:N 300kg·hm-2,P2O5 120kg·hm-2,K2O 100kg·hm-2;猪粪堆肥养分含量为:有机质45.4%,N 2.3%,P2O5 2.9%,K2O1.2%,含水量29.1%。采取同实施例1中的工艺参数以及工艺步骤。
测得NO3--N,NH4+-N浓度结果如图5所示,经运算,NO3--N,NH4+-N浓度均在培养后7天及14天的浓度下降速率最快。
所得数据以14d的15:0iso为例:
PFAME=16.273,PISTD=24.569,ng Std=6.2,W=3,所以Mi=1.3688;
δ13Cc=1.242,δ13Ccontrol=1.074,δ13CM=99,所以Pi=0.171;
∑Pi=1.734,∑Mi=62.648,pt=2.768。
因数据量较大,不一一赘述。
共测得20种磷脂脂肪酸,经计算得出各磷脂脂肪酸的13C富集比例(pt)如图6所示,横坐标即测得的各种磷脂脂肪酸,纵坐标即各种磷脂脂肪酸占总磷脂脂肪酸的百分比。从图6可看出,培养14d有机处理水稻土的土壤厌氧氨氧化微生物群落结构多样性。
根据磷脂脂肪酸所指示的不同微生物,表征细菌的磷脂脂肪酸含量占约92.1%,而真菌的占约0.6%,放线菌的占约7.3%。
说明:培养7d后土壤所得结论基本同上。
验证实验、采用现有的本行业公认的检测精度高的DGGE结合qPCR对实施例1、实施例2、实施例3所述的土壤进行检测,所得结果的简述如表1所述:
表1
对比例1-1、将实施例1中的使土壤中13C-尿素-N的浓度由200mg/kg改成150mg/kg,将NO3--N浓度由200mg/kg改成150mg/kg,其余等同于实施例1。
结果显示,细菌含量有显著下降(仅为80%左右),真菌变化不大,放线菌含量有上升,与验证实验的数据相差较大,不能正确显示实际结果。
对比例1-2、将实施例1中的使土壤中13C-尿素-N的浓度由200mg/kg改成250mg/kg,将NO3--N浓度由200mg/kg改成250mg/kg,其余等同于实施例1。
结果显示,细菌含量上升,真菌与放线菌含量均降低(放线菌仅为3.5%左右),与验证实验的数据相差较大,不能正确显示实际结果。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!