一种基于复合光子晶体微球的多组分表面增强拉曼光谱检测方法与流程
本发明属于生物医学检测技术领域,具体涉及一种基于复合光子晶体微球的多组分表面增强拉曼光谱检测方法。
背景技术:
早期的分析检测肿瘤标志物在临床诊断上具有重要意义,由于致癌过程的复杂性,许多生物标志物并不是特定于一个癌症。因此,发展同时测定多个肿瘤标志物的方法非常必要。相对于单组份检测,多元检测技术简便了分析过程,缩短了分析时间,降低了分析成本,使得获取巨大数目的生物分子信息成为可能,已经成为近年来研究的热点。
表面增强拉曼散射技术(SERS)因其具备超灵敏性、高选择性以及检测条件温和等特点,作为一种分析检测手段被广泛应用于生物免疫学等领域。基于SERS的多元生物分析方法在药物筛选、基因功能分析和生物分析、临床诊断中的应用研究广泛。然而,功能单一的流动编码载体存在如编码量少、不易分离、编码稳定性低等不足,目前通过利用不同材料的性能来拓宽流动编码载体的应用范围。因此,制备一种高活性且可实现多元分析的SERS增强基底十分重要。
由于量子点稳定的光化学性质,利用其进行编码在多元检测方面有很大的应用前景。目前已有报道银纳米颗粒/CdTe/聚苯乙烯复合材料被用于荧光光谱和SERS结合的复合检测,该复合材料是沉积在玻璃板上得到的,其结构在检测时不稳定而且灵敏度不高,检测限范围有限,最关键的是其信号的重现性不能得到保障(Physicochem.Eng.Aspects,2014,443,467–472)。中国专利201110226795.4将拉曼编码微球运用到肿瘤标志物检测中,依据不同拉曼活性分子的特征谱峰进行拉曼编码,通过拉曼编码微球表面超强SERS效应和编码分子的拉曼信号输出实现对多肿瘤标志物的同步检测,对肿瘤标志物CEA的检测范围为0.1pg/mL~1.0ng/mL。也有报道将SiO2光子晶体编码微球与具有高SERS活性的银纳米粒子相结合(Chem.Commun.2016,52,284-288),通过SiO2光子晶体微球的编码/解码与拉曼信号结合,该方法为SERS领域提供了一个多元检测新思路,对肿瘤标志物CEA的检测范围为0.01pg/mL~1000pg/mL,AFP浓度范围为0.1pg/mL~1000pg/mL。但是上述方法中的拉曼编码微球和SiO2光子晶体编码微球其本身并没有拉曼增强的效果,只起到了编码的功能。综上所述,现有的SERS检测方法在检测时仍然存在信号不够稳定,灵敏度不高,重现性不好等缺陷,无法实现检测范围较宽的多元分析。
技术实现要素:
针对现有的SERS多元检测技术中存在的不足,本发明提供了一种基于复合光子晶体微球的多组分表面增强拉曼光谱检测方法,该方法能实现高活性的多元肿瘤标志物的分析检测。
本发明的技术方案如下:
一种基于复合光子晶体微球的多组分表面增强拉曼光谱检测方法,包括以下步骤:
步骤1,制备复合光子晶体微球:将银纳米粒子包覆二氧化钛光子晶体微球按质量比为800~600:1加入到链霉亲和素溶液中,4℃过夜后加入1%的牛血清蛋白溶液封闭,清洗后得到修饰有链霉亲和素的银纳米粒子包覆二氧化钛光子晶体微球;将CdTe量子点的水溶液与生物素溶液按CdTe量子点的摩尔量与生物素的质量的比为4~6.4:1在室温下混合,摇床反应,得到修饰有生物素的CdTe量子点溶液;将修饰有链霉亲和素的银纳米粒子包覆二氧化钛光子晶体微球加入到修饰有生物素的CdTe量子点溶液中,摇床反应后清洗得到复合光子晶体微球;加入不同发光颜色的CdTe量子点,制备不同编码的复合光子晶体微球;
步骤2,固定包被用抗体:将步骤1得到的复合光子晶体微球置于包被用抗体的磷酸盐缓冲溶液中,4℃过夜,洗涤后加入1%的牛血清蛋白溶液封闭,清洗后得到固定有包被用抗体的复合光子晶体微球;
步骤3,制备拉曼信号放大探针:将拉曼探针分子对巯基苯甲酸的磷酸盐缓冲溶液、银纳米颗粒的磷酸盐缓冲溶液加入到标记用抗体的磷酸盐缓冲溶液中,触发反应后4℃过夜,清洗后得到固定有标记用抗体的对巯基苯甲酸/抗体/银纳米颗粒拉曼信号放大探针;
步骤4,多组分表面增强拉曼光谱检测:将多种固定有包被用抗体的复合光子晶体微球和相应的多种固定有标记用抗体的对巯基苯甲酸/抗体/银纳米颗粒拉曼信号放大探针加入待测溶液中,25~37℃下温浴反应,冲洗液冲洗后,检测微球表面的拉曼和荧光信号,根据量子点荧光确定待测溶液中的生物分子的种类,根据拉曼信号强度确定待测溶液中各生物分子的浓度。
步骤1中,所述的CdTe量子点浓度为0.8mmol/L,生物素浓度为1mg/mL,所述的链霉亲和素的浓度为500μg/mL。
步骤2中,所述的复合光子晶体微球与包被用抗体的质量比为75~100:1。
步骤3中,所述的对巯基苯甲酸、银纳米颗粒与标记用抗体的质量比为1:2.6:1~2。
步骤4中,所述的温浴时间为10~60min。
本发明可应用于肿瘤标记物CEA、AFP、CA125、CA199、CA211、CA724等的生物分子检测中。
与现有技术相比,本发明具有以下显著效果:
(1)利用亲和素-生物素系统将不同颜色的水相CdTe量子点均匀地修饰在银纳米粒子包覆二氧化钛光子晶体微球上得到复合光子晶体微球,复合编码微球编码性能比较稳定,是一种流动的编码形式,表面修饰的抗原抗体均一性好,在实际检测中具备更好的选择性;
(2)将量子点与灵敏度高、重现性好的银纳米粒子包覆二氧化钛光子晶体微球基底材料结合运用到多组分表面增强拉曼光谱检测中,通过量子点的编码/解码与拉曼信号结合,利用纳米信号放大系统,能够实现了对CEA、AFP、CA125、CA199、CA211、CA724等肿瘤标记物的多元检测;
(3)本发明的检测方法展现出较宽的线性范围和较高的灵敏性,检测过程信号稳定,重现性好,通过荧光光谱和显微镜照片实现对其解码,操作简单,区分明显,其中CEA和AFP的检测范围为1×100~1×10-8ng/mL,CA125的检测范围为5×102~5×10-5U/mL。本发明的基于复合光子晶体微球的多组分表面增强拉曼光谱检测方法在多元表面增强拉曼光谱检测方面存在较大的应用前景。
附图说明
图1是复合光子晶体微球的SEM图(a)及EDX图(b)。
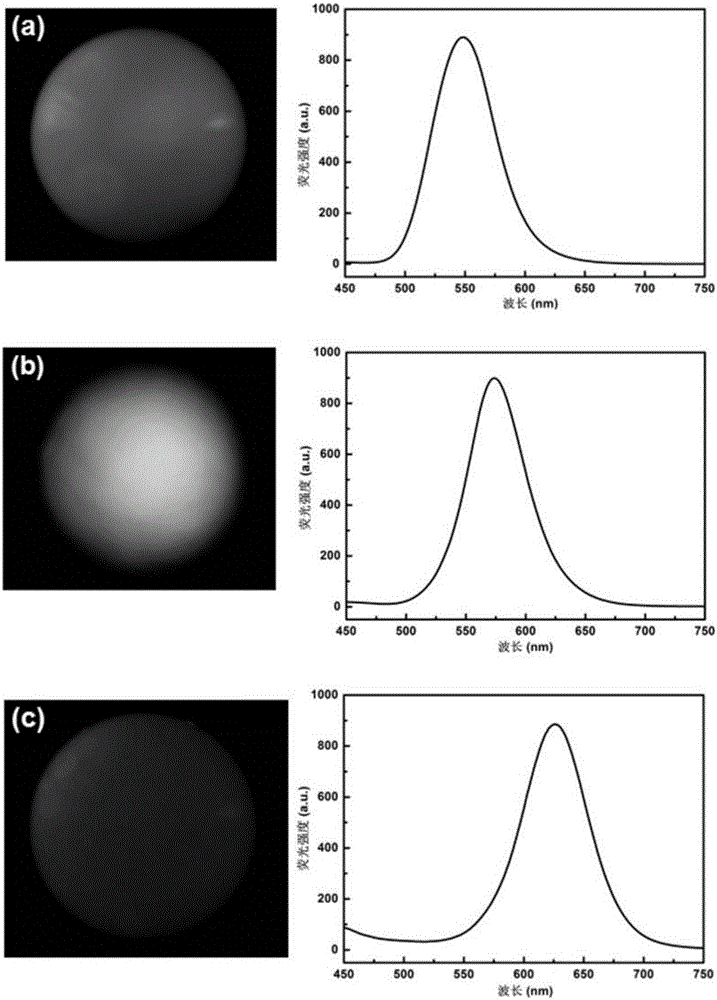
图2是3种复合光子晶体微球的荧光显微镜照片以及对应的荧光光谱图。
图3是3种不同肿瘤标记物的SERS拉曼光谱图。
具体实施方式
本发明的银纳米粒子包覆二氧化钛光子晶体微球按现有文献报道方法制备,参考中国专利201610038980.3制备得到。
下面结合实施例和附图对本发明作进一步详述。
实施例1
(1)制备复合光子晶体微球:首先在制备好的银纳米粒子包覆二氧化钛光子晶体微球0.006g中加入链霉亲和素溶液200μL(500μg/mL)4℃过夜,加入100μL的1%的牛血清蛋白室温下封闭2h,将封闭好的微球用磷酸盐缓冲溶液洗净后待用;同时取制备好的3种颜色分别为绿、黄、红色的水相CdTe量子点各1mL(0.8mmol/L)分别与生物素200μL(1mg/mL)在室温下混合,并放入摇床反应3h;将上述修饰有链霉亲和素的银纳米粒子包覆二氧化钛光子晶体微球分别加入到3种修饰有生物素的量子点溶液中,在室温下摇床3h,最后用磷酸盐缓冲溶液洗涤3次;
(2)抗体的固定:将上述制备好的3种复合光子晶体微球各0.0075g分别置于200μL CEA包被用抗体,AFP包被用抗体和CA125包被用抗体的磷酸盐缓冲溶液中(0.5mg/mL),触发反应后4℃过夜,将包被用抗体固定在复合光子晶体微球的表面;第二天将修饰好抗体的固相载体微球取出用磷酸盐缓冲溶液洗净后,加入100μL的1%的牛血清蛋白室温下封闭2h,将封闭好的微球用磷酸盐缓冲溶液洗净后待用;
(3)制备拉曼信号放大探针:分别取100μL拉曼探针分子对巯基苯甲酸(2.6mg/mL)和200μL银纳米颗粒的磷酸盐缓冲溶液(0.5mg/mL)加入到200μL的CEA标记用抗体,AFP标记用抗体和CA125标记用抗体的磷酸盐缓冲溶液中(0.5mg/mL),触发反应后4℃过夜,第二天离心洗涤除去未反应的对巯基苯甲酸和抗体,将形成的3种拉曼信号放大探针(对巯基苯甲酸/抗体/银纳米颗粒)分别分散在1mL的磷酸盐缓冲溶液中;
(4)多组分表面增强拉曼光谱检测方法:配置一系列不同浓度(1×100~1×10-9ng/mL)的CEA、AFP和CA125抗原混合溶液,将三种固定有抗体的复合光子晶体微球和对应的拉曼信号放大探针(对巯基苯甲酸/抗体/银纳米颗粒)分别置于其中,37℃温浴反应50min,最终在复合光子晶体微球的表面形成夹心生物复合物,用冲洗液冲洗后,置于激光共焦拉曼光谱仪下,切换光路,通过测定编码微球表面的拉曼和荧光信号来实现检测和解码,通过编码信息(量子点荧光)来确定待测生物分子的种类,利用检测信息(拉曼信号)来确定待测生物分子的浓度。
实施例2
(1)制备复合光子晶体微球:首先在制备好的银纳米粒子包覆二氧化钛光子晶体微球0.007g中加入链霉亲和素溶液200μL(500μg/mL)4℃过夜,加入100μL的1%的牛血清蛋白室温下封闭2h,将封闭好的微球用磷酸盐缓冲溶液洗净后待用;同时取制备好的3种颜色分别为绿、黄、红色的水相CdTe量子点各1.4mL(0.8mmol/L)分别与生物素200μL(1mg/mL)在室温下混合,并放入摇床反应3h;将上述修饰有链霉亲和素的银纳米粒子包覆二氧化钛光子晶体微球分别加入到3种修饰有生物素的量子点溶液中,在室温下摇床3h,最后用磷酸盐缓冲溶液洗涤3次;
(2)抗体的固定:将上述制备好的3种复合光子晶体微球各0.0075g分别置于200μL CEA包被用抗体,CA199包被用抗体和CA724包被用抗体的磷酸盐缓冲溶液中(0.5mg/mL),触发反应后4℃过夜,将包被用抗体固定在复合光子晶体微球的表面;第二天将修饰好抗体的固相载体微球取出用磷酸盐缓冲溶液洗净后,加入100μL的1%的牛血清蛋白室温下封闭2h,将封闭好的微球用磷酸盐缓冲溶液洗净后待用;
(3)制备拉曼信号放大探针:分别取100μL拉曼探针分子对巯基苯甲酸(2.6mg/mL)和200μL银纳米颗粒的磷酸盐缓冲溶液(0.5mg/mL)加入到200μL的CEA标记用抗体,CA199标记用抗体和CA724标记用抗体的磷酸盐缓冲溶液中(0.5mg/mL),触发反应后4℃过夜,第二天离心洗涤除去未反应的对巯基苯甲酸和抗体,将形成的3种拉曼信号放大探针(对巯基苯甲酸/抗体/银纳米颗粒)分别分散在1mL的磷酸盐缓冲溶液中;
(4)多组分表面增强拉曼光谱检测方法:配置一系列不同浓度的CEA、CA199和CA724抗原混合溶液,将三种固定有抗体的复合光子晶体微球和对应的拉曼信号放大探针(对巯基苯甲酸/抗体/银纳米颗粒)分别置于其中,25℃温浴反应60min,最终在复合光子晶体微球的表面形成夹心生物复合物,用冲洗液冲洗后,置于激光共焦拉曼光谱仪下,切换光路,通过测定编码微球表面的拉曼和荧光信号来实现检测和解码,通过编码信息(量子点荧光)来确定待测生物分子的种类,利用检测信息(拉曼信号)来确定待测生物分子的浓度。
实施例3
(1)制备复合光子晶体微球:首先在制备好的银纳米粒子包覆二氧化钛光子晶体微球0.008g中加入链霉亲和素溶液200μL(500μg/mL)4℃过夜,加入100μL的1%的牛血清蛋白室温下封闭2h,将封闭好的微球用磷酸盐缓冲溶液洗净后待用;同时取制备好的3种颜色分别为绿、黄、红色的水相CdTe量子点各1.6mL(0.8mmol/L)分别与生物素200μL(1mg/mL)在室温下混合,并放入摇床反应3h;将上述修饰有链霉亲和素的银纳米粒子包覆二氧化钛光子晶体微球分别加入到3种修饰有生物素的量子点溶液中,在室温下摇床3h,最后用磷酸盐缓冲溶液洗涤3次;
(2)抗体的固定:将上述制备好的3种复合光子晶体微球各0.0075g分别置于200μL CEA包被用抗体,CA211包被用抗体和CA199包被用抗体的磷酸盐缓冲溶液中(0.5mg/mL),触发反应后4℃过夜,将包被用抗体固定在复合光子晶体微球的表面;第二天将修饰好抗体的固相载体微球取出用磷酸盐缓冲溶液洗净后,加入100μL的1%的牛血清蛋白室温下封闭2h,将封闭好的微球用磷酸盐缓冲溶液洗净后待用;
(3)制备拉曼信号放大探针:分别取100μL拉曼探针分子对巯基苯甲酸(2.6mg/mL)和200μL银纳米颗粒的磷酸盐缓冲溶液(0.5mg/mL)加入到200μL的CEA标记用抗体,CA211标记用抗体和CA199标记用抗体的磷酸盐缓冲溶液中(0.5mg/mL),触发反应后4℃过夜,第二天离心洗涤除去未反应的对巯基苯甲酸和抗体,将形成的3种拉曼信号放大探针(对巯基苯甲酸/抗体/银纳米颗粒)分别分散在1mL的磷酸盐缓冲溶液中;
(4)多组分表面增强拉曼光谱检测方法:配置一系列不同浓度的CEA、CA211和CA199抗原混合溶液,将三种固定有抗体的复合光子晶体微球和对应的拉曼信号放大探针(对巯基苯甲酸/抗体/银纳米颗粒)分别置于其中,37℃温浴反应10min,最终在复合光子晶体微球的表面形成夹心生物复合物,用冲洗液冲洗后,置于激光共焦拉曼光谱仪下,切换光路,通过测定编码微球表面的拉曼和荧光信号来实现检测和解码,通过编码信息(量子点荧光)来确定待测生物分子的种类,利用检测信息(拉曼信号)来确定待测生物分子的浓度。
图1是步骤1中制备得到的复合光子晶体微球的SEM图(a)及EDX图(b)。图1(a)显示复合光子晶体微球局部仍然保持六方堆积的结构,结构规整,从1(b)图能谱中能明显的看出CdTe量子点成功修饰在银纳米粒子包覆二氧化钛光子晶体微球表面。
图2是步骤1中制备得到的3种复合光子晶体微球的荧光显微镜照片以及对应的荧光光谱图。如图2(a)、2(b)、2(c)所示,可以清楚地看出3种不同颜色的量子点均匀地修饰在银纳米粒子包覆二氧化钛光子晶体微球表面(图2(a)为绿色,图2(b)为黄色,图2(c)为红色),且各自显现的颜色与右图中的荧光光谱一一对应,为多元检测提供了编码/解码的条件。
图3是实施例1检测得到的3种不同肿瘤标记物的SERS拉曼光谱图。图3(a)为检测不同浓度CEA的SERS拉曼光谱图及以1342cm-1处的峰为参考峰得到的浓度依赖的CEA的SERS强度变化的标准曲线图。图3(b)为检测不同浓度AFP的SERS拉曼光谱图及以1342cm-1处的峰为参考峰得到的浓度依赖的AFP的SERS强度变化的标准曲线图。图3(c)为检测不同浓度CA125的SERS拉曼光谱图及以1342cm-1处的峰为参考峰得到的浓度依赖的CA125的SERS强度变化的标准曲线图。由图可以看出本发明方法成功实现了对相应抗原的检测,且展现出较宽的线性范围和较高的灵敏性。如图3(a)所示,对于CEA的检测范围为1×100~1×10-8ng/mL,而且基线平稳特征峰明显;右图以1342cm-1处的峰为参考峰得到的浓度依赖的CEA的SERS强度变化的标准曲线图中可以看出本发明检测方法检测限范围较宽,线性拟合关系良好。如图3(b)、3(c)所示对于AFP和CA125的检测范围分别为1×100~1×10-8ng/mL和5×102~5×10-5U/mL,对应的右图可以看出检测限范围较宽,线性拟合关系良好。与图2的显微镜照片相结合,本发明方法实现对肿瘤标记物的解码,实现了3种不同肿瘤标记物的多元检测,并且操作简单,区分明显,检测限显著优于现有的SERS检测方法,更适用于实际检测。
- 还没有人留言评论。精彩留言会获得点赞!