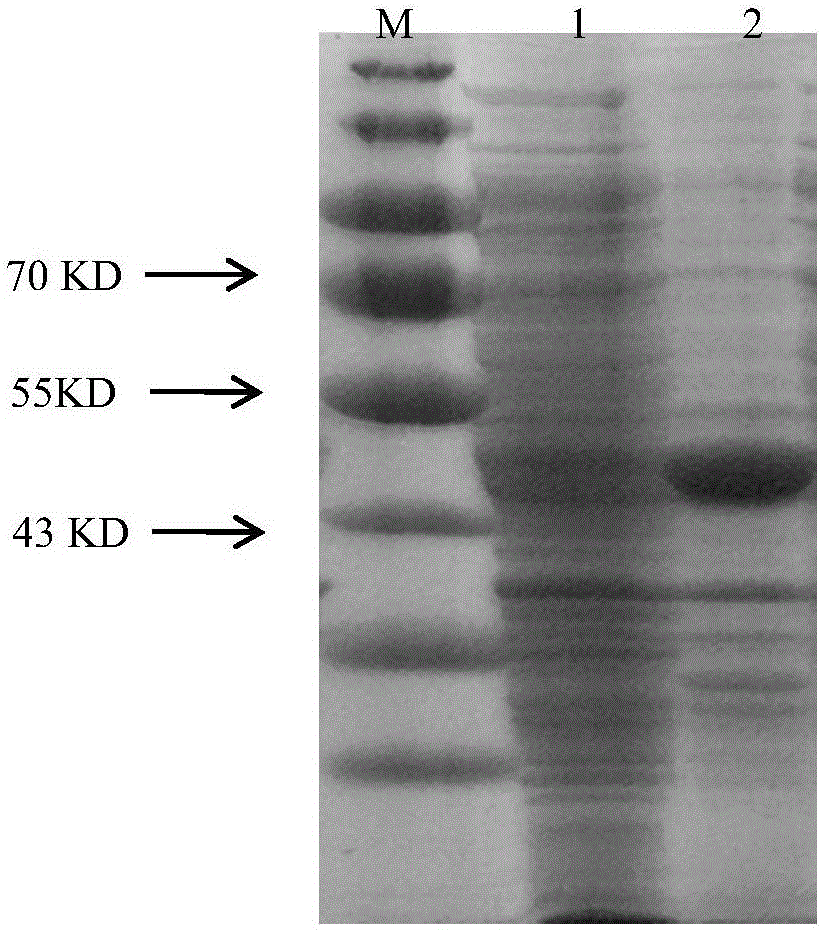
本发明涉及一种用于检测亚精胺/精胺乙酰转移酶(spermidine/spermineN1-actyltransferase,简称SSAT)含量的方法,特别是一种检测SSAT含量的体外检测试剂盒及其检测方法。
背景技术:
:多胺是人体中一类重要的含高密度正电荷的小分子有机化合物,包括腐胺、亚精胺和精胺,参与细胞内众多重要的生物学过程,如基因转录、蛋白合成、细胞周期等。SSAT是多胺代谢途径的速度限制酶,含171个氨基酸残基,其同源二聚体为SSAT的活性形式,表面含有两个酶活性位点。SSAT为胞质酶,半衰期非常短(20-40min),能被泛素化和蛋白酶体快速降解。研究表明,多胺水平的高低与癌症、炎症、中风、肾衰和糖尿病等多种疾病密切相关,其含量的增加能促进肿瘤的发生、发展。SSAT在维持体内多胺代谢平衡中起重要作用。SSAT催化亚精胺/精胺的乙酰化反应,分别将它们转化为N1-乙酰亚精胺和N1-乙酰精胺,还可继续将N1-乙酰精胺乙酰化,生成N1,N12-二乙酰精胺。反应所需的乙酰基由乙酰CoA提供。亚精胺和精胺被转化为乙酰多胺,从而有效降低了细胞内的多胺水平。在正常情况下,细胞内SSAT含量极低,但在高多胺水平、多胺类似物处理和多种病理性刺激下,SSAT表达水平迅速增加,因为多胺或多胺类似物与SSAT结合后,SSAT的半衰期大大延长。SSAT含量的高低还与胰腺炎、再生组织生长障碍、肥胖、糖尿病等相关。有研究指出,SSAT持续性高表达能促进肿瘤发生,而急性诱导性SSAT高表达则能抑制肿瘤生长和诱导肿瘤细胞凋亡。有报道患有伴X染色体病——棘状秃发性毛囊炎的病人的SSAT基因片段重复,因此推断可能与SSAT过表达有关;此外,还有研究显示自杀倾向的精神病人的SSAT表达有所减少。SSAT含量的高低与人类健康密切相关。因此,SSAT定量检测具有十分重要的意义。如果通过测定乙酰多胺产物的量间接测定SSAT含量,测定结果往往偏高,因为无法将SSAT乙酰化产物与其他蛋白的乙酰化产物区分;也可以测定SSAT专一催化的亚精胺N1位乙酰化产物的量,但需要结合使用SSAT抗血清,测定过程比较繁杂;有报道用14C标记乙酰辅酶A,进而测定含有14C的乙酰多胺产物来测定细胞粗提物中SSAT的含量,但此方法不适用于检测大量样本,且成本较高。目前用于直接测定SSAT含量的方法报道较少,本研究开发的利用全自动生化分析仪检测SSAT含量的纳米金检测试剂盒,是一种廉价、方便的检测技术,能够一次对大量样本进行检测,并且其检测的含量范围广。技术实现要素:本发明目的在于提供一种检测SSAT含量的体外检测试剂盒及其检测方法。为实现上述目的本发明采用的技术方案为:一种检测SSAT含量的体外检测试剂盒,包括R1、R2试剂、SSAT标准品和SSAT质控品;R1、R2试剂为纳米金标记物R1、R2试剂,其中,R1试剂与R2试剂为1:3至3:1。所述纳米金标记物R1、R2试剂是针对重组人SSAT抗原所制备的鼠抗人单克隆抗体经纳米金标记所得。所述R1试剂为单偶联5F4的纳米金的保存液,R2试剂为单偶联2D6的纳米金的保存液;其中,R1试剂中5F4的添加量为5-40μg/mL,R2试剂中2D6的添加量为5-40μg/mL。其中,纳米金标记物R1、R2试剂是针对重组人SSAT抗原所制备的鼠抗人单克隆抗体经纳米金标记所得,鼠抗人单克隆抗体包含2D6和5F4。所述鼠抗人单克隆抗体2D6和5F4均与SSAT抗原特异性结合。R1和R2试剂的具体制备方法为:取1mL纳米金加0-10.5μL的0.2MK2CO3,混匀后再加入10-25μg的5F4或2D6抗体,迅速混匀静置10-20min,加入10-20μLBSA,再次混匀静置10-20min,7000-9000r/min离心5-10min,弃上清,沉淀用1-2mL复溶液复溶即得R1、R2试剂。所述R1、R2试剂中保存液按重量百分比计,均为Tris0-0.6%、BSA0.2-3%、PEG-200000.1-0.5%、海藻糖0.5-8%、PVP-400-1.5%、Tween-800-0.5%、叠氮钠0.02-0.1%,PEG60001-5%,NaCl0.6-1.6%,余量组分为水。所述SSAT标准品为重组人SSAT抗原经纯化所得的精胺/精眯N1-乙酰基转移酶(SSAT)的重组酶;SSAT质控品为重组人SSAT抗原经纯化所得的精胺/精眯N1-乙酰基转移酶(SSAT)的重组酶或含有该酶的样本。所述重组人SSAT抗原经纯化所得的精胺/精眯N1-乙酰基转移酶(SSAT)的重组酶为将产精胺/精眯N1-乙酰基转移酶(SSAT)的重组大肠杆菌BL21(DE3)接种于种子培养基中,于30~37℃振荡培养8~12h,而后将种子培养液按体积比3~10%的接种量接种至表达培养基,于30~37℃振荡培养4~6h小时,摇床转速150~200r/min;而后向表达培养基中添加诱导剂,于20~30℃振荡诱导培养14~22h,摇床转速150~200r/min,所得培养液离心后收集上清液,即为胞外粗提重组酶SSAT;沉淀离心收集菌体细胞沉淀并超声破碎,将所得超声破碎液离心,取上清,即为胞内粗提重组酶SSAT;将获得胞外和胞内粗提重组酶经纯化,即可。所述产精胺/精眯N1-乙酰基转移酶(SSAT)的重组大肠杆菌BL21(DE3)为将经密码子优化的精胺/精眯N1-乙酰基转移酶(SSAT)基因(SEQIDNo.1)两端进行修饰,而后与pET-39b(+)载体连接,连接后转化到大肠杆菌感受态细胞,得到重组大肠杆菌,待用。所述表达培养基成分按克/升计为:蛋白胨9~11g,酵母粉5~24g,MgCl20~0.83g,KCl0~0.186g,ZnCl20~0.186g,50%的甘油0~20%,50%的蔗糖0~20%,50%的葡萄糖0~20%,精氨酸0~10mM,半胱氨酸0~10mM,其余成分为0.25mol/LTris-HCl。所述表达培养基中添加的诱导剂为每升所述表达培养基0~5g,其中诱导剂为IPTG或乳糖。种子培养基成分按克/升计为:蛋白胨9~11g,酵母粉4~6g,NaCl9~11g,其余成分为水。一种利用检测SSAT含量的体外检测试剂盒检测的方法,利用抗原抗体反应产生凝集,再通过纳米金和乳胶颗粒经微粒放大信号的原理检测样本中SSAT的含量。原理:本试剂盒采用双抗体夹心免疫比浊法原理,SSAT抗原与标记在纳米金上的抗SSAT单克隆抗体特异性结合,使纳米金聚集形成免疫复合物,通过生化分析仪可测定溶液浊度,浊度与复合物的含量成正比,可通过测定标准品,建立一条反应度对应浓度的标准曲线,即可测定SSAT含量。其中R1和R2分别标记可同SSAT特异性结合的抗体,试剂盒中的SSAT标准品用于检测过程中的标准曲线的建立,SSAT质控品用于的标准曲线及试剂盒进行质量控制。本发明所具有的优点:本发明所采用的体外检测试剂盒的内容物中包括针对SSAT的特异性单克隆抗体和纳米金标记测定所需试剂,与新型纳米金免疫检测方法相结合,用于检测人体SSAT含量的体外检测,具有操作简便、检测速度快、精密度高、重复性好、检测结果不受操作影响等优势。附图说明图1是SSAT生化检测产品标准曲线。图2为SSAT酶SDS-PAGE图;其中,M为蛋白标准;1号泳道为SSAT酶表达沉淀、2号泳道为SSAT酶表达上清。图3为诱导剂浓度图;其中,M为蛋白标准;1号泳道为加入0.1g/L乳糖诱导的SSAT酶表达沉淀、2号泳道为0.1g/L乳糖诱导的SSAT酶表达上清、3号泳道为加入0.7mMIPTG诱导的SSAT酶表达沉淀、4号泳道为0.7mMIPTG诱导的SSAT酶表达上清、5号泳道为未加入诱导剂的SSAT酶表达沉淀、6号泳道为未加入诱导剂的SSAT酶表达上清。具体实施方式下列实施例应被理解被仅仅是举例说明性的,而不是以任何方式限制本发明。实施例1试剂盒包括R1试剂,R2试剂,标准品和质控品;其中R1试剂与R2试剂体积比为=150:150;其中,R1试剂为2mL纳米金、20μg5F4抗体和2mLR1保护液;R2试剂为2mL纳米金、20μg2D6抗体和2mLR1保护液;R1、R2保护液按重量百分比计为:0.5%Tris、0.5%BSA、0.5%PEG-20000、5%海藻糖、1%PVP-40、0.01%Tween-80、4%PEG6000、1%NaCl、0.05%的叠氮钠,余量组分为水。所述R1试剂的配制,取2mL纳米金加7μL的0.2MK2CO3;混合后加入20μg5F4抗体,混匀静置10min;再加10μL封闭液(20%BSA)进行封闭,再次混匀静置10min;离心5min,转速为8000r/min,弃上清,沉淀用2mLR1保护液复溶。所述R2试剂的配制,取2mL纳米金加7μL的0.2MK2CO3;混合后加入20μg2D6抗体,混匀静置10min;再加10μL封闭液(20%BSA)进行封闭,再次混匀静置10min;离心5min,转速为8000r/min,弃上清,沉淀用2mLR1保护液复溶。精胺/精眯N1-乙酰基转移酶(SSAT)基因密码子的优化,根据大肠杆菌密码子的偏好性表和经验,对精胺/精眯N1-乙酰基转移酶(SSAT)基因密码子的优化。优化结果如序列所示。精胺/精眯N1-乙酰基转移酶(SSAT)基因的克隆,优化的精胺/精眯N1-乙酰基转移酶(SSAT)由生物技术有限公司合成。在该基因的两端设计酶切位点,分别为BamHI和XhoI,将该基因连接在pET-39b(+)载体上。将构建成功的重组表达载体pET39b-p.MD-SSAT转化到大肠杆菌感受态BL21(DE3)中,在培养平板上筛选阳性克隆。将上述鉴定正确的重组阳性克隆接种于种子培养基中,37℃振荡培养12h小时。将上述培养所得活化种子液按体积百分比6%的接种量接种至3瓶表达培养基,于30℃振荡培养,摇床转速180r/min;培养至1号瓶OD600=0.639、2号瓶OD600=0.667和3号瓶OD600=0.633,再向2号瓶中添加0.7mM的诱导剂IPTG,3号瓶中添加0.1g/L的诱导剂乳糖,1号瓶中不添加任何诱导剂,于20℃振荡诱导培养18h,摇床转速160r/min表达完毕;8000r/min离心5min收集菌体,称重后加入湿菌种(g)×20倍的PBS缓冲液,进行超声破碎;12000r/min、4℃离心10min,收集上清。将上述超声破碎后离心收集的发酵菌体,使用PBS缓冲液(pH7.4)重悬菌体,重悬后对菌体进行冰浴,同时进行超声破碎。收集破碎产物12000rpm,4℃离心20min,收集离心上清,0.45μm过滤。使用PBS缓冲液平衡Ni-NTA色谱柱,将过滤后含有SSAT重组蛋白的样本上样,上样完成后使用PBS+25mM咪唑缓冲液(pH7.4)漂洗色谱柱,使用PBS+250mM咪唑缓冲液(pH7.4)洗脱目的蛋白,观察紫外吸收变化情况,收集蛋白。使用PBS(pH7.4)缓冲液平衡SephadexG25色谱柱,将目的蛋白上样,上样完成后使用PBS缓冲液冲洗色谱柱,观察紫外吸收变化情况,收集SSAT蛋白纯品,并使用蛋白浓度检测试剂盒对SSAT浓度进行确认。上述,种子培养基成分按克/升计为:蛋白胨10g,酵母粉5g,NaCl10g,其余成分为水。表达培养基成分按克/升计为:蛋白胨20g,酵母粉5g,NaCl0.5g,MgCl20.39g,KCl0.186g,50%的甘油2%,半胱氨酸80mM,其余成分为0.25mol/LTris-HCl。5F4、2D6的获得:1选择纯种BalB/C小鼠,SSAT抗原加佐剂:初次免疫,抗原1~50μg加福氏完全佐剂皮下多点注射或脾内注射(0.4ml,0.1ml/点);3周后第二次,免疫剂量同上,佐剂使用弗氏不完全佐剂;3周后第三次免疫,剂量及试剂同第二次免疫,(7天后采血测其效价);3周后加强免疫,剂量50~100μg为宜,静脉内注射;3天后无菌取脾脏,使用RPMI1640无血清培养液洗一次,脾脏研碎,过细胞筛,离心,脾细胞用RPMI1640无血清培养液洗2次,计数,取1×108脾淋巴细胞悬液备用。(细胞融合前一天制备饲养细胞,使用BalB/C鼠,向其腹腔注入10mlRPMI1640无血清培养液,按揉3分钟,吸出培养液洗一次,计数,按每孔2万个饲养细胞量铺96孔细胞培养板,备用)2制备骨髓瘤细胞取对数生长骨髓瘤细胞离心,用RPMI1640无血清培养液洗2次,计数,取得1×107细胞备用。3融合①骨髓瘤细胞与脾细胞按细胞个数比1:5的比例混合在一起,在50ml离心管中用RPMI1640无血清培养液洗1次,离心,1200rpm,8min;弃上清,用吸管吸净残留液体,以免影响聚乙二醇(PEG)浓度。轻轻弹击离心管底,使细胞沉淀略松动。②90s内加入37℃预温的1ml45%PEG(分子量4000)溶液,边加边轻微摇动。37℃水浴作用90s。③加37℃预热的RPMI1640无血清培养液,每隔2min分别加入1ml、2ml、3ml、4ml、5ml和6ml。④离心,800rpm,6min。⑤弃上清,用含20%小牛血清HAT选择培养液重悬。⑥将上述细胞,加到已有饲养细胞的96孔板内,每孔加100μl。一般一个免疫脾脏可接种4块96孔板。⑦将培养板置于37℃、5%CO2培养箱中培养。4脾细胞和骨髓瘤细胞经PEG处理后,在用HAT选择培养液培养1~2天内,将有大量骨髓瘤细胞死亡,3~4天后瘤细胞消失,杂交瘤细胞形成小集落,HAT选择培养液维持7~10天后应换用HT培养液,再维持2周,改用一般培养液。在上述选择培养期间,杂交瘤细胞布满孔底1/10面积时,即可开始检测特异性抗体,筛选出所需要的杂交瘤细胞系。5使用ELISA方法对抗体活性进行鉴定。6亚克隆(1)克隆前1天制备饲养细胞层(同细胞融合)。(2)将要克隆的杂交瘤细胞从培养孔内轻轻吹吸成细胞悬液,计数。(3)调整细胞浓度为10~40个细胞/ml。(4)取前一天准备好饲养细胞的培养板,每孔加入稀释细胞100μl。孵育于37℃、5%CO2培养箱中。(5)在第7天换液,以后每2~3天换液1次。(6)8~9天可见细胞克隆形成,及时检测抗体活性。(7)将阳性孔的细胞移至24孔板中扩大培养。(8)再将细胞扩至175培养瓶中,备制备腹水用。(9)向BalB/C鼠腹腔注射0.5ml液体石蜡,1周后腹腔注射1×106个杂交瘤细胞,接种细胞7~10天后可产生腹水。(10)腹水经纯化后可得单克隆SSAT抗体纯品。通过免疫层析方法筛选不同克隆的抗体,经筛选配对使用5F4、2D6作为本试剂盒使用配对抗体。将纯化后的不同克隆的抗体分别标记在纳米金和包被NC膜上,所有抗体标记工艺均为1mL纳米金中加入7μL0.2MK2CO3后加入20μg抗体,标记后离心加入100μL复溶液悬浮,复溶液成分为40mMtris、1g/LPEG20000、1g/LPVP40、40g/L海藻糖,悬浮后喷在玻璃纤维上,45℃烘干30min,所有包被工艺均使用10mMPBSPH=7.2将抗体稀释至1mg/mL后包被在NC膜上,37℃烘干15min,将结合了不同抗体的纳米金-玻璃纤维和NC膜配对做成试纸条后加入浓度为10μg/mLSSAT样本和0.5%Casein-na,挑选0.5%Casein-na不显色,同时10μg/mLSSAT样本显色最深的配对抗体。按照该方法进行筛选得出5F4、2D6最佳配对。所述SSAT标准品是使用含20%BSA、120mM壳聚糖溶液梯度稀释SSAT重组蛋白纯品浓度为0、5、10、15、20μg/mL5个浓度。所述质控品是使用小牛血清稀释SSAT重组蛋白至10μg/mL、15μg/mL两个浓度。纳米金为按照现有柠檬酸三钠还原氯金酸法制备获得。SEQIDNo.1(a)序列特征:*长度:513bp*类型:核苷酸*链型:单链*拓扑结构:直链(b)分子类型:cDNA(c)假设:否(d)反义:否(e)最初来源:人工设计实施例2采用上述实施例的体外检测试剂盒进行体外检测:(1)采取人体静脉血4mL于EDTA或肝素钠抗凝管中,再加入4mL淋巴细胞分离液混合,4℃2500rpm离心10min,分离淋巴细胞,分离后用生理盐水洗涤3次,每次4℃、1500rpm离心10min,最后一次离心后的细胞用生理盐水重悬,细胞破碎仪破碎处理后4℃2500rpm离心10min,吸取上清备用。(2)取出R1试剂、R2试剂放置室温下至温度平衡;(3)将R1、R2试剂和SSAT标准品放在生化分析仪相应的位置,制定标准曲线(表1和参见图1);表1浓度(μg/mL)05101520反应度(第一次)0.00450.01190.02380.04110.0758反应度(第二次)0.00260.01100.02460.04260.0751平均值0.00360.01150.02420.04190.0755(4)通过全自动生化分析仪检测SSAT质控品,设置加入R1试剂150μL,R2试剂150μL,加入样本5μL,第22点作为第一点检测,第45点为第二点检测,以两点差值为检测值,通过标准曲线回归,确定检测结果有效性(参见表2);表2(5)用全自动生化分析仪检测SSAT样本,设置加入R1试剂150μL,R2试剂150μL,加入样本5μL,第22点作为第一点检测,第45点为第二点检测,以两点差值为检测值,通过标准曲线回归得出最终结果;(6)检测SSAT样本检测结果如下表3所示表3从表3可以看出,本方法检测样本的SSAT含量于理论值的相差不大,相对偏差不超过±10%。其它未举例的试剂盒成分的制备方法,在上述制备方法的指引下能很容易地实现,此处不再冗述。应当理解的是,本领域的普通技术人员在本发明的启示下,在不脱离本发明的权利要求所保护的范围情况下,还可以做出替换、简单组合等多种变行,本发明的权利保护范围应以所述权利要求为准。当前第1页1 2 3