细胞分析装置及细胞分析方法与流程
本发明涉及一种细胞分析装置及细胞分析方法。更详细而言,本发明涉及一种分析脑脊髓液、体腔液等体液中的细胞的细胞分析装置及细胞分析方法。
背景技术:
为诊断疾病而分析患者的体液是人们一直以来的做法。比如,特开(日本专利公开)2008-209386号公报中公开了一种获取血液中白细胞信息的血细胞分析装置和体液分析方法。在专利文献1所记述的方法中,将体液中的白细胞与白细胞以外的粒子——即巨噬细胞、间皮细胞和肿瘤细胞等异性粒子分离并进行解析。在以侧向荧光强度为纵轴以侧向散射光强度为横轴的散点图中,除去有上述异性粒子存在的荧光强度较大的区域、以及分布有因溶血而产生的红细胞血影的荧光强度较小的区域后的区域被设定为白细胞出现的区域。
特开2008-209386号公报中记述了作为异性粒子的肿瘤细胞存在于体液中一事,但未能判断出现在体液中的异性粒子是巨噬细胞、间皮细胞或肿瘤细胞中的哪一种。因此无法检测出体液中包含肿瘤细胞。
本发明正是针对此类情况,其目的在于提供一种能够检测出体液中肿瘤细胞的细胞分析装置和细胞分析方法。
技术实现要素:
本发明的范围只由后附权利要求所规定,在任何程度上都不受这一节发明内容的陈述所限。
本发明第一方案涉及的细胞分析装置包括:供包含体液的测定试样流动的流动室;光照在流动室流动的测定试样的光照部件;检测出从光照下的测定试样中的细胞产生的前向散射光的光检测部件;根据光检测部件中检测出的前向散射光信号检测出体液中的细胞的解析部件;以及输出部件。解析部件根据前向散射光信号强度和前向散射光信号宽度向输出部件输出体液中肿瘤细胞的相关信息。
优选地,所述解析部件对属于前向散射光信号强度和前向散射光信号宽度比白细胞分布区域大的凝集细胞检测区域的细胞数进行计数,所述解析部件根据计数的属于所述凝集细胞检测区域的细胞数的信息向所述输出部件输出体液中肿瘤细胞的相关信息。
优选地,所述流动室使体液中有核细胞的核酸已荧光染色的测定试样流动,所述光检测部件检测出光照下的所述测定试样中的细胞产生的荧光,所述解析部件根据荧光信号强度和前向散射光信号强度向所述输出部件输出体液中肿瘤细胞的相关信息。
优选地,所述解析部件对属于荧光信号强度位于白细胞分布区域和间皮细胞分布区域之间的区域的非凝集细胞检测区域的细胞数进行计数,所述解析部件根据计数的属于所述非凝集细胞检测区域的细胞数向所述输出部件输出体液中肿瘤细胞的相关信息。
优选地,试样制备部件,用于制备已使所述体液中的红细胞溶血的测定试样。
优选地,所述试样制备部件制备已将所述体液中的有核细胞的核酸荧光染色的测定试样。
本发明第二方案涉及的细胞分析装置包括:供已将体液中有核细胞的核酸荧光染色的测定试样流动的流动室;光照在流动室流动的测定试样的光照部件;检测出从光照下的测定试样中的细胞产生的荧光的光检测部件;根据光检测部件中检测出的荧光信号强度检测出体液中的细胞的解析部件;以及输出部件。解析部件根据荧光信号强度和前向散射光信号强度向输出部件输出体液中肿瘤细胞的相关信息。
优选地,所述解析部件对属于荧光信号强度位于白细胞分布区域和间皮细胞分布区域之间的区域的非凝集细胞检测区域的细胞数进行计数,所述解析部件根据计数的属于所述非凝集细胞检测区域的细胞数的信息向所述输出部件输出体液中肿瘤细胞的相关信息。
本发明第三方案涉及的细胞分析方法包括如下步骤:光照包含体液的测定试样,检测出从光照下的测定试样中的细胞产生的前向散射光,根据前向散射光信号强度和前向散射光信号宽度输出体液中肿瘤细胞的相关信息。
优选地,对属于前向散射光信号强度和前向散射光信号宽度比白细胞的分布区域大的凝集细胞检测区域的细胞数进行计数;根据计数的属于所述凝集细胞检测区域的细胞数信息输出与体液中肿瘤细胞相关的信息。
优选地,使体液中的红细胞溶血并制备测定试样。
优选地,检测出从所述测定试样中的细胞产生的荧光;根据荧光信号强度和前向散射光信号强度向所述输出部件输出体液中肿瘤细胞的相关信息。
优选地,对属于荧光信号强度位于白细胞分布区域和间皮细胞分布区域之间的区域的非凝集细胞检测区域的细胞数进行计数;根据计数的属于所述非凝集细胞检测区域的细胞数的信息输出体液中肿瘤细胞的相关信息。
优选地,对体液中的有核细胞的核酸进行荧光染色并制备测定试样。
本发明第四方案涉及的细胞分析方法包括如下步骤:制备已将体液中有核细胞的核酸荧光染色的测定试样,光照测定试样,检测出从测定试样中的细胞发出的荧光,根据荧光信号强度和前向散射光强度输出体液中肿瘤细胞的相关信息。
优选地,对属于荧光信号强度位于白细胞分布区域和间皮细胞分布区域之间的区域的非凝集细胞检测区域的细胞数进行计数;根据计数的属于所述非凝集细胞检测区域的细胞数的信息输出与体液中肿瘤细胞相关的信息。
本发明第五方案涉及的细胞分析方法包括如下步骤:光照包含体液的测定试样,检测出从光照下的测定试样中的细胞获得的光,根据通过检测出的光信息生成的细胞的分布信息,至少从白细胞、巨噬细胞和间皮细胞中分离出肿瘤细胞并进行计数,输出体液中肿瘤细胞的相关信息。
通过本发明的细胞分析装置和细胞分析方法能够检测出体液中的肿瘤细胞。
附图说明
图1为本发明的细胞分析装置一实施方式的外观斜视图;
图2为图1所示细胞分析装置中测定单元的结构示意图;
图3为图1所示细胞分析装置中光学检测器的结构示意图;
图4为图1所示细胞分析装置中信息处理单元的结构说明图;
图5为阴性样本的散点图一例;
图6为在凝集细胞检测区域检测出凝集肿瘤细胞的散点图一例;
图7为在非凝集细胞检测区域检测出非凝集肿瘤细胞的散点图一例;
图8为第一实施方式涉及的细胞分析方法中测定单元和信息处理单元进行处理的流程图;
图9为第一实施方式涉及的细胞分析方法所使用的散点图的示意图;
图10为第二实施方式涉及的细胞分析方法中测定单元和信息处理单元进行处理的流程图;
图11为第二实施方式涉及的细胞分析方法所使用的散点图的示意图;
图12为第三实施方式涉及的细胞分析方法中测定单元和信息处理单元进行处理的流程图。
优选实施方式
下面参照附图就本发明的细胞分析装置和细胞分析方法的实施方式进行详细说明。本发明不限于这些例示,本发明由权利要求所示并包括与权利要求具有同等的含意和范围的内容下的所有的变更。
(细胞分析装置)
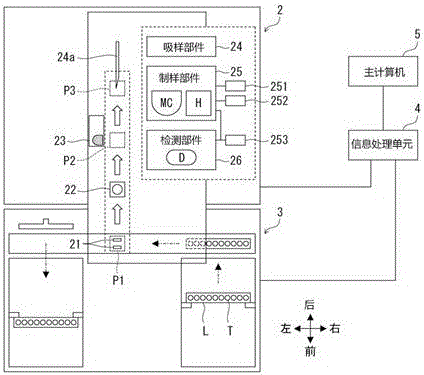
本实施方式涉及的细胞分析装置1是一种检测出体液样本中所包含的白细胞、巨噬细胞、间皮细胞、肿瘤细胞等有核细胞并对各细胞计数的细胞分析装置。本发明中的“体液”指除血液以外的脑脊髓液、腹水、胸水、滑液、腹膜透析引流液等。细胞分析装置1如图1所示,其具有测定单元2、配置在测定单元2前面的运送单元3、以及信息处理单元4。采自患者的体液样本装入样本容器T中。复数个样本容器T支撑在样架L上。样架L由运送单元3运送,由此使体液样本供应到测定单元2。
信息处理单元4具有输出部件41和输入部件42。信息处理单元4与测定单元2、运送单元3及主计算机5(参照图2)进行可通信连接。信息处理单元4控制测定单元2和运送单元3的作业,根据测定单元2检测的测定结果进行解析,将解析结果传送至主计算机5。
如图2所示,测定单元2具有手部件21、样本容器放置部件22、条形码单元23、样本吸移部件24、试样制备部件25和检测部件26。样本吸移部件24具有穿刺针24a并从样本容器T吸移样本。试样制备部件25具有混合舱室MC和加热器H,通过将试剂混入样本来制备测定中使用的测定试样。检测部件26具有光学检测器D,其从测定试样中检测出细胞。测定单元2的各部分由信息处理单元4控制。
被运送单元3置于位置P1的样本容器T由手部件21夹持并从样架L向上方抽出。摇动手部件21,以此搅拌样本容器T内的样本。搅拌结束后的样本容器T由手部件21放置到被置于位置P1的样本容器放置部件22。然后,样本容器T由样本容器放置部件22运送至位置P2。
样本容器T被置于位置P2后,通过设置在位置P2附近的条形码单元23从贴在样本容器T上的条形码标签读取样本号。然后,样本容器T由样本容器放置部件22运送至位置P3。样本容器T被置于位置P3后,由样本吸移部件24通过穿刺针24a从样本容器T吸移一定量样本。样本吸移结束后,样本容器T由样本容器放置部件22向前方运送,并由手部件21将其送回原来的样架L的支撑位置。在穿刺针24a被移送到混合舱室MC的位置后,由样本吸移部件24向混合舱室MC排出一定量的通过穿刺针24a吸移的样本。
试样制备部件25通过管分别与装第一试剂的试剂容器251、装第二试剂的试剂容器252、装鞘液(稀释液)的试剂容器253连接。试样制备部件25连接到压缩机(无图示),且能够通过上述压缩机生成的压力从试剂容器251~253取用各试剂。试样制备部件25在混合舱室MC内混合体液样本、第一试剂、第二试剂,并用加热器H加热此混合液一定时间,制备测定试样。试样制备部件25中制备的测定试样供应到检测部件26的光学检测器D。
检测部件26通过管连接装鞘液(稀释液)的试剂容器253。检测部件26还连接压缩机(无图示),且能够通过由所述压缩机产生的压力从试剂容器253取用鞘液(稀释液)。
如图3所示,光学检测器D具有流动室D1、鞘流系统D2、射束点形成系统D3、前向散射光受光系统D4、侧向散射光受光系统D5和荧光受光系统D6。
鞘流系统D2使测定试样在被鞘液包被的状态下送入流动室D1,在流动室D1内产生液流。射束点形成系统D3使光照部件——即半导体激光器D31照射的光通过准直镜D32和聚光镜D33并照射到流动室D1。以此,激光照射到从流动室D1内通过的液流中所包含的细胞。射束点形成系统D3还具有束霖止器D34。
前向散射光受光系统D4通过前向集光镜D41聚集向前方的散射光(前向散射光),并用光电二极管D43接收通过了针孔D42的光。光电二极管D43根据接收的前向散射光的峰值输出前向散射光信号(FSC)。侧向散射光受光系统D5以侧向集光镜D51聚集向侧向的散射光(侧向散射光),并用分色镜D52将一部分光反射,由光电二极管D53接收这一部分的光。光电二极管D53根据接收的侧向散射光的峰值输出侧向散射光信号(SSC)。
光散射是诸如细胞那样的粒子作为障碍物挡在光的前进方向上,使光因粒子而改变其前进方向所产生的现象。检测出此散射光就能获得粒子大小和材质的相关信息。特别是从前向散射光中能够获得粒子(细胞)大小的相关信息。此外,从侧向散射光中能够获得粒子内部的信息。当激光照射到细胞时,侧向散射光强度依赖于细胞内部的复杂程度(核的形状、大小、密度及颗粒的量)。
荧光受光系统D6进一步让侧向散射光中透过分色镜D52的光(荧光)通过分光滤光器D61,以雪崩光电二极管D62接收该光。雪崩光电二极管D62根据接收到的荧光峰值输出荧光信号(SFL)。
光照被荧光物质染色的细胞时,会发出波长比照射光波长长的荧光。而细胞染色越充分则荧光强度越强,测定此荧光强度就能获得细胞染色程度的相关信息。
在本实施方式中,光电二极管D43、光电二极管D53和雪崩光电二极管D62构成了光检测部件。
返回图2,通过光学检测器D获取的前向散射光信号、侧向散射光信号和荧光信号传送至信息处理单元4。信息处理单元4根据接收的这些信号进行解析。
如图4所示,信息处理单元4由个人电脑组成,由主机40、输出部件41和输入部件42构成。主机40具有CPU401、ROM402、RAM403、硬盘404、读取装置405、图像输出接口406、输入输出接口407和通信接口408。本实施方式中的输出部件41是能够显示图像等的显示器,但也可以采用以纸质方式输出信息的打印机等作为输出部件。
构成解析部件的CPU401执行存储在ROM402的计算机程序和下载到RAM403中的计算机程序。RAM403用于读取存储在ROM402和硬盘404的计算机程序。RAM403还作为执行上述计算机程序时的CPU401的工作空间使用。
硬盘404中存储有操作系统、供CPU401执行的计算机程序、以及执行计算机程序所用的数据。硬盘404中还存储有执行图8、图10和图12所示信息处理单元4的处理的程序404a。读取装置405由CD驱动器或DVD驱动器等构成,其能够读取存储于存储介质405a的计算机程序和数据。程序404a存储于存储介质405a时,由读取装置405从存储介质405a读取的程序404a存储到硬盘404。
图像输出接口406将与图像数据相应的影像信号输出到输出部件41,输出部件41根据图像输出接口406输出的影像信号显示图像。用户通过输入部件42输入指示。输入输出接口407接收通过输入部件42输入的信号。通信接口408连接测定单元2、运送单元3和主计算机5,CPU401通过通信接口408与这些装置之间传输指示信号和数据。
在试样制备部件25,混合体液样本和试剂,以使体液中可能包含的红细胞溶血,破坏白细胞等细胞的细胞膜直到荧光色素能透过的程度,染色细胞(有核细胞)的核酸,制备测定试样。具体而言,将以下第一试剂和第二试剂混入体液样本,制备测定试样。
第一试剂含有能够染色有核细胞的核酸的荧光色素,是一种对经后述第二试剂处理后的体液试样中的有核细胞的核酸进行荧光染色的试剂。通过用第一试剂对血液试样进行处理,有核酸的白细胞等细胞被染色。
荧光色素只要能染色核酸即可,在本发明没有特别限定,可以与光源(半导体激光器D31)照射的光的波长相应地进行适当选择。这种荧光色素比如有:碘化丙啶(propidium Iodide)、溴化乙锭(Ethidium bromide)、乙锭-吖啶异质二聚体(ethidium -acridine heterodimer)、乙锭二叠氮化物(Ethidium diazide)、乙锭同型二聚体-1(Ethidium homodimer-1)、乙锭同型二聚体-2(Ethidium homodimer-2)、乙锭单叠氮化物(Ethidium monoazide)、三亚甲基双[[3‐[[4‐[[(3‐甲基苯并噻唑‐3‐鎓)‐2‐基]亚甲基]‐1,4‐二氢喹啉]‐1‐基]丙基]二甲基铵]・四碘化物(TOTO-1)(英文为:trimethylene bis[[3‐[[4‐[[(3‐methylbenzothiazole‐3‐ium)‐2‐yl]methylene]‐1,4‐Dihydroquinoline]‐1‐yl]propyl]dimethylaminium]・tetraiodide)、4‐[(3‐甲基苯并噻唑‐2(3H)‐亚基)甲基]‐1‐[3‐(三甲基氨基)丙基]喹啉鎓・二碘化物(TO-PRO-1)(英文为:4‐[(3‐Methylbenzothiazole‐2(3H)‐ylidene)methyl]‐1‐[3‐(Trimethylaminio)propyl]Quinolinium・diiodide)、N,N,N',N'‐四甲基‐N,N'‐双[3‐[4‐[3‐[(3‐甲基苯并噻唑‐3‐鎓)‐2‐基]‐2‐亚丙烯基]‐1,4‐二氢喹啉‐1‐基]丙基]‐1,3‐丙烷二铵・四碘化物(TOTO-3)(英文为:N,N,N',N'‐tetramethyl‐N,N'‐bis[3‐[4‐[3‐[(3‐Methylbenzothiazole‐3‐ium)‐2‐yl]‐2‐propenylidene]‐1,4‐Dihydroquinoline‐1‐yl]propyl]‐1,3‐propanediaminium・tetraiodide)、或2‐[3‐[[1‐[3‐(三甲基氨基)丙基]‐1,4‐二氢喹啉]‐4‐亚基]‐1‐丙烯基]‐3‐甲基苯并噻唑‐3‐鎓・二碘化物(TO-PRO-3)(英文为:2‐[3‐[[1‐[3‐(Trimethylaminio)propyl]‐1,4‐Dihydroquinoline]‐4‐ylidene]‐1‐propenyl]‐3‐Methylbenzothiazole‐3‐ium・diiodide)以及以下通式(I)所示荧光色素。其中尤以以下通式(I)所示荧光色素为宜。
【化1】
式(I)中,R1及R4彼此相同或不同,为氢(hydrogen)原子、烷(alkyl)基、有羟(hydroxy)基的烷基(alkyl)链、有醚基(ether group)的烷基(alkyl)链、有酯(ester)基的烷基链(alkyl chain)、或可以有取代基的苯甲基(benzyl group)。R2及R3彼此相同或不同,为氢(hydrogen)原子、羟基(hydroxyl group)、卤素(halogen)、烷(alkyl)基、链烯基(alkenyl group)、炔(alkynyl)基、烷氧(alkoxy)基、烷磺酰基(alkylsulfonyl group)或苯基(phenyl group)。Z为硫(sulfur )原子、氧原子或有甲基(methyl group)的碳原子(carbon atom),n为0、1、2或3;X-为阴离子。
在本实施方式中,烷基(alkyl group)是直链(linear-chain)或支链(branched-chain)都可。式(I)中,当R1和R4其中之一为碳数6~18的烷基(alkyl group)时,另一者最好为氢原子(hydrogen atom)或碳数不足6的烷基(alkyl group)。碳数6~18的烷基(alkyl group)中以碳数为6、8或10的烷基(alkyl group)为宜。
式(I)中,R1及R4的苯甲基(benzyl group)的取代基例如可列举出:碳数1~20的烷基(alkyl group)、碳数2~20的链烯基(alkenyl group)或碳数2~20的炔基(alkynyl group)。其中最好是甲基(methyl group)或乙基(ethyl group)。
式(I)中,R2和R3的链烯基(alkenyl group)例如可列举出碳数2~20的链烯基(alkenyl group)。R2和R3的烷氧基(alkoxy group)可列举出碳数1~20的烷氧基(alkoxy group)。其中尤以甲氧基(methoxy group)或乙氧基(ethoxy group)为宜。
式(I)中,阴离子X-如有F-、CI-、Br-、I-一类的卤素离子、CF3SO3-、BF4-等。
第一试剂中的荧光色素可以是一种,也可以是二种以上。
第一试剂中的荧光色素浓度可以与荧光色素种类相应地进行适当设定,通常选择0.01~100pg/μL,尤以0.1~10pg/μL为宜。比如,当使用式(I)所示的荧光色素作为第一试剂的荧光色素时,第一试剂中的该荧光色素浓度以0.2~0.6pg/μL为宜,0.3~0.5pg/μL更佳。
第一试剂可以如下获取:将所述荧光色素用适当溶剂溶解,直至其达到上述浓度。溶剂只要能溶解上述荧光色素即可,无特别限定,比如有水、有机溶剂及其混合物。有机溶剂如有乙醇(alcohol)、乙二醇(ethylene glycol)、二甲基亚砜(DMSO)(Dimethyl Sulfoxide)等。荧光色素在水溶液中的保存稳定性有时较差,故最好使其溶解在有机溶剂中。
第一试剂也可以使用市面出售的白细胞分类用染色试剂。此种染色试剂例如有希森美康株式会社生产的FLUOROCELL(注册商标)WDF。FLUOROCELLWDF是包含式(I)所示荧光色素的染色试剂。
第二试剂含有使红细胞溶血并给细胞的细胞膜造成足以让上述第一试剂中的荧光色素透过的破坏的表面活性剂——即阳离子型表面活性剂和/或非离子型表面活性剂。第二试剂以20mM以上50mM以下的浓度含有芳香族的有机酸。在此,第二试剂的特征是:当芳香族有机酸的浓度为20mM以上且小于30mM时,第二试剂的pH为5.5以上6.4以下,当芳香族有机酸的浓度为30mM以上50mM以下时,第二试剂的pH为5.5以上7.0以下。
在本实施方式中,第二试剂中的芳香族有机酸浓度为20mM以上且不到30mM时,第二试剂的pH以5.5以上6.4以下为宜,5.5以上6.2以下更为理想。当第二试剂中的芳香族有机酸浓度为30mM以上50mM以下——最好为40mM以上50mM以下时,第二试剂的pH为5.5以上7.0以下。最为理想的是,当第二试剂中的芳香族有机酸浓度为40mM以上50mM以下时,第二试剂的pH为5.5以上6.2以下。
在本实施方式中,所谓芳香族有机酸指分子中至少有一个芳香环的酸及其盐。芳香族有机酸例如有芳香族羧酸(carboxylic acid)、芳香族磺酸(Sulfonic acid)等。在本实施方式中宜使用邻苯二甲酸(Phthalic acid)、安息香酸(benzoic acid)、水杨酸(salicylic acid)、马尿酸(hippuric acid)、对氨基苯磺酸(p- Aminobenzenesulfonic Acid)、苯磺酸(benzenesulfonic acid)及上述物质的盐。第二试剂中的芳香族有机酸可以是一种,也可以是二种以上。当第二试剂中包含二种以上芳香族有机酸时,其浓度合计在20mM以上50mM以下即可。
阳离子型表面活性剂可以使用季铵盐(quaternary ammonium salt)类表面活性剂或吡啶盐(Pyridinium Salt)类表面活性剂。
季铵盐(quaternary ammonium salt)类表面活性剂例如有以下式(II)所示的总碳数为9~30的表面活性剂。
【化2】
(II)中,R1是碳数为6~18的烷基(alkyl group)或链烯基(alkenyl group),R2及R3彼此相同或不同,是碳数为1~4的烷基(alkyl group)或链烯基(alkenyl group)。R4是碳数为1~4的烷基(alkyl group)或链烯基(alkenyl group)、或者苯甲基(benzyl group),X-是卤素(halogen)原子。
式(II)中,R1较为理想的是碳数为6、8、10、12和14的烷基(alkyl group)或链烯基(alkenyl group),尤以直链烷基(alkyl group)为宜。更具体而言,R1可以列举出辛基(octyl)、癸基(decyl)和十二烷基(dodecyl)。R2和R3以甲基(methyl group)、乙基(ethyl group)和丙基(propyl)较为理想。R4较为理想的是甲基(methyl group)、乙基(ethyl group)和丙基(propyl group)。
吡啶盐(Pyridinium Salt)类表面活性剂例如有以下式(III)中表示的表面活性剂。
【化3】
式(III)中,R1是碳数为6~18的烷基(alkyl group)或链烯基(alkenyl group),X-是卤素(halogen)原子。
式(III)中,R1较为理想的是碳数为6、8、10、12和14的烷基(alkyl group)或链烯基(alkenyl group),尤以直链烷基(alkyl group)为宜。更具体而言,R1可以列举出辛基(octyl)、癸基(decyl)和十二烷基(dodecyl)。
第二试剂中的阳离子型表面活性剂浓度可以根据表面活性剂的种类适当调节,通常为10~10000ppm,尤以100~1000ppm为宜。
非离子型表面活性剂最好是以下式(VI)所示聚氧乙烯(polyoxyethylene)类非离子表面活性剂。
R1-R2-(CH2CH2O)n-H (VI)
式(VI)中,R1为碳数8~25的烷基(alkyl group)、链烯基(alkenyl group)或炔基(alkynyl group),R2为氧原子、-COO-或
【化4】
,
其中n为10~50的整数。
上述非离子型表面活性剂具体可列举出:聚氧乙烯烷基醚(polyoxyethylene alkyl ether)、聚氧乙烯甾醇(polyoxyethylene sterol)、聚氧乙烯蓖麻油(polyoxyethylene castor oil)、聚氧乙烯山梨糖醇脂肪酸酯(polyoxyethylene sorbitol fatty acid ester )、聚氧乙烯烷基胺(polyoxyethylene alkylamine)、聚氧乙烯聚氧丙烯烷基醚( polyoxyethylene polyoxypropylene alkyl ether)等。
第二试剂中的非离子型表面活性剂的浓度通常为10~100000ppm,最好为100~10000ppm,1000~5000ppm更佳。
第二试剂也可以包含缓冲剂以保持一定的pH值。此种缓冲剂例如有柠檬酸盐(citrate)、HEPES和磷酸盐等。有时上述芳香族有机酸会显示出缓冲作用。使用此类芳香族有机酸时,向第二试剂中添加缓冲剂可以随意。
第二试剂的渗透压在本发明中无特别限定,但从高效地使红细胞溶血的角度出发,最好为20~150mOsm/kg。
第二试剂可以如下获取:在适当的溶剂中溶解上述表面活性剂和芳香族有机酸或其盐,根据需要也溶解上述缓冲剂,调整到上述芳香族有机酸浓度,再用NaOH和HCI等调整pH获得。溶剂只要能够溶解上述成分即可,本发明中无特别限定,比如有水、有机溶剂及其混合物。有机溶剂如有乙醇(alcohol)、甲醇(Methanol)、乙二醇(ethylene glycol)、DMSO等。
第二试剂还可以使用市场销售的白细胞分类用溶血试剂。这种溶血试剂例如有希森美康株式会社生产的LYSERCELL(注册商标)WDF。LYSERCELLWDF是包含上述阳离子型表面活性剂和非离子型表面活性剂的溶血试剂。
通过如上构成的第二试剂使红细胞溶血,给细胞的细胞膜造成第一试剂中的荧光色素能够通过的程度的破坏。再通过如上构成的第一试剂染色第二试剂破坏了细胞膜的细胞。
[细胞分析方法]
下面就用上述结构的细胞分析装置检测出体液样本中肿瘤细胞的方法进行说明。
本发明是以肿瘤细胞的种类与各肿瘤细胞在分布图(散点图)中的分布区域之间存在相关性这一认识为基础的。本发明是在散点图中设定不同种类肿瘤细胞分别特异性分布的区域,计数属于所述区域的细胞数,根据计数的细胞数检测出体液中肿瘤细胞。
在本实施方式中,鉴于肿瘤细胞中有细胞之间凝集而成的凝集肿瘤细胞和未凝集的非凝集肿瘤细胞,将这些凝集肿瘤细胞和非凝集肿瘤细胞视为不同种类的肿瘤细胞。凝集肿瘤细胞和非凝集肿瘤细胞在散点图中分别特异性地分布在某个特定区域。
凝集肿瘤细胞比包括白细胞、巨噬细胞和间皮细胞在内的有核细胞大,其特异性地分布在散点图的“凝集细胞检测区域”。因此,计数属于凝集细胞检测区域的细胞数就能从体液中的其他细胞中识别并检测出体液中的凝集肿瘤细胞。比如可以在前向散射光信号强度和前向散射光信号宽度的散点图中,将前向散射光信号宽度比非凝集粒子分布的区域大的区域设定为凝集细胞检测区域。
另一方面,非凝集肿瘤细胞特异性地分布在荧光信号强度位于白细胞分布区域和间皮细胞分布区域之间的区域的、散点图的“非凝集细胞检测区域”。因此,计数属于非凝集细胞检测区域的细胞数就能将体液中的非凝集肿瘤细胞从体液中的其他细胞识别出来并检测出来。比如,可以在荧光信号强度和前向散射光信号强度的散点图中,将荧光信号强度比白细胞分布区域大、且荧光信号强度比间皮细胞分布区域小的区域设定为非凝集细胞检测区域。
凝集细胞检测区域和非凝集细胞检测区域以及巨噬细胞等有核细胞在散点图中分布的区域例如可以如下求得。即,在显微镜下通过目测观察细胞的涂片标本,以此求出体液中凝集肿瘤细胞和巨噬细胞等的比例(%)。然后,根据上述比例信息确定在散点图中的某个区域分布有什么。比如,当巨噬细胞在体液中以30%的比例存在时,推断在散点图中占整体的30%的个数集中分布的区域分布着巨噬细胞。对复数个样本进行此类工作,由此就能确定某种有核细胞在散点图上分布在哪个区域。
图5例示了不包含肿瘤细胞的阴性样本的散点图。在图5和后面出现的图6~7中,(a)为以前向散射光信号强度(FSC)为纵轴、以前向散射光信号宽度(FSCW)为横轴的散点图,(b)为以荧光信号强度(SFL)为纵轴、以前向散射光信号强度(FSC)为横轴的散点图。
肿瘤细胞在所述阴性样本中的比例为0.00%,间皮细胞的比例为21.21%。另外,“%”表示相对于白细胞数的比例,间皮细胞的比例为21.21%指在100个白细胞中包含间皮细胞21.21个。
在凝集细胞检测区域和非凝集细胞检测区域均未从上述阴性样本中检测出肿瘤细胞。
图6例示了包含凝集肿瘤细胞的样本的散点图。此样本中的肿瘤细胞比例为66.2%,间皮细胞比例为13.14%。
关于此样本,在图6的(a)粗黑箭头所示凝集细胞检测区域检测出凝集肿瘤细胞。
图7例示了包含非凝集肿瘤细胞的样本的散点图。此样本中的肿瘤细胞比例为662.0%,间皮细胞比例为8.00%。
关于此样本,在图7的(b)粗黑箭头所示非凝集细胞检测区域检测出非凝集肿瘤细胞。
[第一实施方式]
图8为第一实施方式涉及的细胞分析方法中测定单元2和信息处理单元4进行处理的流程图。第一实施方式能够检测出肿瘤细胞中的凝集肿瘤细胞。凝集肿瘤细胞比包括白细胞、巨噬细胞和间皮细胞的有核细胞大,在前向散射光信号强度和前向散射光信号宽度的散点图中,其特异性分布在前向散射光信号宽度比非凝集粒子分布区域大的区域(凝集细胞检测区域)。利用其特异性分布于上述区域这一特征检测出肿瘤细胞中的凝集肿瘤细胞。
首先,测定单元2在步骤S1中为使体液样本中所包含的红细胞溶血并对有核细胞的核酸进行荧光染色而进行测定试样制备处理。具体而言,如上所述,将采自患者的体液样本、第一试剂和第二试剂混合,此混合液经加热器H加热,以此制备出测定试样。
然后,测定单元2在步骤S2中根据在步骤S1制备的测定试样进行细胞检测处理。具体而言,如上所述,通过光学检测器D获取与各细胞相关的前向散射光信号、侧向散射光信号和荧光信号。
通过测定单元2获取的信号在步骤S3传送至信息处理单元4。
信息处理单元4的CPU401在步骤S11从测定单元2接收与各细胞相关的前向散射光信号、侧向散射光信号和荧光信号,将所接收的信号存储在硬盘404。
然后,CPU401在步骤S12根据所接收的信号绘制第一散点图。第一散点图是以前向散射光信号的强度(FSC)为纵轴、以前向散射光信号的宽度(FSCW)为横轴的散点图。
图9为绘制的第一散点图的示意图。凝集肿瘤细胞比包括白细胞、巨噬细胞及间皮细胞的有核细胞大,故如前所述,其特异性分布在前向散射光信号强度和前向散射光信号宽度比白细胞等非凝集粒子分布区域(非凝集细胞检测区域)大的区域(凝集细胞检测区域)。另外,前向散射光信号强度在一定值以上且从散点图外扩的大粒子显示在散点图上的最高强度的位置。
接着,CPU401在步骤S13对分布在凝集细胞检测区域的细胞数C1进行计数。
然后,CPU401在步骤S14判断在步骤S13计数的细胞数C1是否在一定值T1以上。如果判断细胞数C1在一定值T1以上(是),则进入步骤S15,CPU401将RAM403或硬盘404中存储的判断标记的值设为1。而若判断细胞数C1小于一定值T1(否),则CPU401使处理进入步骤S16。
然后,CPU401在步骤S16在输出部件41显示分析结果界面。此分析结果界面上能够显示例如样本号、考察项目、绘制的第一散点图和后述警告等。
接下来,CPU401在步骤S17判断判断标记的值是否为1。若判断判断标记的值为1(是),则进入步骤S18,在步骤S18,CPU401使输出部件41的分析结果界面上显示表示所测定的体液样本中可能包含凝集肿瘤细胞的警告。另一方面,当判断判断标记的值不是1时(否)时,结束处理。
[第二实施方式]
图10为第二实施方式涉及的细胞分析方法中测定单元2和信息处理单元4进行处理的流程图。第二实施方式能够检测出肿瘤细胞中的非凝集肿瘤细胞。非凝集肿瘤细胞在荧光信号强度和前向散射光信号强度的散点图中,跨单核白细胞和间皮细胞出现的区域而出现。然而,其特异性分布在比单核白细胞分布区域荧光信号强度更大、且比间皮细胞分布区域荧光信号强度更小的区域(非凝集细胞检测区域)。利用其在上述区域特异性分布这一特征,检测出肿瘤细胞中的非凝集肿瘤细胞。在此方法中,当非凝集肿瘤细胞只出现在单核白细胞和间皮细胞的出现区域时检测不出来。但是,非凝集肿瘤细胞以非凝集细胞检测区域为中心跨单核白细胞和间皮细胞出现区域而出现,因此,通过计数非凝集细胞检测区域中的细胞出现数,能够以高特异度检测出体液样本中非凝集肿瘤细胞的出现。
测定单元2中测定试样的制备处理(步骤S1)、细胞的检测处理(步骤S2)、以及获取信号向信息处理单元4的传送(步骤S3)与第一实施方式的步骤S1到步骤S3相同。因此,为了简单,省略关于这些处理的说明。
信息处理单元4的CPU401在步骤S21从测定单元2接收与各细胞相关的前向散射光信号、侧向散射光信号和荧光信号,并将所接收的信号存储在硬盘404。
然后,CPU401在步骤S22根据接收的信号绘制第二散点图。第二散点图是以荧光信号强度(SFL)为纵轴,以前向散射光信号强度(FSC)为横轴的散点图。
图11为绘制的第二散点图的示意图。非凝集肿瘤细胞在以荧光信号强度(SFL)为纵轴,以前向散射光信号强度(FSC)为横轴的散点图中,特异性分布在比白细胞分布区域的荧光信号强度大、且比间皮细胞分布区域的荧光信号强度小的区域(非凝集细胞检测区域)。
然后,CPU401在步骤S23计数分布在非凝集细胞检测区域的细胞数C2。通过设定上述非凝集细胞检测区域,能够根据通过检测出的荧光信号等光信息绘制的第二散点图如图11所示地至少从白细胞、巨噬细胞和间皮细胞分离出并计数非凝集肿瘤细胞。
然后,CPU401在步骤S24判断步骤S23计数的细胞数C2是否在一定值T2以上。如果判断细胞数C2在一定值T2以上(是),则进入步骤S25,CPU401将存储在RAM403或硬盘404中的判断标记的值设为1。而若判断细胞数C2小于一定值T2(否),则CPU401使处理进入步骤S26。
然后,CPU401在步骤S26在输出部件41显示分析结果界面。可以使此分析结果界面上显示例如样本号、考察项目、绘制的第二散点图和后述警告等。
然后,CPU401在步骤S27判断判断标记的值是否为1。若判断判断标记的值为1(是),则进入步骤S28,在步骤S28,CPU401使输出部件41的分析结果界面上显示表示所测定的体液样本中可能包含非凝集肿瘤细胞的警告。另一方面,当判断判断标记的值不是1(否)时,结束处理。
[第三实施方式]
图12为第三实施方式涉及的细胞分析方法中测定单元2和信息处理单元4进行处理的流程图。第三实施方式能够分别检测出肿瘤细胞中的凝集肿瘤细胞和非凝集肿瘤细胞。即,与第一实施方式同样地进行凝集肿瘤细胞的检测,与第二实施方式同样地进行非凝集肿瘤细胞检测。因此,第三实施方式涉及的细胞分析方法与第一实施方式或第二实施方式涉及的细胞分析方法相比能够进一步提高肿瘤细胞的检测精度。此外,还可以与分析的可靠度相应地改变警告的内容,比如当检测出一定数以上的凝集肿瘤细胞和非凝集肿瘤细胞时设为精确度高的警告(高),当检测出一定数以上的其中一种肿瘤细胞时,设为精确度略低的警告(低)等。
测定单元2中的测定试样制备处理(步骤S1)、细胞检测处理(步骤S2)、以及获取的信号向信息处理单元4的传送(步骤S3)与第一实施方式或第二实施方式的步骤S1到步骤S3相同。因此,为了简单,省略关于这些处理的说明。
信息处理单元4的CPU401在步骤S31从测定单元2接收与各细胞相关的前向散射光信号、侧向散射光信号和荧光信号,将所接收的信号存储在硬盘404。
然后,CPU401在步骤S32根据接收的信号绘制第一散点图。第一散点图是以前向散射光信号的强度(FSC)为纵轴,以前向散射光信号的宽度(FSCW)为横轴的散点图(参照图9)。
接着,CPU401在步骤S33对分布在凝集细胞检测区域的细胞数C1进行计数。
然后,CPU401在步骤S34判断在步骤S33计数的细胞数C1是否在一定值T1以上。如果判断细胞数C1在一定值T1以上(是),则进入步骤S35,CPU401将存储在RAM403或硬盘404中的判断标记的值设为1。而若判断细胞数C1小于一定值T1(否),则CPU401使处理进入步骤S36。
然后,CPU401在步骤S36根据接受的信号绘制第二散点图。第二散点图是以荧光信号强度(SFL)为纵轴,以前向散射光信号强度(FSC)为横轴的散点图(参照图11)。
然后,CPU401在步骤S37计数分布在非凝集细胞检测区域的细胞数C2。
然后,CPU401在步骤S38判断步骤S37计数的细胞数C2是否在一定值T2以上。如果判断细胞数C2在一定值T2以上(是),则进入步骤S39, 在步骤S39判断判断标记是否为1。若判断判断标记为1(是),则进入步骤S40,在步骤S40,CPU401将存储在RAM403或硬盘404中的判断标记的值设为2。另一方面,当判断判断标记不是1(否)时,CPU401使处理进入步骤S41。
然后,CPU401在步骤S41在输出部件41显示分析结果界面。可以使此分析结果界面上显示例如样本号、考察项目、绘制的第一散点图和第二散点图、后述警告(高)或警告(低)等。
接着,CPU401在步骤S42判断判断标记的值是否为2。若判断判断标记的值为2(是),则进入步骤S43,在步骤S43,CPU401使输出部件41的分析结果界面上显示表示所测定的体液样本包含凝集肿瘤细胞的可能性大的警告(高)。另一方面,当判断判断标记的值不是2(否)时,CPU401使处理进入步骤S44,在步骤S44,判断判断标记的值是否为1。若在步骤S44判断判断标记的值为1(是),则进入步骤S45,在步骤S45,CPU401使输出部件41的分析结果界面上显示表示所测定的体液样本有可能包含凝集肿瘤细胞的警告(低)。另一方面,当判断判断标记的值不是1(否)时,处理结束。
在本实施方式中,绘制第一散点图,计数此第一散点图的凝集细胞检测区域中的细胞数C1之后,绘制第二散点图,计数此第二散点图的非凝集细胞检测区域中的细胞数C2,并检测出体液中的肿瘤细胞,但也可以先绘制第二散点图,计数此第二散点图的非凝集细胞检测区域中的细胞数C2之后,再绘制第一散点图,计数此第一散点图的凝集细胞检测区域中的细胞数C1,检测出体液中的肿瘤细胞。
此外,在本实施方式中会发出二种警告,但也可以发出一种警告。即,也可以当计数的凝集肿瘤细胞和非凝集肿瘤细胞数中的至少其中之一在一定值以上时发出警告。与仅根据凝集肿瘤细胞和非凝集肿瘤细胞其中一者的判断情况来进行有无肿瘤细胞的警告相比,此情况能够更正确地检测出体液样本中有无肿瘤细胞。
[实施例]
下面说明本发明的细胞分析方法的实施例,但本发明从根本上并不是只限于此实施例。
[实施例1]
对220个样本按照第一实施方式涉及的细胞分析方法进行了肿瘤细胞的检测。样本种类是脑脊髓液、胸水,以被认为会凝集的腺癌为对象。第一试剂使用了FluorocellWDF,第二试剂使用LysercellWDF。与目测法比较的结果见表1。在表1中,“1”表示阳性判断(有凝集肿瘤细胞),“0”表示阴性判断(无凝集肿瘤细胞)。
【表1】
在实施例1的灵敏度为72.2%,特异度为98.0%。阳性预测值(Positive Predictive Value, PPV)为76.5%,阴性预测值(Negative Predictive Value,NPV)为98.6%。
[实施例2]
对209个样本按照第二实施方式涉及的细胞分析方法进行了肿瘤细胞的检测。样本种类是脑脊髓液、胸水,以腺癌以外的肿瘤为对象。第一试剂使用了FluorocellWDF,第二试剂使用了LysercellWDF。与目测法比较的结果见表2。
【表2】
在实施例2的灵敏度为37.5%,特异度为95.0%。阳性预测值PPV为23.1%,阴性预测值NPV为97.4%。
[实施例3]
对220个样本按照第三实施方式涉及的细胞分析方法进行了肿瘤细胞的检测。样本种类是脑脊髓液、胸水,第一试剂使用了FluorocellWDF,第二试剂使用了LysercellWDF。与目测法比较的结果见表3。检测出在一定数以上的凝集肿瘤细胞和非凝集肿瘤细胞中的至少其中之一即是阳性判断。
【表3】
在实施例3中的灵敏度为72.2%,特异度为98.0%。阳性预测值PPV为76.5%,阴性预测值NPV为97.5%。
[其他变更例]
本发明不限于上述实施方式,其在权利要求范围内可以有各种变更。
- 还没有人留言评论。精彩留言会获得点赞!