一种大气颗粒物毒性的研究方法及其系统与流程
本发明涉及大气颗粒物毒性研究领域,特别涉及一种大气颗粒物毒性的研究方法及其系统。
背景技术:
空气污染严重地影响着人体健康。流行病学研究表明,大气细颗粒物(特别是PM2.5)由于可以深入人体肺部而危害更大,其人体暴露能够造成心血管系统发病率以及死亡率上升,也可显著增加慢性阻塞性肺病(COPD)、肺功能下降等呼吸系统疾病,大量毒理学研究还发现大气细颗粒物可以引起系统炎症、改变血管收缩状态、削弱血管功能、动脉粥状硬化等。PM2.5对心血管及呼吸系统的损伤机理还在探索进程中,其进入人体后引起的活性氧簇的生成和氧化应激的发生所受关注较多。
动物暴露实验是研究大气颗粒物毒性的一种重要方法,目前多用小鼠或大鼠进行,具体染毒方式多采用大气颗粒物滤膜采样样品悬液气管滴注方法,操作比较繁琐,与实际呼吸暴露存在一定的差距。大气颗粒物的粒径越小越容易深入人的肺部,甚至可以进入血液,随循环系统分布到身体更多的靶器官。目前,还没有相关研究证明进入血液的大气颗粒物会造成哪些负面影响。此外,大气颗粒物,特别是PM2.5的毒性究竟有多大,目前的研究存在一定的差别,主要是由暴露方式、颗粒物组分的差别造成的。
技术实现要素:
为了直观地了解大气颗粒物(尤其是PM2.5)的毒性,研究大气细颗粒物进入血液后会对人体健康造成哪些负面影响,本发明以大鼠为实验模型,建立了一种大气颗粒物毒性的研究系统及方法。本发明的主要思路是通过大鼠背部静脉埋置的导管将采集的不同浓度的大气颗粒物样品悬液直接注入血液,通过血液生物标志物检测、视频记录、组织病理分析等手段来研究大气颗粒物进入血液后对大鼠机体产生的健康影响,从而从活体动物水平上了解大气颗粒物的毒性。
在本发明的一方面,提供了一种大气颗粒物毒性研究方法,包括以下步骤:
1)采集大气颗粒物并制成一定浓度的悬液;
2)将大气颗粒物悬液注射到大鼠静脉中;
3)在一个实验周期内定期从大鼠静脉抽取血液样本,对相关生物标志物进行检测,同时视频记录大鼠日常活动,观察其对外界刺激的反应;
4)一个实验周期结束后处死大鼠,对大鼠进行解剖并摘取主要脏器进行病理分析。
上述方法,所述大气颗粒物主要指PM2.5,将不同浓度的PM2.5滤膜样品悬液注射到大鼠血液中,通过注射前后大鼠血液中生物标志物的浓度水平检测、PM2.5滤膜样品悬液成分检测、组织病理学分析、以及视频记录大鼠日常活动来研究PM2.5进入血液后对机体产生的氧化损伤、炎症反应等健康影响。
上述步骤1)中,优选采用为四通道大气细颗粒物采样器,将PM2.5采集到Teflon滤膜上,采集流量优选16.7L/min;采样后将PM2.5从Teflon滤膜上萃取到缓冲液(例如磷酸盐生理盐水缓冲液,PBS)中,低温超声萃取30分钟,制备成PM2.5悬液。用PBS将PM2.5悬液进行不同程度的稀释,获得不同浓度的PM2.5悬液,合理配置浓度梯度,可研究不同浓度的PM2.5悬液毒性的差异。
优选地,对大气颗粒物悬液成分进行检测,以更好地判断其可能产生的健康影响,检测内容包括但不限于:细菌总量检测、细菌种类检测、元素检测、内毒素检测。其中,细菌总量可以采用q-PCR的方法检测;细菌种类可以采用高通量基因测序的方法检测;元素可以采用ICP-MS(电感耦合等离子体质谱仪)进行检测;内毒素可以采用ELISA(酶联免疫吸附法)测定。
上述步骤2)中,优选使用进行过背部静脉导管埋置的SD大鼠,将大气颗粒物悬液通过背部导管注射到大鼠静脉中。为准确判断大鼠在注射大气颗粒物悬液后体内产生的健康影响,避免单一的指标可能产生的偏倚或纰漏,上述步骤3)优选采用多种生物标志物来综合表征氧化损伤和炎症反应,例如如下5种标志物:肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、C反应蛋白(CRP)、8羟基脱氧鸟苷(8-OHdG)、内毒素(Endotoxin)。标志物浓度水平的检测选用酶联免疫吸附法(ELISA)。
进一步的,为掌握大鼠血液中各类生物标志物的浓度水平变化情况,更好地分析PM2.5的血液毒性,步骤3)对采血的时间进行了合理规划,一个实验周期(一般为9天)对每只大鼠共采血6次:注射前、注射后1小时、注射后3天、注射后5天、注射后7天、注射后9天。同时利用摄像机对注射和无注射的大鼠在外界扰动下的行为活动进行拍摄记录,观察其对外界刺激的反应,进而分析颗粒物的毒性。
优选地,在步骤2)和3)对大鼠进行注射和取血操作时,应注意控制剂量。单次注射剂量不能超过大鼠血液总量的5%,大鼠血液总量在20mL左右,因此单次注射剂量一般不超过1mL;如果需要进行多次注射,则每天注射次数不能超过1次,每次注射量不能超过0.6mL。单次取血剂量不能超过1mL,如果仅需要在一个实验周期中的1天进行取血,则当天取血次数不能超过3次,总取血量不能超过3mL;如果需要每天进行取血,每天最多取血1次,当天总取血量不能超过0.3mL;如果需要隔天进行取血,每天最多取血1次,当天总取血量不能超过0.5mL。
上述步骤2)和3)中,优选地,合理安排对大鼠进行导管操作的时间,所有实验操作尽量保证在大鼠进行导管埋置手术后10天内进行,随着时间延长,埋置的导管会因为大鼠生长速度较快等原因出现不同程度的堵塞。每次进行导管操作后,应向大鼠导管内注射50μL封闭液(50%葡萄糖溶液,肝素钠500IU/mL),以防止血液凝集堵塞导管。
上述步骤3)中,在采血实验的同时利用摄像机对大鼠在外界扰动下的行为活动进行拍摄,对注射和无注射的大鼠在同样外界刺激下在不同时间段的动作行为进行视频拍摄,包括上午、中午、下午,观察其对外界刺激的反应,进而分析颗粒物的毒性。
上述步骤4)中,一个实验周期结束后处死大鼠,对大鼠进行解剖并取五脏(心肝脾肺肾)制作病理切片(HE染色),借助光学显微镜观察分析颗粒物对组织、器官的毒性。
在本发明的另一方面,提供了一种大气颗粒物毒性研究系统,该研究系统可以实现大气颗粒物(特别是PM2.5)的采集及悬液制备,悬液注射进入实验动物血液以及实验动物血液样本的采集,主要包括:大气颗粒物采样装置、悬液制备装置、注射装置、血液采样装置;其中,所述大气颗粒物采样装置为四通道大气细颗粒物采样器;所述悬液制备装置包括低温超声萃取仪和缓冲液;所述注射装置包括静脉导管和无菌注射器;所述血液采样装置包括无菌注射器;大气颗粒物采样装置采集的大气颗粒物由悬液制备装置制成大气颗粒物悬液,该大气颗粒物悬液通过注射装置注射入实验动物静脉中,血液采样装置定期采集实验动物的血液样品进行研究。
通常,上述大气颗粒物毒性研究系统在运用时,首先通过四通道大气细颗粒物采样器将PM2.5采集到Teflon滤膜上,采集流量16.7L/min;采样后将PM2.5从Teflon滤膜上萃取到磷酸盐生理盐水缓冲液(PBS)中,低温超声萃取30分钟,制备成PM2.5悬液;实验选用进行过背部静脉导管埋置的SD大鼠,用无菌注射器将PM2.5悬液通过背部导管注射到大鼠静脉中;实验期间使用无菌注射器通过背部导管从大鼠静脉抽取血液样本。
需要说明的是,上述研究方法和系统的研究对象并不局限于PM2.5,若需要研究其他有毒有害物质进入血液后可能对机体产生的健康影响,也可借助该方法将所研究物质的悬液或溶液注射进入实验动物血液,并进行血液样本采集及分析。本发明提供的研究方法及其系统借助动物模型(大鼠)对大气颗粒物(PM2.5)的毒性进行研究分析,主要特点是:
1)本发明提供了一种大气颗粒物毒性研究系统,该研究系统可以通过大鼠背静脉内埋置的导管直接将大气颗粒物悬液注射进入其血液中,同时实现血液样本的便捷采集;
2)该系统方法可以借助大鼠日常活动特征、大气颗粒物悬液成分检测、血液中生物标志物的浓度水平变化以及组织病理分析多角度研究大气颗粒物(PM2.5)的毒性,间接地对比研究不同浓度及来源的大气颗粒物(PM2.5)的毒性;
3)不同于现有的暴露方法,该系统方法大气颗粒物(PM2.5)暴露简单、可控,而且可以在单个活体动物水平上观察其毒性;
4)不同于现有的大气颗粒物(PM2.5)毒性的研究,该系统方法考虑颗粒物的组分包括生物成分对健康的负面影响;
5)该系统方法能够回答颗粒物进入血液后可对活体组织、器官产生何种毒性等。
附图说明
图1是实施例1进行PM2.5毒性研究的流程示意图。
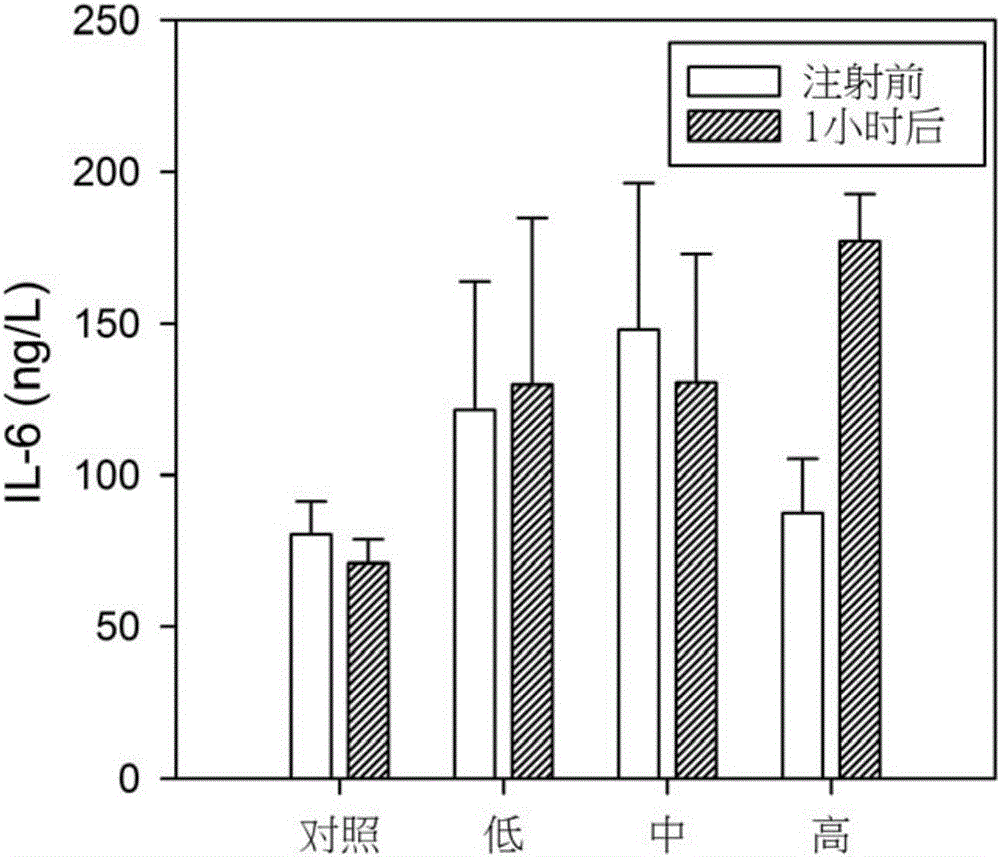
图2显示了实施例1注射PM2.5悬液后各组大鼠血液中白介素6的浓度变化。
具体实施方式
下面结合附图,通过实施例对本发明的大气细颗粒物(PM2.5)毒性研究系统和方法做进一步阐述,本领域技术人员可以理解:在不脱离本发明及所附的权利要求的精神和范围内,各种替换和修改都是可能的。因此,本发明不应局限于实施例所公开的内容,本发明要求保护的范围以权利要求书界定的范围为准。
实施例1:
对PM2.5毒性研究的流程如图1所示,具体步骤如下:
1.选取12只体重、年龄相近,生理状态基本一致的已经做好背部静脉导管埋置的雄性SD大鼠,随机分成四组(高剂量注射组、中剂量注射组、低剂量注射组、对照组),每组3只大鼠。
2.使用四通道大气细颗粒物采样器采集PM2.5滤膜样品,采样流量16.7L/min,采样时间24h,所用滤膜为Teflon滤膜。
3.采样结束后,取一张滤膜置于15mL无菌离心管中,加入6mL磷酸盐生理盐水缓冲液(PBS),低温超声萃取30min,此萃取液悬液用作高剂量组注射;将高剂量组所注射悬液用PBS分别稀释10倍和100倍,分别用作中剂量组和低剂量组注射;取一张未采样的空白滤膜,按照相同方法低温超声萃取30min,用作对照组注射。同时对悬液成分进行检测,包括细菌总量检测(q-PCR)、细菌种类检测(高通量测序)、元素检测(ICP-MS)、内毒素检测(ELISA)。
4.注射PM2.5悬液前,对每只大鼠取血0.3mL,然后注射悬液1mL,注射后1h、3d、5d、7d、9d分别对每只大鼠取血0.3mL,血样-20℃冻存。其中,注射和取血使用1mL无菌注射器(配有23G无菌平头针)通过大鼠背部静脉埋置导管进行。为保证大鼠在实验操作过程中不会过度挣扎干扰实验,对大鼠进行导管操作时,对大鼠进行遮挡视线并固定后肢。合理安排对大鼠进行导管操作的时间,所有实验操作尽量保证在大鼠进行导管埋置手术后10天内进行,随着时间延长,埋置的导管会因为大鼠生长速度较快等原因出现不同程度的堵塞。每次注射或取血前要用一只无菌注射器将导管内的封闭液(50%葡萄糖注射液,含500IU/mL肝素)吸出,每次注射或取血后要向导管内注入50μL封闭液(50%葡萄糖溶液,肝素钠500IU/mL),以防止血液凝集堵塞导管。取血后,对血样进行生物标志物浓度检测,主要采用ELISA法,检测的生物标志物包括肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、C反应蛋白(CRP)、8羟基脱氧鸟苷(8-OHdG)、内毒素(Endotoxin)。
5.注射后每天对大鼠的日常活动进行视频记录。
6.第9天取血后处死大鼠,解剖,取五脏(心肝脾肺肾)用福尔马林溶液固定,之后做HE染色病理切片。
7.结合视频记录、悬液成分检测、血样生物标志物检测以及HE染色病理切片分析结果,探究PM2.5进入血液后对机体造成的氧化损伤及炎症反应。
结果分析:
视频记录发现,注射悬液之后,高剂量组大鼠与对照组相比活动明显迟钝、嗜睡,但在3-5天后日常活动恢复正常,与对照组无异。血样检测发现,高剂量组大鼠注射悬液1h后,表征氧化损伤和炎症反应的生物标志物浓度较对照组和低剂量组明显升高,以白介素6(IL-6)为例,如图2所示,注射1h后,高剂量组大鼠血液中白介素6的浓度是是注射前的2倍,相比之下其他各组变化并不显著。
- 还没有人留言评论。精彩留言会获得点赞!