测定利格列汀原料药中利格列汀含量的方法与流程
本发明涉及生物医药领域,具体的,本发明涉及测定利格列汀原料药中利格列汀含量的方法。
背景技术:
ii型糖尿病是由于机体胰岛β细胞分泌胰岛素不足或靶细胞对胰岛素不敏感(胰岛素抵抗)所致,亦称非胰岛素依赖性糖尿病。ii型糖尿病多在35~40岁之后发病,占糖尿病患者90%以上。
利格列汀(linagliptin)是一种二肽基肽酶-4(dpp-4)的抑制剂,是一种用于治疗ii型糖尿病的有效药。其分子结构为:
利格列汀原料药中利格列汀的含量为影响利格列汀原料药药效的关键因素,也是评估利格列汀原料药药用安全的关键指标。然而,如何有效测定利格列汀原料药中利格列汀的含量仍有待进一步开发。
技术实现要素:
本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明的一个目的在于提出了一种简便、准确、灵敏地检测利格列汀原料药中利格列汀含量的方法。
在本发明的第一方面,本发明提出了一种测定利格列汀原料药中利格列汀含量的方法,根据本发明的实施例,所述方法包括:通过高效液相色谱分析方法对所述利格列汀原料药进行分析,以便获得色谱图;以及基于所述色谱图,确定所述利格列汀原料药中利格列汀的含量,其中,所述高效液相色谱采用以下条件:色谱柱为ymc-packods-am,4.6×250mm,5微米,检测器为dad,检测波长为294nm,柱温为35℃,流动相a相为10~50mmol/l的磷酸二氢钾缓冲液,所述磷酸二氢钾缓冲液的ph为3.0~5.0,流动相b相为乙腈,流速为1.0ml/min,洗脱采用等度洗脱,所述等度洗脱中a相和b相的体积比为72:28,运行时间为10min。利用根据本发明实施例的检测方法,可简便、准确、灵敏地、专属性地测定利格列汀原料药中利格列汀的含量,从而有效控制利格列汀原料药的药效、质量和药用安全。
根据本发明的实施例,上述测定利格列汀原料药中利格列汀含量的方法还可以进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述磷酸二氢钾缓冲液的ph为4.0。发明人在实验中发现,磷酸二氢钾缓冲液的ph为4.0,利格列汀主峰与杂质峰存在形态单一,峰分离度好,主峰形尖锐并且可实现主峰保留时间重现的分离效果。
根据本发明的实施例,所述流动相a相为50mmol/l的磷酸二氢钾缓冲液。发明人通过实验发现,流动相a相采用50mmol/l的磷酸二氢钾缓冲液,利格列汀的主峰拖尾小、峰形好。
根据本发明的实施例,所述利格列汀原料药是以供试品溶液的形式提供的,其中,所述供试品溶液为利格列汀原料药的磷酸二氢钾-乙腈溶液,并且基于每毫升所述供试品溶液,利格列汀原料药的含量为0.2mg,其中,所述磷酸二氢钾-乙腈溶液是所述a相和b相的混合溶液,所述a相和b相的体积比为72:28。利格列汀原料药的进样浓度在0.2mg/ml时,既可保证足够好的检测灵敏度,又可保证利格列汀主峰不因浓度过载而变形、不在uv的线性响应范围内,确保不因浓度过高而导致uv谱变形从而致使纯度因子不合格。
根据本发明的实施例,所述供试品溶液的用量为10微升。根据本发明的实施例,供试品溶液的用量为10微升,可保证对利格列汀含量的测定更加真实、可靠、准确。
根据本发明的实施例,所述高效液相色谱分析方法采用标准对照溶液,所述标准对照溶液是利格列汀标准品的磷酸二氢钾-乙腈溶液,并且基于每毫升所述标准对照溶液,利格列汀标准品的质量为0.2mg。依据供试品溶液配制标准对照溶液,从而可以以较高的专属性快速准确测定利格列汀原料药中利格列汀的含量。
根据本发明的实施例,所述基于所述色谱图,确定所述利格列汀原料药中利格列汀的含量是通过以下公式确定的:
其中,ws1为标准对照溶液中利格列汀标准品的质量;at为供试品溶液中利格列汀主峰峰面积;dt为供试品溶液的稀释倍数;as1为标准对照溶液中利格列汀主峰峰面积;ds1为标准对照溶液的稀释倍数;wt为供试品溶液中利格列汀原料药的质量;p为利格列汀标准品的纯度;w为利格列汀原料药中水分的含量。根据本发明的实施例,采用上述方式确定利格列汀原料药中利格列汀的含量,准确率高,结果更加真实可靠。
在本发明的第二方面,本发明提出了一种测定利格列汀原料药中利格列汀含量的方法,根据本发明的实施例,所述方法包括:
(1)色谱条件
色谱柱为ymc-packods-am,4.6×250mm,5微米,
检测器为dad,
检测波长为294nm,
柱温为35℃,
流动相a相为50mmol/l的磷酸二氢钾缓冲液,所述磷酸二氢钾缓冲液的ph为4.0,
流动相b相为乙腈,
流速为1.0ml/min,
洗脱采用等度洗脱,所述等度洗脱中a相和b相的体积比为72:28,
运行时间为10min,
(2)配制空白溶液
a相和b相的体积比为72:28的混合溶液作为所述空白溶液,
(3)配制供试品溶液
精密称定利格列汀原料药20mg,置100ml容量瓶中,用空白溶液溶解,并做超声处理,稀释至刻度,摇匀,即得所述供试品溶液,
(4)配制标准对照溶液
精密称定利格列汀标准品20mg,置100ml容量瓶中,用空白溶液溶解,并做超声处理,稀释至刻度,摇匀,即得所述标准对照溶液,
(5)将10微升供试品溶液注入色谱仪,得到色谱图,根据所述色谱图计算得到供试品溶液中利格列汀的含量,
其中,按以下公式计算供试品溶液中利格列汀的含量,取2次测定结果的平均值作为测定结果:
式中,ws1为标准对照溶液中利格列汀标准品质量;
at为供试品溶液中利格列汀主峰峰面积的平均值;
dt为供试品溶液的稀释倍数;
as1为供试品溶液前后各2针标准对照溶液中利格列汀主峰峰面积的平均值;
ds1为标准对照溶液的稀释倍数;
wt为供试品溶液中利格列汀原料药的质量;
p为利格列汀标准品的纯度;
w为利格列汀原料药中水分的含量;
1针标准对照溶液的用量为10微升。
利用根据本发明实施例的检测方法,可简便、准确、灵敏、专属性地测定利格列汀原料药中利格列汀的含量,从而有效控制利格列汀原料药的药效、质量和药用安全。
附图说明
图1是根据本发明实施例1的利格列汀的hplc-dad紫外光谱图;
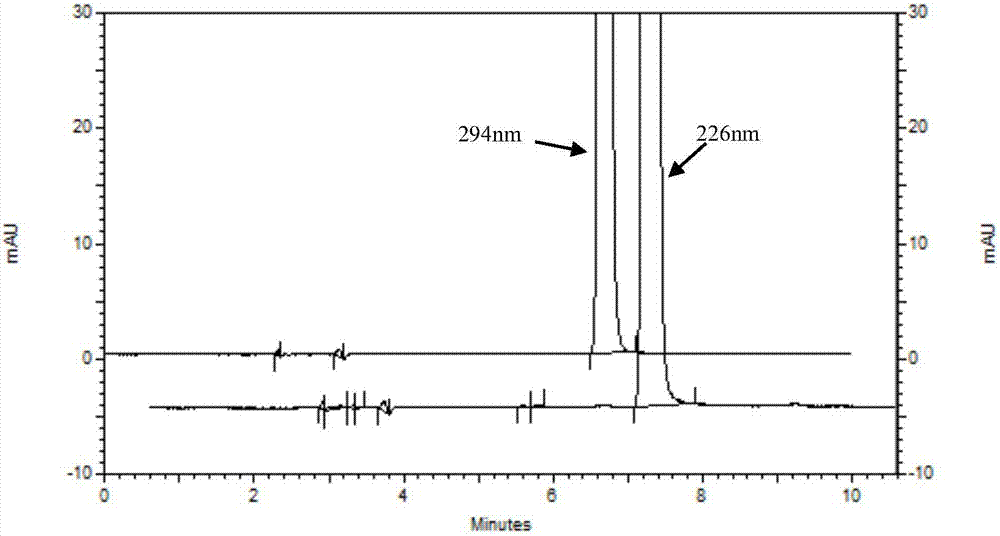
图2是根据本发明实施例1的利格列汀原料药在226nm和294nm下的色谱图;
图3是根据本发明实施例1的利格列汀原料药在ph=4.010mm磷酸二氢钾缓冲溶液作为流动相和等度洗脱条件下的色谱图;
图4是根据本发明实施例1的利格列汀原料药在ph=4.050mm磷酸二氢钾缓冲溶液作为流动相下的色谱图;
图5是根据本发明实施例2的空白溶液色谱图;
图6是根据本发明实施例2的标准对照溶液的色谱图;以及
图7是根据本发明实施例2的供试品溶液色谱图。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
在本发明实施例中,发明人详细介绍了测定利格列汀原料药中利格列汀含量的方法的开发过程。
1.1检测波长的确定
hplc-dad紫外光谱图显示,主峰利格列汀在226nm、294nm有特征吸收峰,结果如图1所示。但在226nm条件下,杂质峰的数量较多,结果如图2所示。为了尽量减少杂质峰的干扰,发明人选用第二吸收波长294nm进行含量分析方法开发。
1.2洗脱方式筛选
发明人在本实验室前期研发(测定利格列汀原料药中杂质含量的方法)的基础上,发明人对洗脱方式进行进一步了筛选,来确定测定利格列汀原料药中利格列汀含量的方法,发明人发现,在等度洗脱的条件下,较之梯度洗脱,利格列汀能够在短时间内洗脱出来,而且利格列汀极性较大,在反相上保留弱。具体检测色谱条件如下所述:
色谱柱:ymc-packods-am250*4.6mm,5微米;
检测波长:294nm;
流速:1.0ml/min;
柱温:35℃;
流动相:a相为10mmph=4.0磷酸二氢钾缓冲溶液(配制方法为:称取1.4g磷酸二氢钾,加1l超纯水溶解,用磷酸调ph到4.0,用0.45微米滤膜过滤,脱气即得);
b相为乙腈;
进样量:10微升;
运行时间:10min;
溶液配制:取利格列汀原料药约20mg,精密称定,置100ml容量瓶中,用稀释剂(a相和b相的体积比为72:28的混合溶液)适量使溶解并稀释至刻度,摇匀,即得;
等度洗脱:a相:b相=72:28。
在上述条件下,获得色谱图如图3所示,主峰保留时间约为7.10min,对称因子约为2.3,峰高约420mau。
1.3流动相的确定
发明人在本实验室前期研发(测定利格列汀原料药中杂质含量的方法)的基础上,对流动相的磷酸二氢钾的浓度进行了进一步了筛选,来确定最优的测定利格列汀原料药中利格列汀含量的方法。
图3结果显示,使用ph=4.010mm磷酸二氢钾缓冲溶液,主峰的对称因子为2.3。
图4结果显示,增大磷酸二氢钾缓冲溶液浓度至50mm,主峰的对称因子为1.5,拖尾得到改善。为保护色谱柱,缓冲盐浓度不宜再升高。因此发明人优先选择ph=4.050mm磷酸二氢钾缓冲溶液做为利格列汀含量测定方法的a相缓冲液。
1.4供试品溶液制备方法确定
选择a相和b相的体积比为72:28的混合溶液作为利格列汀原料药的溶剂,发明人在实验中发现,供试品浓度为0.2mg/ml,进样量为10微升,所得色谱图中,利格列汀的主峰峰高约为600mau,利格列汀主峰不变形、在uv的线性响应范围内,纯度因子合格。
实施例2
在本实施例中,发明人考察了实施例1所确定的测定利格列汀原料药中利格列汀含量的方法的系统适用性和回收率,并详细介绍了如何基于实施例1所确定的色谱条件下获得的色谱图,计算得到利格列汀的含量。
2.1相关溶液的配制
稀释液(空白溶液)为:a相:b相=72:28的混合溶液;
标准对照溶液:取利格列汀标准品约20mg,精密称定,置100ml容量瓶中,用稀释液适量使溶解并稀释至刻度,摇匀,即得标准对照溶液,平行配制两份,命名为标准对照溶液1和标准对照溶液2;
供试品溶液:取利格列汀原料药约20mg,精密称定,置100ml容量瓶中,用稀释液适量使溶解并稀释至刻度,摇匀,即得供试品溶液,平行配制两份,命名为供试品溶液1和供试品溶液2。
2.2色谱条件
色谱柱:ymc-packods-am250*4.6mm5微米;
柱温:35℃;
检测波长:294nm;
流速:1.0ml/min;
进样体积:10微升;
运行时间:10min;
流动相:a相(50mmph=4.0磷酸二氢钾缓冲溶液):取磷酸二氢钾约6.8g,加水1l使溶解,用磷酸调ph=4.0,摇匀,用0.45微米滤膜过滤,超声脱气,即得;
b相:乙腈;
等度洗脱:a相:b相=72:28。
2.3相关操作
待基线平衡后,取空白溶液按2.2色谱条件进样1-2针(系统充分平衡后),然后取标准对照溶液1和2以及供试品溶液1和2按下面的序列进样,记录色谱图。取第一次进标准对照溶液1的前3针和供试品溶液后(随行)的标准对照溶液的2针,计算峰面积的rsd,要求≤2.0%;如进多次随行对照,同法计算。要求rsd≤2.0%。
其中,进样序列如表1所示,
表1:进样序列
其中,
空白溶液检测结果显示(色谱图如图5),2.2色谱条件下的检测方法不受干扰;
标准对照溶液图谱如图6所示;
系统适用性检测结果显示,利用2.2色谱条件下的检测方法,检测标准对照溶液所得图谱中,主峰的对称因子在0.8~2.0之间;标准对照溶液1连续进样5针,主峰峰面积rsd不超过0.73%,2.2色谱条件下的检测方法的系统适用性良好。
回收率结果显示,利用2.2色谱条件下的检测方法,标准对照溶液1和2进样之后,标准对照品溶液2的回收率在99.0%~101.0%,2.2色谱条件下的检测方法的回收率良好。
其中,回收率计算公式为:
ws1:标准对照溶液1中利格列汀标准品的称样量,mg;
ws2:标准对照溶液2中利格列汀标准品的称样量,mg;
as1:标准对照溶液1(连续进样5次)主峰峰面积的平均值;
as2:标准对照溶液2中主峰峰面积的平均值。
供试品溶液图谱如图7所示。
2.4基于色谱图的利格列汀含量的计算方法
按照以下公式计算供试品溶液中利格列汀的含量:
其中:ws1为标准对照溶液1中利格列汀标准品的称样量,mg;
at为供试品溶液中利格列汀主峰峰面积的平均值;
dt为供试品溶液的稀释倍数;
as1为标准对照溶液1(第一次计算取重复进样5针和供试品溶液后随行对照2针,后续计算取供试品溶液前后各2针随行对照)中主峰峰面积的平均值;
ds1为标准对照溶液1的稀释倍数;
wt为供试品溶液中利格列汀原料药的质量,mg;
p为利格列汀标准品的纯度;
w为利格列汀原料药中水分的含量,%。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!