一种用于免疫层析试纸条的包被液及其制备方法与流程
本发明属于医学检验领域,具体地,涉及一种免疫层析试纸条的包被缓冲液及其制备方法。
背景技术:
在制备免疫层析试纸条的过程中,包被缓冲液用于包被抗体包被在硝酸纤维素膜上,能有效保护抗体的效价和减少抗体的非特异结合,提高免疫层析试纸条的稳定性和分辨率。目前,在免疫层析试纸条的制备上,都是采用传统的包被缓冲液将抗体包被在硝酸纤维素膜上,烘干后再用封闭液对包被膜进行封闭。传统的包被缓冲液的配方为:1%BSA,余量为0.025M、pH=7.4的PBS。使用传统的包被缓冲液存在以下缺陷:(1)抗体包被于硝酸纤维素膜后,需再配制封闭液对其进行封闭,操作步骤繁琐,增加成本,延长生产时间。(2)抗体一经包被固化后,抗体效价降低,反应荧光信号大幅下降,从而使整个试剂的检测灵敏度和精密度降低,有效期缩短。
技术实现要素:
为了克服现有技术的不足,本发明的第一个目的在于提供一种用于免疫层析试纸条的包被液;本发明所添加的BSA含量较传统配方含量高,对硝酸纤维素膜起到一定程度的封闭作用;添加较高含量的蔗糖和一定量的海藻糖能够保护抗体;有利于提高试剂测试的灵敏度和延长试剂有效期。
本发明的第二个目的是为了提供一种上述用于免疫层析试纸条的包被液的制备方法。
实现本发明的目的可以通过采取如下技术方案达到:
一种用于免疫层析试纸条的包被液,包括如下按重量分数计的各组分:
优选地,所述缓冲液为Tris-HCl缓冲液或者磷酸盐缓冲液。
优选地,所述缓冲液的浓度为10mM-50mM。
优选地,所述缓冲液的pH值为7.0–7.4。
优选地,所述的包被液包括如下按重量分数计的各组分:
所述磷酸盐缓冲液的浓度为10mM-50mM,pH为7.0-7.4。
优选地,所述的包被液包括如下按重量分数计的各组分:
所述磷酸盐缓冲液的浓度为30mM,pH为7.2。
优选地,所述的包被液包括如下按重量分数计的各组分:
所述磷酸盐缓冲液的浓度为30mM,pH为7.4。
本发明还提供一种用于免疫层析试纸条的包被液的制备方法,包括如下步骤:
1)用纯水配置缓冲液作为基础液;
2)称取配方量的BSA、海藻糖、蔗糖、NaN3,溶于配方量的基础液中,混匀,调节pH至7.0-7.4;
3)采用滤膜过滤除菌获得包被液。
优选地,步骤3)所述滤膜的过滤孔径为0.22~0.25μm。
优选地,步骤2)所述的pH为7.2;步骤3)所述的滤膜的孔径为0.22μm。
相比现有技术,本发明的有益效果在于:
1、本发明的包被缓冲液配方中,BSA含量较传统配方含量高,对硝酸纤维素膜起到一定程度的封闭作用,节省了包被膜再封闭的步骤,可显著降低抗体与样品发生非特异反应,从而有利于提高测试的精密度和灵敏度。
2、本发明的包被缓冲液加入了较高含量的蔗糖和一定量的海藻糖,能进一步提高抗体耐热能力,有保护包被抗体效价的作用,可显著降低抗体包被后,效价和反应荧光信号大幅下降的问题,从而有利于提高试剂测试的灵敏度和延长试剂有效期。
附图说明
图1为用实施例1包被液制备的CRP定量检测免疫层析试纸条的检测结果。
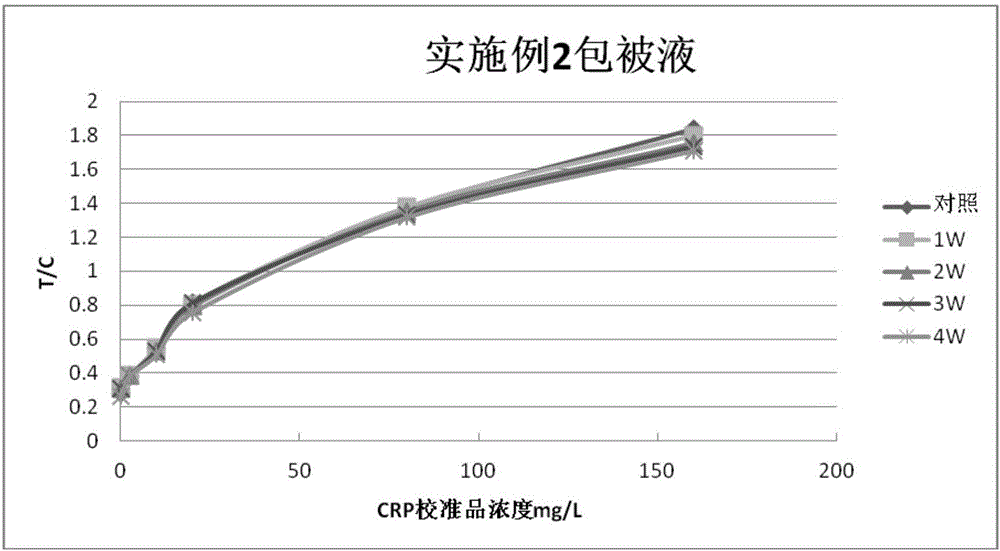
图2为用实施例2包被液制备的CRP定量检测免疫层析试纸条的检测结果。
图3为用实施例3包被液制备的CRP定量检测免疫层析试纸条的检测结果。
图4为用传统技术的包被液制备的CRP定量检测免疫层析试纸条的检测结果。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述:
实施例1:
一种用于免疫层析试纸条的包被液,包括如下按重量分数计的各组分:
所述缓冲液为缓冲液为磷酸盐缓冲液,浓度为10mM,pH为7.0。
所述的包被液由以下方法制备而成:
1)用纯水配置缓冲液作为基础液;
2)称取配方量的BSA、海藻糖、蔗糖、NaN3,溶于配方量的基础液中,混匀,调节pH至7.0;
3)采用孔径为0.22μm孔径的滤膜过滤除菌获得包被液。
实施例2:
一种用于免疫层析试纸条的包被液,包括如下按重量分数计的各组分:
所述缓冲液为缓冲液为Tris-HCl缓冲液,浓度为50mM,pH为7.2。
所述的包被液由以下方法制备而成:
1)用纯水配置缓冲液作为基础液;
2)称取配方量的BSA、海藻糖、蔗糖、NaN3,溶于配方量的基础液中,混匀,调节pH至7.2;
3)采用孔径为0.22μm孔径的滤膜过滤除菌获得包被液。
实施例3:
一种用于免疫层析试纸条的包被液,包括如下按重量分数计的各组分:
所述缓冲液为磷酸盐缓冲液,所述磷酸盐缓冲液的浓度为30mM,pH为7.2。
所述的包被液由以下方法制备而成:
1)用纯水配置缓冲液作为基础液;
2)称取配方量的BSA、海藻糖、蔗糖、NaN3,溶于配方量的基础液中,混匀,调节pH至7.2;
3)采用孔径为0.23μm孔径的滤膜过滤除菌获得包被液。
实施例4:
一种用于免疫层析试纸条的包被液,包括如下按重量分数计的各组分:
所述缓冲液为缓冲液为磷酸盐缓冲液,浓度为20mM,pH为7.2。
所述的包被液由以下方法制备而成:
1)用纯水配置缓冲液作为基础液;
2)称取配方量的BSA、海藻糖、蔗糖、NaN3,溶于配方量的基础液中,混匀,调节pH至7.2;
3)采用孔径为0.22μm孔径的滤膜过滤除菌获得包被液。
实施例5:
一种用于免疫层析试纸条的包被液,包括如下按重量分数计的各组分:
所述缓冲液为缓冲液为磷酸盐缓冲液,浓度为20mM,pH为7.4。
所述的包被液由以下方法制备而成:
1)用纯水配置缓冲液作为基础液;
2)称取配方量的BSA、海藻糖、蔗糖、NaN3,溶于配方量的基础液中,混匀,调节pH至7.4;
3)采用孔径为0.25μm孔径的滤膜过滤除菌获得包被液。
实施例6:
一种用于免疫层析试纸条的包被液,包括如下按重量分数计的各组分:
所述缓冲液为缓冲液为Tris-HCl缓冲液,浓度为50mM,pH为7.4。
所述的包被液由以下方法制备而成:
1)用纯水配置缓冲液作为基础液;
2)称取配方量的BSA、海藻糖、蔗糖、NaN3,溶于配方量的基础液中,混匀,调节pH至7.4;
3)采用孔径为0.22μm孔径的滤膜过滤除菌获得包被液。
实施例7:
一种用于免疫层析试纸条的包被液,包括如下按重量分数计的各组分:
所述缓冲液为缓冲液为磷酸盐缓冲液,浓度为30mM,pH为7.4。
所述的包被液由以下方法制备而成:
1)用纯水配置缓冲液作为基础液;
2)称取配方量的BSA、海藻糖、蔗糖、NaN3,溶于配方量的基础液中,混匀,调节pH至7.4;
3)采用孔径为0.25μm孔径的滤膜过滤除菌获得包被液。
对比例1
1%BSA,余量为0.025M、pH=7.4的磷酸盐缓冲液。制得传统技术的包被液。
本对比例所述的包被液由一下方法制得:
1)用纯水配置磷酸盐缓冲液作为基础液;
2)称取配方量的BSA溶于配方量的基础液中,混匀,调节pH至7.4;
3)采用孔径为0.22μm孔径的滤膜过滤除菌获得包被液。
验证实施例
以CRP定量检测免疫层析试纸条为例来说明本发明的包被液与传统技术的包被液灵敏度、精密度和稳定性对比。所述CRP定量检测免疫层析试纸条包括底衬及设在所述底衬上的包被膜,所述包被膜的两端分别搭接有样品垫和吸水纸,所述样品垫上喷有荧光胶乳标记CRP单克隆抗体和兔IgG抗体,包被膜上设置有包被线区,所述包被线区包括从靠近所述样品垫端至靠近所述吸水纸端依次平行设置的包被羊抗兔IgG抗体的质控线、包被能与待检抗原CRP特异性结合的另一株CRP单克隆抗体的检测线。
CRP定量检测免疫层析试纸条的制备方法如下,包括以下步骤:
(1)、荧光胶乳的共价活化
超声波处理胶乳微球体30秒后,调节胶乳微球体浓度为1.0×1012/ml,15000xg离心20分钟,离心后收集沉淀物用蒸馏水或者100mMpH6.0磷酸盐溶液溶解,并超声波200W处理30秒;先加入30μl的100mg/mlEDC,震荡混匀,再加入30μl的20mg/mlSμlfo-NHS,震荡混匀;室温孵育30分钟后15000xg、离心20分钟,沉淀用100mM、pH6.0的柠檬酸缓冲液溶解,放置在2~8℃条件下备用;
(2)、荧光胶乳微粒标记蛋白的制备
将活化后的荧光胶乳超声波200W处理30秒后,按照50μg标记抗体/100μl荧光胶乳的比例加入兔IgG抗体、CRP单克隆抗体,混匀后室温搅拌反应2小时,离心洗涤3次,每次15000xg、离心20分钟,沉淀用PBS-TBN溶解并超声波100W处理30秒,用PBS-TBN恢复离心前体积,4℃保存,备用;
(3)、制备样品垫
用标记稀释液稀释标记有CRP单克隆抗体的荧光胶乳标记有兔IgG抗体的荧光胶乳,将这两种标记抗体的胶乳混合,喷于样品垫上。荧光胶乳标记的CRP单克隆抗体的浓度为0.5mg/ml,按20%的稀释比,8μl/cm的用量喷在样品垫上;荧光胶乳标记的兔IgG抗体的浓度为0.5mg/ml,按2%的稀释比,8μl/cm的用量喷在样品垫上。
(4)、硝酸纤维素膜上质控线和检测线的制备
用包被缓冲液稀释(实施例1、实施例2、实施例3和传统技术的包被液)羊抗兔IgG抗体以及能与待检抗原特异结合的另一位点的单克隆抗体,并将稀释后的两种抗体分别依次平行地划线于硝酸纤维素膜上,所述质控线靠近样品垫一端。质控线包被的羊抗兔IgG抗体的浓度为1mg/ml,用量为20μl/27-35cm,CRP检测线包被的CRP单克隆抗体的浓度为1mg/ml,用量为20μl/27-35cm。质控线、CRP检测线相互间隔4mm。将包被好的硝酸纤维素膜置于湿度<30%的50℃的烘箱,干燥72h后,于2℃~30℃密封干燥平衡7天以上封袋备用。
(5)、制备试纸条
在底衬上搭接粘贴包被膜,在包被膜靠近标记线的一端搭接粘贴样品垫,在包被膜另一端搭接粘贴吸水纸,得到试纸板,按照要求切割成适当宽度的试纸条。
在本验证例中,试纸条的结构及其它参数都是相同的,不同之处仅在于:抗体包被在试纸条上(即质控线和检测线制备)所使用的包被缓冲液不相同。
在相同的加样量下,考察实施例3包被液与传统技术的包被液对免疫层析试纸的灵敏度、精确度的影响。试验结果如下所示。
1.1灵敏度(最低检测限)
以5%人血清白蛋白为空白样本,用实施例3包被液制备的试纸条与用传统包被液制备的试纸条进行测定,重复20次,结果为:
实施例3包被液制备的试纸条计算结果均值为0.02,标准差SD为0.036,用稀释后浓度分别为0.10mg/L、0.25mg/L和0.5mg/LCRP标准品溶液测定,测定结果分别为0.098mg/L、0.253mg/L、0.498mg/L,因此实施例3包被液制备的试纸条检测CRP灵敏度为0.10mg/L;
传统包被液制备的试纸条计算结果均值为0.08,标准差SD为0.046,
用稀释后浓度分别为0.10mg/L、0.25mg/L和0.5mg/L CRP标准品溶液测定,测定结果分别为0.2mg/L、0.246mg/L、0.501mg/L,因此传统包被液制备的试纸条检测CRP灵敏度为0.25mg/L。
2.2精密度
随机抽取用实施例3包被液制备的试纸条10份,分别对浓度为10.0mg/L的CRP校准品进行测定,测定结果平均值为10.11,标准差SD为0.7258,变异系数为1.0%;
随机抽取用传统包被液制备的试纸条10份,分别对浓度为10.0mg/L的CRP校准品进行测定,测定结果平均值为10.24,标准差SD为0.9258,变异系数为3.5%;
从上述实验结果可看出,用实施例3包被液制备的试纸条比用传统包被液的制备的试纸条灵敏度、精密度都要高。
用CRP定量检测免疫层析试纸条来比较本发明包被液制备的试纸条与传统包被液制备的试纸条的有效期。
将组装好的试纸条,按以下设计进行加速破坏试验:
(1)对照:室温保存。
(2)破坏组:50℃破坏(保存)1周(W);50℃破坏2周(W);50℃破坏3周(W);50℃破坏周(W)。
对照与破坏组平行测定各浓度水平在各破坏条件下灵敏度、线性水平、线性范围的一致性,观察各条件下反应曲线的重合度。
CRP定量检测免疫层析试纸条的试验结果如图1-4所示。
从图1-3可以看出,采用实施例1-3包被液制备的试纸条,对照组和破坏组都有比较好的曲线重合度,其中以实施例3的最优,实施例1和实施例2次之,从图4可以看出,传统的包被液制备的试纸在破坏1W后,其T/C值已经下降的很快,不能与对照线重合,因此,本发明的包被液与传统包被液相比,具有更好的热破坏稳定性。
综上所述,本发明的包被稀释液与传统稀释液相比,操作简便、成本低、灵敏度高、精密度好,且热稳定性高,使试剂具有更长的保质期。
对于本领域的技术人员来说,可根据以上描述的技术方案以及构思,做出其它各种相应的改变以及变形,而所有的这些改变以及变形都应该属于本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!