一种通用型的氯虫苯甲酰胺残留量的定量检测方法与流程
本发明涉及农药残留量的检测方法领域,具体涉及一种通用型的氯虫苯甲酰胺残留量的定量检测方法,该定量检测方法是采用多壁碳纳米管(MWCNTS)与PSA作为吸附剂的改进QuEChERS方法对样品除杂净化,再用气相色谱-电子捕获检测器(GC-ECD)测定不同种类样品中的氯虫苯甲酰胺,以达到快速、简便、可靠的目的。
背景技术:
近年来随着世界各国对有机磷、有机氯等高毒农药的禁用和限用,以及害虫对现有杀虫剂抗药性的快速发展,寻找开发新的作用机制的农药成为国内外关注的焦点。氯虫苯甲酰胺(CAS No.:500008-45-7),又名氯虫酰胺,商品名称康宽、普尊、奥得腾,化学名称3-溴-N-{4-氯-2-甲基-6-[(甲氨基甲酰基)苯}-1-(3-氯-2-吡啶基)-1-氢-吡啶-5-甲酰胺,其化学结构式为,是美国杜邦公司研发的新型邻甲酰氨基苯甲酰胺类杀虫剂。氯虫苯甲酰胺以昆虫鱼尼丁受体(ryanodine receptor, RyR)为作用靶标,通过高效激活昆虫细胞中的RyR,导致细胞内源钙离子释放失控和大量流失,引起昆虫肌肉调节衰弱、麻痹、瘫痪,直至最终死亡。氯虫苯甲酰胺具有优良的耐雨水冲刷性、高效的滞留活性和超高的杀虫性能,对危害水稻、蔬菜、瓜果等作物的几乎所有的鳞翅目害虫具有快速、长效的防治作用,并能有效控制传统杀虫剂产生抗性的害虫,在我国农业生产领域广泛应用。尽管氯虫苯甲酰胺毒性较低,没有“三致”作用以及神经、生殖毒性,但是基于安全考虑,各国纷纷制定了严格的限量标准,以限制其在不同基体中的最大残留量(maximum residue limit, MRL),如日本对稻米、鱼和奶品的MRL为0.05 mg/kg,我国强制性食品安全国家标准 GB 2763-2014《食品中农药最大残留限量》中规定谷物(糙米、麦类、玉米)、蔬菜、水果等农产品中氯虫苯甲酰胺的临时最大残留限量为0.02~20 mg/kg。
在氯虫苯甲酰胺残留检测的样品前处理中,现有的报道大多采用普适性较强的QuEChERS方法或改良QuEChERS方法。原始QuEChERS方法采用乙二胺-N-丙基硅烷(PSA) 对样品提取液进行分散固相净化,改良QuEChERS方法以PSA为主,与石墨化碳(GCB) 、十八烷基硅烷键合硅胶(C18)和中性氧化铝的1~2种混合使用以提高净化效率、改善净化效果。在QuEChERS方法中,吸附剂是决定方法选择性和灵敏度的关键因素,传统的商品化吸附剂由于重复使用率低、选择性差、价格较贵,已满足不了当前农药残留样品分析技术发展的要求。
在仪器检测方面,已报道的不同样本基质中氯虫苯甲酰胺残留检测方法主要有液相色谱法、液相色谱-质谱法和酶联免疫吸附分析法。液相色谱法是目前最为成熟且容易推广使用的一种检测方法,但溶剂消耗大,使用成本高,而且对样品的净化程度要求很高;液相色谱-质谱法样品用量少,对样品前处理要求低,但是质谱仪价格昂贵,运行成本高,操作要求也高,基层检测单位和普通实验室难以配备和使用,而且液相色谱-质谱法没有商品化标准谱库检索,只能自己建库或解析谱图,定性定量分析仍需借助于标准物质;酶联免疫吸附分析法操作简便,特异灵敏,不需要大型仪器设备以及专业人员操作,对前处理要求低,但是该方法只能用于定性和半定量检测,准确性和可靠性仍需借助色谱法进行验证。除以上方法外,中国专利“一种蔬菜和水果中氯虫苯甲酰胺残留量的测定方法”(CN 104502504 B)和“一种果蔬中氯虫苯甲酰胺残留量的测定方法”(CN 104459001 B)报道了用于检测蔬菜和水果中氯虫苯甲酰胺残留量的气相色谱-电子轰击离子源-质谱方法和气相色谱-负化学离子源-质谱方法。该专利报道方法虽然操作简单、能够定性定量,但样品采用均质提取,样品数量较多时,处理效率较低,且容易产生交叉污染,同时气质联用仪价格较贵,普及率较低,推广使用难度较大。
技术实现要素:
本发明的目的在于提供一种通用型的氯虫苯甲酰胺残留量的定量检测方法,该定量检测方法操作简单、快速、准确、成本低,易于掌握普及,为不同样本基质中氯虫苯甲酰胺残留分析提供了一种快速可靠的方法。
为达到上述目的,本发明采用的技术方案是:一种通用型的氯虫苯甲酰胺残留量的定量检测方法,其特征在于:所述定量检测方法有两部分组成:
第一部分,用气相色谱-电子捕获法建立已知梯度浓度的被测的氯虫苯甲酰胺的标准曲线;所述标准曲线的建立由以下步骤组成:
第一步,制备空白基质样品,制备方法由以下步骤组成:
(1)准确称取5.0~10.0 g经测定不含被测的氯虫苯甲酰胺的空白供试样品,置于50 mL离心管中,当所述空白供试样品为含水率小于10%的干性样品时,预先加入适量超纯水浸润5~10min,然后加入10~20 mL乙腈溶剂,混匀,超声提取15~30 min,加入1~2 g氯化钠和3 g无水硫酸镁,涡旋2 min,以7000 r/min转速离心4min,取上清液即为待净化的空白基质提取液;
(2)另取一支10 mL离心管,加入0.06~0.08g 多壁碳纳米管、0.1~0.15g PSA和0.3g无水硫酸镁,加入4mL所述待净化的空白基质提取液,涡旋2min,以9000 r/min转速离心5min;离心后移取2.0 mL上清液,在70℃水浴下氮气缓慢吹至近干,得到空白基质样品;
第二步,向所述第一步中得到的空白基质样品中分别加入1mL梯度质量浓度的氯虫苯甲酰胺的标准工作溶液,振荡混匀,过0.22μm有机滤膜,得到相应质量浓度的基质匹配标准工作溶液,所述基质匹配标准工作溶液中氯虫苯甲酰胺的质量浓度分别为1 mg/kg、0.5 mg/ kg、0.2 mg/ kg、0.1 mg/ kg以及0.05 mg/ kg;
第三步,用气相色谱-电子捕获法测定所述基质匹配标准工作溶液中氯虫苯甲酰胺的色谱峰保留时间和色谱峰面积,以色谱峰保留时间定性,然后以质量浓度为横坐标,以色谱峰面积为纵坐标绘制出氯虫苯甲酰胺的标准曲线;
其中,测定氯虫苯甲酰胺的色谱条件为:
色谱柱:型号为HP-5的毛细管色谱柱,规格为30m×0.32mm×0.25μm;柱升温程序:初始温度80℃,保持1min,30℃/min升至180℃,保持5min,20℃/min升至260℃,保持18min;ECD温度:300℃;进样口温度:240℃,隔垫吹扫3mL/min;载气:氮气,纯度≥99.999%,流速1mL/min;尾吹气:高纯氮气,60mL/min;进样量:1.0μL,不分流进样;
第二部分,测定供试样品中氯虫苯甲酰胺残留量,所述供试样品为土壤、茶叶或叶类蔬菜,定量检测方法包括以下步骤:
第一步,对供试样品进行提取;
称取供试样品于50 mL离心管中,当所述供试样品为含水率小于10%的干性样品时,预先加入适量超纯水浸润5~10min,然后加入乙腈溶剂,其中,所述供试样品与所述乙腈溶剂的投入比为向每0.5g供试样品中投入1mL乙腈溶剂,混匀,超声提取15~30 min,加入氯化钠和无水硫酸镁,其中,所述供试样品、氯化钠以及无水硫酸镁的质量比为5~10:1:3,涡旋1~3 min,以6000~8000 r/min的转速离心3~5min,取上清液即为待净化的供试样品提取液;
第二步,对所述待净化的供试样品提取液进行净化;
另取一支10 mL离心管,加入多壁碳纳米管、PSA以及无水硫酸镁,加入所述待净化的供试样品提取液,投入的多壁碳纳米管、PSA以及无水硫酸镁在待净化的供试样品提取液中的含量分别为0.015~0.02mg/mL、0.025~0.0375mg/mL、0.075 mg/mL,涡旋1~3min,以9000~10000 r/min转速离心4~6min;离心后移取2.0 mL上清液至试管中,在65~75℃水浴下氮气缓慢吹至近干,用丙酮-正己烷混合溶剂定容至1.0 mL,过有机系滤膜,得到用于测定氯虫苯甲酰胺残留量的供试样品提取净化液;
第三步,用气相色谱-电子捕获法测定所述供试样品提取净化液中的氯虫苯甲酰胺残留量,记录色谱峰保留时间和色谱峰面积,通过色谱峰保留时间定性后,将所述供试样品提取净化液检测出的色谱峰面积与所述第一部分得到的氯虫苯甲酰胺的标准曲线进行比较,得到所述供试样品提取净化液中含有的氯虫苯甲酰胺的测定值;再将所述测定值带入到定量计算公式中,最终得到待测供试样品中氯虫苯甲酰胺残留量;
定量计算公式:ω=(ρ×v×f)/m,式中ω为待测供试样品中氯虫苯甲酰胺残留量,单位为mg/kg,ρ为测定值,单位为mg/L,m为称取的样品量,单位为g,v为定容体积,单位为mL,f为稀释倍数;
其中,测定所述供试样品提取净化液中的氯虫苯甲酰胺残留量的色谱条件与所述第一部分的第三步中的氯虫苯甲酰胺的色谱条件相同。
上述技术方案中的有关内容解释如下:
1、上述方案中,在所述第一部分的第二步中,配制成的所述标准工作溶液中氯虫苯甲酰胺的梯度质量浓度分别为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L以及0.05 mg/L。在实际操作中,先配制标准储备溶液,再由标准储备溶液配制成标准工作溶液。
标准储备溶液的配制:将新购置的溶解在甲醇溶剂中的1mL 100mg/L氯虫苯甲酰胺标准溶液转移至10mL容量瓶中,在氮吹仪下缓慢吹至近干,用丙酮-正己烷(体积比1:1)稀释定容,此时使用丙酮-正己烷混合溶剂对甲醇进行溶剂交换,配成质量浓度为10 mg/L的标准储备溶液,置于4℃冰箱中保存。
标准工作溶液的配制:将上述标准储备溶液从冰箱中取出回复到室温,以丙酮-正己烷(体积比1:1)为溶剂逐级稀释,配制成质量浓度为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L、0.05 mg/L的系列标准工作溶液。
2、上述方案中,所述丙酮-正己烷混合溶剂中丙酮与正己烷的体积比1:1。
3、上述方案中,涉及到的氯虫苯甲酰胺标准溶液的质量浓度100 mg/L,购自农业部环境保护科研监测所;多壁碳纳米管(英文简称MWCNTS),外径10~20nm,生产厂家为中国Agela Technologies公司;乙二胺-N-丙基硅烷(英文简称PSA),粒度40~60μm,生产厂家为中国Agela Technologies公司;正己烷,色谱纯,生产厂家为瑞典Oceanpak公司;丙酮,色谱纯,生产厂家为上海国药集团化学试剂有限公司;乙腈、氯化钠、无水硫酸镁(使用前620℃下灼烧4h,备用),均为分析纯,生产厂家为上海国药集团化学试剂有限公司;实验用水为超纯水(18.4 MΩ)。
本发明的设计特点以及有益效果是:本发明首次建立了使用多壁碳纳米管(MWCNTS)和乙二胺- N-丙基硅烷(PSA)作为吸附剂的改进QuEChERS-气相色谱-电子捕获法快速检测不同样品基质中氯虫苯甲酰胺残留量的方法。供试样品基质中残留的氯虫苯甲酰胺采用乙腈溶剂超声提取,以适量MWCNTS和PSA作为联合吸附剂去除杂质,上清液氮吹浓缩近干,用丙酮-正己烷(体积比1:1)定容,采用HP-5色谱柱程序升温分离,电子捕获检测器(ECD)测定,基质外标法定量。
与现有样品基质中氯虫苯甲酰胺残留检测方法相比,第一,本发明利用基于MWCNTS 与PSA作为联合吸附剂的改进QuEChERS方法对复杂基质样品除杂净化,对复杂基质样品的除杂净化更有针对性和通用性,供试样品可以为土壤、茶叶或叶类蔬菜。相对于GCB和C18等QuEChERS方法中常见的吸附剂而言,多壁碳纳米管(MWCNTS)是碳六元环构成的类石墨平面卷曲而成的纳米中空管,作为一种新型吸附材料,其与PSA、GCB、C18相比具有更大的比表面积,吸附容量更大,具有快速吸附和去除色素能力,对目标农药氯虫苯甲酰胺的吸附量不大,但MWCNTS对茶多酚、有机酸类物质、脂肪酸、一些糖类物质等吸附效果一般,与此同时,PSA可以有效去除茶多酚、脂肪酸、甾醇、有机酸以及一些糖类物质,PSA去除色素效果一般,这表明单独用MWCNTS或PSA对供试样品进行吸附可能都达不到去除杂质、净化提取好的目的,因此,将MWCNTS与PSA联用,对于茶叶、土壤、叶类蔬菜等复杂基质样品而言更有针对性,净化效果更好,吸附容量更大,吸附剂的总使用量明显减少,并且MWCNTS的市售价格低廉,大大节约样品检测成本。
第二,本发明的改进QuEChERS方法大大缩短了样品前处理时间,能够在40分钟之内就完成对样品的提取、净化。
第三,本发明的改进QuEChERS方法中采用超声法提取样品,速度快、效率高、操作简单,可满足大批量样品分析对进度的要求。
第四,QuEChERS方法一般推荐GC-MS或HPLC-MS对农药进行检测,然而,质谱检测器是通用型检测器,受样品背景干扰严重,价格昂贵,运行成本高,操作要求也高,基层检测单位和普通实验室难以配备和使用。与此同时,尽管电子捕获检测器(英文简称ECD)属于专用型检测器,对含氯或含溴的分子有相应,但本领域技术人员普遍认为GC-ECD受待测物背景的影响较大,定性可靠性不如质谱方法高。本发明正是克服了现有技术中存在的技术偏见,在结合了改进的QuEChERS方法之后,利用氯虫苯甲酰胺分子中含有2个氯原子和1个溴原子,在电子捕获检测器(ECD)上有灵敏的响应,选用电子捕获检测器与气相色谱进行联用。从最终本发明的实验结果表明,在GC-ECD色谱图上,氯虫苯甲酰胺的色谱分离效果好,峰形对称,在待测组分出峰处无杂质干扰,不影响其定性分析的准确性,氯虫苯甲酰胺在ECD检测器上具有较高的响应值,检测灵敏度也高,定量效果好,本发明选用GC-ECD对氯虫苯甲酰胺进行检测是合理的。此外,GC-ECD的仪器价格便宜,操作维护简单,技术要求不如色谱-质谱联用严格,特别适合在广大基层检测机构和单位推广使用。
总之,本发明的方法操作简单、快速、准确,易于普及掌握,且成本低,为不同样品基质中氯虫苯甲酰胺残留测定提供了一种通用的、快速可靠的方法,可满足大批量样品分析对质量和进度的要求。
附图说明
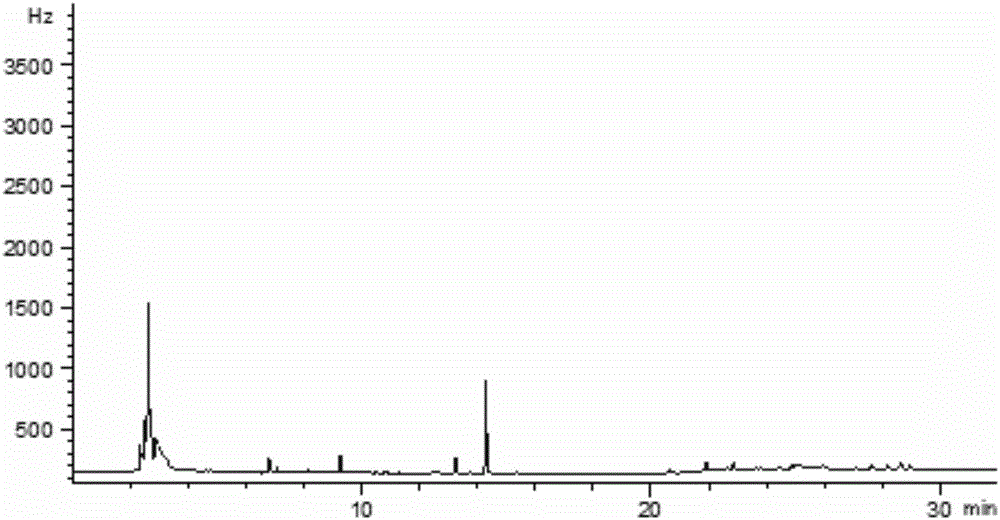
附图1为本发明实施例1中氯虫苯甲酰胺溶剂标准溶液GC-ECD色谱图;
附图2为本发明实施例1中氯虫苯甲酰胺茶叶基质标准溶液GC-ECD色谱图;
附图3为本发明实施例1中茶叶空白样品GC-ECD色谱图;
附图4为本发明实施例1中茶叶加标样品GC-ECD色谱图;
附图5为本发明实施例1中氯虫苯甲酰胺在茶叶中的基质效应;
附图6为本发明实施例1中氯虫苯甲酰胺茶叶基质标准工作曲线;
附图7为本发明实施例2中氯虫苯甲酰胺溶剂标准溶液GC-ECD色谱图;
附图8为本发明实施例2中氯虫苯甲酰胺土壤基质标准溶液GC-ECD色谱图;
附图9为本发明实施例2中土壤空白样品GC-ECD色谱图;
附图10为本发明实施例2中土壤加标样品GC-ECD色谱图;
附图11为本发明实施例2中氯虫苯甲酰胺在土壤中的基质效应;
附图12为本发明实施例2中氯虫苯甲酰胺土壤基质标准工作曲线。
具体实施方式
下面结合附图及实施例对本发明作进一步描述:
实施例1:一种茶叶中氯虫苯甲酰胺残留量的定量检测方法
空白茶叶样品取自江苏太湖地区农业科学研究所茶叶试验田,在种植过程中未施加任何农药,采摘的鲜叶按照传统绿茶加工工艺制成干茶。
实际检测茶叶样品购自超市,产地为苏州东洞庭山茶园。将茶叶样品用粉碎机粉碎,混匀,储存在4℃的冰箱。
所述定量检测方法有两部分组成:
第一部分,用气相色谱-电子捕获法建立已知梯度浓度的被测的氯虫苯甲酰胺的标准曲线;所述标准曲线的建立由以下步骤组成:
第一步,制备空白基质样品,制备方法由以下步骤组成:
(1)准确称取5.0 g经测定不含被测的氯虫苯甲酰胺的空白茶叶样品,置于50 mL聚四氟乙烯离心管中,加入5 mL超纯水浸润5~10min后,加入10 mL乙腈溶剂,混匀,超声提取15~30 min,加入1 g氯化钠和4 g无水硫酸镁,涡旋2 min,以7000 r/min转速离心4min,取上清液即为待净化的空白基质提取液;
(2)另取一支10 mL聚四氟乙烯离心管,加入0.08g 多壁碳纳米管、0.15g PSA和0.3g无水硫酸镁,加入4mL所述待净化的空白基质提取液,涡旋2min,以9000 r/min转速离心5min;离心后移取2.0 mL上清液,在70℃水浴下氮气缓慢吹至近干,得到空白基质样品;
第二步,向所述第一步中得到的空白基质样品中分别加入1mL梯度质量浓度的氯虫苯甲酰胺的标准工作溶液,振荡混匀,过0.22μm有机滤膜,得到相应质量浓度的基质匹配标准工作溶液,所述基质匹配标准工作溶液中氯虫苯甲酰胺的质量浓度分别为1 mg/kg、0.5 mg/ kg、0.2 mg/ kg、0.1 mg/ kg以及0.05 mg/ kg;
配制成的所述标准工作溶液中氯虫苯甲酰胺的梯度质量浓度分别为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L以及0.05 mg/L;在实际操作中,先配制标准储备溶液,再由标准储备溶液配制成标准工作溶液;
标准储备溶液的配制:将新购置的溶解在甲醇溶剂中的1mL 100mg/L氯虫苯甲酰胺标准溶液转移至10mL容量瓶中,在氮吹仪下缓慢吹至近干,用丙酮-正己烷(体积比1:1)稀释定容,此时使用丙酮-正己烷混合溶剂对甲醇进行溶剂交换,配成质量浓度为10 mg/L的标准储备溶液,置于4℃冰箱中保存;
标准工作溶液的配制:将上述标准储备溶液从冰箱中取出回复到室温,以丙酮-正己烷(体积比1:1)为溶剂逐级稀释,配制成质量浓度为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L、0.05 mg/L的系列标准工作溶液;
第三步,用气相色谱-电子捕获法测定所述基质匹配标准工作溶液中氯虫苯甲酰胺的色谱峰保留时间和色谱峰面积,以色谱峰保留时间定性,然后以质量浓度为横坐标,以色谱峰面积为纵坐标绘制出氯虫苯甲酰胺的标准曲线;
其中,测定氯虫苯甲酰胺的色谱条件为:
色谱柱:型号为HP-5的毛细管色谱柱,规格为30m×0.32mm×0.25μm;柱升温程序:初始温度80℃,保持1min,30℃/min升至180℃,保持5min,20℃/min升至260℃,保持18min;ECD温度:300℃;进样口温度:240℃,隔垫吹扫3mL/min;载气:氮气,纯度≥99.999%,流速1mL/min;尾吹气:高纯氮气,60mL/min;进样量:1.0μL,不分流进样;
第二部分,测定茶叶样品中氯虫苯甲酰胺残留量,定量检测方法包括以下步骤:
第一步,对茶叶样品进行提取;
准确称取5.0 g茶叶样品于50 mL聚四氟乙烯离心管中,加入5 mL超纯水浸润5~10min后,加入10 mL乙腈溶剂,混匀,超声提取15~30 min,加入1 g氯化钠和4 g无水硫酸镁,涡旋2min,以7000 r/min的转速离心4min,取上清液即为待净化的茶叶样品提取液;
第二步,对所述待净化的茶叶样品提取液进行净化;
另取一支10 mL聚四氟乙烯离心管,加入0.08g多壁碳纳米管、0.15g PSA以及0.3g无水硫酸镁,加入4mL所述待净化的提取液,涡旋2min,以9000 r/min转速离心5min;离心后移取2.0 mL上清液至试管中,在70℃水浴下氮气缓慢吹至近干,用丙酮-正己烷混合溶剂定容至1.0 mL,丙酮-正己烷混合溶剂中丙酮与正己烷的体积比1:1,过0.22μm有机系滤膜,得到用于测定氯虫苯甲酰胺残留量的茶叶样品提取净化液;
第三步,用气相色谱-电子捕获法测定所述茶叶样品提取净化液中的氯虫苯甲酰胺残留量,记录色谱峰保留时间和色谱峰面积,通过色谱峰保留时间定性后,将所述茶叶样品提取净化液检测出的色谱峰面积与所述第一部分得到的氯虫苯甲酰胺的标准曲线进行比较,得到所述茶叶样品提取净化液中含有的氯虫苯甲酰胺的测定值;再将所述测定值带入到定量计算公式中,最终得到待测茶叶样品中氯虫苯甲酰胺残留量;
定量计算公式:ω=(ρ×v×f)/m,式中ω为待测茶叶样品中氯虫苯甲酰胺残留量,单位为mg/kg,ρ为测定值,单位为mg/L,m为称取的样品量,单位为g,v为定容体积,单位为mL,f为稀释倍数;
其中,测定所述茶叶样品提取净化液中的氯虫苯甲酰胺残留量的色谱条件与所述第一部分的第三步中的氯虫苯甲酰胺的色谱条件相同。
以上实施例中,所用的仪器与设备有:7890A气相色谱仪,配有电子捕获检测器(ECD)和7693自动进样器和Chemstation色谱工作站(美国Agilent公司);KQ-500DE超声波清洗器(昆山超声仪器公司);TG16-WS台式高速离心机(湖南湘仪实验仪器公司);K600粉碎机 (德国博朗公司);HSC-24 B氮吹仪(天津恒奥科技公司);VM-10涡旋振荡器(韩国Daihan Scientific公司);SX2-4-10马弗炉(上海跃进医疗器械公司);Direct-Q 5 UV型超纯水机(美国Millipore公司)。
所用的药品与试剂:氯虫苯甲酰胺标准溶液的质量浓度100 mg/L,购自农业部环境保护科研监测所;多壁碳纳米管(英文简称MWCNTS),外径10~20nm,生产厂家为中国Agela Technologies公司;乙二胺-N-丙基硅烷(英文简称PSA),粒度40~60μm,生产厂家为中国Agela Technologies公司;正己烷,色谱纯,生产厂家为瑞典Oceanpak公司;丙酮,色谱纯,生产厂家为上海国药集团化学试剂有限公司;乙腈、氯化钠、无水硫酸镁(使用前620℃下灼烧4h,备用),均为分析纯,生产厂家为上海国药集团化学试剂有限公司;实验用水为超纯水(18.4 MΩ)。
实施例1的试验结果:
1、GC-ECD色谱图
氯虫苯甲酰胺的溶剂标准溶液、基质标准溶液、茶叶空白样品及茶叶空白加标色谱图分别见附图1~4。从图中可以看出,供试农药的色谱分离效果较好,峰形对称,基线稳定,在标准组分出峰处无明显的干扰杂峰,说明本方法的仪器条件和前处理方法选择合适。
2、基质效应
采用气相色谱法检测农药残留时,待测农药极易受到样品基质效应的影响,从而引起分析结果的偏差和对样品分析过程回收率的错误计算,所以对基质效应进行考察评估并采取有效措施进行消除或补偿,是进行农药残留准确分析的重要环节。有很多方法可以用来降低或补偿基质效应,如标准加入法、同位素内标法、基质净化法、分析保护剂法、基质匹配标准溶液法,其中以基质匹配标准溶液法最常用。基质效应由农药结构、性质和浓度以及基质含量和种类等因素决定,并与检测器、进样口温度及类型等操作条件有关。本研究对溶剂标准溶液和基质匹配标准溶液进行了对比检测。结果(参见附图 5所示)表明,在低浓浓度下(0.05~0.2mg/kg),氯虫苯甲酰胺基质匹配标准溶液峰面积高于纯溶剂标准溶液峰面积,表明在检测茶叶中氯虫苯甲酰胺时存在基质增强效应,故在使用外标法定量时,采用基质匹配标准溶液建立校准曲线,以消除基质干扰,减少误差。
3、标准曲线与线性范围
取配制好的质量浓度为0.05~1mg/kg的氯虫苯甲酰胺基质匹配标准工作溶液,按所述第一部分的第三步中的氯虫苯甲酰胺的色谱条件进行GC-ECD测定,以质量浓度(ρ,mg/kg)为横坐标,对应峰面积(y)为纵坐标,绘制基质标准工作曲线。结果表明,氯虫苯甲酰胺的质量浓度(ρ)在0.05~1 mg/kg范围内与峰面积(y)呈良好的线性关系,标准曲线y=1436.4ρ+ 228.72,相关系数(r)为0.9987,参见附图6所示。
4、添加回收率与精密度
称取5.0g空白茶叶样品若干份,准确添加一定体积的氯虫苯甲酰胺标准储备溶液,添加浓度分别为1 mg/kg、0.2mg/kg、0.05 mg/kg,涡旋混匀,静置30min~60min,按照本方法样品前处理条件进行提取和净化及色谱条件测定,对每个添加水平作5个平行,采用基质外标法定量,计算方法的回收率及其相对标准偏差。
由表1可知,在0.05~1 mg/kg添加浓度下,氯虫苯甲酰胺在茶叶中的平均回收率为93.1 %~106.1 %,相对标准偏差(n=5)为4.5%~6.1%,表明该方法具有很好的准确性和重复性,符合农药残留检测的要求。
表1 氯虫苯甲酰胺在茶叶中的添加回收率和相对标准偏差
5、方法检出限与定量限
在本方法条件下,对氯虫苯甲酰胺最低添加水平(0.05mg/kg)的茶叶样品进行测定,得到色谱图。以色谱图中信噪比的3倍为检出限,以最小添加水平为实际定量限,得到氯虫苯甲酰胺的检出限和实际定量限分别为0.005mg/kg 、0.05mg/kg。
6、实际样品的检测
利用本研究建立的方法对采自苏州东洞庭山茶园16个批次的茶叶样品进行检测,结果均未检出氯虫苯甲酰胺残留,原因可能是该茶园茶叶中残留的氯虫苯甲酰胺含量低于本方法检出限,或该茶园未曾使用过氯虫苯甲酰胺药剂及其相关产品,因此检测不到。
7、结论
结果表明,氯虫苯甲酰胺在0.05~1mg/kg范围内,峰面积与相应质量浓度间呈良好的线性关系,相关系数为0.9939,在0.05~1mg/kg添加水平下,平均回收率为92.1 %~100.7 %,相对标准偏差(n=5)为2.5%~7.5%,检出限为0.005mg/kg,实际定量限为0.05mg/kg。
实施例2:一种土壤中氯虫苯甲酰胺残留量的定量检测方法
土样取自苏州东洞庭山茶园,取样深度为0~15cm,土壤类型为黄壤土(pH=4.1~4.7)。样品在通风避光处自然风干,除去大颗粒砂、草根和其他碎屑,研磨,过0.25mm(60目)筛后,装入自封袋保存。制备好的土样尽快分析,否则置于-18℃~- 20℃温度下冷冻保存。空白土样也取自苏州东洞庭山茶园,经检测不含待测农药。
所述定量检测方法有两部分组成:
第一部分,用气相色谱-电子捕获法建立已知梯度浓度的被测的氯虫苯甲酰胺的标准曲线;所述标准曲线的建立由以下步骤组成:
第一步,制备空白基质样品,制备方法由以下步骤组成:
(1)准确称取5.0 g经测定不含被测的氯虫苯甲酰胺的空白土样,置于50 mL聚四氟乙烯离心管中,加入2 mL超纯水浸润5~10min后,加入10 mL乙腈溶剂,混匀,超声提取15~30 min,加入1 g氯化钠和3 g无水硫酸镁,涡旋2 min,以7000 r/min转速离心4min,取上清液即为待净化的空白基质提取液;
(2)另取一支10 mL聚四氟乙烯离心管,加入0.06g 多壁碳纳米管、0.1g PSA和0.3g无水硫酸镁,加入4mL所述待净化的空白基质提取液,涡旋2min,以9000 r/min转速离心5min;离心后移取2.0 mL上清液,在70℃水浴下氮气缓慢吹至近干,得到空白基质样品;
第二步,向所述第一步中得到的空白基质样品中分别加入1mL梯度质量浓度的氯虫苯甲酰胺的标准工作溶液,振荡混匀,过0.22μm有机滤膜,得到相应质量浓度的基质匹配标准工作溶液,所述基质匹配标准工作溶液中氯虫苯甲酰胺的质量浓度分别为1 mg/kg、0.5 mg/ kg、0.2 mg/ kg、0.1 mg/ kg以及0.05 mg/ kg;
配制成的所述标准工作溶液中氯虫苯甲酰胺的梯度质量浓度分别为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L以及0.05 mg/L;在实际操作中,先配制标准储备溶液,再由标准储备溶液配制成标准工作溶液;
标准储备溶液的配制:将新购置的溶解在甲醇溶剂中的1mL 100mg/L氯虫苯甲酰胺标准溶液转移至10mL容量瓶中,在氮吹仪下缓慢吹至近干,用丙酮-正己烷(体积比1:1)稀释定容,此时使用丙酮-正己烷混合溶剂对甲醇进行溶剂交换,配成质量浓度为10 mg/L的标准储备溶液,置于4℃冰箱中保存;
标准工作溶液的配制:将上述标准储备溶液从冰箱中取出回复到室温,以丙酮-正己烷(体积比1:1)为溶剂逐级稀释,配制成质量浓度为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L、0.05 mg/L的系列标准工作溶液;
第三步,用气相色谱-电子捕获法测定所述基质匹配标准工作溶液中氯虫苯甲酰胺的色谱峰保留时间和色谱峰面积,以色谱峰保留时间定性,然后以质量浓度为横坐标,以色谱峰面积为纵坐标绘制出氯虫苯甲酰胺的标准曲线;
其中,测定氯虫苯甲酰胺的色谱条件为:
色谱柱:型号为HP-5的毛细管色谱柱,规格为30m×0.32mm×0.25μm;柱升温程序:初始温度80℃,保持1min,30℃/min升至180℃,保持5min,20℃/min升至260℃,保持18min;ECD温度:300℃;进样口温度:240℃,隔垫吹扫3mL/min;载气:氮气,纯度≥99.999%,流速1mL/min;尾吹气:高纯氮气,60mL/min;进样量:1.0μL,不分流进样;
第二部分,测定土壤样品中氯虫苯甲酰胺残留量,定量检测方法包括以下步骤:
第一步,对土壤样品进行提取;
准确称取5.0 g土壤样品于50 mL聚四氟乙烯离心管中,加入2 mL超纯水浸润5~10min后,加入乙腈溶剂,混匀,超声提取15~30 min,加入1 g氯化钠和3 g无水硫酸镁,涡旋2min,以7000 r/min的转速离心3~5min,取上清液即为待净化的土壤样品提取液;
第二步,对所述待净化的土壤样品提取液进行净化;
另取一支10 mL聚四氟乙烯离心管,加入0.06g MWCNTS、0.1g PSA和0.3g无水硫酸镁,加入4mL所述待净化的土壤样品提取液,涡旋1~3min,以9000 r/min转速离心5min;离心后移取2.0 mL上清液至试管中,在70℃水浴下氮气缓慢吹至近干,用丙酮-正己烷混合溶剂定容至1.0 mL,所述丙酮-正己烷混合溶剂中丙酮与正己烷的体积比1:1,过0.22μm有机系滤膜,得到用于测定氯虫苯甲酰胺残留量的土壤样品提取净化液;
第三步,用气相色谱-电子捕获法测定所述土壤样品提取净化液中的氯虫苯甲酰胺残留量,记录色谱峰保留时间和色谱峰面积,通过色谱峰保留时间定性后,将所述土壤样品提取净化液检测出的色谱峰面积与所述第一部分得到的氯虫苯甲酰胺的标准曲线进行比较,得到所述土壤样品提取净化液中含有的氯虫苯甲酰胺的测定值;再将所述测定值带入到定量计算公式中,最终得到待测土壤样品中氯虫苯甲酰胺残留量;
定量计算公式:ω=(ρ×v×f)/m,式中ω为待测土壤样品中氯虫苯甲酰胺残留量,单位为mg/kg,ρ为测定值,单位为mg/L,m为称取的样品量,单位为g,v为定容体积,单位为mL,f为稀释倍数;
其中,测定所述土壤样品提取净化液中的氯虫苯甲酰胺残留量的色谱条件与所述第一部分的第三步中的氯虫苯甲酰胺的色谱条件相同。
以上实施例中,所用的仪器与设备有:7890A气相色谱仪,配有电子捕获检测器(ECD)和7693自动进样器和Chemstation色谱工作站(美国Agilent公司);KQ-500DE超声波清洗器(昆山超声仪器公司);TG16-WS台式高速离心机(湖南湘仪实验仪器公司);K600粉碎机 (德国博朗公司);HSC-24 B氮吹仪(天津恒奥科技公司);VM-10涡旋振荡器(韩国Daihan Scientific公司);SX2-4-10马弗炉(上海跃进医疗器械公司);Direct-Q 5 UV型超纯水机(美国Millipore公司)。
所用的药品与试剂:氯虫苯甲酰胺标准溶液的质量浓度100 mg/L,购自农业部环境保护科研监测所;多壁碳纳米管(英文简称MWCNTS),外径10~20nm,生产厂家为中国Agela Technologies公司;乙二胺-N-丙基硅烷(英文简称PSA),粒度40~60μm,生产厂家为中国Agela Technologies公司;正己烷,色谱纯,生产厂家为瑞典Oceanpak公司;丙酮,色谱纯,生产厂家为上海国药集团化学试剂有限公司;乙腈、氯化钠、无水硫酸镁(使用前620℃下灼烧4h,备用),均为分析纯,生产厂家为上海国药集团化学试剂有限公司;实验用水为超纯水(18.4 MΩ)。
实施例2的试验结果:
1、GC-ECD色谱图
氯虫苯甲酰胺的溶剂标准溶液、基质标准溶液、土壤空白样品及土壤空白加标色谱图分别见附图7~10。从图中可以看出,供试农药的色谱分离效果较好,峰形对称,基线稳定,在标准组分出峰处无明显的干扰杂峰,说明本方法的仪器条件和前处理方法选择合适。
2、基质效应
采用气相色谱法检测农药残留时,待测农药极易受到样品基质效应的影响,从而引起分析结果的偏差和对样品分析过程回收率的错误计算,所以对基质效应进行考察评估并采取有效措施进行消除或补偿,是进行农药残留准确分析的重要环节。有很多方法可以用来降低或补偿基质效应,如标准加入法、同位素内标法、基质净化法、分析保护剂法、基质匹配标准溶液法,其中以基质匹配标准溶液法最常用。基质效应由农药结构、性质和浓度以及基质含量和种类等因素决定,并与检测器、进样口温度及类型等操作条件有关。本研究对溶剂标准溶液和基质匹配标准溶液进行了对比检测。结果(参见附图 11)表明,在不同浓度下,氯虫苯甲酰胺纯溶剂标准溶液峰面积整体上均高于基质匹配标准溶液峰面积,表明在检测土壤中氯虫苯甲酰胺时存在基质减弱效应,故在使用外标法定量时,采用基质匹配标准溶液建立校准曲线,以消除基质干扰,减少误差。
3、标准曲线与线性范围
取配制好的质量浓度为0.05~1mg/kg的氯虫苯甲酰胺基质匹配标准工作溶液,按所述第一部分的第三步中的氯虫苯甲酰胺的色谱条件进行GC-ECD测定,以质量浓度(ρ,mg/kg)为横坐标,对应峰面积(y)为纵坐标,绘制基质标准工作曲线。结果表明,氯虫苯甲酰胺的质量浓度(ρ)在0.05~1 mg/kg范围内与峰面积(y)呈良好的线性关系,标准曲线y=1145.1ρ+ 439.57,相关系数(r)为0.9939,参见附图12所示。
4、添加回收率与精密度
称取5.0g空白土壤样品若干份,准确添加一定体积的氯虫苯甲酰胺标准储备溶液,添加浓度分别为1 mg/kg、0.2mg/kg、0.05 mg/kg,涡旋混匀,静置30min~60min,按照本方法样品前处理条件进行提取和净化及色谱条件测定,对每个添加水平作5个平行,采用基质外标法定量,计算方法的回收率及其相对标准偏差。
由表2可知,在0.05~1 mg/kg添加浓度下,氯虫苯甲酰胺在土壤中的平均回收率为92.1 %~100.7 %,相对标准偏差(n=5)为2.5%~7.5%,表明该方法具有很好的准确性和重复性,符合农药残留检测的要求。
表2 氯虫苯甲酰胺在土壤中的添加回收率和相对标准偏差
5、方法检出限与定量限
在本方法条件下,对氯虫苯甲酰胺最低添加水平(0.05mg/kg)的土壤样品进行测定,得到色谱图。以色谱图中信噪比的3倍为检出限,以最小添加水平为实际定量限,得到氯虫苯甲酰胺的检出限和实际定量限分别为0.009mg/kg、0.05mg/kg。
6、实际样品的检测
利用本研究建立的方法对采自苏州东洞庭山茶园16个批次的土壤样品进行检测,结果均未检出氯虫苯甲酰胺残留,原因可能是该茶园土壤中残留的氯虫苯甲酰胺含量低于本方法检出限,或该茶园未曾使用过氯虫苯甲酰胺药剂及其相关产品,因此检测不到。
7、结论
结果表明,氯虫苯甲酰胺在0.05~1mg/kg范围内,峰面积与相应质量浓度间呈良好的线性关系,相关系数为0.9939,在0.05~1mg/kg添加水平下,平均回收率为92.1 %~100.7 %,相对标准偏差(n=5)为2.5%~7.5%,检出限为0.009mg/kg,实际定量限为0.05mg/kg。
实施例3:一种白菜中氯虫苯甲酰胺残留量的定量检测方法
白菜购自苏州市望亭镇农贸市场,用干净纱布轻轻擦去其表面附着物,然后用粉碎机打碎,装入PE袋中待测。空白白菜样品为经检测不含待测农药的白菜。
所述定量检测方法有两部分组成:
第一部分,用气相色谱-电子捕获法分别建立已知梯度浓度的被测的氯虫苯甲酰胺的标准曲线;所述标准曲线的建立由以下步骤组成:
第一步,制备空白基质样品,制备方法由以下步骤组成:
(1)准确称取10.0g经测定不含被测的氯虫苯甲酰胺的空白白菜样品,置于50 mL聚四氟乙烯离心管中,加入20 mL乙腈溶剂,混匀,超声提取15~30 min,加入1 g氯化钠和3 g无水硫酸镁,涡旋2 min,以7000 r/min转速离心4min,取上清液即为待净化的空白基质提取液;
(2)另取一支10 mL聚四氟乙烯离心管,加入0.07g 多壁碳纳米管、0.12g PSA和0.3g无水硫酸镁,加入4mL所述待净化的空白基质提取液,涡旋2min,以9000 r/min转速离心5min;离心后移取2.0 mL上清液,在70℃水浴下氮气缓慢吹至近干,得到空白基质样品;
第二步,向所述第一步中得到的空白基质样品中分别加入1mL梯度质量浓度的氯虫苯甲酰胺的标准工作溶液,振荡混匀,过0.22μm有机滤膜,得到相应质量浓度的基质匹配标准工作溶液,所述基质匹配标准工作溶液中氯虫苯甲酰胺的质量浓度分别为1 mg/kg、0.5 mg/ kg、0.2 mg/ kg、0.1 mg/ kg以及0.05 mg/ kg;
配制成的所述标准工作溶液中氯虫苯甲酰胺的梯度质量浓度分别为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L以及0.05 mg/L;在实际操作中,先配制标准储备溶液,再由标准储备溶液配制成标准工作溶液;
标准储备溶液的配制:将新购置的溶解在甲醇溶剂中的1mL 100mg/L氯虫苯甲酰胺标准溶液转移至10mL容量瓶中,在氮吹仪下缓慢吹至近干,用丙酮-正己烷(体积比1:1)稀释定容,此时使用丙酮-正己烷混合溶剂对甲醇进行溶剂交换,配成质量浓度为10 mg/L的标准储备溶液,置于4℃冰箱中保存;
标准工作溶液的配制:将上述标准储备溶液从冰箱中取出回复到室温,以丙酮-正己烷(体积比1:1)为溶剂逐级稀释,配制成质量浓度为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L、0.05 mg/L的系列标准工作溶液;
第三步,用气相色谱-电子捕获法测定所述基质匹配标准工作溶液中氯虫苯甲酰胺的色谱峰保留时间和色谱峰面积,以色谱峰保留时间定性,然后以质量浓度为横坐标,以色谱峰面积为纵坐标绘制出氯虫苯甲酰胺的标准曲线;测定氯虫苯甲酰胺的色谱条件与实施例1相同。
第二部分,测定白菜样品中氯虫苯甲酰胺残留量,定量检测方法包括以下步骤:
第一步,对白菜样品进行提取;
准确称取10.0 g白菜样品于50 mL聚四氟乙烯离心管中,加入20 mL乙腈溶剂,混匀,超声提取15~30 min,加入1 g氯化钠和3 g无水硫酸镁,涡旋2min,以7000 r/min的转速离心3~5min,取上清液即为待净化的白菜样品提取液;
第二步,对所述待净化的白菜样品提取液进行净化;
另取一支10 mL聚四氟乙烯离心管,加入0.07g MWCNTS、0.12g PSA和0.3g无水硫酸镁,加入4mL所述待净化的白菜样品提取液,涡旋2min,以9000 r/min转速离心5min;离心后移取2.0 mL上清液至试管中,在70℃水浴下氮气缓慢吹至近干,用丙酮-正己烷混合溶剂定容至1.0 mL,丙酮-正己烷混合溶剂中丙酮与正己烷的体积比1:1,过0.22μm有机系滤膜,得到用于测定氯虫苯甲酰胺残留量的白菜样品提取净化液;
第三步,用气相色谱-电子捕获法测定所述白菜样品提取净化液中的氯虫苯甲酰胺残留量,记录色谱峰保留时间和色谱峰面积,通过色谱峰保留时间定性后,将所述白菜样品提取净化液检测出的色谱峰面积与所述第一部分得到的氯虫苯甲酰胺的标准曲线进行比较,得到所述白菜样品提取净化液中含有的氯虫苯甲酰胺的测定值;再将所述测定值带入到定量计算公式中,最终得到待测白菜样品中氯虫苯甲酰胺残留量;
定量计算公式:ω=(ρ×v×f)/m,式中ω为待测白菜样品中氯虫苯甲酰胺残留量,单位为mg/kg,ρ为测定值,单位为mg/L,m为称取的样品量,单位为g,v为定容体积,单位为mL,f为稀释倍数;
其中,测定所述白菜样品提取净化液中的氯虫苯甲酰胺残留量的色谱条件与所述第一部分的第三步中的氯虫苯甲酰胺的色谱条件相同。
实施例3的实验结果:氯虫苯甲酰胺在0.05~1mg/kg范围内,峰面积与相应质量浓度间呈良好的线性关系,相关系数为0.9963,在0.05~1mg/kg添加水平下,平均回收率为90.3%~101.0%,相对标准偏差(n=5)为6.5%~9.8%,检出限为0.006mg/kg,实际定量限为0.05mg/kg。
实施例4:一种苋菜中氯虫苯甲酰胺残留量的定量检测方法
苋菜购自苏州市望亭镇农贸市场,用干净纱布轻轻擦去其表面附着物,然后用粉碎机打碎,装入PE袋中待测。空白苋菜样品为经检测不含待测农药的苋菜。
所述定量检测方法有两部分组成:
第一部分,用气相色谱-电子捕获法分别建立已知梯度浓度的被测的氯虫苯甲酰胺的标准曲线;所述标准曲线的建立由以下步骤组成:
第一步,制备空白基质样品,制备方法由以下步骤组成:
(1)准确称取10.0g经测定不含被测的氯虫苯甲酰胺的空白苋菜样品,置于50 mL聚四氟乙烯离心管中,加入20 mL乙腈溶剂,混匀,超声提取15~30 min,加入1 g氯化钠和3 g无水硫酸镁,涡旋2 min,以7000 r/min转速离心4min,取上清液即为待净化的空白基质提取液;
(2)另取一支10 mL聚四氟乙烯离心管,加入0.07g 多壁碳纳米管、0.12g PSA和0.3g无水硫酸镁,加入4mL所述待净化的空白基质提取液,涡旋2min,以9000 r/min转速离心5min;离心后移取2.0 mL上清液,在70℃水浴下氮气缓慢吹至近干,得到空白基质样品;
第二步,向所述第一步中得到的空白基质样品中分别加入1mL梯度质量浓度的氯虫苯甲酰胺的标准工作溶液,振荡混匀,过0.22μm有机滤膜,得到相应质量浓度的基质匹配标准工作溶液,所述基质匹配标准工作溶液中氯虫苯甲酰胺的质量浓度分别为1 mg/kg、0.5 mg/ kg、0.2 mg/ kg、0.1 mg/ kg以及0.05 mg/ kg;
配制成的所述标准工作溶液中氯虫苯甲酰胺的梯度质量浓度分别为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L以及0.05 mg/L;在实际操作中,先配制标准储备溶液,再由标准储备溶液配制成标准工作溶液;
标准储备溶液的配制:将新购置的溶解在甲醇溶剂中的1mL 100mg/L氯虫苯甲酰胺标准溶液转移至10mL容量瓶中,在氮吹仪下缓慢吹至近干,用丙酮-正己烷(体积比1:1)稀释定容,此时使用丙酮-正己烷混合溶剂对甲醇进行溶剂交换,配成质量浓度为10 mg/L的标准储备溶液,置于4℃冰箱中保存;
标准工作溶液的配制:将上述标准储备溶液从冰箱中取出回复到室温,以丙酮-正己烷(体积比1:1)为溶剂逐级稀释,配制成质量浓度为1 mg/L、0.5 mg/L、0.2 mg/L、0.1 mg/L、0.05 mg/L的系列标准工作溶液;
第三步,用气相色谱-电子捕获法测定所述基质匹配标准工作溶液中氯虫苯甲酰胺的色谱峰保留时间和色谱峰面积,以色谱峰保留时间定性,然后以质量浓度为横坐标,以色谱峰面积为纵坐标绘制出氯虫苯甲酰胺的标准曲线;测定氯虫苯甲酰胺的色谱条件与实施例1相同。
第二部分,测定苋菜样品中氯虫苯甲酰胺残留量,定量检测方法包括以下步骤:
第一步,对苋菜样品进行提取;
准确称取10.0 g苋菜样品于50 mL聚四氟乙烯离心管中,加入20 mL乙腈溶剂,混匀,超声提取15~30 min,加入1 g氯化钠和3 g无水硫酸镁,涡旋2min,以8000 r/min的转速离心3~5min,取上清液即为待净化的苋菜样品提取液;
第二步,对所述待净化的苋菜样品提取液进行净化;
另取一支10 mL聚四氟乙烯离心管,加入0.07g MWCNTS、0.12g PSA和0.3g无水硫酸镁,加入4mL所述待净化的苋菜样品提取液,涡旋2min,以10000 r/min转速离心5min;离心后移取2.0 mL上清液至试管中,在70℃水浴下氮气缓慢吹至近干,用丙酮-正己烷混合溶剂定容至1.0 mL,丙酮-正己烷混合溶剂中丙酮与正己烷的体积比1:1,过0.22μm有机系滤膜,得到用于测定氯虫苯甲酰胺残留量的苋菜样品提取净化液;
第三步,用气相色谱-电子捕获法测定所述苋菜样品提取净化液中的氯虫苯甲酰胺残留量,记录色谱峰保留时间和色谱峰面积,通过色谱峰保留时间定性后,将所述苋菜样品提取净化液检测出的色谱峰面积与所述第一部分得到的氯虫苯甲酰胺的标准曲线进行比较,得到所述苋菜样品提取净化液中含有的氯虫苯甲酰胺的测定值;再将所述测定值带入到定量计算公式中,最终得到待测苋菜样品中氯虫苯甲酰胺残留量;
定量计算公式:ω=(ρ×v×f)/m,式中ω为待测苋菜样品中氯虫苯甲酰胺残留量,单位为mg/kg,ρ为测定值,单位为mg/L,m为称取的样品量,单位为g,v为定容体积,单位为mL,f为稀释倍数;
其中,测定所述苋菜样品提取净化液中的氯虫苯甲酰胺残留量的色谱条件与所述第一部分的第三步中的氯虫苯甲酰胺的色谱条件相同。
实施例4的实验结果:氯虫苯甲酰胺在0.05~1mg/kg范围内,峰面积与相应质量浓度间呈良好的线性关系,相关系数为0.9910,在0.05~1mg/kg添加水平下,平均回收率为89.9%~110.7%,相对标准偏差(n=5)为7.4%~9.5%,检出限为0.007mg/kg,实际定量限为0.05mg/kg。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!