一种定量检测sST2的时间分辨荧光免疫试纸条及其制备方法与流程
本发明属于医学检验领域,具体涉及一种定量检测sST2的时间分辨荧光免疫试纸条及其制备方法。
背景技术:
生长刺激表达基因2蛋白(ST2)是心肌细胞受到生物机械应力后产生的一种心肌蛋白,1989年Tominaga等首先发现了ST2基因,但因未发现其功能性配体,一直被误认为是孤儿受体。2005年Schmitz等发现其特异性功能配体白细胞介素IL-33。ST2基因表达于肥大细胞、激活的辅助性T细胞(Th2)、巨噬细胞和心肌细胞。人的ST2基因可编码一种可溶性生长刺激表达基因2蛋白(sST2)和一种跨膜形式生长刺激表达基因2蛋白(ST2L),两者的转录分别受到不同的启动子调控。
IL-33属于IL-1家族,广泛存在于多种组织细胞中,是炎症反应的重要调节因子之一。正常情况下,IL-33存在于细胞核中,作为转录抑制因子发挥作用。当细胞受到损伤时,IL-33可分泌到胞外,主要通过结合受体ST2传递信号,作为细胞因子发挥免疫调节等作用。ST2L/IL-33信号通路在抗动脉粥样硬化、抗心肌纤维化和心肌细胞肥大等的过程中发挥重要作用。心脏成纤维细胞受到机械应力刺激后可产生IL-33,而IL-33与其受体ST2L结合后,将活化信号传递至细胞内,经过下游的IL-1相关蛋白激酶、髓样分化因子88和肿瘤坏死因子受体相关因子6等一系列信号分子,激活核转录核因子(NF)-κB和Map激酶,从而影响基因的转录,诱发Th2细胞效应分子IL-4和IL-5等的释放。当心脏成纤维细胞和心肌细胞受到强压力负荷时,这些效应分子可使心脏做出保护性变化,拮抗牵拉过度导致的心肌肥大并心肌纤维化发生。而sST2是IL-3的诱骗受体,能够结合并中和IL-33,表现为对ST2L/IL-33信号通路的负性调节。血清中过多的sST2可以使心肌在受到机械应力损伤时缺乏足够的IL-33保护作用,进而发生心肌重塑和心功能障碍。
与冠脉造影和左心室功能正常人群相比,主动脉狭窄患者和充血性心肌病患者的sST2水平显著增高。急性心衰患者的sST2水平越高,心衰的严重程度越高,sST2与NYHA心功能分级正相关。因此,通过检测sST2水平,可鉴别不同风险水平的患者,从而针对不同风险的患者给予适当的治疗方案,进而有效降低心衰的发病率和死亡率。临床上,sST2的浓度可用于估计心脏代谢失调,心室重构等。sST2可作为心衰的标志物,不仅可用于筛查心衰患者,独立的对心力衰竭进行诊断,对心衰患者进行风险分层;作为急性心力衰竭患者结构和功能恶化的预测性指标,是急性心力衰竭预后的强有力的预测因子;sST2能够很好的预测患者在短期、中长期(三个月、一年、三至五年)内的死亡率,为患者是否进行心脏移植提供数据支持,有利于提前干预提供患者的治愈率和成活率。
标记免疫分析法是将具有高度敏感性的标记示踪技术和免疫学中抗原抗体的高度特异性反应相结合的产物,包括放射免疫(RIA)、酶联免疫分析(EIA)、化学发光免疫分析(CLIA)、电化学发光免疫分析(ECLIA)和时间分辨荧光免疫分析(TRFIA)。TRFIA技术是20世纪70年代末Wallac公司创立的一种非放射性标记免疫分析技术。示踪物选用的是镧系元素如铕、铋、钐和镝的三价稀土离子及其螯合物,用以代替荧光物质、酶、同位素、化学发光物质来标记抗体、抗原、激素、多肽、蛋白质、核酸探针及生物细胞等,在一定的反应体系(例如常用的抗原抗体反应、生物素亲和素反应、核酸探针杂交反应、靶细胞与效应细胞的杀伤反应等)内发生反应后,用时间分辨荧光免疫分析检测仪测定反应产物中的特异荧光强度,并与相对应的标准荧光曲线比对,判断反应体系中分析物的浓度,从而达到定量分析待测物的目的。
TRFIA的反应原理和其他标记免疫分析相似。常用的有双位点夹心法和固相抗体竞争法。双位点夹心分析法多用来测定蛋白质类大分子化合物。使用针对被测物上不同抗原决定簇的两个单克隆抗体,一个用Eu3+标记,另一个包被固相载体,经过免疫反应形成免疫复合物后,再将Eu3+从复合物上完全解离下来,在Eu3+的增强液中与另一种螯合剂结合,在协同剂的作用下,形成一个Eu3+包裹于其内部的微胶囊(胶态分子团)。它在激发光作用下能发射出很强的荧光信号,其强弱与待测抗原(或抗体)含量相关。该法用于测定蛋白质类大分子化合物。固相抗体竞争法多用于一些小分子半抗原化合物的测定,因分子质量小,不能直接进行固相包被,如多肽、甲状腺激素类和一些药物等,都必须经过化学耦联剂与载体蛋白质进行共价键结合,然后可包被聚苯乙烯微量滴定条孔壁,制成固相抗原。其原理是:限量固相抗体与Eu3+标记抗原和样品中的待测抗原竞争性结合,样品中的抗原浓度越高,固相抗体结合的Eu3+标记抗原量就越少,反之亦然,即固相抗体上的荧光信号强度与样品中的抗原浓度成反比。
TRFIA技术是近年来新兴起来的一种超微量快速免疫检测技术,具有灵敏度高、特异性强、稳定性好,而且测定范围更宽,实际寿命长,操作简便和非放射性等特点,非常适用于生物学、医学上的分析检测。该技术越来越受到各领域科研工作者的关注,应用范围也不断发展,是继放射免疫分析、酶标、化学发光、电化学发光之后的一种更新、更灵敏的检测方法。
目前,检测sST2的方法主要是采用的是酶联免疫法(ELISA)。ELISA技术存在以下缺点:检测设备要求高,成本高;干扰因素较多,重复性不好;检测时间长。因此酶联免疫技术检测可溶性生长刺激基因2蛋白不适合临床快速诊断。
技术实现要素:
为了解决现有技术存在的缺陷,本发明提供一种可用于定量检测sST2的时间分辨荧光免疫分析试纸条及其制备方法,采用该免疫分析试纸条,不仅能够提供较高的灵敏度和特异性,操作简单,可实现快速检测,满足了临床检验的需要,而且降低了成本,满足国内市场的需求。
为了解决上述技术问题,本发明提供如下技术方案:
本发明一种定量检测sST2的时间分辨荧光免疫分析试纸条,包括:包括底板,底板上依次相互交错排列样品垫、结合垫、包被膜和吸水纸,包被膜贴合在底板中部,包被膜一侧边缘上端贴覆结合垫,另一侧边缘上端贴合吸水纸,结合垫远离包被膜的一侧边缘上方贴覆样品垫;
底板以及底板上依次相互交错排列的样品垫、结合垫、包被膜和吸水纸,所述包被膜贴合在底板中部上,所述结合垫贴合在底板上,一侧压覆在包被膜一侧边缘上,所述样品垫贴合在底板上,一侧压覆在结合垫边缘上,所述吸水纸一侧压覆在包被膜另一侧边缘上;
所述结合垫上包被有稀土离子微球标记的sST2单克隆抗体I,所述稀土离子微球标记的sST2单克隆抗体I为鼠源性sST2单克隆抗体,所述包被膜上包被有检测线和质控线,所述检测线固定有识别不同抗原表位的sST2单克隆抗体II,所述质控线固定有兔抗鼠IgG抗体;
所述包被膜上检测线和质控线相互平行,所述检测线靠近所述结合垫,所述质控线靠近所述吸水纸。
优选的,所述结合垫为聚酯膜。
优选的,所包被膜为硝酸纤维素膜。
优选的,所述稀土离子微球为用于标记的任何镧系金属元素微球。
优选的,所述稀土离子微球表面带有活性基团,可以连接蛋白、糖类等生物物质。
优选的,所述稀土离子微球的直径为100nm-300nm。
优选的,本发明提供定量检测sST2的时间分辨荧光免疫分析试纸条,还包括一卡壳,所述试纸条装入在卡壳内,露出样品垫、结合垫、包被膜上的检测线和质控线、以及吸水垫。
优选的,所述卡壳为塑料卡壳。
本发明提供上述定量检测sST2的时间分辨荧光免疫分析试纸条的制备方法,包括如下步骤:
(1)在包被膜的不同位置分别固定识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体,形成检测线和质控线;
(2)制备稀土离子微球标记的sST2单克隆抗体I,并喷涂在结合垫上;
(3)在底板上依次相互交错的黏贴上样品垫、结合垫、包被膜和吸水纸,然后切割成宽度为0.4~0.6cm大小,装入卡壳。
优选的,步骤(1)中包被膜的制备方法为:使用含有1%-10%蔗糖的0.01-0.05mol/L的pH为7.2-7.6的磷酸盐缓冲液,分别将识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体稀释到0.5mg/mL-2.0mg/mL的浓度,使用定量喷膜仪以1μL/cm-2μL/cm的量将二者以0.5cm-1.0cm的间隔喷于包被膜上,35-38℃烘干0.5-2.0h,加入干燥剂封存备用。
优选的,步骤(2)中所述稀土离子微球标记的sST2单克隆抗体I的制备方法为:将sST2单克隆抗体I用0.01mol/L-0.05mol/L的pH为7.2-7.6的磷酸缓冲液在2~4℃温度下透析过夜,之后调整浓度为1mol/L-1.5mol/L;使用0.02mol/L-0.05mol/L的pH为7.2-7.6的MES活化缓冲液洗涤微球,加入碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),终浓度为10mmol/L,室温反应10-20分钟,充分洗涤稀土离子微球,用0.02mol/L-0.05mol/L的pH为7.2-7.6的磷酸盐缓冲液复溶后加入透析后的sST2单克隆抗体I,使sST2单克隆抗体I与稀土离子微球的质量比为1:50-4:50,室温反应1.5~2.5小时,加入含有1%-10%BSA的0.01-0.05mol/L的pH7.2-7.6的磷酸盐缓冲液,室温反应25~35分钟,洗涤稀土离子微球,用含有0.05%-1%BSA,0.05%-0.1%Tween-20,0.01-0.05mol/L的pH7.2-7.6的磷酸盐缓冲液保存液复溶至原体积,使用定量喷膜仪以3μL/cm-5μL/cm喷涂于结合垫上,避光,在35-38℃烘干0.5~1.5小时,加入干燥剂封存备用。
与现有技术相比,本发明具有以下优点:将时间分辨免疫层析技术引入可溶性生长刺激基因2蛋白的检测中,结合时间分辨荧光检测仪,实现了可溶性生长刺激基因2蛋白的单人份定量检测,且灵敏度高,批内、批间差小,为临床使用提供了极大便利;本发明操作简便,具有良好的稳定性,检测时间短,且灵敏度高、准确性好,标准曲线R2值接近1,线性稳定,由标准曲线拟合出的回归方程准确,便于样品浓度计算;无辐射污染,适合大规模生产,对于可溶性生长刺激基因2蛋白的定量检测有着积极的意义。
附图说明
图1是本发明中定量检测sST2的时间分辨免疫分析试纸条的结构示意图;
图2是本发明包含卡壳的时间分辨荧光免疫分析试纸条结构示意图;
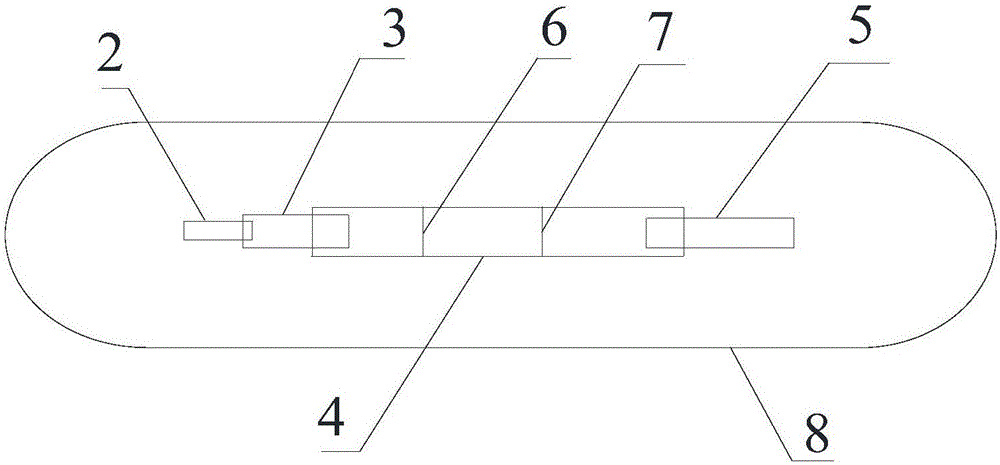
其中,1、底板,2、样品垫,3、结合垫,4、包被膜,5、吸水纸,6、检测线,7、质控线,8、壳体。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合具体实施方式对本发明进一步详细说明。应当理解,此处所描述的具体实施方式仅仅用以解释本发明,但并不用于限定本发明。
如图1所示,一种快速检测sST2的时间分辨荧光免疫分析试纸条,包括底板1,底板1上依次相互交错排列样品垫2、结合垫3、包被膜4和吸水纸5,包被膜4贴合在底板1中部,包被膜4一侧边缘上端贴覆结合垫3,另一侧边缘上端贴合吸水纸5,结合垫3远离包被膜4的一侧边缘上方贴覆样品垫2;
结合垫3上包被有稀土离子微球标记的sST2单克隆抗体I,包被膜3上包被有检测线6和质控线7,检测线6固定有识别不同抗原表位的sST2单克隆抗体II,质控线7固定有兔抗鼠IgG抗体;
包被膜4上检测线6和质控线7相互平行,检测线6靠近结合垫3,质控线7靠近吸水纸5。
结合垫3为聚酯膜,能够负载足量的稀土离子微球,并且在遇到样品时能够迅速释放微球。
包被膜4为硝酸纤维素膜。
稀土离子微球为用于标记的任何镧系金属元素微球,稀土离子微球表面带有活性基团,可以连接蛋白、糖类等生物物质,稀土离子微球的直径为100nm-300nm。
如图2所示,定量检测sST2的时间分辨荧光免疫分析试纸条,还包括一卡壳8,试纸条装入在卡壳内,露出样品垫2、结合垫3、包被膜4上的检测线6和质控线7、以及吸水垫5。
卡壳8为塑料卡壳。
实施例1
定量检测sST2的时间分辨荧光免疫分析试纸条的制备方法,包括如下步骤:
(1)在包被膜4的不同位置分别固定识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体,形成检测线和质控线;
(2)制备稀土离子微球标记的sST2单克隆抗体I,并喷涂在结合垫3上;
(3)在底板1上依次相互交错的黏贴上样品垫2、结合垫3、包被膜4和吸水纸5,然后切割成宽度为0.5cm大小,装入卡壳8。
步骤(1)中包被膜4的制备方法为:使用含有1%蔗糖的0.01mol/L的pH为7.2的磷酸盐缓冲液,分别将识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体稀释到0.5mg/mL的浓度,使用定量喷膜仪以1μL/cm的量将二者以0.5cm的间隔喷于包被膜4上,35℃烘干2h,加入干燥剂封存备用。
步骤(2)中稀土离子微球标记的sST2单克隆抗体I的制备方法为:将sST2单克隆抗体I用0.01mol/L的pH为7.2的磷酸缓冲液在2℃温度下透析过夜,之后调整浓度为1mol/L;使用0.02mol/L的pH为7.2的MES活化缓冲液洗涤微球,加入碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),终浓度为10mmol/L,室温反应10分钟,充分洗涤稀土离子微球,用0.02mol/L的pH为7.2的磷酸盐缓冲液复溶后加入透析后的sST2单克隆抗体I,使sST2单克隆抗体I与稀土离子微球的质量比为1:50,室温反应1.5小时,加入含有1%BSA的0.01mol/L的pH7.2的磷酸盐缓冲液,室温反应25分钟,洗涤稀土离子微球,用含有0.05%BSA,0.05%Tween-20,0.01mol/L的pH7.2的磷酸盐缓冲液保存液复溶至原体积,使用定量喷膜仪以3μL/cm喷涂于结合垫3上,避光,在35℃烘干1.5小时,加入干燥剂封存备用。
实施例2
定量检测sST2的时间分辨荧光免疫分析试纸条的制备方法,包括如下步骤:
(1)在包被膜4的不同位置分别固定识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体,形成检测线和质控线;
(2)制备稀土离子微球标记的sST2单克隆抗体I,并喷涂在结合垫3上;
(3)在底板1上依次相互交错的黏贴上样品垫2、结合垫3、包被膜4和吸水纸5,然后切割成宽度为0.5cm大小,装入卡壳8。
步骤(1)中包被膜4的制备方法为:使用含有5.5%蔗糖的0.03mol/L的pH为7.4的磷酸盐缓冲液,分别将识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体稀释到1.25mg/mL的浓度,使用定量喷膜仪以1.5μL/cm的量将二者以0.75cm的间隔喷于包被膜4上,37℃烘干1.25h,加入干燥剂封存备用。
步骤(2)中稀土离子微球标记的sST2单克隆抗体I的制备方法为:将sST2单克隆抗体I用0.03mol/L的pH为7.4的磷酸缓冲液在3℃温度下透析过夜,之后调整浓度为1.25mol/L;使用0.03mol/L的pH为7.4的MES活化缓冲液洗涤微球,加入碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),终浓度为10mmol/L,室温反应15分钟,充分洗涤稀土离子微球,用0.03mol/L的pH为7.4的磷酸盐缓冲液复溶后加入透析后的sST2单克隆抗体I,使sST2单克隆抗体I与稀土离子微球的质量比为2.5:50,室温反应2小时,加入含有5.5%BSA的0.03mol/L的pH7.4的磷酸盐缓冲液,室温反应30分钟,洗涤稀土离子微球,用含有0.55%BSA,0.55%Tween-20,0.03mol/L的pH7.4的磷酸盐缓冲液保存液复溶至原体积,使用定量喷膜仪以4μL/cm喷涂于结合垫3上,避光,在37℃烘干1小时,加入干燥剂封存备用。
实施例3
定量检测sST2的时间分辨荧光免疫分析试纸条的制备方法,包括如下步骤:
(1)在包被膜4的不同位置分别固定识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体,形成检测线和质控线;
(2)制备稀土离子微球标记的sST2单克隆抗体I,并喷涂在结合垫3上;
(3)在底板1上依次相互交错的黏贴上样品垫2、结合垫3、包被膜4和吸水纸5,然后切割成宽度为0.5cm大小,装入卡壳8。
步骤(1)中包被膜4的制备方法为:使用含有10%蔗糖的0.05mol/L的pH为7.6的磷酸盐缓冲液,分别将识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体稀释到2.0mg/mL的浓度,使用定量喷膜仪以2μL/cm的量将二者以1.0cm的间隔喷于包被膜4上,38℃烘干0.5h,加入干燥剂封存备用。
步骤(2)中稀土离子微球标记的sST2单克隆抗体I的制备方法为:将sST2单克隆抗体I用0.05mol/L的pH为7.6的磷酸缓冲液在4℃温度下透析过夜,之后调整浓度为1.5mol/L;使用0.05mol/L的pH为7.6的MES活化缓冲液洗涤微球,加入碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),终浓度为10mmol/L,室温反应20分钟,充分洗涤稀土离子微球,用0.05mol/L的pH为7.6的磷酸盐缓冲液复溶后加入透析后的sST2单克隆抗体I,使sST2单克隆抗体I与稀土离子微球的质量比为4:50,室温反应2.5小时,加入含有10%BSA的0.05mol/L的pH7.6的磷酸盐缓冲液,室温反应35分钟,洗涤稀土离子微球,用含有1%BSA,0.1%Tween-20,0.05mol/L的pH7.6的磷酸盐缓冲液保存液复溶至原体积,使用定量喷膜仪以5μL/cm喷涂于结合垫3上,避光,在38℃烘干0.5小时,加入干燥剂封存备用。
实施例4
定量检测sST2的时间分辨荧光免疫分析试纸条的制备方法,包括如下步骤:
(1)在包被膜4的不同位置分别固定识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体,形成检测线和质控线;
(2)制备稀土离子微球标记的sST2单克隆抗体I,并喷涂在结合垫3上;
(3)在底板1上依次相互交错的黏贴上样品垫2、结合垫3、包被膜4和吸水纸5,然后切割成宽度为0.5cm大小,装入卡壳8。
步骤(1)中包被膜4的制备方法为:使用含有5.5%蔗糖的0.03mol/L的pH为7.6的磷酸盐缓冲液,分别将识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体稀释到1.25mg/mL的浓度,使用定量喷膜仪以1.5μL/cm的量将二者以0.75cm的间隔喷于包被膜4上,37℃烘干1.25h,加入干燥剂封存备用。
步骤(2)中稀土离子微球标记的sST2单克隆抗体I的制备方法为:将sST2单克隆抗体I用0.03mol/L的pH为7.6的磷酸缓冲液在3℃温度下透析过夜,之后调整浓度为1.25mol/L;使用0.03mol/L的pH为7.6的MES活化缓冲液洗涤微球,加入碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),终浓度为10mmol/L,室温反应15分钟,充分洗涤稀土离子微球,用0.03mol/L的pH为7.6的磷酸盐缓冲液复溶后加入透析后的sST2单克隆抗体I,使sST2单克隆抗体I与稀土离子微球的质量比为2.5:50,室温反应2小时,加入含有5.5%BSA的0.03mol/L的pH7.6的磷酸盐缓冲液,室温反应30分钟,洗涤稀土离子微球,用含有0.55%BSA,0.55%Tween-20,0.03mol/L的pH7.6的磷酸盐缓冲液保存液复溶至原体积,使用定量喷膜仪以4μL/cm喷涂于结合垫3上,避光,在37℃烘干1小时,加入干燥剂封存备用。
实施例5
定量检测sST2的时间分辨荧光免疫分析试纸条的制备方法,包括如下步骤:
(1)在包被膜4的不同位置分别固定识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体,形成检测线和质控线;
(2)制备稀土离子微球标记的sST2单克隆抗体I,并喷涂在结合垫3上;
(3)在底板1上依次相互交错的黏贴上样品垫2、结合垫3、包被膜4和吸水纸5,然后切割成宽度为0.5cm大小,装入卡壳8。
步骤(1)中包被膜4的制备方法为:使用含有7.5%蔗糖的0.02mol/L的pH为7.4的磷酸盐缓冲液,分别将识别不同抗原表位的sST2单克隆抗体II和兔抗鼠IgG抗体稀释到1.5mg/mL的浓度,使用定量喷膜仪以1.5μL/cm的量将二者以0.5cm的间隔喷于包被膜4上,37℃烘干1.25h,加入干燥剂封存备用。
步骤(2)中稀土离子微球标记的sST2单克隆抗体I的制备方法为:将sST2单克隆抗体I用0.03mol/L的pH为7.4的磷酸缓冲液在3℃温度下透析过夜,之后调整浓度为1.3mol/L;使用0.04mol/L的pH为7.4的MES活化缓冲液洗涤微球,加入碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),终浓度为10mmol/L,室温反应15分钟,充分洗涤稀土离子微球,用0.04mol/L的pH为7.4的磷酸盐缓冲液复溶后加入透析后的sST2单克隆抗体I,使sST2单克隆抗体I与稀土离子微球的质量比为3:50,室温反应2小时,加入含有7.5%BSA的0.04mol/L的pH7.4的磷酸盐缓冲液,室温反应30分钟,洗涤稀土离子微球,用含有0.5%BSA,0.5%Tween-20,0.02mol/L的pH7.4的磷酸盐缓冲液保存液复溶至原体积,使用定量喷膜仪以4μL/cm喷涂于结合垫3上,避光,在37℃烘干1小时,加入干燥剂封存备用。
本发明的使用方法:使用本发明提供的定量检测sST2的时间分辨荧光免疫分析试纸条,在样品垫2上加入样品液,在毛细作用下,样品液向吸水纸5一端泳动,至结合垫3时,如果待测样本中含有sST2时,样品液中的sST2与结合垫3上的稀土离子微球标记的sST2单克隆抗体I形成抗原-抗体复合物,随着层析作用,抗原-抗体复合物向前移动,到达包被膜4的检测线6处时,抗原-抗体复合物与检测线6上的能够识别不同抗原表位的sST2单克隆抗体II形成抗体-抗原-抗体夹心复合物,聚集在检测线6处,而未结合sST2单克隆抗体II的稀土离子微球标记的sST2单克隆抗体I继续前行,到达质控线时,兔抗鼠IgG抗体与稀土离子微球标记的的鼠源性sST2单克隆抗体I结合,在C线处出现稀土离子微球的聚集。整个反应在10-15分钟内完成,并进行上机读卡。检测线6和质控线7都会产生相应的荧光信号,荧光检测仪会根据定标卡上的信息将实际检测值带入预设的标准曲线中算出定量的结果;样品液中不含有sST2时,则只在质控线处产生荧光信号。
如果待测标本中不含有sST2时,样品液随着层析作用向前移动,到达结合垫3时,样品液带动结合垫3上的稀土离子微球标记的sST2单克隆抗体I向前继续移动,经过包被膜4上的检测线6时,没有形成抗体-抗原-抗体夹心复合物,检测线6处不出现荧光;含有稀土离子微球标记的sST2单克隆抗体I的样品液继续前行,到达质控线7时,质控线7处的兔抗鼠IgG抗体与稀土离子微球标记的sST2单克隆抗体I结合,在质控线7处会出现稀土离子微球的聚集并产生相应的荧光。
试纸条使用时,待测标本中不含有sST2,只会在质控线7处出现荧光;待测标本中含有sST2,则检测线6和质控线7处均会出现荧光。因此,当质控线7处未出现荧光,即使检测线6处出现荧光,也判定检测结果无效。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!